大孔树脂分离纯化豆酱中大豆苷元的研究
2016-11-17李志江魏春红臧延青王鹤霖黑龙江八一农垦大学食品学院黑龙江大庆163319
关 琛,李志江,魏春红,臧延青,王鹤霖,丁 洁(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
大孔树脂分离纯化豆酱中大豆苷元的研究
关 琛,*李志江,魏春红,臧延青,王鹤霖,丁 洁
(黑龙江八一农垦大学食品学院,黑龙江大庆 163319)
以豆酱中游离异黄酮大豆苷元为研究对象,经比较选择AB-8型大孔树脂进行大豆苷元的分离纯化。结果显示,最佳动态吸附解析条件为上样质量浓度3 mg/mL,吸附速度2.0 mL/min,洗脱速度2.0 mL/min。在此条件下,大豆苷元的纯度为71.50%。
大豆苷元;大孔树脂;纯化
0 引言
豆酱是我国传统的发酵食品,以大豆作为主要原料[1],味道醇厚、咸鲜适口,营养成分主要有大豆异黄酮、多肽、功能性低聚糖、蛋白黑素类、大豆皂苷等[2]。大豆异黄酮在预防骨质疏松、抗肿瘤、预防和缓解妇女更年期综合症等多方面都有较好的功效。
对大豆异黄酮的提取研究大多以总异黄酮为研究对象,而大豆苷元单体成分则具有更高的生物活性。通常可采用溶剂萃取法、微波辅助萃取法、薄层层析和纸层析等进行分离提取;随着分离技术的发展,运用高速逆流色谱法、超临界CO2抗溶剂法、膜分离等新技术也取得了较好的效果[3-5]。
大孔吸附树脂是一种弱极性聚合物吸附剂,其聚合单体为苯乙烯和丙酸酯,交联剂为乙烯苯,致孔剂为甲苯、二甲苯[6]。因其操作简便、成本低、易再生、除去干扰成分效果好[7-8]而被广泛使用。
本文在前期试验基础上,以成品豆酱为原料,通过大孔树脂分离纯化大豆苷元,以探究豆酱功能性成分的组成及含量,为豆酱的综合利用、研制富含大豆苷元的食品、开发保健品等提供理论依据。
1 材料与方法
1.1 材料与试剂
成品豆酱,黑龙江农垦宝泉酱业提供;大豆苷元,购自Sigma公司,纯度≥99%;AB-8,HPD-600,ADS-7和D101型大孔树脂,沧州宝恩吸附材料科技有限公司提供;乙腈、二甲基亚砜、甲醇、乙醇,均为分析纯;水为纯净水。
1.2 仪器与设备
Z型玻璃层析柱(40 cm×2.0 cm),上海精科实业有限公司产品;Agilent 1200型高效液相色谱仪,杭州天钊科技有限公司产品;HD-9797型电脑紫外检测仪、HL-2D型定时数显恒流泵,上海精科实业有限公司产品。
1.3 试验方法
1.3.1 大孔树脂的静态吸附试验
(1)静态吸附率、解析率的测定。称取预处理过的5 g湿树脂、100 mL大豆苷元提取液置于锥形瓶中,25℃吸附24 h后,吸取上清液,测定大豆苷元酮的质量浓度。计算大孔吸附树脂对大豆苷元的吸附量Q和吸附率E。

式中:C0——吸附前大豆苷元质量浓度,mg/mL;
C1——吸附后大豆苷元质量浓度,mg/mL;
V——溶液体积,mL;
W——大孔树脂湿质量,g。
滤去上清液后,用蒸馏水洗涤,待洗涤液呈无色透明时,加入100 mL 70%乙醇溶液(V/V),25℃下解析24 h后,吸取上清液,进行大豆苷元质量浓度的测定。

(2)静态吸附、解析动力学曲线的测定。称量5 g预处理的湿树脂、100 mL的大豆苷元提取液置于锥形瓶中,于25℃吸附,每30 min取样,测定大豆苷元的质量浓度。
吸附后的树脂滤出水洗后,加入100 mL 70%乙醇溶液(V/V),25℃摇床进行振荡,间隔20 min取样,测定大豆苷元的质量浓度。
(3)静态吸附、解析条件的选择。①吸附时间对静态吸附效果的影响,称取5 g预处理的湿树脂、100 mL大豆苷元提取液置于锥形瓶中,25℃吸附12 h,每隔2 h吸取上清液,计算吸附率以确定最佳吸附时间。②洗脱时间对静态吸附效果的影响,吸附后的树脂滤出,水洗后置于锥形瓶中,加入100 mL 70%乙醇溶液(V/V),洗脱12 h,每隔2 h吸取上清液,计算吸附率以确定最佳洗脱时间。③乙醇体积分数对静态吸附效果的影响,将吸附后的树脂滤出,水洗后置于锥形瓶中,分别加入100 mL体积分数为30%,40%,50%,60%,70%,80%,90%的乙醇溶液(V/V),洗脱12 h后,吸取上清液,计算吸附率以确定最佳的乙醇体积分数。
1.3.2 大孔树脂吸附的动态试验
(1)吸附速度对动态吸附试验结果的影响。树脂预处理后装入玻璃层析柱进行淋洗,上样质量浓度为2 mg/mL,将提取液以1.0,2.0,3.0 mL/min的速度泵入。上样后分步泵入40%,80%的乙醇溶液(V/V),洗脱速度为2.0 mL/min,根据图谱选择最佳吸附速度。
(2)洗脱速度对吸附动态试验结果的影响。树脂预处理后装入玻璃层析柱进行淋洗,上样质量浓度为2 mg/mL,以2.0 mL/min的速度泵入层析柱。上样后分步泵入40%,80%的乙醇溶液(V/V),洗脱速度分别为1.0,2.0,3.0 mL/min,根据图谱选择最佳洗脱速度。
(3) 上样质量浓度对吸附动态试验结果的影响。将预处理后的树脂装入玻璃层析柱后进行淋洗,制备大豆苷元质量浓度分别为1.0,2.0,3.0,4.0,5.0 mg/mL的提取液,吸附速度为2.0 mL/min。上样后分步泵入40%,80%的乙醇溶液(V/V),洗脱速度为2.0 mL/min,根据图谱选择最佳上样质量浓度。
2 结果与分析
2.1 大孔树脂吸附的静态吸附试验结果
2.1.1 树脂的选择
不同树脂对大豆苷元的静态吸附、解析效果见表1。

表1 不同树脂对大豆苷元的静态吸附、解析效果
AB-8和ADS-7型大孔树脂对大豆苷元的吸附率较好;HPD-600和AB-8型大孔树脂对大豆苷元的解析率较好;D101型大孔树脂的吸附率和解析率都比较差。综合静态吸附、解析效果,试验选择AB-8,HPD-600和ADS-7型大孔树脂分别进行静态吸附解析试验,以确定纯化大豆苷元最佳的树脂材料。
2.1.2 3种大孔树脂静态吸附、解析条件的确定
(1)吸附时间对吸附效果的影响。吸附时间对吸附效果的影响见图1。

图1 吸附时间对吸附效果的影响
由图1可知,AB-8,HPD-600型大孔树脂对大豆苷元的吸附率达到最高需4 h,ADS-7型大孔树脂需要8 h。AB-8和ADS-7型大孔树脂对大豆苷元的吸附效果比HPD-600型大孔树脂好。
(2)解析时间对解析效果的影响。
解析时间对解析效果的影响见图2。

图2 解析时间对解析效果的影响
由图2可知,AB-8,HPD-600,ADS-7型解析率分别在2,3,5 h达到最高,AB-8和HPD-600型大孔树脂解析率比ADS-7型大孔树脂高。
(3)洗脱剂乙醇体积分数对吸附效果的影响。
乙醇体积分数对解析效果的影响见图3。
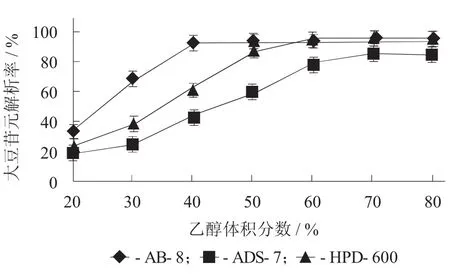
图3 乙醇体积分数对解析效果的影响
由图3可知,当乙醇体积分数为40%时,可以将AB-8型大孔树脂上吸附的大豆苷元解析完全,而ADS-7和HPD-600型大孔树脂需要60%的乙醇。
综上,AB-8型大孔树脂的吸附量大、吸附快、解析率高,适合用于大豆苷元的分离纯化。
2.2 AB-8型大孔树脂的动态吸附试验
2.2.1 吸附速度对动态吸附效果的影响
不同吸附速度的洗脱图谱见图4。
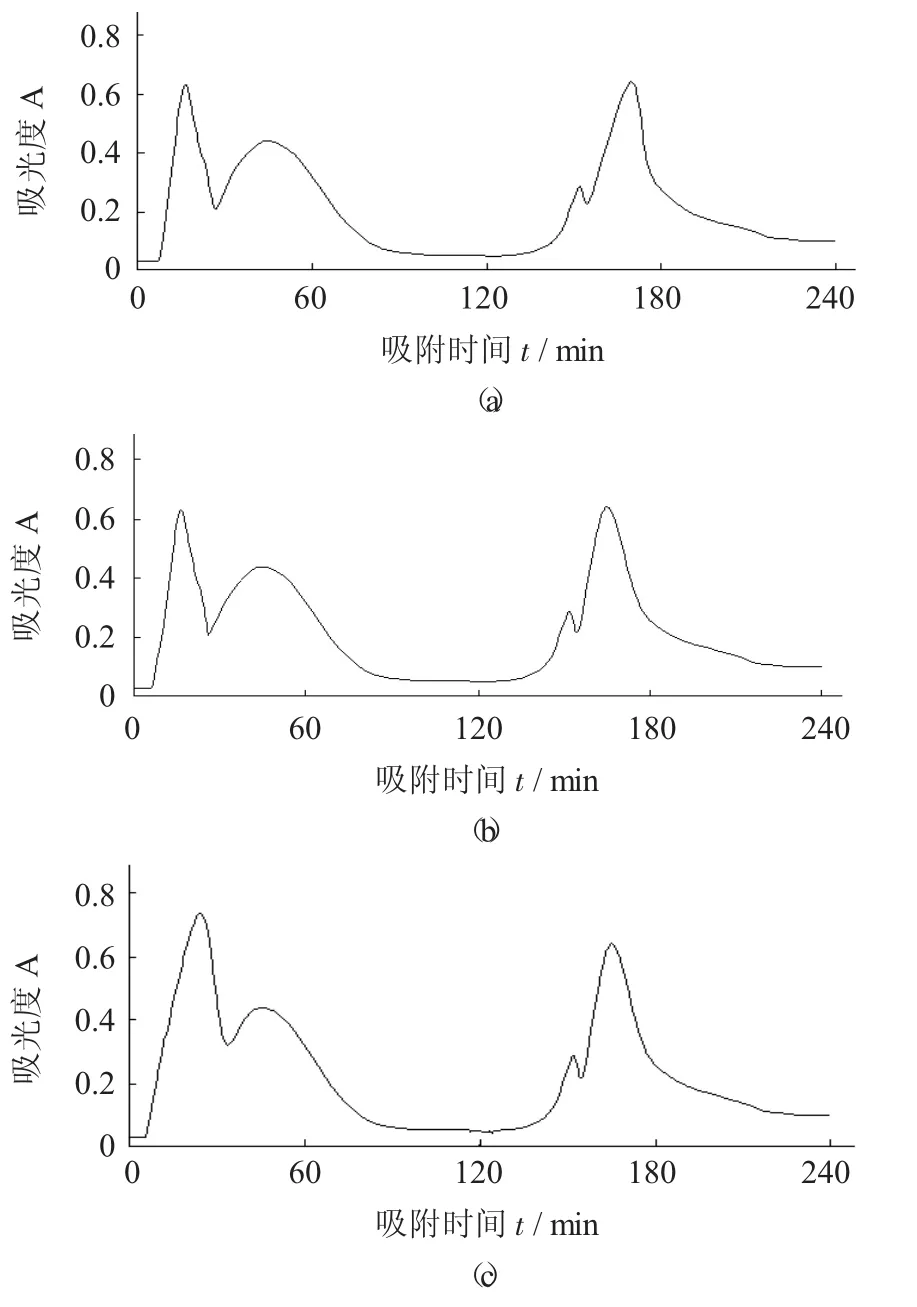
图4 不同吸附速度的洗脱图谱
由图4可知,吸附速度为1.0,2.0,3.0 mL/min,对动态吸附效果影响不大。故在实际操作中,可以选择与洗脱速度相同的吸附速度,不必再调节恒流泵。
2.2.2 洗脱速度对动态解析效果的影响
不同洗脱速度的洗脱图谱见图5。
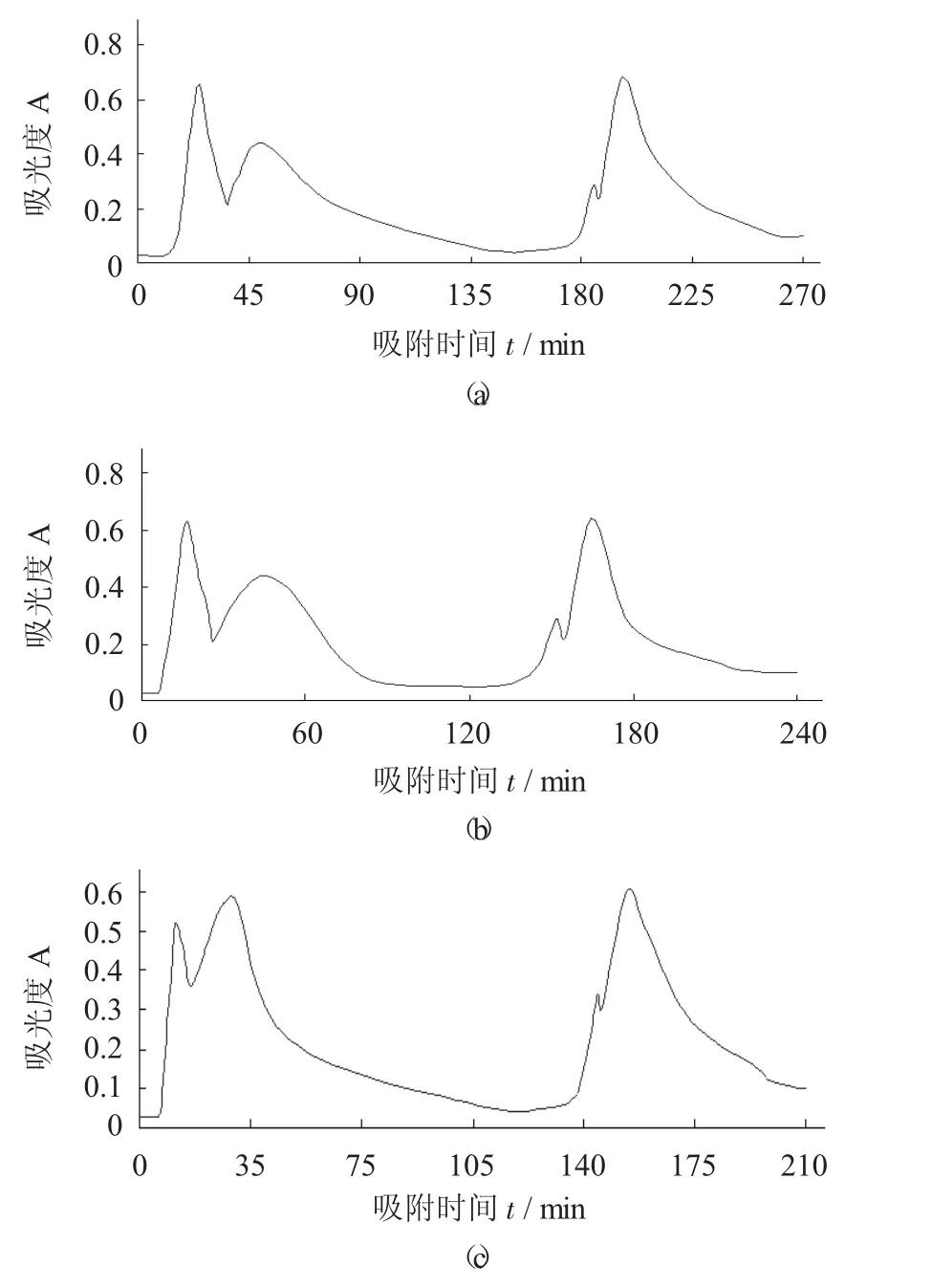
图5 不同洗脱速度的洗脱图谱
由图5可知,洗脱速度为2.0 mL/min时洗脱效果最好,有4个洗脱峰,40%与80%乙醇2个峰有较好的分离度;洗脱速度为1.0 mL/min时,洗脱峰均有拖尾,洗脱周期长且第2、第3洗脱峰重叠;洗脱速度为3.0 mL/min时,40%,80%乙醇洗脱2个峰的分离度均大幅下降。故选择洗脱速度为2.0 mL/min。
2.2.3 上样质量浓度对动态吸附效果的影响
不同上样质量浓度的洗脱图谱见图6。
由图6可知,当上样质量浓度为1,2,3 mg/mL时均有4个洗脱峰;当上样质量浓度为1,2 mg/mL时洗脱峰的分离度比较好,但峰型不好,收集范围不容易确定;当上样质量浓度大于3 mg/mL时,洗脱峰重叠较多,分离效果较差。故选择上样质量浓度为3 mg/mL。
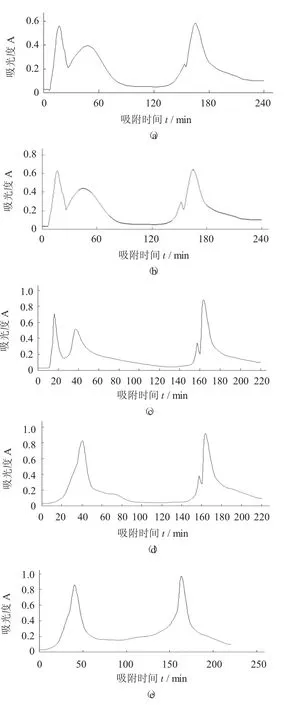
图6 不同上样质量浓度的洗脱图谱
2.2.4 最佳动态吸附解析条件下的洗脱图谱
最佳工艺的洗脱图谱见图7。

图7 最佳工艺的洗脱图谱
确定动态吸附解析条件为上样质量浓度3 mg/mL,吸附速度2.0 mL/min,洗脱速度2.0 mL/min。
2.3 纯化后大豆苷元的纯度
收集最佳工艺的洗脱液后进行浓缩,测定浓缩液的体积,通过高效液相色谱测定大豆苷元含量,冷冻干燥后称量。
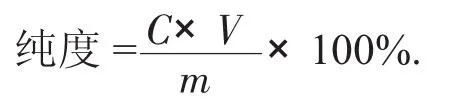
式中:C——大豆苷元含量,mg/L;
V——浓缩液体积,L;
m——冷冻干燥后质量,mg。
大豆苷元经AB-8型大孔树脂纯化后纯度为71.50%。
3 结论
通过比较AB-8,D101,ADS-7,HPD-600型大孔树脂对大豆苷元的静态吸附效果,选择了吸附量较大、吸附速度较快、解析率较高的AB-8型大孔树脂对大豆苷元进行分离纯化。确定最佳动态吸附解析条件为上样质量浓度3 mg/mL,吸附速度2.0 mL/min,洗脱速度2.0 mL/min,大豆苷元的纯度为71.50%。
[1] 包启安.酱及酱油的起源及其生产技术(一) [J].中国调味品,1992(9):3-6,25.
[2] 范俊峰,李里特,张艳艳,等.传统大豆发酵食品的生理功能 [J].食品科学,2005,26(1):250-254.
[3] 彭义交,刘宗林.大豆异黄酮双向纸层析分析方法的研究 [J].食品科学,2004,25(4):141-144.
[4] 杨学东,邓志成,王晶,等.反相高效液相色谱法制备纯化大豆异黄酮糖苷 [J].色谱,2006,24(4):363-366.
[5] 曲丽萍,宓鹤鸣,范国荣,等.高速逆流色谱法分离制备淡豆豉中大豆素和染料木黄酮 [J].中草药,2006,37(3):375-377.
[6] 李乃洁,周长民,刘然.合成着色剂标准样品杂质纯化的基本方法 [J].品牌与标准化,2011(24):35-37.
[7] 王如意,安日明.HP20大孔吸附树脂对L-苯丙氨酸吸附条件的研究 [J].广东化工,2011(6):78-80.
[8] 陈琛.白藜芦醇提纯技术研究进展 [J].精细与专用化学品,2011(3):39-42.◇
Study on Purification of Daidzein from Soy Sauce by Macroporous Resin
GUAN Chen,*LI Zhijiang,WEI Chunhong,ZANG Yanqing,WANG Helin,DING Jie
(College of Food Science,Heilongjiang Bayi Agricultural University,Daqing,Heilongjiang 163319,China)
In order to free soy is oflavones daidzein as research object,using AB-8 resin to isolate and purify daidzein which extracted from soy sauce.The results show that AB-8 resin has a good isolation and purifying ability for daidzein.The optimum conditions are as follows:the concentration of loading sample is 3 mg/mL,the adsorption flow rate is 2.0 mL/min,the desorption flow rate is 2.0 mL/min.Under these conditions,the purity of daidzein is 71.50%.
daidzein;macroporousresin;purification
S816.7
A
10.16693/j.cnki.1671-9646(X).2016.10.004
1671-9646(2016)10a-0013-04
2016-08-22
大庆市指导性科技计划项目(SZDFY201533)。
关 琛(1983— ),女,硕士,讲师,研究方向为发酵与酿造技术。
*通讯作者:李志江(1977— ),男,博士,副教授,研究方向为发酵与酿造。
