氢气还原钨酸锌的标准生成吉布斯自由能变计算及实例
2016-11-17邓登飞黄泽辉赵立夫张立
邓登飞,黄泽辉,赵立夫,张立
氢气还原钨酸锌的标准生成吉布斯自由能变计算及实例
邓登飞1,黄泽辉2,赵立夫2,张立1
(1.中南大学粉末冶金国家重点实验室,湖南长沙410083;2.崇义章源钨业股份有限公司,江西崇义341300)
针对人工计算标准生成吉布斯自由能变比较复杂且工作量大等问题,采用MATLAB软件对氢气还原钨酸锌反应进行了ΔrGθT计算和绘图,获得了该反应的标准生成吉布斯自由能变,并通过该软件获得了一次拟合函数式。通过拟合函数可知,该反应为吸热反应,升高温度有利于反应的进行。在不同的温度下获得了氢气还原钨酸锌的产物,结果表明:还原温度为700℃时,反应未完全,产物的XRD表明还有钨酸锌存在;当反应温度为900℃时,反应已经完全,产物的XRD分析为钨粉,同时通过SEM观察该钨粉为超细粉末;当反应温度为1 100℃时,获得亦是钨粉,但该粉末晶粒之间的桥连现象比较多。由试验可知,该反应能够进行且为吸热反应,证实了MATLAB软件计算、拟合出的函数与实际相符,论证了该方法的科学性。
MATLAB;钨酸锌;还原;标准生成吉布斯自由能;吸热反应;超细钨粉
0 引言
吉布斯自由能G是物理化学中非常重要、应用非常广泛的一个热力学状态函数[1-2]。在任意条件下,无论是简单的状态变化过程,还是复杂的化学变化过程和相变化过程,当系统处于一定状态时就有确定的吉布斯自由能G,而当系统的状态发生改变时就有吉布斯自由能变ΔG的存在。ΔG是分析和判断反应及相变能否进行的重要参数,其值越负,表明反应向指定方向进行的可能性越大[3]。
由于实际反应和相变的条件很复杂,难以计算出ΔG的值。在实际应用时,通常采用计算ΔrGθT的结果来近似分析和判断反应及相变发生的可能性。通过采用MATLAB进行热力学计算,可以解决以往的热力学计算大部分采用人工计算,存在计算量大,耗时长,易出错等问题。刘莎[4]等介绍了一种用MATLAB软件计算反应无相变的ΔrGθT及绘图的简便方法,此后该团队[5]在介绍TiC涂层反应时,同样通过MATLAB软件精确计算和绘制TiC涂层反应的与温度关系图形与温度关系图形,虽然有提及相变反应,但是没有给出程序代码。
在钨生产过程中,主要的固体中间产物为仲钨酸铵(APT)和偏钨酸铵(AMT)。目前研究人员对如何获得这两种固体中间产物,以及如何后续使用这两种物质进行了广泛而全面的研究。实际上从钨酸铵溶液到APT固体,是一个氨气和水蒸气的挥发过程[6-7]。该过程将需要大量的能源,同时挥发的氨气也是造成环境污染的气体,回收氨尾气需要大量的资金。如何避免出现氨尾气的问题,目前还没有相关研究。
钨酸锌目前一般作为功能材料[8-9],广泛地应用在微波材料、闪烁体材料及光学晶格材料等领域,主要是因它具有高化学稳定性、高X射线吸收系数、低衰减时间、高平均折射系数及低长余辉发光等性能。同时我们可知钨酸锌不溶于水,溶度积为1.2× 10-8。而把钨酸锌作为钨产业链中的中间产物进行使用未见相关报道。
本文采用MATLAB软件,通过理论计算获得了H2还原ZnWO4的ΔrG与T的表达式,且通过该软件画出了ΔrG-T图,拟合出两者的线性关系。同时通过试验来进一步证实了钨酸锌被氢气还原的可行性,以及如何使用MATLAB软件对有相变、熔化或者蒸发存在的化学反应进行了热力学计算,为试验提供理论依据。
1 建立标准吉布斯自由能变计算模型
首先可以根据实用无机物热力学数据手册[10]查得反应方程式(1)中各反应物和生成物的热力学数据,见表1。
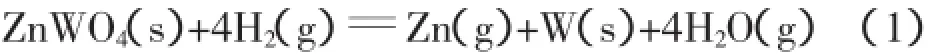
由表1数据可知,此Zn存在熔化点TM=693K和蒸发点TB=1 180 K。
该反应的ΔrG的计算公式为[11]:
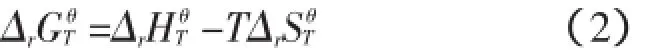

表1 各反应物和生成物的热力学数据[10]Tab.1 Thermodynamic data of reactants and products
而在T时,标准反应焓差ΔrHθT可表示为:

该反应中除Zn存在熔化点TM=693 K和蒸发点TB=1 180 K,其他各物质(ZnWO4,H2,W,H2O)没有相变点、熔化点和蒸发点。物质i在T时的标准生成ΔHθ(i,f,T),可表示为:

而存在熔化点TM=693 K和蒸发点TB=1 180 K的Zn,它的标准生成ΔHθ(i,f,T),可表示为:




式(2)~(8)中:ΔHM为Zn在熔点TM时的熔化热;ΔHB为Zn在沸点TB时的蒸发热;T为反应温度;TM为Zn的熔化温度;TB为Zn的挥发温度;Δ表示为纯物质i在T时的标准摩尔热;Δ表示为纯物质i在298 K时的标准摩尔热;Δ表示为纯物质Zn在T时的标准摩尔热;Δ表示为纯物质Zn在298K时的标准摩尔热;纯物质i表示:ZnWO4(s),H2(g),W(s),H2O(g);Δ表示为纯物质i在T时的标准摩尔熵;Δ表示为纯物质i在298 K时的标准摩尔熵;Δ表示为纯物质Zn在T时的标准摩尔熵;Δ表示为纯物质Zn在298 K时的标准摩尔熵;Cp,i表示为纯物质i摩尔定压热容;Cp,Zn表示为纯物质Zn在固态时的摩尔定压热容;C'p,Zn表示为纯物质Zn在液态时的摩尔定压热容;C''p,Zn表示为纯物质Zn在气态时的摩尔定压热容。
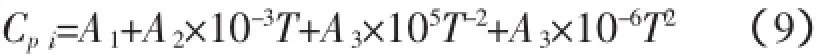
结合表1的热力学数据并根据式(2)~(9),可以得到以下各表达式。
W在T时标准摩尔热的表达式:
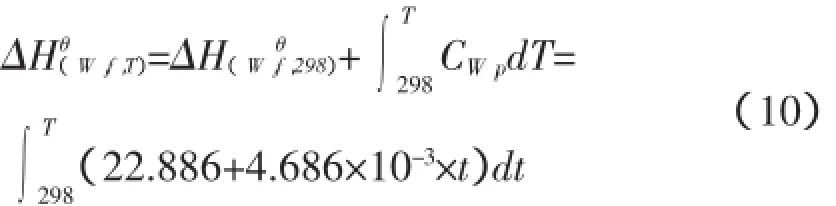
H2O在T时标准摩尔热的表达式:

Zn在T时标准摩尔热的表达式:

ZnWO4在T时标准摩尔热的表达式:

W在T时的标准摩尔熵的表达式:
Zn在T时标准摩尔熵的表达式:

ZnWO4在T时标准摩尔熵的表达式:


由式(2)~(19),可以获得如下模型:

2MATLAB编程和绘图
根据已建立的热力学计算模型以及等式(10)~(20),利用MATLAB进行编写计算与绘图程序。为了
程序代码如下所示:


运行上述程序所得计算和绘图结果如图1所示。

即直线方程为:ΔrG=-175.63T+314 414.407。

图1 氢还原钨酸锌Δr与温度的关系(T≥1180K)Fig.1 Relationship between Gibbs free energy and temperature of H2reducing ZnWO4(T≥1 180 K)
在等温等压和只做体积功条件下,化学反应总是朝着Δr减少(即Δr<0)的方向自发进行。通过MATLAB软件拟合函数Δr=-175.63T+314 414.407可知,当没有外界做功时,T≥1 790.21 K(1 517.06℃)时,氢气还原钨酸锌的反应才能自发进行,临界温度T0≈1 790.21 K。
通过拟合函数可知,Δr≈314 414.407 J/mol,该反应为吸热反应,升高温度有利于反应的进行。
3 试验
3.1钨酸锌的制备和检测
文献[8]制备钨酸锌的工艺是利用分析纯的Na2WO4·2H2O和Zn(NO3)2·6H2O,溶于100 mL蒸馏水中,用HNO3和NaOH进行调节pH值,然后加入含有溴化十六烷基三甲基铵充分搅拌30 min后,将溶液移入150 mL聚四氟乙烯水热釜中,于180℃下保温24 h,并用水和乙醇清洗数次沉淀产物后烘干,既可以获得超细钨酸锌纳米棒。而文献[9]是采用分析纯的Na2WO4·2H2O和ZnCl2,在聚四氟乙烯水热釜中,于160℃下保温24 h,其余工艺条件同文献[8],获得所需的钨酸锌固体。为了节约成本以及控制产物中杂质元素钠的干扰,作者采用生产钨酸铵浓料(以三氧化钨浓度计,WO3=266.42 g/L)与乙酸锌(分析纯)在1 L分解釜中进行反应,制备钨酸锌。反应的条件为:温度160℃,时间为2.5 h,搅拌速度为450 r/min,乙酸锌用量1.1倍。反应结束后,获得的钨酸锌经100℃烘干,用于检测和后续还原试验。
采用X-光能谱仪分析沉淀的物相;采用场发射扫描电镜观察沉淀物质的形貌。
检测结果图2和图3所示。从图2可知,沉淀获得的物质为钨酸锌。由图3可知,获得的钨酸锌形貌为小颗粒的团聚体,自制的钨酸锌活性比较大。

图2 沉淀获得物质的XRD图谱Fig.2 XRD spectrum for the precipitated matter

图3 沉淀获得物质的SEM形貌Fig.3 SEM morphology for the precipitated matter
3.2结果与讨论
将制备的钨酸锌固体称量10 g,装入陶瓷舟皿。然后将舟皿通入到小型管式定碳炉进行反应。试验用到的小型管式定碳炉额定温度为1 200℃,试验采用的钨酸锌是自制的,且通入露点为-65~-70℃的氢气,探索在低于理论计算获得自发反应温度T0= 1 517.06℃下,该反应能否自发进行,且反应与温度的关系。设定的反应条件为温度700℃、900℃、1 100℃,时间1.5 h,氢气流量为0.5 m3/h。反应结束后,自然冷却至室温,并将还原产物送检测分析。
从图4可知,当反应温度为700℃时,钨酸锌未被完全还原;当反应温度为900℃时,还原产物为单一晶型的钨粉;而当反应温度为1 100℃时,产物为不同晶型的钨粉。可以说明该反应为吸热反应,与通过MATLAB计算的结果相吻合。

图4 氢气还原钨酸锌获得产物的XRD图谱Fig.4 XRDspectrumforthehydrogenreducedproductfromzinctungstate
从图5可知,反应温度为900℃时,获得的钨粉为超细颗粒,晶型单一,钨晶粒之间的桥连现象较少。而反应温度为1100℃时,获得的钨粉也为超细颗粒,钨晶粒之间的桥连现象比较多,是由于两种不同晶型的钨晶粒之间发生了相互转化,与XRD结果一致。
从试验中,我们可以看出自制的钨酸锌能在900℃下获得钨粉,该温度低于理论计算获得自发反应温度T0=1 517.06℃。主要原因[12-13]是由于化学反应的等温方程式为ΔrGT=ΔrG+RT×LnQp,式中ΔrGT是指在指定条件下反应的吉布斯自由能变化,它是表示化学反应进行方向的物理量变化。而ΔrG是指反应的标准吉布斯自由能变化,它是表示化学反应进行限度的物理量,ΔrG=ΔrH-TΔrS。因此,有气相存在的反应,ΔrGT和ΔrG是可以不一样的,从而获得的反应自发进行的温度也是不一样的。其中,ΔrGT还与参与反应中各气相的分压Qp有直接的关系。

图5 氢气还原钨酸锌获得产物的SEM形貌Fig.5 SEM morphology for the Hydrogen reduced product from zinc tungstate
4 结论
MATLAB软件的运用使ΔrG与T关系的计算和绘图变得简便,极大程度上减少了人工计算量,丰富了存在相变ΔrG与T关系的计算途径,能够拟合ΔrG与T关系。本文通过MATLAB软件的计算和拟合,获得了氢气还原钨酸锌的ΔrG=-175.63T+ 314 414.407。通过自制的钨酸锌通入氢气进行还原,温度为700℃时反应未完全,而反应温度为900℃时反应完全,获得晶型单一的超细钨粉,且低于理论计算获得自发反应温度T0=1 517.06℃。
[1]张颖.吉布斯自由能的多功能性质探讨[J].大学化学,2011,26(2):67-72.
ZHANG Ying.On the multi functional properties of Gibbs's free energy[J].University Chemistry,2011,26(2):67-72.
[2]刘有芹,颜芸,徐悦华.物理化学中吉布斯自由能理解及计算[J].广东化工,2010,37(12):150-151,158.
LIU Youqin,YAN Yun,XU Yuehua.The understanding and calculation of Gibbs's free energy in physical chemistry[J]. Guangdong Chemical Industry,2010,37(12):150-151,158.
[3]王淑兰.物理化学[M].北京:冶金工业出版社,2007.
[4]刘沙,张静秋.关于标准生成吉布斯自由能的一种计算方法及绘图实例[J].稀有金属与硬质合金,2004,32(4):56-58.
LIU Sha,ZHANG Jingqiu.A method to calculate the free energy of Gibbs free energy and its drawing example[J].Rare Metal and Cemented Carbide,2004,32(4):56-58.
[5]刘沙,张静秋.TiC涂层反应标准吉布斯自由能变化的计算及其绘图[J].稀有金属与硬质合金,2005,33(4):60-62.
LIU Sha,ZHANG Jingqiu.The calculation and plotting of the free energy change of the reaction standard of TiC coating[J].Rare Metal and Cemented Carbide,2005,33(4):60-62.
[6]路辉,谢刚,万林生,等.生成条件对仲钨酸铵物性的影响[J].湿法冶金,2009,28(4):208-213.
LU Hui,XIE Gang,WAN Linsheng,et al.The influence of the formation conditions on the physical properties of ammonium[J]. Hydrometallurgy,2009,28(4):208-213.
[7]肖清清.仲钨酸铵制备的工艺研究和下游产品的开发[D].银川:宁夏大学,2009.
XIAOQingqing.Processresearchanddevelopmentofthe downstream products of the preparation process[D].Yinchuan:Physical Chemistry of Ningxia University,2009.
[8]梁英,刘素芹.超细钨酸锌纳米棒的制备及其光催化性能[J].应用化学,2014,31(1):65-68.
LIANG Ying,LIU Suqin.Preparation and photocatalytic properties of ultrafine zinc zinc nanorods[J].Application Chemistry,2014,31(1):65-68.
[9]李蕾,曾涑源,米玉伟,等.钨酸锌纳米结构的水热合成及其光催化性能研究[J].无机化学学报,2012,28(8):1643-1650.
LI Lei,ZENG Suyuan,Mi Yuwei,et al.Nano structure of zinc tungstate hydrothermal synthesis and photocatalytic properties[J]. Journal of Inorganic Chemistry,2012,28(8):1643-1650.
[10]胡建华,叶大伦.实用无机物热力学数据手册[M].第2版.北京:冶金工业出版社,2002.
[11]梁英教,车荫昌.无机物热力学数据手册[M].沈阳:东北大学出版社,1994.
[12]曹永,姚文志.普通化学中吉布斯自由能变的计算[J].科技信息,2012(2):141.
CAO Yong,YAO Wenzhi.Calculation of Gibbs free energy in general chemistry[J].Science and Technology Information,2012(2):141.
[13]陈瑞战,王晓菊.化学反应中吉布斯自由能不同表示方法的区别与联系[J].长春师范学院学报,2000(5):4-6.
CHEN Ruizhan,WANG Xiaoju.The difference and connection between the different representation methods of Gibbs's free energy in chemical reactions[J].Journal of Changchun Normal University,2000(5):4-6.
Standard Generation of Gibbs Free Energy Calculation and Instance of the Reaction of H2Reducing ZnWO4
DENG Dengfei1,HUANG Zehui2,ZHAO Lifu2,ZHANAG Li1
(1.State Key Laboratory of Powder Metallurgy,Central South University,Changsha 410083,Hunan,China;2.Chongyi Zhangyuan Tungsten Industry Co.,Ltd.,Chongyi 341300,Jiangxi,China)
To solve the heavy-workload in the artificial calculation of the standard generation of Gibbs free energy,the author used the MATLAB to calculate and draw the standard generation of Gibbs free energy on the reaction of the H2reduction ZnWO4.The reaction of the standard Gibbs free is obtained.The results show that the temperature for the endothermic reaction is beneficial.The results showed that the reaction was not complete when the temperature was 700℃,because the XRD of the product showed that there existed ZnWO4;when the reaction temperature was 900℃the reaction was complete,because the XRD analysis of the products was tungsten powder andtheSEMobservationoftheproductswastheUltrafinetungstenpowder;whenthereactiontemperaturewas1100℃,the products also was tungsten powder,and the powder grain bridging phenomenon was much more than the reaction temperature was 900℃.From the above experiments,it was known that the reaction could be carried out and it was endothermic reaction,which confirmed with the MATLAB calculation and fitting results.
MATLAB;ZnWO4;reduction;the standard generation of Gibbs free energy;endothermic reaction;ultrafine tungsten powder
TF125.2+41;TP399
A
10.3969/j.issn.1009-0622.2016.05.008
2016-06-17
邓登飞(1985-),男,江西上饶人,博士研究生,主要从事难熔金属与硬质合金的研究。
张立(1965-),女,湖南沅江人,博士,教授,本刊编委,主要从事硬质合金材料科学与工程研究。
