拮抗菌Burkholderia contaminans对玫瑰香葡萄采后灰霉病的抗性诱导
2016-11-15范三红施俊凤
范三红,李 静,施俊凤
(1.山西大学生命科学学院,山西 太原 030006;2.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031)
拮抗菌Burkholderia contaminans对玫瑰香葡萄采后灰霉病的抗性诱导
范三红1,李 静1,施俊凤2
(1.山西大学生命科学学院,山西 太原 030006;2.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031)
以玫瑰香葡萄为实验试材,研究洋葱霍尔德氏菌(Burkholderia contaminans B-1)对玫瑰香葡萄采后灰霉病的抗性诱导机理,对经拮抗菌处理贮藏后果实的腐烂率及其抗性相关物质进行测定。结果表明:拮抗菌B. contaminans B-1可有效降低玫瑰香葡萄采后腐烂率,与对照相比,果梗腐烂率降低69.58%,果肉腐烂指数降低63.93%。拮抗菌处理对果实苯丙烷代谢途径、活性氧代谢途径和其他抗性相关酶类活性均有影响。与对照相比,B. contaminans B-1处理可提高葡萄果实苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、超氧化物歧化酶(SOD)和多酚氧化酶(PPO)活性,促进过氧化氢(H2O2)含量积累,延缓过氧化氢酶(CAT)活性峰值出现的时间。此外, 拮抗菌处理也可以诱导果实病程相关蛋白几丁质酶(CHI)和β-1,3葡聚糖酶(GLU)活性的上升。
玫瑰香葡萄;生物防治;抗性诱导
玫瑰香葡萄又名麝香葡萄,因其含糖量高、着色好、麝香味浓而受到消费者喜爱[1],与其他品种相比,玫瑰香葡萄皮薄、含汁量大,在贮藏保鲜期间极易发生腐烂[2]。灰霉病是鲜食葡萄采后常见的一种病害,其病原菌灰葡萄孢霉(Botrytis cinerea)寄主范围广,耐低温,在葡萄贮藏环境中极易繁殖,直接影响其商品价值及食用价值[3]。果实采后生防技术是近年来发展起来的一种“绿色防腐”技术,与传统的SO2熏蒸处理相比,该技术具有对人畜安全无残毒、对环境无污染、对病原菌无抗性、且不破坏生态平衡等优点[4]。
果实采后抗性激发子主要包括生物因子和非生物因子。这些因子通过激发植物自身的抗病能力来有效抵御或杀死病原菌,从而降低腐烂[5]。生物因子主要指一些生防菌株,目前已有多种生防菌株诱导果实产生抗性的相关报道,如酵母拮抗菌P. membrunefacaen可以降低桃果实由葡枝根霉(Rhizopus stolonafer)引起的采后软腐病的发病率,还可提高果实过氧化物酶(peroxidase,POD)、多酚氧化酶(polyphenloxidase,PPO)、苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)等酶活性[6];Droby等[7]采用拮抗菌Candida oleophila喷洒葡萄表面,可显著提高其果实组织中几丁质酶(chitinase,CHI)和β-1,3葡聚糖酶(β-1,3-glucanase,GlU)活性。本实验以洋葱霍尔德氏菌(Burkholderia contaminans B-1)为生防菌株,研究其对玫瑰香葡萄采后抗病性的诱导机理,以期为葡萄采后生物防治技术的发展提供一定的参考依据。
1 材料与方法
1.1 材料、菌种与试剂
玫瑰香葡萄采自山西省太谷县玫瑰香种植基地,达到商品成熟期时进行采摘,采摘当天运回实验室预冷并贮藏于0 ℃冷库中。
洋葱霍尔德氏菌由本实验室分离于杏果实表面,并根据核糖体26S D1/D2区和ITS区核甘酸序列比对及生理生化特性进行鉴定;灰葡萄孢霉(Botrytis cinerea)分离于自然发病的葡萄果实,并通过ITS区和形态特征进行鉴定。
细菌培养基为LB培养基[8]:酵母膏10.0 g/L、蛋白胨 10.0 g/L、氯化钠5.0 g/L、pH 7.2;真菌培养基为PDA培养基[9]:马铃薯200 g/L、葡萄糖20 g/L、琼脂15 g/L、pH 7.0。
对氨基苯磺酸、3,5-二硝基水杨酸、酒石酸钾钠、邻苯二酚 天津市光复精细化工研究所;愈创木酚、a-萘胺、昆布多糖、甲壳素、核黄素、蜗牛酶 北京索莱宝科技有限公司;β-巯基乙醇、四氮唑蓝 美国Amresco公司。
1.2 仪器与设备
LS-B50L-I型立式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;DHP-9272型电热恒温培养箱 上海一恒科技有限公司;HPG-280BX光照培养箱 哈尔滨市东联电子技术开发有限公司;GL-20G-II离心机 上海安亭科学仪器厂;Ultrospec 2000紫外-可见分光光度计美国Pharmacia公司。
1.3 方法
1.3.1 实验材料的制备与果实处理
1.3.1.1 洋葱霍尔德氏菌发酵原液的制备
将-80 ℃保存的拮抗菌B-1在LB固体培养基活化后,挑取经活化的LB固体培养基上的拮抗菌B. contaminans B-1单菌落在300/1 000 mL LB液体培养基中28 ℃条件下200 r/min振荡培养24 h。
1.3.1.2 霉菌孢子悬浮液制备
将灰葡萄孢霉(Botrytis cinerea)于PDA平板培养7 d后,刮取分生孢子,采用血球计数法用无菌水配制成浓度为1.0×l05spores/mL的孢子悬浮液。
1.3.1.3 果实贮藏效果样品处理
挑选外观无机械伤且成熟度一致的玫瑰香葡萄于拮抗菌LB不同浓度(a.发酵原液;b.稀释5 倍发酵液;c.稀释10 倍发酵液)培养液中浸泡2 min(对照不进行处理)后分别置于灭菌塑料筐(每筐20 串,每串约20 粒果实)中,于0 ℃条件下保湿贮藏70 d后检查。实验重复3 次。
1.3.1.4 果实抗性相关物质指标测定样品处理
挑选无机械伤且成熟度一致的玫瑰香葡萄约750 粒,将其随机等量分为对照组和处理组,将两组果实于2%的次氯酸钠溶液中浸泡2 min,无菌风吹干,用灭菌针在其赤道部位刺直径4 mm深度3 mm的伤口,每个葡萄各刺1 个伤口。处理组在伤口处加30 μL B. contaminans的24 h发酵液,对照组加30 μL无菌水。2 h后于各伤口处再加15 μL霉菌孢子悬浮液,无菌风吹干后于25 ℃培养箱中保湿培养6 d。每天分别取50 粒处理组和对照组果实,于其伤口处病斑与健康组织交接部位的果肉作为实验材料,液氮处理后于-80 ℃条件下贮存待用。实验重复3 次。
1.3.2 果实贮藏效果测定
对贮藏70 d后的果实和果梗腐烂程度进行调查,根据腐烂程度将果实分级后称质量,并按(1)、(2)分别计算果梗腐烂率、果实腐烂指数。
果梗发生霉变为腐烂,未发生霉变为正常。

根据果实腐烂程度分为5 个等级,分级标准如下:其中0级:果实完好,无任何腐烂;1级:果实表面现轻微斑点,腐烂面积占果面的1/3以下;2级:果实果面有明显腐烂,腐烂面积约占果实表面的1/3~1/2;3级:果实超过果面的1/2腐烂,但果实尚有一定硬度;4级:果实整体完全溃烂。将果实分级后分别称质量。

1.3.3 果实抗性相关物质指标测定
1.3.3.1 苯丙烷类代谢途径相关酶的活性测定
在植物抗病反应中,许多重要的抗菌物质都可在苯丙烷类代谢途径中产生,PAL和POD、PPO分别是该代谢途径的第一关键酶和末端相关酶[10]。实验中PAL活性测定方法参照Assis等[11]的方法加以改进,酶活性以每小时波长290 nm处吸光度增加0.01为一个酶活单位(U)。PPO活性测定采用邻苯二酚法[12],以每分钟波长398 nm处吸光度上升0.1作为一个酶活单位(U)。POD活性测定采用愈创木酚法[13],以每分钟波长460 nm处吸光度上升0.01作为一个酶活单位(U)。
1.3.3.2 活性氧代谢途径相关指标的测定
活性氧与植物的抗病性密切相关,植物受病原菌侵染时体内会积累过氧化氢(H2O2)超氧阴离子自由基(O2-·),同时活性氧清除和保护相关酶过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和POD活性也会随之发生变化。CAT活性参照Wang等[14]的方法加以改进,以每分钟波长240 nm处吸光度下降0.001作为一个酶活单位(U)。SOD活性参照Prochazkova等[15]方法加以修改,以每毫克蛋白的反应体系抑制氮蓝四唑光化还原的50%为一个SOD活性单位(U/g)。H2O2含量参考杜淑红等[16]的方法进行改进,含量以μmol/mL表示。·产生速率的测定参照王爱国等[17]方法加以修改,产生速率以nmol/(min·g)表示。
1.3.3.3 其他抗性相关酶活测定
CHI和GlU是植物中普遍存在的抗性物质,它们可分别水解真菌细胞壁主要组分几丁质和1,3-葡聚糖。CHI和GLU活性分别参考赵妍[18]的方法加以改进,CHI以每毫升上清液每小时分解胶体几丁质所释放1 μmol N-乙酰葡萄糖胺作为一个酶活单位(U),GLU以每毫升上清液每小时分解产生1 mg葡萄糖作为一个酶活单位(U)。
1.4 数据统计与分析
用软件DPS 7.0进行数据统计分析和差异显著性分析。
2 结果与分析
2.1 拮抗菌对玫瑰香葡萄采后贮藏自然腐烂抑制效果
由图1可知,采用拮抗菌的发酵液处理玫瑰香葡萄,于0 ℃条件下贮藏70 d后,3 个不同浓度的发酵液均能有效抑制葡萄的腐烂(P<0.05)。对照果梗和果肉大部分发生霉变腐烂,而采用拮抗菌(Burkholderia contaminans)处理后,腐烂程度显著降低。其中稀释5 倍的发酵液贮藏效果最好,发酵原液效果次之,稀释10 倍发酵液效果相对差些。对照果梗的腐烂率达到100%,果肉腐烂指数为67.14%;而稀释5 倍的发酵液其果梗腐烂率仅为30.42%,果肉腐烂指数仅为3.21%,果梗腐烂率降低69.58%,果肉腐烂指数降低63.93%。

图1 拮抗菌对葡萄采后贮藏腐烂的抑制效果Fig.1 Inhibitory effect of antagonistic bacterial treatment on postharvest rot rate of grapes
2.2 拮抗菌处理对葡萄果实PAL、POD、PPO活性的影响
PAL作为苯丙烷类代谢第一步反应的关键酶,参与植物木质素、植保素和酚类等抗病相关物质的生物合成,PPO氧化酚类物质生成的高毒性醌类物质可限制和毒杀入侵的病原微生物,POD与植物内木质素和植保素的合成及对植物细胞有害的H2O2和O2-·的清除密切相关[19]。
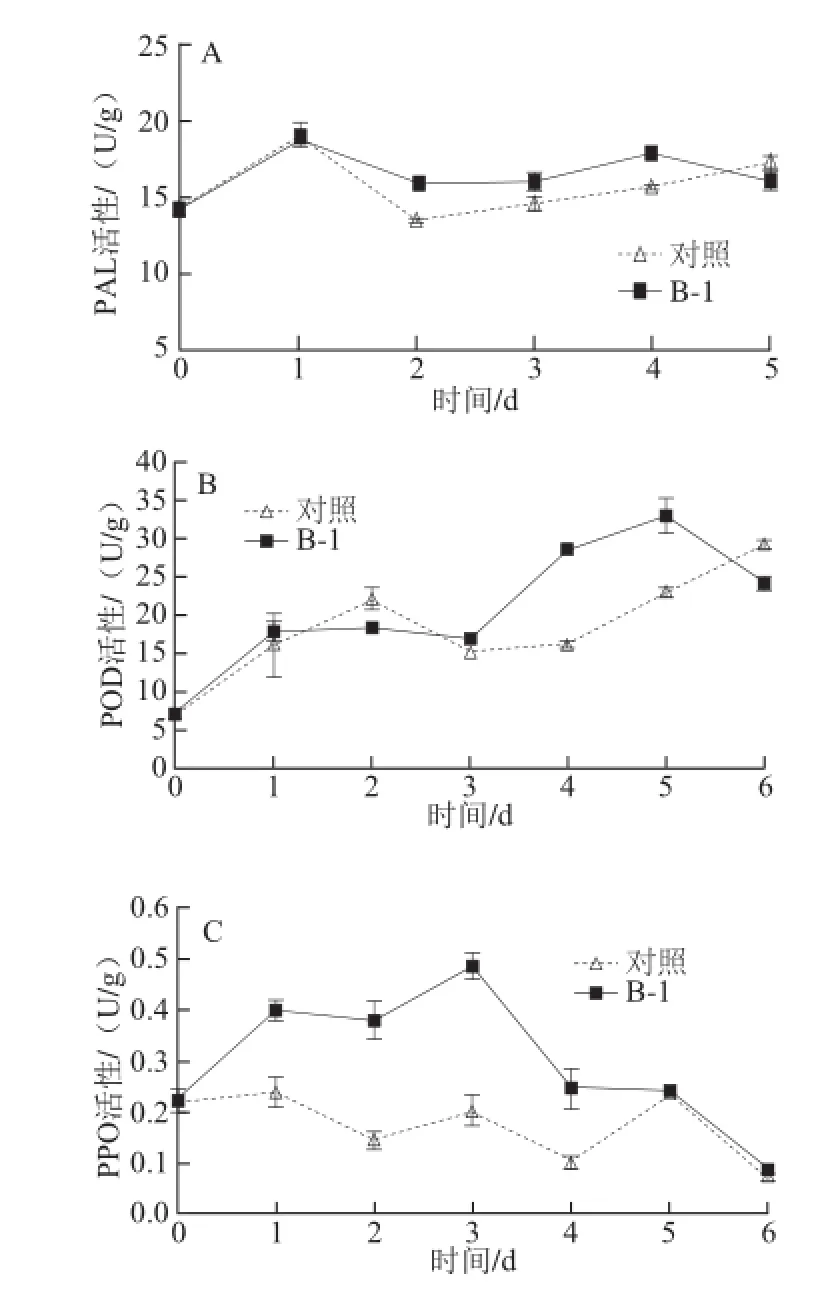
图2 拮抗菌处理对葡萄采后PAL(A)、POD(BB)和PPO(CC)活性的影响Fig.2 Effect of antagonist bacterial treatment on the activities of PAL (A), POD (B) and PPO (C) of postharvest grape
由图2A可知,对照和处理的PAL活性均在第1天时达到高峰,且有一个相近的峰值,在随后的1~5 d,拮抗菌处理过的果实PAL活性稳定高于对照,处理后5 d时,两者间差异缩小。图2B中处理组和对照组的POD活性整体呈上升趋势,前3 d该酶活性差异不大,从第3天开始,处理组的POD活性迅速上升,且数值显著高于对照,到第5天时,两者差别缩小。从图2C可看出,在整个贮藏期间处理组果实的PPO活性显著高于对照,相比对照不明显的变化趋势,实验组的PPO活性在第1天就开始快速上升,在第3天时达到高峰然后开始下降。
2.3 拮抗菌处理对葡萄果实CAT、SOD活性、H2O2含量和·产生速率的影响
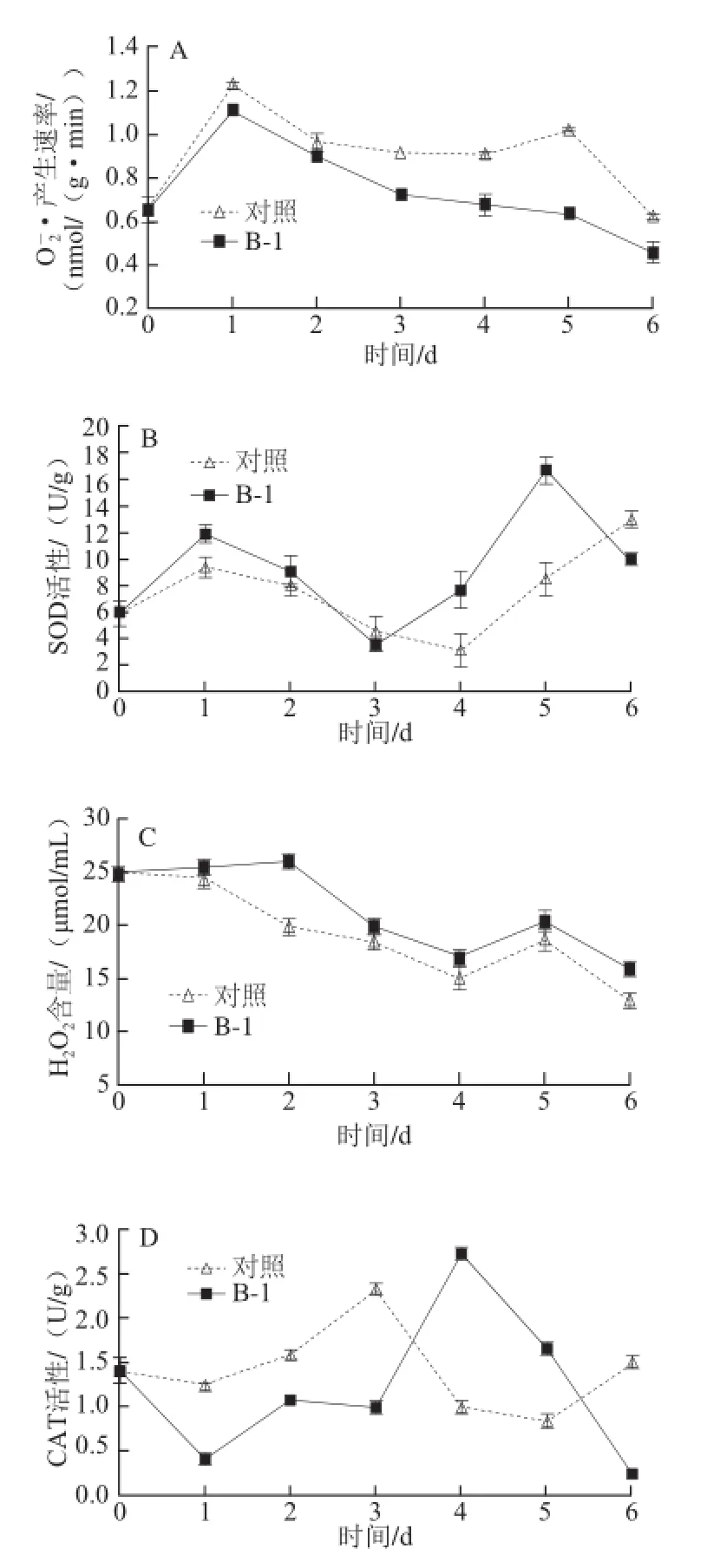
图3 拮抗菌处理对葡萄采后O2·产生速率(A)、SOD活性(BB)、H2O2含量(C)和CAT活性(D)的影响Fig.3 Effect of antagonist bacterial treatment on· production rate (A), SOD activity (B), H2O2content (C) and CAT activity (D) of postharvest grape
在逆境胁迫下,植物组织最快的抗病反应就是形成大量的活性氧(reactive oxygen species,ROS),主要包括H2O2和·等。活性氧不仅能直接杀害入侵的病原微生物,还与植物的过敏反应密切相关。SOD是防御生物体发生氧化损伤的一种酶类,可通过催化·发生反应生成H2O2和分子氧,在随后的反应中,H2O2在CAT等物质的作用下转变为水和分子氧[20]。
2.4 拮抗菌处理对葡萄果实CHI、GLU活性的影响
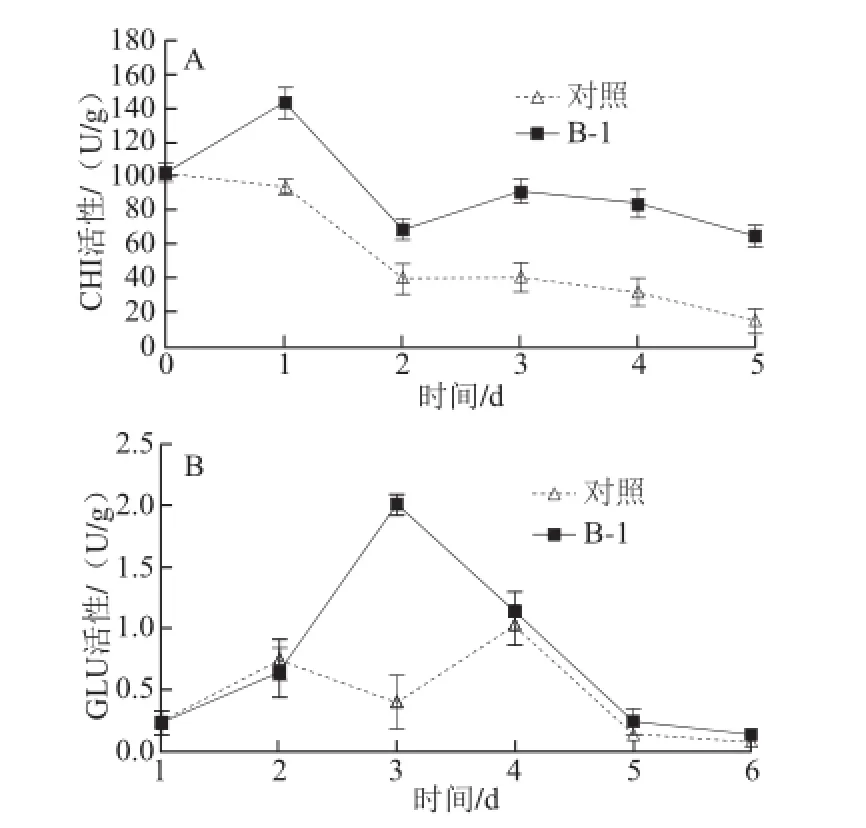
图4 拮抗菌处理对葡萄采后CHI(A)和GLU(B)活性的影响Fig.4 Effect of antagonist bacterial treatment on the activities of CHI (A) and GLU (B) in postharvest grape
由图4A可知,拮抗菌处理的葡萄果实CHI活性显著高于对照组,随着贮藏期的延长,对照组CHI活性快速下降,而处理组在第1天的CHI活性略有上升,形成了一个高峰而后下降。由图4B可知,处理组和对照组在贮藏第1、2天和第4、5天时两者GLU活性差别不太大,除第1天外处理组较对照组稍有增加。但是两者区别明显在于第3天,在第3天时对照组酶活达到最低点,而处理组酶活明显升高,达到最高点,在该时间点处理组酶活是对照组的3 倍左右。
3 讨 论
近年来国内外对葡萄采后贮藏灰霉病的控制主要采用低温结合SO2熏蒸,此技术虽效果显著,应用广泛,但会产生病原微生物抗药性增加、有害人体健康、环境污染等一系列问题[21]。在本研究中,经洋葱霍尔德氏菌发酵液浸泡后的玫瑰香葡萄贮藏后其果梗的霉变及果肉的腐烂率显著低于对照,其中果梗腐烂率降低69.58%,果肉腐烂指数降低63.93%,说明此拮抗菌对葡萄果实具有很好的贮藏保鲜效果。在果蔬贮藏生物防治技术中,诱导抗性是其一个重要方面[22],苯丙烷代谢活性增强是植物诱导抗性后的典型反应,实验中经拮抗菌处理的葡萄果实苯丙烷类代谢中第一关键酶PAL和末端酶POD、PPO均高于对照,其活性的增强了有利于木质素、植保素、酚类等抗性物质的生物合成,提高了植物对病原菌侵染的抵抗能力,这一结论与前人研究[23]一致。其次拮抗菌处理的玫瑰香果实活性氧代谢较为活跃,一般情况下,在动植物细胞中活性氧的产生与清除均存在着一个动态平衡[24]。实验中,和对照组相比,拮抗菌处理的葡萄果实在贮藏期的第1天其SOD活性快速上升而CAT活性显著减少,该变化促使了H2O2在葡萄果实细胞中的积累。因此,在贮藏期的第1天,处理组果实细胞中H2O2含量较高。已有研究[25]证明,H2O2的快速积累在植物的抗病反应中有着重要作用,它不仅具有直接的抗病原微生物功能,且其存在本身就可对病原菌产生伤害。而在贮藏后期处理组的CAT活性显著高于对照组,使果肉中积累的过多H2O2得到清除,从而避免了果实内活性氧过多而引起的机体损伤。另外本实验中处理组的CHI、GLU活性均高于对照,该结果与Yao Hongjie等[26]的研究结果符合,他们在研究中也证实CHI和GLU活性的升高与果蔬在贮藏期间表现出的抗病性密切相关。综上所述,拮抗菌(Burkholderia contaminans B-1)处理作为一种生物防治技术在葡萄采后贮藏中可显著提高果实的抗病能力,达到防腐保鲜的目的。
[1] 张福庆, 李巍, 田卫东, 等. 玫瑰香葡萄品种特性与汉沽产地分析[J].中外葡萄与葡萄酒, 2007(5): 39-42.
[2] 杨立鹏, 马巧玲, 李金红. 玫瑰香葡萄贮藏保鲜技术[J]. 保鲜与加工, 2001(6): 29.
[3] 陈宇飞, 文景芝, 李立军. 葡萄灰霉病研究进展[J]. 东北农业大学学报, 2006, 37(5): 693-699.
[4] 秦丹, 石雪晖, 林亲录, 等. 葡萄采后病害生物防治研究进展[J]. 食品与机械, 2007, 23(6): 142-144.
[5] WALLING L L. Induced resistance: from the basic to the applied[J]. Trends in Plant Science, 2001, 6: 445-447. DOI:10.1016/S1360-1385(01)02046-5.
[6] QIN G Z, TIAN S P, LIU H B, et al. Polyphenol oxidase, peroxilose, and phenylalanine ammoniumlyase induce in postharvest peach fruits by inoculation with Pichia membranefaciens or Rhizopus stolonifey[J]. Agricultural Sciences in China, 2002, 12: 1242-1249. DOI:10.1094/ PHYTO.2002.92.4.393.
[7] DROBYS, VINOKUR V, WISS B, et al. Induction of resistance to Penicillium in grapefruit by the yeast biocontrol agent Candida oleophila[J]. Phytopathology, 2002, 92: 393-399.
[8] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 46.
[9] NIEMANN H, LOSEKANN T, de BEER D, et al. Novel microbial communities of the Haakon Mosby mud volcano and their role as a methane sink[J]. Nature, 2006, 443: 854-858. DOI:10.1038/ nature05227.
[10] 王军节. 采前Harpin处理对厚皮甜瓜果实抗病性的诱导及其机理[D].兰州: 甘肃农业大学, 2006.
[11] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology, 2001, 23: 33-39. DOI:10.1016/S0925-5214(01)00100-4.
[12] TIAN S P, XU Y, JIANG A L, et al. Physiological and quality responses of longan fruit to high O2or high CO2atmospheres in storage[J]. Postharvest Biology and Technology, 2002, 24: 335-340. DOI:10.1016/S0925-5214(01)00153-3.
[13] 高海燕. 葡萄SO2伤害敏感性与果皮结构及生理生化特性关系的研究[D]. 杨凌: 西北农林科技大学, 2001.
[14] WANG Y S, TIAN S P, XU Y, et al. Changes in the activities of pro-and anti-oxidant enzymes in peach fruit inoculated with Cryptococcus laurentii or Penicillium expansum at 0 or 20 ℃[J]. Postharvest Biology and Technology, 2004, 34: 21-28. DOI:10.1016/ j.postharvbio.2004.04.003.
[15] PROCHAZKOVA D, SAIRAM R K, SRIVASTAVA G C, et al. Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J]. Plant Science, 2001, 161: 765-771. DOI:10.1016/ S0168-9452(01)00462-9.
[16] 杜淑红, 陈剑杰. 分光光度法测定海蜇中过氧化氢的含量[J]. 广东微量元素科学, 2012, 19(23): 9-11.
[17] 王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J].植物生理学通讯, 1990, 26(6): 55-57.
[18] 赵妍. 拮抗酵母及结合热空气处理对樱桃番茄采后病害的防治及其机理研究[D]. 南京: 南京农业大学, 2010.
[19] 王军节. 采前Harpin处理对厚皮甜瓜果实抗病性的诱导及其机理[D].兰州: 甘肃农业大学, 2006.
[20] CHAN Z L, TIAN S P. Induction of H2O2metabolizing enzymes and total protein synthesis by antagonistic eyeast and salicylic acid in harvested sweet cherry fruit[J]. Postharvest Biology and Technology, 2006, 39: 314-320. DOI:10.1016/j.postharvbio.2005.10.009.
[21] 关文强, 张华云, 刘兴华, 等. 葡萄贮藏保鲜技术研究进展[J]. 果树学报, 2002(5): 326-329.
[22] 李淼, 产祝龙, 田世平, 等. 果实采后病害诱导抗性研究进展[J]. 保鲜与加工, 2010, 10(5): 1-7.
[23] 秦国政, 田世平, 刘海波, 等. 拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J]. 中国农业科学, 2003, 36(1): 89-93.
[24] HEMANDEZ J A, FERRER M A, JIMANEZ A, et al. Antioxidant systems and O2-/H2O2production in the apoplast of pea leaves. Its relation with salt-induced necrotic lesions in minor veins[J]. Plant Physiology, 2001, 127: 817-831.
[25] XU X B, TIAN S P. Salicylic acid alleviated pathogen-induced oxidative stress in harvested sweet cherry fruit[J]. Postharvest Biology and Technology, 2008, 49: 379-385. DOI:10.1016/ j.postharvbio.2008.02.003.
[26] YAO H J, TIAN S P. Effect of a biocontrol agent and methyl jasmonate on postharvest diseases of peach fruit and the possible mechanisms involved[J]. Journal of Applied Microbiology, 2005, 98: 941-950. DOI:10.1111/j.1365-2672.2004.02531.x.
Induction of Disease Resistance against Botrytis cinerea in Postharvest Muscat Grape by Antagonistic Bacterium Burkholderia contaminans
FAN Sanhong1, LI Jing1, SHI Junfeng2
(1. College of Life Science, Shanxi University, Taiyuan 030006, China; 2. Institute of Agricultural Product Storage and Fresh Keeping, Shanxi Academy of Agricultural Sciences, Taiyuan 030031, China)
In this study, the mechanism by which the antagonistic bacterium Burkholderia contaminans B-1 induces resistance to Botrytis cinerea in postharvest Muscat grape berry was investigated. The results showed that B. contaminans B-1 reduced significantly the rot rate of postharvest grape berries. Compared with the control, the rot rates of the stem and fruit treated with B. contaminans were decreased by 69.58% and 63.93%, respectively. B. contaminans B-1 could affect the phenylpropanoid metabolic pathway, reactive oxygen species metabolic pathway, and the activities of resistance-related enzymes. Treatment with B. contaminans B-1 enhanced the activities of phenylalanine ammonia-lyase (PAL), peroxidase (POD), superoxide dismutase (SOD) and polyphenloxidase (PPO). B. contaminans B-1 also increased hydrogen peroxide (H2O2) content and delayed the peak time of catalase (CAT) activity, and enhanced the activities of resistance-related enzymes, chitinase (CHI) and β-1,3-glucanase (GLU), in grapes.
Muscat grape; biological control; induced disease resistance
10.7506/spkx1002-6630-201602047
Q939.92;TS255.3
A
1002-6630(2016)02-0266-05
范三红, 李静, 施俊凤. 拮抗菌Burkholderia contaminans对玫瑰香葡萄采后灰霉病的抗性诱导[J]. 食品科学, 2016, 37(2): 266-270. DOI:10.7506/spkx1002-6630-201602047. http://www.spkx.net.cn
FAN Sanhong, LI Jing, SHI Junfeng. Induction of disease resistance against Botrytis cinerea in postharvest muscat grape by antagonistic bacterium Burkholderia contaminans[J]. Food Science, 2016, 37(2): 266-270. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201602047. http://www.spkx.net.cn
2015-07-09
山西省农业科学院博士后基金项目(BSH-2015JJ-003);山西省农业科学院自主创新项目(2015ZZCX-16);国家自然科学基金面上项目(31371868)
范三红(1963—),男,副教授,硕士,研究方向为食品科学。E-mail:fsh729@sxu.edu.cn
