TEMPO氧化魔芋葡甘露聚糖微球的制备及其在运载食品活性因子中的应用
2016-11-15陈钰莹陈小冬史梦璇路美玲赵陆海
陈钰莹,陈小冬,史梦璇,路美玲,赵陆海,李 媛
(北京化工大学生命科学与技术学院,北京 100029)
TEMPO氧化魔芋葡甘露聚糖微球的制备及其在运载食品活性因子中的应用
陈钰莹,陈小冬,史梦璇,路美玲,赵陆海,李 媛*
(北京化工大学生命科学与技术学院,北京 100029)
以2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethyl-piperidine-1-oxyl,TEMPO)为催化剂,次氯酸钠为氧化剂,对魔芋甘露聚糖(konjac glucomannan,KGM)进行氧化,制备出氧化度为80%的TEMPO氧化魔芋多糖( TEMPO-oxidized konjac glucomannan,OKGM)。用OKGM为原料、Fe3+为交联剂借助双重乳液法制备微球。内油相中包覆β-胡萝卜素,多糖水相吸附花色苷,实现亲疏水活性因子的共装载。红外光谱显示出KGM上羟基成功氧化为羧基;MTT法验证了OKGM没有细胞毒性;采用单因素试验,确定制备微球的最佳工艺条件是OKGM质量分数10%、FeSO4·7H2O与OKGM质量比1∶5、交联时间30 min、交联温度35 ℃;通过动态光散射法发现微球粒径分布在20~40 μm之间,平均粒径为26.8 μm;通过扫描电子显微镜和原子力显微镜观察了微球的表面形貌;荧光共聚焦显微镜显示微球中能够同时分布着花色苷和β-胡萝卜素。结果表明OKGM微球在多种活性因子的共装载方面有良好的应用前景。
魔芋葡甘露聚糖;微球;活性因子;分散性;稳定性;肠靶向;缓释;微胶囊化
食品天然产物活性因子往往具有增强机体免疫力、抗氧化和防止多种癌症等重要生理功能,但因食品活性因子存在稳定性差的问题[1],限制了其应用和人体营养吸收。而载体可以用来保护食品活性因子,维持其稳定性,并能提高其分散性,进而提高生物利用度[2]。天然高分子具有可再生、生物兼容性和降解性等优点,成为制备活性因子载体的最佳材料。目前运用于装载活性因子的天然高分子有淀粉[3]、糊精类[4]、蛋白[5]、海藻酸钠[6]等。
魔芋葡甘聚糖(konjac glucomannan,KGM)主要成分为葡萄糖和甘露糖,二者通过β-1,4-或者β-1,3-糖苷键连接(图1)[7]。KGM分子质量在500~2 000 kD之间,在水中的溶解度为1%左右,吸水膨胀后体积约为干状态的80 倍。它具有良好的增稠性[8]、凝胶性、成膜性[9]和一些特殊的生理功能[10],目前已被用于减肥、降脂[11]以及食品添加剂领域[12]。但由于KGM分子质量高,溶解度低,溶胶黏度大以及稳定性差,限制了KGM进一步的开发利用。KGM目前主要通过与其他生物大分子例如黄原胶复配的方式[13]或共价交联的方法[14]作用于药物缓释领域。Suphat等[15]将经过高碘酸钠氧化的魔芋多糖与壳聚糖通过静电作用复配制膜,用来缓释双氯芬酸钠;Huang Renliang等[16]通过自组装将魔芋多糖与Fmoc-苯丙氨酸二肽形成水凝胶,并选用紫杉醇作为模型药,通过控制魔芋多糖的添加量、分子质量、老化时间以及β-甘露聚糖酶用量来控制药物释放时间。但基于静电复配作用形成的载体机械强度低,稳定性差;共价交联所使用的交联剂(主要是二异氰酸盐、环氧化合物及醛类)存在细胞毒性,降低了载体的生物相容性和安全性[17]。因此需要开发一种稳定性强、安全性高的魔芋载体应用于装载食品活性因子。
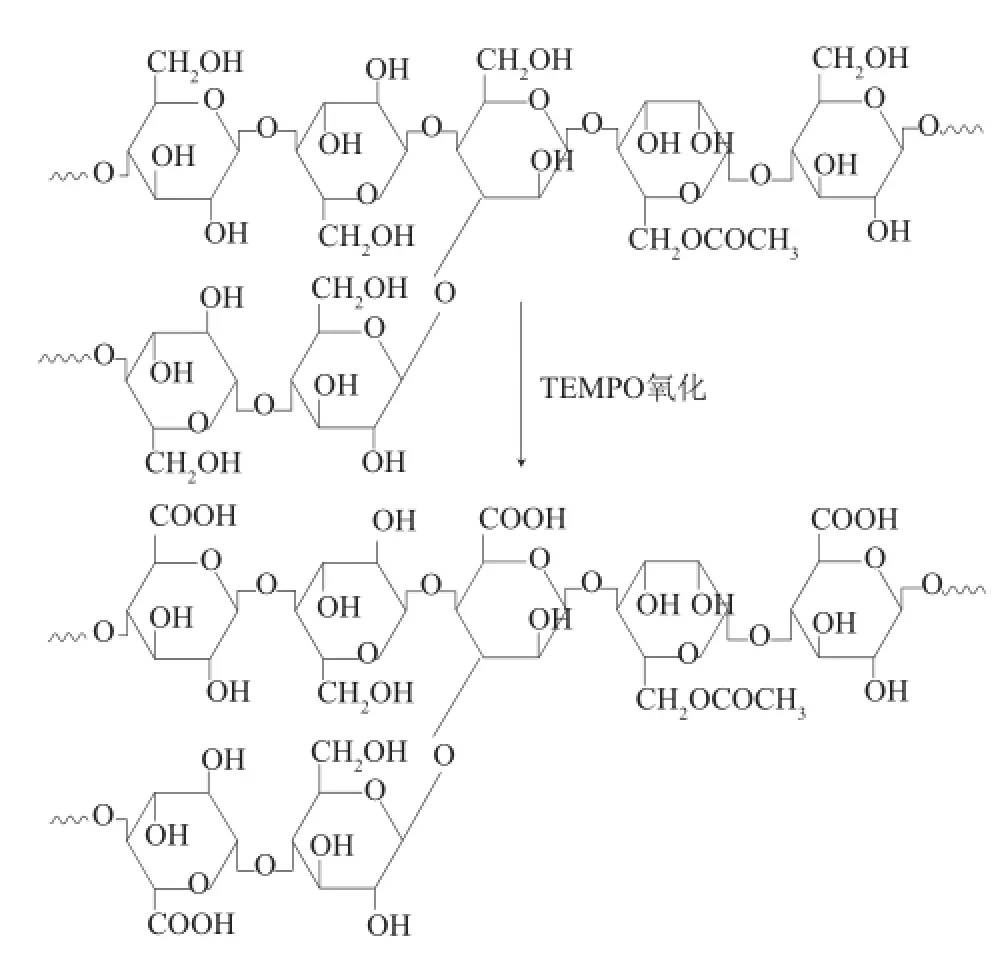
图1 氧化魔芋的结构式Fig.1 TEMPO oxidation of konjac glucomannan
2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethylpiperidine-1-oxyl,TEMPO)氧化法是近年来新起的一种具有高活性和高选择性绿色环保氧化方法[18]。TEMPO是一种有机小分子催化剂。TEMPO氧化法反应条件温和,催化剂用量少(0.1%),可通过固载化的方法避免残留于原料中,并可循环使用。TEMPO氧化的优点是高选择性和氧化度可控。可以选择性地氧化多糖的单糖单元(葡萄糖、甘露糖)上C-6位上的伯醇基团为羧基,且氧化度精确可控,最高可达90%。通过TEMPO氧化处理后的魔芋葡甘聚糖(oxidized konjac glucomannan,OKGM)溶解度提高、水溶胶黏度降低、稳定性增强,引入大量羧基作为功能基团能够与Fe3+通过配位作用交联[7]。利用乳液聚合法,通过Fe3+交联OKGM可制成带有可控负电荷的微球,该微球能够吸附正电荷活性因子。进一步采用双重乳液法可包埋脂溶性活性因子。
研究发现,相同浓度条件下多因子协同作用可产生远大于单因子作用的抗氧化性[19]。花色苷作为一种抗氧化剂,在水溶液中的稳定性极差,易受溶液pH值和温度影响[20-21]。β-胡萝卜素是VA前体,具有抗癌、预防心血管疾病的功效,但其难溶性和对光热氧敏感的缺点也限制了其应用[22]。因此,若能有效提高花色苷和β-胡萝卜素的稳定性并能使两者协同作用,将为预防心血管、癌症起到积极作用。鉴于此,本实验尝试用OKGM微球提高活性因子的稳定性和分散性,同时装载多种活性因子,实现多种抗氧化剂协同作用,有效提高活性因子的生物利用率。
本研究首先对采用TEMPO氧化法制得OKGM上的羧基进行表征,然后摸索了利用通氧乳液聚合法制备的OKGM微球的最佳条件,包括油水比、铁与羧基的质量比、反应时间、反应温度。接着对所得到的OKGM微球的粒径和表面形貌进行表征。最后对微球包埋活性因子的应用进行了初步探讨,主要用该微球来吸附正电荷花色苷以及包埋β-胡萝卜素,证实了氧化魔芋微球在共装载多种活性因子方面具有广阔的应用前景。并且,OKGM将成为一种新型活性因子微胶囊壁材,其pH值响应性使其具有肠靶向释放的潜力。该研究对充分利用我国魔芋资源,提高敏感活性因子的分散性和稳定性,使其更有效地发挥营养健康功效具有重要意义。
1 材料与方法
1.1 材料与试剂
KGM(纯度98%) 湖北一致魔芋有限公司;β-甘露聚糖酶(比活力20 IU/mg) 诺维信公司; TEMPO、SUPE R-green Ⅰ、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5)-dimethylthiahiazo (-z-y1)-2,5-diphenytetrazoliumromide,MTT) 美国Sigma-Aldrich公司;紫薯花色苷 湖北紫鑫生物科技有限公司;β-胡萝卜素(纯度97%) 日本TCI公司;尼罗红等其他试剂均为分析纯。
1.2 仪器与设备
RCT磁力搅拌器 德国艾卡公司;IRAffinity-1傅里叶变换红外光谱仪 日本岛津公司;SP2共聚焦激光扫描电镜 德国莱卡公司;Nano-ZS激光粒度仪 英国马尔文有限公司;UB100i光学显微镜 重庆澳浦光技术有限公司;Dimension FastScan原子力显微镜 美国维易科仪器公司;S-4700扫描电子显微镜 日本日立公司。
1.3 方法
1.3.1 OKGM的制备
称取20 g KGM溶解到2 L沸水中。待KGM全部溶解后,向溶液中加入1 mg β-甘露聚糖酶,酶解温度为50 ℃,酶解时间为10 min。将酶解后的KGM溶液移入水浴锅,沸水浴10 min灭酶。用乙醇析出固体后进行真空冷冻干燥。
称取8.2 g酶解后的KGM分散在200 mL水中,用磁力搅拌器搅拌并加入0.064 8 g TEMPO,用盐酸调节溶液pH 10。向溶液中加入pH 10的次氯酸钠溶液,氧化反应开始发生,当溶液pH值降低时,向溶液中逐滴加入 0.5 mol/L的氢氧化钠溶液,使溶液pH值恒定为10。当氢氧化钠溶液加入量为80 mL时,加入10 mL无水乙醇终止反应。1 h后用浓盐酸调节溶液pH 3,再调节pH值为7并保持该pH值1 h后停止搅拌。缓慢加入300 mL无水乙醇,过滤析出白色沉淀,用乙醇洗涤3 次,丙酮洗涤3 次。将沉淀出来的固体溶于50 mL水中,真空冷冻干燥后得到OKGM。
1.3.2 OKGM结构红外光谱表征
称取2 mg KGM和OKGM制成KBr压片,用傅里叶变换红外光谱仪在4 000~400 cm-1的范围内进行红外吸收扫描。
1.3.3 OKGM细胞毒性实验
取人体肝癌细胞株HepG2和人体子宫颈癌细胞株Hela分别接种于96 孔板,每孔接种5 000 个细胞,置于37 ℃细胞培养箱培养,在培养基中加入OKGM,OKGM质量浓度在0.01~1 mg/mL之间。培养24 h后,每孔加入20 μL MTT(5 mg/mL),继续培养4 h,每孔加入150 mL二甲基亚砜(dimethyl sulfoxide,DMSO),用酶标仪测定每孔在490 nm波长的吸光度,计算细胞存活率。

1.3.4 OKGM微球的制备
单乳液法:称取一定量的OKGM溶解于水中,用0.1mol/L的盐酸调节溶液pH 3。称取一定质量的FeSO4·7H2O溶解于500 μL pH 3的OKGM溶液中制成水相,另称取0.75 g司盘80溶解在20 g的液体石蜡中制成油相。将水相加入油相中,用磁力搅拌器搅拌形成W/O乳液。双重乳液法:在上述水相中加入溶有脂溶性活性因子(例如β-胡萝卜素)的玉米油(内油相),形成O/W乳液,再以此为水相加入到液体石蜡中,最终形成O/W/O的复乳。向上述两种乳液中通入空气,可以分别制得不含内油相和含有内油相的氧化魔芋微球。
微球用正己烷和甲醇分别洗涤3 次,离心分离,真空干燥。采用单因素试验的方法,依次考察OKGM质量分数(4 %、6.7 %、10 %)、FeSO4·7H2O与OKGM质量比(0.45∶5、1∶5、1.95∶5)、交联温度(15、35、55 ℃)和交联时间(30、40、60 min)对微球制备的影响,以选取最佳的条件,优化制备微球的工艺。
1.3.5 微球尺寸测量及形貌观察
在最佳的制备条件下制备微球,并对微球的尺寸和形貌进行测量和观察。
用马尔文激光粒度仪测定微球的粒度分布情况。对微球表面进行喷金处理后,用扫描电子显微镜扫描(测试的加速电压为15 kV),观察微球大小和形貌。取微球溶解于pH 3盐酸溶液中,用滴管吸取少量含有微球的溶液滴于云母片上,在空气中自然风干后放于载物台上,采用原子力显微镜轻敲模式观察微球形貌。
1.3.6 单乳液法制备的微球吸附花青素
称取一定量的微球溶解在pH 3的盐酸溶液中,加入花色苷,用磁力搅拌器搅拌1.5 h,用pH 3的盐酸溶液洗涤,离心,移去未被吸附的花色苷。利用花色苷自发荧光的特性,在共聚焦激光扫描电镜下(激发波长为488 nm,发射波长为505 nm),观测花色苷的吸附情况。
1.3.7 双重乳液法制备的微球吸附β-胡萝卜素和花色苷
称取一定量的OKGM溶于500 μL pH 3的盐酸溶液中,用磁力搅拌器搅拌溶解后,加入15 mg吐温20制成水相。另称取β-胡萝卜素溶解在玉米油中制成油相,将水相加入油相中,制成初乳。向初乳中加入FeSO4·7H2O,用磁力搅拌器搅拌均匀。称取0.5 g司盘80加入到50 mL液体石蜡中,制成外油相。将初乳缓慢滴加到外油相中,连续搅拌,制成双重乳液。向乳液中通入空气,并不断搅拌。含有β-胡萝卜素的微球用正己烷和甲醇分别洗涤3 次,离心分离,真空干燥。称取一定量的微球溶解在pH 3的盐酸溶液中,加入花色苷,用磁力搅拌器搅拌一段时间后,用pH 3的盐酸溶液洗涤,离心,移去未被吸附的花色苷。
为了观测利用双重乳液法制备的微球共装载亲疏水物质的可行性,本实验用尼罗红代表疏水性活性分子,SUPER-greenⅠ代表亲水性活性因子。将尼罗红溶到内油相中,之后加入正电荷染料SUPER-greenⅠ通过静电作用结合到含有多糖的水相中。洗去未被吸附的染料之后,用共聚焦激光扫描电镜观察双染色的微球。尼罗红激发和发射波长分别为561 nm和636 nm。SUPER-greenⅠ的激发和发射波长分别是488 nm和520 nm。利用两种染料在不同波段发射而显示出不同颜色,可以同时观察到水溶性和油溶性分子在微球中的分布。
2 结果与分析
2.1 OKGM的制备及体外毒性分析
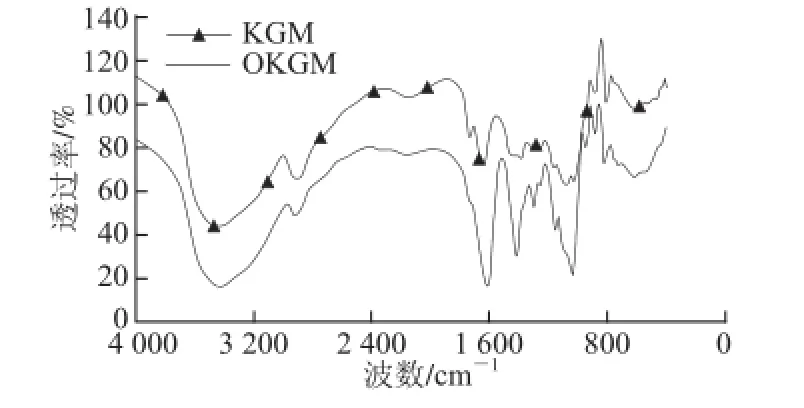
图2 氧化魔芋的红外表征Fig.2 FT-IR spectra of TEMPO-oxidized konjac glucomannan
如图2所示,1 600~1 650 cm-1是多糖羧基的特征峰位置,KGM经过氧化后,1 620 cm-1附近的羧基吸收峰显著增强,说明经过TEMPO氧化后,KGM上羟基成功氧化为羧基。且由之前的研究可知,羧基量和氧化度呈正比,氧化度精确可控[23]。

图3 OKGM体外毒性实验Fig.3 In vitro cytotoxicity of DO80% OKGM polymers
由于细胞吞噬微米级魔芋微球的能力有限,因此本实验首先验证了TEMPO氧化KGM的细胞毒性。通过利用MTT法,将OKGM和细胞共孵育24 h,细胞毒性结果如图3所示,当OKGM质量浓度从0.01 mg/mL增加到1 mg/mL时,发现人体肝癌细胞HepG2的细胞存活率在90%以上,人体子宫颈癌细胞Hela的细胞存活率在80%以上,由此可见OKGM的细胞毒性可以忽略。若需要验证铁交联后的OKGM微球毒性,可通过急性毒性实验来进一步证明。
2.2 微球制备工艺的优化
OKGM质量分数、交联度、交联温度和时间都是影响微球制备的关键因素。将不同条件下制得的微球在显微镜下观察,探讨通过O/W/O复乳法制备含有内油相的氧化魔芋微球的最优条件。由图4A可以看出,当OKGM质量分数为4%时,显然OKGM质量分数过低造成微球结构脆弱,发生破裂。而6.7%的质量分数仍然无法制备出结构坚固的微球。当质量分数为10%时,微球稳固存在,且内油相均匀分布于微球中,形成的微球形状规则。因此初步确定10%为制备微球的最佳质量分数。氧化魔芋微球的交联原理是OKGM上的羧基和三价铁离子发生了配位反应。利用空气中的氧气能使预交联剂Fe2+氧化为交联剂Fe3+,Fe3+将OKGM交联使其在水相中固化,最终制得氧化魔芋微球。因此铁离子质量分数直接决定了微球的交联度。由图4B可以看出,当FeSO4·7H2O与OKGM质量比为0.45∶5时,交联度过低,不能很好地形成微球。当质量比为1.95∶5时,形成的微球发生团聚,这是由于过量的Fe2+中和了羧基的负电荷,减弱了微球之间的排斥力,引起团聚。质量比1∶5时,形成的微球形状规则,分散性较好。所以1∶5确定为最佳的交联比例。温度可以影响Fe2+氧化为Fe3+的化学反应动力学,也因此影响到微球形成的动力学。如图5C所示,当温度为15 ℃时,微球呈透明状,说明交联度较弱。当反应温度为55 ℃时,反应过快,引起微球团聚。当温度为35 ℃时,微球交联密度提高且分散性较好。从图4D可以看出,当交联时间为30 min时,OKGM微球形成,且形状规则,分散性好。当交联时间超过30 min时,微球开始团聚,且随着反应时间的延长,团聚现象加重。因此选择30 min作为最适合的反应时间。
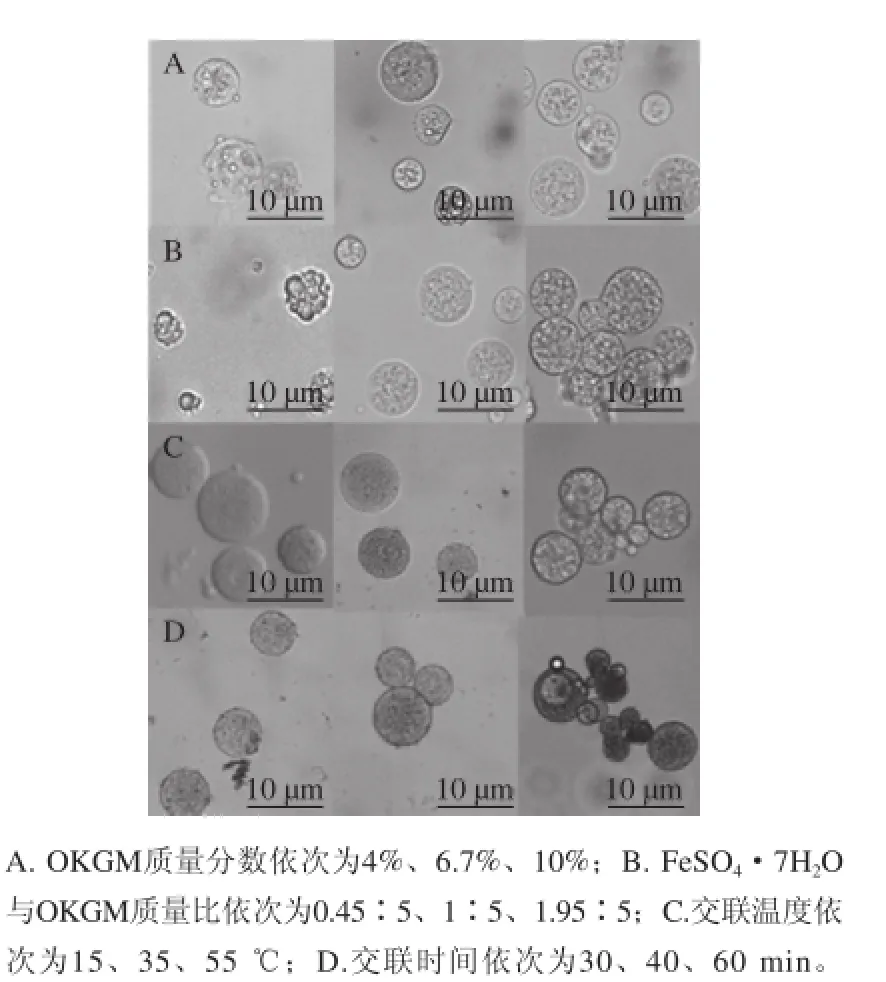
图4 各因素对微球制备的影响Fig.4 Effects of polysaccharide concentration (A), cross-linker concentration (B), temperature (C) and reaction time (D) on (O/W) OKGM microsphere formation by the double emulsion method
综上所述,形成微球的最佳条件是:OKGM质量分数10%、预交联剂FeSO4·7H2O与OKGM质量比1∶5、交联时间30 min、交联温度35 ℃。
2.3 微球尺寸测量及形貌观察

图5 微球的粒径分布Fig.5 Size distribution of microspheres
如图5所示,微球粒径主要集中在20~40 μm之间,平均粒径为26.8 μm。

图6 扫描电镜下微球的形态Fig.6 Morphology of mirospheres under SEM
如图6所示,微球呈光滑球形,大小在几微米到几十微米之间,和图5 的粒径分布结果相符。

图7 原子力显微镜下微球的形态Fig.7 Morphology of microspheres under AFM
原子力显微镜可以进一步观察到纳米尺度的微球表面细微结构,图7B显示的是微球表面褶皱,褶皱的平均厚度约3 nm,这可能是由多糖和铁在微球表面的交联反应不均一造成的。
2.4 单乳液法制备的微球吸附花色苷

图8 荧光分光光度计下微球吸附花色苷图Fig.8 CLSM images of anthocyanin s encapsulated in OKGM micr ospheres
采用W/O单乳液法可制备不含内油相的氧化魔芋微球。负电荷氧化微球可用来吸附正电荷的活性因子。花色苷因在pH 3的条件下带正电荷,能够通过静电作用吸附于OKGM微球中。花色苷也是一种天然荧光剂,可以被488 nm波长的光激发发射产生荧光。共聚焦激光扫描显微镜可以聚焦到样品中心的微米级薄厚,因此利用此手段,能够观察到花色苷在微球中心薄层中的分布。如图8所示,花色苷均匀地分散在微球内部,这表明OKGM微球能够成功吸附花色苷。前期研究表明TEMPO氧化淀粉水凝胶同样可以吸附花色苷,并且吸附受盐质量浓度以及溶液的pH值影响[24]。该结果表明OKGM可以成功地吸附正电荷的活性小分子。
2.5 双重乳液法制备的微球共装载亲疏水性小分子

图9 荧光分光光度计下微球 同时吸附脂溶性、水溶性药物图Fig.9 CLSM images of co-delivery of hydrophobic and hydrophilic drugs in OKGM microspheres
如果利用O/W/O双重乳液法,可制备出含有内油相的OKGM微球,在内油相中溶有疏水性活性因子,例如β-胡萝卜素,可解决难溶性活性因子的水溶性和稳定性问题。如果再通过静电吸附作用吸附正电荷亲水小分子,可使OKGM微球同时递送疏水和亲水性活性分子,协同发挥作用,抗氧化能力更强。为了验证该想法的可行性,用荧光染料尼罗红和SUPER-greenⅠ分别代表疏水性和亲水性小分子,两者激发后可以在不同波段发射出不同颜色的荧光,这样便可借助荧光分光光度计观察和区分两者在微球中的分布。如图9所示,红色的内油相和绿色的水相表明微球可以成功地包埋和吸附疏水性和亲水性分子。实验表明该微球可以同时吸附β-胡萝卜素和花色苷。由于三价铁在酸性条件下稳定而在碱性条件下易和水反应生成铁的氧化物。因此OKGM微球在胃酸条件下稳定,在肠中性环境下破裂释放出被包埋物质,因此,pH值相应的OKGM微球也具有肠靶向释放营养物质的功能[25]。
3 结 论
以TEMPO氧化得到的OKGM为原料,铁离子为交联剂,通过物理交联的方式制得了氧化魔芋微球。通过双重乳液交联法制得含有内油相的氧化魔芋微球,可实现亲疏水活性因子的共装载。采用单因素试验,确定制备微球的最佳工艺条件是OKGM质量分数10%、FeSO4·7H2O与OKGM质量比1∶5、交联时间30 min、交联温度35 ℃。
本研究提供了一种以氧化KGM为新材料制备微球实现活性因子稳态化的新策略,该微球可提高难溶性和敏感活性因子的分散性和稳定性,并同时装载多种活性因子,在食品工业中具有较好的应用前景。
[1] BOON C S, MCCLEMENTS D J, WEISS J, et al. Factors influencing the chemical stability of carotenoids in foods[J]. Critical Reviews in Food Science and Nutrition, 2010, 50: 515-532. DOI:10.1080/10408390802565889.
[2] ACOSTA E. Bioavailability of nanoparticles in nutrient and nutraceutical delivery[J]. Current Opinion in Colloid and Interface Science, 2009, 14: 3-15. DOI:10.1016/j.cocis.2008.01.002.
[3] LI Y, RENKO D V, TED S, et al. Preparation and characterization of oxidized starch polymer microgels for encapsulation and controlled release of functional ingredients[J]. Biomacromolecules, 2009, 10: 1931-1938. DOI:10.1021/bm900337n.
[4] TIAN X N. Inclusion interactions and molecular microcapsule of Salvia sclarea L. essential oil with β-cyclodextrin derivatives[J]. European Food Research and Technology, 2008, 227(4): 1001-1007. DOI:10.1007/s00217-007-0813-7.
[5] HEBRARD G, BLANQUET S, BEYSSAC E, et al. Use of whey protein beads as a new carrier system for recombinant yeasts in human digestive tract[J]. Journal of Technology, 2006, 127(1): 151-167. DOI:10.1016/j.jbiotec.2006.06.012.
[6 ] LEE K Y, HEO T R. Survival of Bifidobacterium longum immobilized in calcium alginate beads in simulated gastric juices and bile salt solution[J]. Applied and Environmental Microbiology, 2000, 66(2): 869-873. DOI:10.1128/AEM.66.2.869-873.2000.
[7] CHEN X D, WANG S S, LU M L, et al. Formation and characterization of light-responsive TEMPO-oxidized konjac glucomannan microspheres[J]. Biomacromolecules, 2014, 15: 2166-2171. DOI:10.1128/AEM.66.2.869-873.2000.
[8] CHUA M, BALDWIN T C, HOCKING T J, et al. Traditional uses and potential health benefits of Amorphophallus konjac K Koch ex N. E. Br.[J]. Journal of Ethnopharmacology, 2010, 128: 268-278. DOI:10.1016/j.jep.2010.01.021.
[9] FANG W X, WU P W. Variations of konjac glucomannan (KGM) from Amorphophallus konjac and its refined powder in China[J]. Food Hydrocolloids, 2004, 18: 167-170. DOI:10.1016/S0268-005X(03)00044-4.
[10] 尚晓娅, 钦传光, 牛卫宁, 等. 新型功能材料魔芋葡甘聚糖的研究与应用[J]. 材料导报, 2009(19): 32-36. DOI:10.3321/j.issn:1005-023X.2009.19.008.
[11] 席晓莉, 吴道澄, 吴红. 魔芋超细粉末的减肥作用[J]. 第四军医大学学报, 2003, 19: 1812-1814. DOI:10.3321/ j.issn:1000-2790.2003.19.025.
[12] 黄来发. 食品增稠剂[M]. 2版. 北京: 中国轻工业出版社, 2009: 1-5.
[13] FELIPE A M, KEVIN B, STEFAAN C D, et al. Characterization of diffusion of macromolecules in konjac glucomannan solutions and gels by fluorescence recovery after photobleaching technique[J]. International Journal of Pharmaceutics, 2006, 316: 37-46. DOI:10.1016/j.ijpharm.2006.02.029.
[14] 罗立新, 冯长根. 交联魔芋葡甘露聚糖微球的制备与表征[J]. 林产化学与工业, 2004, 24(2): 77-79. DOI:10.3321/j.issn:0253-2417.2004.02.018.
[15] SUPHAT K, PORNPUSADEE U, NARONG P, et al. Controlled release of diclofenac from matrix polymer of chitosan and oxidized konjac glucomannan[J]. Marine Drugs, 2011, 9: 1649-1663. DOI:10.3390/md9091649.
[16] HUANG R L, QI W, FENG L B, et al. Self-assembling peptidepolysaccharide hybrid hydrogel as a potential carrier for drug delivery[J]. Soft Matter, 2011, 7: 6222-6230. DOI:10.1039/ C1SM05375B.
[17] 仰振球, 宋宝珍, 李巧霞, 等. 生物黏附性微球的制备及其评价: Ⅰ.离子交联法制备生物黏附性微球及其粒径预测[J]. 过程工程学报, 2005, 5(5): 558-562. DOI:10.3321/j.issn:1009-606X.2005.05.020.
[18] NOOY A E J D, BESEMER A C, BEKKUM H V. Highly selectively nitroxyl radical-medical-mediated oxidation of primary alcohol groups in water-soluble glucans[J]. Carbohydrate Research, 1995, 269: 89-98. DOI:10.1016/0008-6215(94)00343-E.
[19] CUI Y N, XU Q X, CHOW P K H, et al. Transferrin-conjugated magnetic silica PLGA nanoparticles loaded with doxorubicin and paclitaxel for brain glioma treatment[J]. Biomaterials, 2013, 34(33): 8511-8520. DOI:10.1016/j.biomaterials.2013.07.075.
[20] KONG J M, CHIA L S, GOH N K, et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry, 2003, 64(5): 923-933. DOI:10.1016/S0031-9422(03)00438-2.
[21] SUDA I, OKI T, MASUDA M, et al. Direct absorption of acylated anthocyanin in purple-fleshed sweet potato into rats[J]. Journal of Agriculture and Food Chemistry, 2002, 50: 1672-1676. DOI:10.1021/ jf011162x.
[22] SHIR J, CHEN K Y, WEN Y D, et al. Genistein and beta-carotene enhance the growth-inhibitory effect of trichostatin A in A549 cells[J]. European Journal of Nutrition, 2010, 49: 19-25. DOI:10.1007/s00394-009-0044-8.
[23] LI Y, de VRIES R, KLEIGN M, et al. Lysozyme uptake by oxidized starch polymer microgels[J]. Biomacromolecules, 2009, 11(7): 1754-1762. DOI:10.1021/bm100206k.
[24] WANG Z R, LI Y, CHEN L, et al. A study of controlled uptake and release of anthocyanins by oxidized starch microgels[J]. Journal of Agricultural and Food Chemistry, 2013, 61(24): 5880-5887. DOI:10.1021/jf400275m.
[25] WANG S S, CHEN X D, SHI M X, et al. Absorption of whey protein isolated (WPI)-stabilized β-carotene emulsions by oppositely charged oxidized starch microgels[J]. Food Research International, 2015, 67: 315-322. DOI:10.1016/j.foodres.2014.11.041.
Preparation and Application of TEMPO-Oxidized Konjac Glucomannan Micropsheres in Delivery of Food Bioactives
CHEN Yuying, CHEN Xiaodong, SHI Mengxuan, LU Meiling, ZHAO Luhai, LI Yuan*
(College of Life Science and Technology, Beijing University of Chemical Technology, Beijing 100029, China)
2,2,6,6-Tetramethyl-1-piperidinyloxy (TEMPO) was applied to catalyze the oxidation of konjac glucomannan (KGM), which was selectively oxidized by sodium hypochloryte to 80% degree of oxidization (DO) yielding TEMPO-oxidized konjac glucomannan (OKGM). A microsphere delivery system that allowed the co-delivery of hydrophobic and hydrophilic ingredients was prepared by cross-linking the carboxyl groups of TEMPO-OKGM polymers with ferric ions through double emulsion cross-linking reaction which enabled the dissolution of β-carotene in the inner oil phase and the absorption of anthocyanins to the polymer phase. Fourier transform infrared spectroscopic (FT-IR) results proved the oxidation of the hydroxyl groups into carboxyl groups. The cell viability experiment showed that the OKGM polymer had negligible cytotoxicity. The optimum conditions for OKGM microspheres preparation were as follows: OKGM concentration, 10%; mass ratio of cross-linker FeSO47H2O to polymer, 1:5; cross-linking time, 30 minutes; and reaction temperature, 35 ℃. The size distribution of OKGM microspheres measured by dynamic light scattering was 20 to 40 μm, and the av erage diameter was 26.8 μm. The surface morphology of microspheres was observed by scanning electron microscopy and atomic force microscopy. By confocal laser scanning microscopy, the distribution of hydrophobic and hydrophilic ingredients was observed simultaneously. OKGM microspheres showed a great potential for delivering multiple nutrients.
konjac glucomannan; microspheres; bioactive ingredients; dispersibility; stability; intestine-specific; controlled release; microencapsulation
10.7506/spkx1002-6630-201602001
TS201.2
A
1002-6630(2016)02-0001-06
陈钰莹, 陈小冬, 史梦璇, 等. TEMPO氧化魔芋葡甘露聚糖微球的制备及其在运载食品活性因子中的应用[J]. 食品科学, 2016, 37(2): 1-6. DOI:10.7506/spkx1002-6630-201602001. http://www.spkx.net.cn
CHEN Yuying, CHEN Xiaodong, SHI Mengxuan, et al. Preparation and application of TEMPO-oxidized konjac glucomannan micropsheres in delivery of food bioactives[J]. Food Science, 2016, 37(2): 1-6. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201602001. http://www.spkx.net.cn
2015-05-18
国家自然科学基金青年科学基金项目(31471577);国家自然科学基金面上项目(31201334)
陈钰莹(1990—),女,硕士,研究方向为食品生物大分子载体、食品胶体科学。E-mail:chenyuxiaoying@163.com *通信作者:李媛(1982—),女,副教授,博士,研究方向为活性因子稳态化、食品生物大分子载体、食品胶体科学。E-mail:liyuan@mail.buct.edu.cn
