EB病毒感染与XRCC1-Arg399Gln基因多态性在鼻咽癌发生中的交互作用
2016-11-15郭俊英郑瑜宏崔兆磊辛小琴李筱莉
郭俊英,郑瑜宏,崔兆磊,辛小琴,李筱莉,陈 燕
(福建医科大学附属肿瘤医院,福建省肿瘤转化医学重点实验室,福建省肿瘤医院检验科,福建福州350014)
·论著·
EB病毒感染与XRCC1-Arg399Gln基因多态性在鼻咽癌发生中的交互作用
郭俊英,郑瑜宏,崔兆磊,辛小琴,李筱莉,陈 燕
(福建医科大学附属肿瘤医院,福建省肿瘤转化医学重点实验室,福建省肿瘤医院检验科,福建福州350014)
目的评估XRCCl-Arg399 Gln单核苷酸多态性在鼻咽癌发病中的风险,研究XRCCl-Arg399 Gln单核苷酸多态性与EB病毒感染的交互作用。方法采用病例对照研究,收集90名经病理确诊的鼻咽癌患者作为病例组和75名在我院进行健康体检的病人作为对照,并按照性别和年龄1∶1配对,提取全血基因组DNA进行PCR扩增,对扩增产物再进行测序PCR反应,最后分析得出XRCC1 Arg399Gln的基因型。结果EB病毒感染能增加鼻咽癌发病风险,VCA-IgA、EA-IgA和Rta-IgG抗体三项阳性时可以增加鼻咽癌发病风险,但单项VCA-IgA阳性是鼻咽癌发病的最强危险因素(OR=26.526,95% CI:11.190~62.884),单因素条件Logistic回归分析显示,与携带XRCC-1 Arg399Gln的AA基因型相比,携带XRCC-1 Arg399Gln的GG基因型可增加鼻咽癌发病风险(OR=4.3,95%CI:1.184~15.618);XRCC-1 Arg399Gln的GA基因型与VCAIgA存在交互作用(OR=20.755,95%CI:5.312~81.094)。结论XRCC-1基因的Arg399Gln基因多态性能够增加患鼻咽癌的风险,且Arg399Gln的GA基因型与EB病毒感染具有一定的交互作用。
XRCC1;鼻咽癌;基因多态性;VCA-IgA;EA-IgA;Rta-IgG
研究显示,鼻咽癌(Nasopharyngeal carcinoma,NPC)的发生发展可能与一些DNA修复基因有一定的联系,如人类X射线交错互补修复基因1(X-ray repair cross-complementing gene 1,XRCC1)、着色性干皮病基因D(XPD)、人8-羟基鸟嘌吟糖苷酶1(h OGG1)等。XRCC1基因是人体细胞DNA因电离辐射和氧化损伤引起的碱基切除和单链断裂修复的重要参与基因[3],对维持基因组稳定十分关键。人XRCC1基因位于19q13.2,其编码的蛋白质通过多聚ADP核糖聚合酶(PARP)、DNA连接酶Ⅲ(LigⅢ)及DNA多聚酶β(Polβ)的相互作用参与DNA碱基修复及DNA单断裂修复[1]。目前已经发现XRCC1基因编码区的3个SNP位点C263047T(Arg194Trp)、G27466A(Arg280His)和G28152A(Arg399Gln)基因多态性与多种肿瘤的发生发展有关[2],包括肺癌[4]、食管癌[5]、结肠癌[6]等。
本研究拟采用病例-对照研究方法,结合分子生物学技术和流行病方法,从分子水平上探讨XRCC1-Arg399Gln多态性与鼻咽癌易感性的关系,同时研究基因与基因之间,基因和EBV之间的交互作用,从而为鼻咽癌的预防措施提供有力的科学依据。
1 材料与方法
1.1 研究对象选择2014年4月至2014年12月期间,在我院收治的90例NPC患者为病例组,门诊体检的健康者75例作为对照组。两组均为汉族,长期居住在福州地区,其中患者男性62例,女性28例,平均年龄43岁,健康对照组男性51例,女性24例,平均年龄41岁。NPC纳入标准:⑴所有的患者均为新发病例,并经过病理检查确诊为NPC的患者;⑵签署了知情同意书;⑶心电图、肝肾功能检查正常;⑷无职业致癌物接触史者;⑸本实验经医院伦理委员会批准执行。对照组纳入采用同时期在本院门诊体检的福建地区健康体检者,与病例1∶1匹配,匹配条件包括:与病例同种族、同性别、年龄与病例发病年龄(以诊断时年龄为准)±3岁,无血缘关系,出生居住地域接近,血常规、肝、肾功及心电图检查各项指标均无明显异常等。
1.2 研究方法
1.2.1 EBV抗体的检测采用酶联免疫吸附试验法(enzyme-linked immunosorbent assay,ELISA)检测病例组与对照组的血清学指标:EBV-VCA-IgA、EBV-EA-IgA和EBV-Rta-IgG三种抗体。EBVVCA-IgA、EBV-EA-IgA采用德国欧蒙试剂盒,EBV-Rta-IgG采用北京同昕生物公司的ELISA试剂盒,各指标均为临床成熟检验项目,具体操作与结果判定按说明书及Tecan Freedom EVOlyzer酶免疫分析仪操作规程进行操作。
1.2.2 基因组提取和纯化采集入组患者静脉血,置乙二胺四乙酸二纳抗凝管中,于2h内分装,放置低温冰箱中保存。使用血液基因组提取试剂盒进行血液样本基因组的提取和纯化,操作步骤按照血液基因组DNA提取试剂盒说明书。提取和纯化后的DNA采用紫外分光光度计进行检测,OD260/280值应在1.8~2.0之间,高于此范围说明该DNA样本可能被RNA污染,低于此范围说明蛋白质含量超标。
1.2.3 引物设计与合成利用Primer 5.0软件设计XRCC1-399 PCR扩增引物序列:上游5'-ACTGTCACCGCATGCGT-3',下游5'-AGTAGTCTGCTGGCTCTG-3'。由上海博尚生物公司合成。
1.2.4 PCR扩增及酶解PCR反应体系包括XRCC1-399PCR反应液C(Buffer、dNTPs、引物、探针等)、Taq酶混合液(Taq酶+UDG酶)、已处理样本或质控品,采用上述扩增引物在ABI7300型荧光实时定量PCR仪上扩增。具体反应条件:UDG酶反应37℃2min→预变性95℃3min→变性94℃15s及退火、延伸60℃45s共45个循环。PCR扩增产物的酶解:SAP酶混合液(CIAP+ExoI)加入到PCR产物中,DTC普通基因扩增热循环仪上进行酶解,酶解程序如下:37℃60min,80℃15min。酶解产物经琼脂糖凝胶电泳证实,符合预期,目的条带清晰单一。
1.2.5 测序PCR反应及产物纯化反应体系包括酶解后的扩增产物、测序试剂(Bigdye及缓冲液)和XRCC1 399测序引物(5'-TCCTCCAGCCTTTTCTGATA-3'),在ABI7300型荧光实时定量PCR仪上扩增。反应条件:预变性96℃1min→变性96℃10s→退火50℃5s→延伸60℃2min共30个循环。测序产物采用醋酸钠-乙醇纯化后,Hi-Di Formamide溶解DNA,在DTC普通基因扩增热循环仪上变性:95℃4min,4℃4min。
1.2.6 DNA测序上机电泳,在ABI3130型全自动基因测序分析仪上进行测序。
1.3 统计分析采用SPSS 18.0进行统计分析,P<0.05为差异具有统计学意义。采用χ2检验分析病例组和对照组人口学特征的差异,对照组进行基因型实际频数与理论频数的χ2检验,Hardy-Weinberg平衡检验。病例组和对照组基因型频率与等位基因频率的比较采用χ2检验;单因素logistic回归及交互作用计算比值比(odds ratios,OR)及其95%可信区间(CI)表示相对风险度。
2 结果
2.1 NPC组和健康对照组一般资料比较NPC组中男62例,女28例,年龄43±12岁,对照组中男51例,女24例,年龄41±13岁,两组间性别、年龄差异无统计学意义(P>0.05),具有可比性。
2.2 基因提取及测序结果XRCC1基因提取后进行Arg399Gln位点的PCR扩增,扩增产物电泳结果片段长度为161bp,条带清晰,符合预期。PCR扩增产物进行基因测序,结果采用Chromas软件分析峰图,人工读取具有双峰的碱基,即为杂合子,若为单峰的碱基则为纯合子(图1)。

图1 基因测序峰图
2.3 确定各组样本的基因型分布是否符合Hardyweinberg平衡根据群体遗传学原理,只有符合Hardy-Weinberg平衡的群体才具有可比性。165例受试者(90名NPC患者和75例健康对照者)参与XRCC1基因1个单核苷酸多态性位点与NPC风险性关联的研究,鼻咽癌组和对照组rs1052576基因型实际值和预测值比较见表1。位点P>0.05,均符合Hardy-Weinberg平衡,说明所选取的样本具有代表性和可比性。
2.4 NPC组和正常对照组rs1052576的基因型及等位基因频率NPC病例组和健康对照组中不同VCA-IgA、EA-lgA和Rta-IgG定性结果对应的XRCC-1 Arg399Gln基因型及等位基因例数见表2。
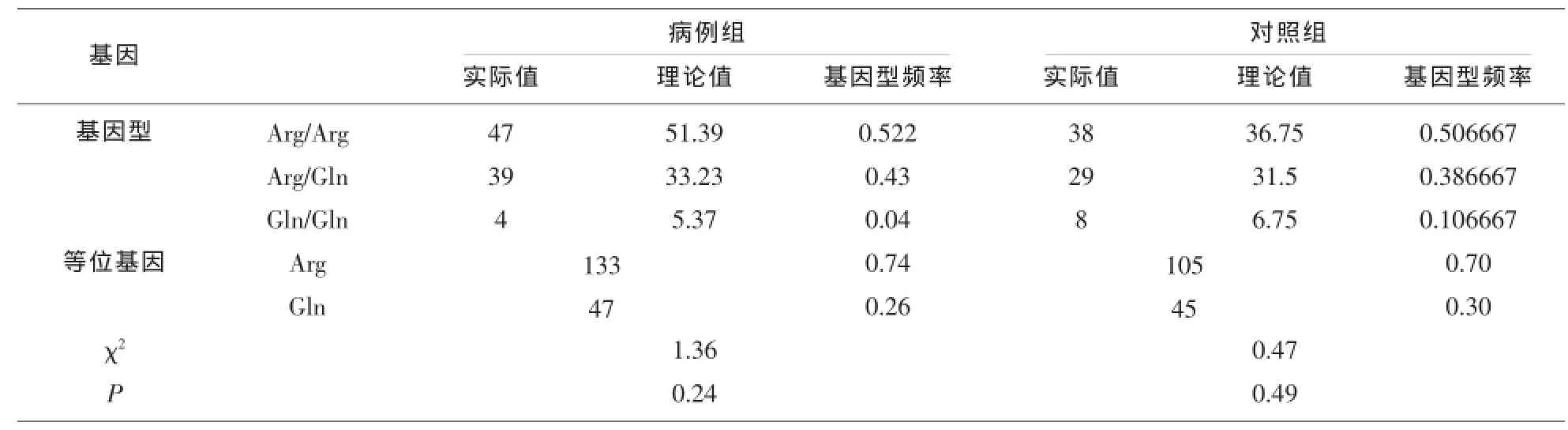
表1 Hardy-Weinberg平衡定律检验(n/%)

表2 XRCC-1 Arg399Gln基因型及等位基因表
2.5 XRCC-1 Arg399Gln单因素Logistic回归分析XRCC-1Arg399Gln单因素Logistic回归分析,XRCC1-Arg399Gln、VCA-IgA、EA-lgA、Rta-IgG均有一定危险度,OR分别为1.790、26.526、4.655,95% CI分别为1.006~3.182、11.190~62.884、2.170~9.982、3.570~14.427;XRCC1~Arg399Gln中仅GG基因型具有一定危险度,OR=4.3,95%CI:1.184~15.618;GA基因型和GG基因型分别与AA基因型比较,AA基因型-GG基因型具有危险度,OR= 4.838,95%CI:1.257~18.624,见表3。

表3 XRCC-1 Arg399Gln单因素Logistic分析表
2.6 XRCC-1 Arg399Gln交互作用Logistic回归分析VCA-IgA、EA-lgA、Rta-IgG与XRCC1-Arg399Gln均具有交互作用(P<0.01),其中GG基因型和GA基因型与AA基因型比较,三种抗体与XRCC-1 Arg399Gln交互性以GG基因型与AA基因型比较危险度更高(P<0.01),OR值分别为35.150、28.308、6.899,95%CI分别为11.442~107.981、3.698~216.679、2.818~16.891;各基因型与VCA-IgA、EA-lgA、RTA-IgG交互分析,GA*VCA、AA*VCA、AA*RTA具有交互作用,OR值分别为20.755、17.146、3.830,95%CI分别为5.312~81.094、4.971~59.142和1.243~11.802(见表4)。

表4 XRCC-1 Arg399Gln交互作用Logistic回归分析表
3 讨论
NPC是我国东南地区常见的上皮源性恶性肿瘤,一般发病于40岁以上的成年人,男女比例约为3∶1,但近年来发病年龄呈现年轻化趋势。NPC是一种多因素影响的复杂性疾病,到目前为止其具体发病机制仍不明确,多数学者认为是多种因素共同作用的结果,即遗传因素、病毒感染及环境因素。我国著名学者曾毅院士提出了NPC病因学假说:即遗传因素是发病基础,病毒感染在NPC的发病过程中起着重要的作用,而环境中的暴露因素(比如致癌物:芳香烃、煤油、煤焦油及杂酌油等)等起着协同作用[7]。NPC的发病有着显著的地域差异和种族差异,这提示遗传易感性可能是其发病的基础。
3.1 EBV与NPC的关系EBV是一种人类疱疹病毒(Human herpesvirus 4,HHV-4),它主要侵袭人类口咽上皮细胞和B淋巴细胞,可引起人类多种疾病,如Burkitt淋巴瘤、NPC及霍杰金淋巴瘤等[8],其中最严重的是NPC,也是研究报道最多的一种。EBV可产生多种抗原,如EBV核抗原(nuclear antigen,NA)、早期抗原(early antigen,EA)、膜抗原(membrance antigen,MA)和衣壳抗原(virus capsid antigen,VCA)等。通过检测NA、EA、Rta、VCA对应的抗体IgA和IgG,对早期诊断NPC及阐明EBV与NPC的关系有重要意义[9]。本研究发现EBVVCA-IgA在NPC病例组及对照组人群中的阳性率分别达89.89%和10.35%,且差异有统计学意义,EA-IgA在NPC病例组及对照组人群中的阳性率分别为达46.59%和3.1%,Rta-IgG在NPC病例组及对照组人群中的阳性率分别为63.25%和5.1%。可见EBV感染是NPC发生的重要风险因素。虽然EBV在人群中的感染率高达90%,但最终只有少部分人发展为NPC。在我们研究中,NPC组和健康对照组之间EBV-VCA-IgA、EA-IgA、Rta-IgG阳性率具有显著的统计学差异,提示EB病毒VCA-IgA、EA-IgA、Rta-IgG可作为筛查NPC发病风险的条件,其EB病毒DNA载量与NPC进展存在密切关系[26]。大量的流行病学调查资料显示,中国高发区居民移居美国、欧洲等低发病率国家数年后,NPC发病率虽然有所下降,并且NPC的发病率随着代数的增加而减少,但仍远高于当地居民[10-12]。这些研究结果提示个体的遗传基因在NPC的发生中起到一定作用。因此EBV感染与遗传易感性共同作用可能促使NPC的发生。
3.2 XRCC-1基因多态性与NPC的关系人体细胞DNA常受有害环境因素的损伤,如活性氧化物质、甲基化、脱氨基和经基化等作用引起的DNA损伤[13,14],但机体内有完整的DNA修复系统,其作用主要是修复这些损伤以保护细胞基因组的稳定性。已有研究表明,当DNA修复能力低于一般人群平均水平的个体时对肿瘤易感[6]。X射线损伤交叉互补蛋白1(XRCC1)是一种重要DNA碱基切除修复基因,是第一个能够影响细胞对电力辐射敏感性的哺乳动物基因,它通过DNA碱基切除修复(Base excision repair,BER)途径影响其DNA单链修复作用。它编码的蛋白质与DNA连接酶Ⅲ、DNA聚合酶β、多(二磷酸腺苷—核糖)多聚酶(poly ADP-ribose polymerase,PARP)相互作用,修复DNA单链断裂和进行碱基切除修复。在此修复过程中,XRCC1基因起整体调控的重要作用[15,16]。
目前研究最多的是XRCC1基因序列第194、280和399密码子的单核苷酸多态性,而仅第399位密码子(A突变为G,第399氨基酸由精氨酸变为谷氨酰胺,记作Aeg399Gln)位于己知的XRCC1功能域上[2],由此提示XRCC1第399位氨基酸的突变对DNA修复功能的影响可能显得更为重要。有学者在体外用争光霉素和二经苯丙花(BPDE)作为诱变剂,结果显示纯合子Gln/Gln个体中每个细胞染色体断裂数大于纯合子Arg/Arg和杂合子Arg/Gln个体[18]。Li等[19]的研究表明,XRCC-1 Arg基因多态性可能与化学诱导性基因损伤有关,且纯合子Gln/Gln个体的损伤程度大于杂合子Arg/ Gln。以上研究提示,提示XRCC-1 Arg399Gln基因多态性影响机体DNA修复功能,且纯合子Gln/Gln影响程度大于杂合子Arg/Gln。
关于XRCC-1 Arg399Gln基因多态性与NPC之间的易感性国内外的学者已经有过一些研究和报道,但多数研究结果显示XRCC-1 Arg399Gln基因多态性与NPC的发病风险没有关联[20-22]。Laantri[23]等学者结果显示XRCC-1 Arg399 A/G基因型和A/A基因型相比,A/G基因型更能够增加NPC的发病风险(OR=1.976,95%CI:1.389~2.321)。Li等[24]研究结果显示,XRCC-1 Arg399 A/G基因型与NPC发病风险相关(OR=1.675,95%CI:1.183-2.371),并且XRCC-1Arg399 A/A基因型可降低NPC的发病风险(OR=0.534,95%:0.377~0.757)。本研究结果显示,XRCC-1Arg399 G/G纯合突变与NPC的发病风险相关(OR=4.3,95%CI:1.184~15.618),而XRCC-1Arg399 A/G杂合突变与NPC的发病风险没有关联(OR=0.981,95%CI:0.468~2.055)。本实验研究结果之所以与前人报道不一致,考虑可能是由于地区种族差异造成的。例如,Laantri等[23]人研究的个体是非洲人群,而本次研究纳入的是中国福建地区人群。由此可见族差异可能影响着XRCC-1 Arg399基因多态性对肿瘤易感性,而且可能与环境因素之间存在一定关联。
3.3 EBV感染-XRCC-1 Arg399Gln基因多态性交互作用与NPC早在1997年美国环境卫生研究所(NIEHS)便提出了环境基因组计划(EGP),旨在研究基因多态性或基因变异与环境之间的交互作用。即使暴露于相同的环境危险因素中,也只有少数个体发病。这说明个体的反应存在很大差别,而且在很多情况下这种差别如果仅从环境因素方面难以进行合理解释,因为机体内在遗传因素在疾病发生中的也发挥重要的作用[25]。因此探讨XRCC-1 Arg399基因遗传多态性与环境因素之间的关联,将成为研究NPC发病机制的重要方向,为NPC的预防和早期诊断提供一个新思路。
本次研究中分析了EBV感染与NPC之间的交互作用,结果分析表明,XRCC-1 Arg399AA基因型与VCA-IgA和Rta-IgG有正交互作用,Arg399AG基因型与VCA-IgA有正交互作用。该结果表明,EBV感染尤其是VCA-IgA抗体阳性时与NPC的发病有正交互作用。然而本结果显示XRCC-1 Arg399 GG基因型与VCA-IgA无明显的交互作用,可能是由纳入研究样本量少造成,因此后期仍更需大样本研究来证实XRCC-1 Arg399 GG基因型与VCA-IgA间的交互作用。以上结果提示,EBV感染会增加NPC的发病风险,且EB病毒VCA-I-gA与XRCC-1 Arg399杂合突变型基因有交互作用。
目前国内外关于基因多态性对NPC的影响的研究越来越多,并且许多基因与NPC的发生相关,但研究结果却不一致,可能由于选择的研究对象不同、选择对象的地域不同、样本量大小不同及人种差异等原因造成。然而本研究存在样本量相对较小等诸多不足,较小的样本量会导致统计检验效能降低。另外,由于突变基因型在人群中的频率较低,即使该突变基因型与疾病存在相关关系,较小的样本量也很可能导致较低的统计检验效能。因此,在今后的NPC遗传学研究中应加大的样本量,并应对不同地域、不同民族、不同人种多项研究结果进行汇总分析并分层分析,对单个基因的多个SNPs进行联合分析,或者是在对单基因的多态性进行分析的同时,还应同时增加对不同染色体的多个基因的遗传变异的详细分析等等。
[1]Lamerdin JE,Montgomery MA,Stilwagen SA,et al.Genomic sequence comparison of the human and mouse XRCC1 DNA repair gene regions[J].Genomics,1995,25(2):547-554.
[2]Shen MR,Jones IM,Mohrenweiser H.Nonconservative amino acid substitution variants exist at polymorphic frequency in DNA repair genes in healthy humans[J].Cancer Res,1998,58(4):604-608.
[3]Kubota Y,Nash RA,Klungland A,et al.Reconstitution of DNA base excision-repair with purified human proteins:interaction between DNA polymerase beta and the XRCC1 protein[J].EMBO J,1996,15(23):6662-6670.
[4]Ratnasinghe D,Yao SX,Tangrea JA,et al.Polymorphisms of the DNA repair gene XRCC1 and lung cancer risk[J].Cancer Epidemiol Biomarkers Prev,2001,10(2):119-123.
[5]Xing D,Qi J,Miao X,et al.Polymorphisms of DNA repair genes XRCC1 and XPD and their associations with risk of esophageal squamous cell carcinoma in a Chinese population[J].Int J Cancer,2002,100(5):600-605.
[6]Abdel-Rahman SZ,Soliman AS,Bondy ML,et al.Inheritance of the 194Trp and the 399Gln variant alleles of the DNA repair gene XRCC1 are associated with increased risk of early-onset colorectal carcinoma in Egypt[J].Cancer Lett,2000,159(1):79-86.
[7]Liu Z,Liu Y,Zeng Y.Synergistic effect of Epstein-Barr virus and tumor promoters on induction of lymphoma and carcinoma in nude mice[J].J Cancer Res Clin Oncol,1998,124(10):541-548.
[8]Thompson MP,Kurzrock R.Epstein-Barr virus and cancer[J].Clin Cancer Res,2004,10(3):803-821.
[9]周丹,何进才.鼻咽癌血清或血浆标志物研究进展[J].实验与检验医学,2012,30(1):37-39.
[10]Wei WI,Sham JS.Nasopharyngeal carcinoma[J].Lancet,2005,365(9476):2041-2054.
[11]Chan AT,Teo PM,Johnson PJ.Nasopharyngeal carcinoma[J].Ann Oncol,2002,13(7):1007-1015.
[12]Zeng YX,Jia WH.Familial nasopharyngeal carcinoma[J].Semin Cancer Biol,2002,12(6):443-450.
[13]Divine KK,Gilliland FD,Crowell RE,et al.The XRCC1 399 glutamine allele is a risk factor for adenocarcinoma of the lung[J]. Mutat Res,2001,461(4):273-278.
[14]Abdel-Rahman SZ,El-Zein RA.The 399Gln polymorphism in the DNA repair gene XRCC1 modulates the genotoxic response induced in human lymphocytes by the tobacco-specific nitrosamine NNK[J].Cancer Lett,2000,159(1):63-71.
[15]Zhang X,Morera S,Bates PA,et al.Structure of an XRCC1 BRCT domain:a new protein-protein interaction module[J].EMBO J,1998,17(21):6404-6411.
[16]Nash RA,Caldecott KW,Barnes DE,et al.XRCC1 protein interacts with one of two distinct forms of DNA ligase III[J].Biochemistry,1997,36(17):5207-5211.
[17]Thompson LH,Brookman KW,Jones NJ,et al.Molecular cloning of the human XRCC1 gene,which corrects defective DNA strand break repair and sister chromatid exchange[J].Mol Cell Biol, 1990,10(12):6160-6171.
[18]Wang Y,Spitz MR,Zhu Y,et al.From genotype to phenotype:correlating XRCC1 polymorphisms with mutagen sensitivity[J]. DNA Repair(Amst),2003,2(8):901-908.
[19]Li Y,Marion MJ,Rundle A,et al.A common polymorphism in XRCC1 as a biomarker of susceptibility for chemically induced genetic damage[J].Biomarkers,2003,8(5):408-414.
[20]Yang ZH,Du B,Wei YS,et al.Genetic polymorphisms of the DNA repair gene and risk of nasopharyngeal carcinoma[J].DNA Cell Biol,2007,26(7):491-496.
[21]Cho EY,Hildesheim A,Chen CJ,et al.Nasopharyngeal carcinoma and genetic polymorphisms of DNA repair enzymes XRCC1 and hOGG1[J].Cancer Epidemiol Biomarkers Prev,2003,12(10):1100-1104.
[22]Visuvanathan S,Chong PP,Yap YY,et al.Distribution and haplotype associations of XPD Lys751Gln,XRCC1 Arg280His and XRCC1 Arg399Gln polymorphisms with nasopharyngeal carcinoma in the Malaysian population[J].Asian Pac J Cancer Prev,2014,15(6):2747-2751.
[23]Laantri N,Jalbout M,Khyatti M,et al.XRCC1 and hOGG1 genes and risk of nasopharyngeal carcinoma in North African countries[J].Mol Carcinog,2011,50(9):732-737.
[24]Li Q,Wang JM,Peng Y,et al.Association of DNA base-excision repair XRCC1,OGG1 and APE1 gene polymorphisms with nasopharyngeal carcinoma susceptibility in a Chinese population[J]. Asian Pac J Cancer Prev,2013,14(9):5145-5151.
[25]Hatagima A.Genetic polymorphisms and metabolism of endocrine disruptors in cancer susceptibility[J].Cad Saude Publica,2002,18(2):357-377.
[26]杨雀飞,何彪,谭贵海.鼻咽癌患者外周血淋巴细胞中EB病毒DNA载量与临床分期的关系研究[J].实验与检验医学,2014,32(2):150-152.
Associations and interactions between EB virus infection and XRCC1 Arg399Gln polymorphism in nasopharyngeal car-cinoma
GUO Junying,ZHEN Yuhong,CHUI Zhaolei,XIN Xiaoqing,LI Xiaoli,CHEN Yan.
Department of Clinical Laboratory,Fujian Provincial Key Laboratory of Tumor Biotherapy,Fujian Provincial Cancer Hospital,Fujian Medical University Cancer Hospital,Fuzhou 350014,China.
Objective To investigate the correlations between XRCC1 Arg399Gln polymorphism and the risk of nasopharyngeal carcinoma(NPC),and trace the mutual interactions between XRCC1 polymorphisms and the EB virus infection.Methods In the matched case-control study,90 NPC patients and 75 healthy controls were enrolled.Genome DNA were extracted from the whole blood and then amplified via PCR.The PCR products were further purified and sent for DNA sequencing to get the genotype of XRCC1 Codon399.At the same time,the S/CO values of VCA-IgA,EA-IgA and Rta-IgG were evaluated using ELISA,and the positive as well as the constituent ratios were assessed.Results VCA-IgA,EA-IgA and Rta-IgG positivewas regarded as a high risk factor in NPC occurrence,especially that single VCA-IgA positive seemed to be achieve the highest OR value of 26.526(95% CI:11.190-62.884).Univairate logistic regression analysis showed that the OR value of patients with XRCC-1 Arg399Gln GG genotype was more higher that that of AA genotype;There was the mutual interactions between XRCC-1 Arg399Gln GA genotype and VCA-IgA(OR=20.755,95%CI:5.312-81.094).Conclusions Arg399Gln GG genotype was associated with the susceptibility of NPC;there were interactions between(XRCC1)Arg399Gln single nucleotide polymorphisms and EB virus infection in NPC.
XRCC1;Polymorphisms;Nasopharyngeal carcinoma;VCA-IgA EA-IgA;Rta-IgG
R739.6,R730.231+.3
A
1674-1129(2016)05-0539-06
10.3969/j.issn.1674-1129.2016.05.002
2016-06-21;
2016-09-29)
福建省自然科学基金资助项目(2014J01297);福建省卫生厅青年科研课题(2012-2-12)
郭俊英,男,1976年8月生,硕士,主管技师,主要从事血液、肿瘤分子诊断
陈燕,女,1963年5月生,主任医师,教授,主要从事肿瘤分子诊断
