MICA基因多态性与结直肠癌的易感关联性研究
2016-11-15邹学森聂德魁王春阳吕赛平陈纯静
陈 恩,邹学森,聂德魁,王春阳,吕赛平,陈 慧,陈纯静,林 琳
(1、江西省肿瘤医院检验科,江西南昌330029;2、丰城市妇幼保健计划生育服务中心,江西丰城331100;3、中南大学湘雅医学院免疫学系,湖南长沙410008;4、厦门医学院基础医学部,福建厦门361008)
MICA基因多态性与结直肠癌的易感关联性研究
陈 恩1,邹学森1,聂德魁2,王春阳1,吕赛平1,陈 慧1,陈纯静3,林 琳4
(1、江西省肿瘤医院检验科,江西南昌330029;2、丰城市妇幼保健计划生育服务中心,江西丰城331100;3、中南大学湘雅医学院免疫学系,湖南长沙410008;4、厦门医学院基础医学部,福建厦门361008)
目的研究MICA等位基因多态性与结直肠癌易感性之间的关联性。方法采用PCR-SSP和PCR-SBT方法对样本MICA等位基因的多态性进行检测。结果结直肠癌患者中检出7种MICA等位基因;和对照组相比较,结直肠癌患者组中MICA*010等位基因分布频率更高,可能是结直肠癌的易感基因(30.0%vs 6.2%,OR=6.43,95%CI:3.51-11.76,Pc<0.05),MICA*008和MICA*045等位基因分布频率更低,可能是保护基因(MICA*008:14%vs 25.4%,OR=0.48,95%CI:0.29-0.78,Pc<0.05;MICA*045:2%vs 12.9%,OR=0.14,95%CI:0.05-0.40,Pc<0.05)。结论MICA等位基因多态性与结直肠癌的易感性间存在关联性。
MICA基因;基因多态性;结直肠癌
结直肠癌(colorectal cancer,CRC)是较为常见的消化道恶性肿瘤,近年来在世界范围内其发病率和死亡率总体呈不断上升的趋势。结直肠癌的发生发展与饮食、生活方式、危险因素暴露及基因变异等多种因素有关。MICA(MHC class I related chain A)是肿瘤相关基因,位于人类第6号染色体短臂,具有广泛的多态性,1994年由美国西雅图大学研究中心Spies教授领导的研究队伍报道[1-3]。MICA编码产物与HLAI类分子极其相似,包括信号肽、胞外α1、α2和α3结构,跨膜区和胞质区,但不与β2球蛋白结合。MICA分子是NK细胞表面活化性受体NKG2D分子的配体,研究表明MICA基因的多态性与多种疾病易感性相关,但暂无与中国南方人群结直肠癌患者易感性相关的报道[4-7]。因此本研究以南方汉族结直肠癌人群为研究对象,以健康人群作为正常对照,对MICA基因多态性及结直肠癌易感性之间的关联性进行研究。
1 材料与方法
1.1 研究对象100名结直肠癌患者来自于南华大学附属南华医院2012年10月-2014年10月的住院病人,均经病理诊断或辅助诊断,符合结直肠癌诊断的要求。患者平均年龄59.5岁(33岁~81岁),其中男性64例(64%),女性36例(36%)。120例健康人群作为对照,年龄35.0岁(18岁~75岁),其中男性82例(68%),女性38例(32%)。研究对象相互间无亲缘关系,均签署知情同意书,并符合伦理委员会的其它相关要求。
1.2 外周血基因组DNA的提取收集新鲜的EDTA抗凝静脉血2ml,采用WHO推荐的标准盐析法提取DNA[8],测定波长260nm和280nm的OD值,A260/A280值在1.6~1.8范围内为宜。
1.3 MICA基因分型方法采用PCR-SSP(PCR sequence-specific primers)[9]与PCR-SBT(PCR sequence-based typing)[10,11]两种不同的方法对样本进行MICA基因分型。大部分样本采用PCR-SSP方法进行分型,考虑到部分罕见MICA等位基因型别无法用PCR-SSP方法分析,采用PCR-SBT方法分析。PCR-SBT方法参照文献[12,13],设计并合成一对外部引物,扩增引物序列如下:
Forward:5'-CGTTCTTGTCCCTTGCCCGTGTG C-3',
Reverse:5'-GATGCTGCCCCATTCCCTTCCCA A-3',
扩增产物长度2.2kb。测序引物序列为:
1F:5'-ATTTCCTGCCCCAGGAAGGTTGG-3';
2R:5'-CAACTCTAGCAGAATTGGAG-3';
3F:5'-AAGAGAAACAGCCCTGTTCCTCTCC-3'
4R:'-GATGCTGCCCCATTCCCTTCCCAA-3'。
引物合成及测序由华大生物公司完成。采用Chromas Lite 2.01软件对测序结果进行分析,扫描MICA多态位点,进行人工判读并与MICA序列数据库中的标准序列进行比对,获得相应的MICA等位基因型别。
1.4 统计学分析MICA等位基因频率、MICA基因型频率、Hardy-Weinberg equilibrium(HWE)采用SHESIS软件进行计算获得。关联性分析采用Logistic回归进行统计分析,显著性检验采用Fisher精确概率检验进行,对P值采用Bonferroni校正后得到的Pc值在5%水平上进行检验。
2 结果
2.1 Hardy-Weinberg平衡吻合度检验所选择的健康对照经Hardy-Weinberg平衡吻合度检验分析表明,各等位基因的分布理论频率与观察频率之间无显著性差异,表明本实验所选样本是符合Hardy-Weinberg平衡的随机婚配群体。
2.2 MICA基因PCR-SSP产物琼脂糖凝胶电泳图图1为一随机研究对象的MICA基因PCR-SSP法扩增产物电泳图,参照MICA分型格局表对其基因型进行分析判断,该随机研究对象MICA基因型为MICA*01201/01201。

图1 一随机研究对象的MICA PCR产物电泳图谱M:Marker;1~67为67个引物对,68孔为空白对照。
1.5.3 MICA等位基因多态性与结直肠癌相关性分析结直肠癌患者中共检出7种MICA等位基因,其中MICA*010、MICA*019、MICA*002是患者组中分布频率最高的3种等位基因,分别占30.0%、22.0%、20.0%。和对照组相比较,结直肠癌患者组中MICA*010等位基因分布频率显著偏高(30.0% vs 6.2%,OR=6.43,95%CI:3.51~11.76,Pc<0.05);MICA*010等位基因可能对结直肠癌易感(OR= 6.43,95%CI:3.51~11.76,Pc<0.05);。MICA*008和MICA*045等位基因在结直肠癌患者组分布频率显著偏低(MICA*008:14.0%vs 25.4%,OR= 0.48,95%CI:0.29~0.78,Pc<0.05;MICA*045:2.0% vs 12.9%,OR=0.14,95%CI:0.05~0.45,Pc<0.05),见表1。
1.5.4 MICA-STR基因多态性与结直肠癌关联性分析结直肠癌患者中共检出5种MICA-STR等位基因,其中MICA-A5在结直肠癌患者组中分布频率最高,占52.0%,与对照组比较,结直肠癌患者组中MICA-A5等位基因显著升高(52%vs 35.4%,OR=1.98,95%CI:1.35~2.90,Pc<0.05);MICA-A5.1等位基因分布则显著降低(14.0%vs 25.4%,OR= 0.48,95%CI:0.29~0.78,Pc<0.05)(见表2)。
1.5.5 MICA基因型与结直肠癌相关性分析和对照组相比较,结直肠癌患者组MICA*008/008基因型分布频率显著减少(2.0%vs 10.8%,OR= 0.17,95%CI:0.04~0.76,Pc<0.05);MICA*002/010、MICA*010/010基因型分布显著升高(MICA*002/ 010:14.0%vs 4.2%,OR=3.74,95%CI:1.30~10.79,Pc<0.05;MICA*010/010:16.0%vs0.8%,OR= 22.67,95%CI:2.95~174.24,Pc<0.05)(见表3)。
3 讨论
结直肠癌是常见的消化道恶性肿瘤,其在世界范围内的发病率和死亡率总体呈不断上升的趋势。在我国,随着经济社会发展和人们生活水平提高,包括饮食、生活方式在内的多种环境因素都在不断的发生变化,直肠癌的发病率也呈逐年上升的趋势[14]。结直肠癌的发病机制复杂,其发生受饮食、生活方式、环境因素、遗传因素、致癌物的暴露强度、种族、地域等多种因素影响。近年来,直结肠癌的遗传易感性机制在其发病中的意义越来越引起人们的重视,大量的研究开始关注于直结肠癌发病与基因多态性之间的关联性研究。研究表明,MMP-7基因多态性可能是直肠癌进展的一个因素;XRCC2基因多态性与直肠癌发病风险存在关联性;IGFBP7 rs11133472AG、rs1718848AG基因型增加直肠癌患病风险[15-17];以上研究结果充分说明,直结肠癌的发生发展与遗传因素密切相关;结直肠癌的发生是多种基因共同作用的结果;单一基因对结直肠癌的发生作用有限;因此需对结直肠癌与基因多态性之间的关联进行深入研究。
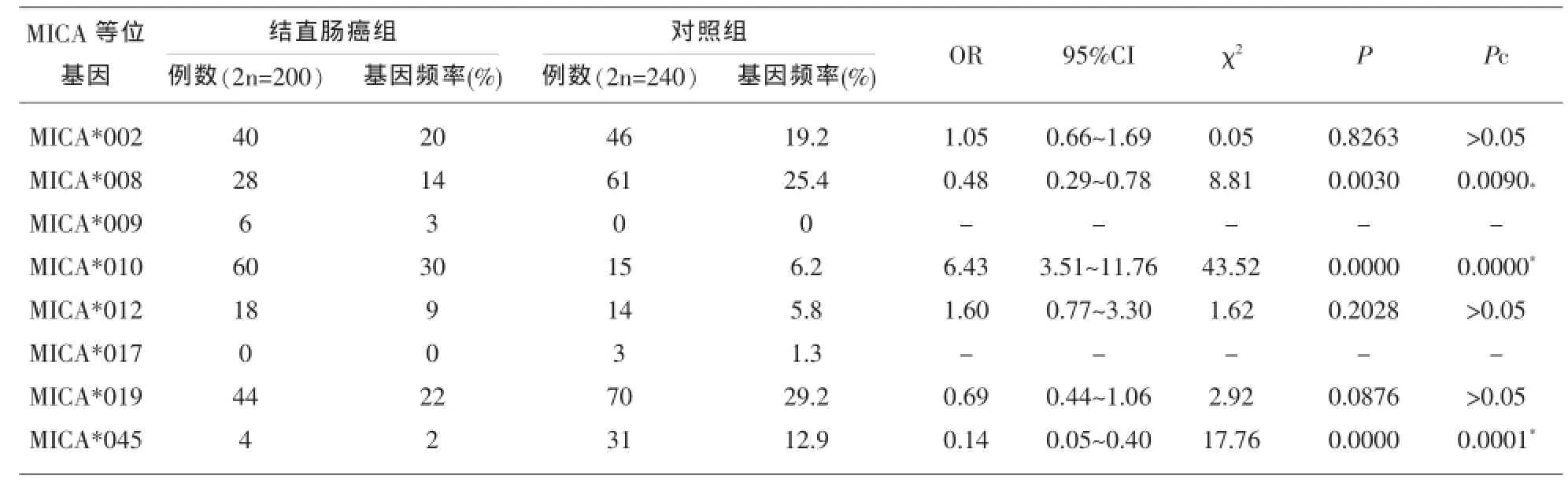
表1 MICA等位基因频率在结直肠癌病人与对照人群中的比较

表2 MICA-STR等位基因频率在肺癌病人与对照人群中的比较

表3 MICA基因型频率在结直肠癌病人与对照人群中的比较
MICA基因具有高度的多态性,目前已报道超过100个基因型。MICA基因的高度多态性与肿瘤、自身免疫病等多种疾病发生发展相关[14-16]。根据编码跨膜区DNA序列微卫星GCT重复次数的不同,已发现有A4、A5、A5.1、A6、A7、A9和A10等MICA跨膜区微卫星基因型。A5.1与其他微卫星基因型主要区别在于第952位处插入了一个鸟嘌呤核苷酸残基,导致移码突变,这种变异的MICA分子在翻译部分跨膜结构后遇终止密码而被中断,从而使MICA-A5.1分子仅含有部分膜区结构,但胞浆尾部结构完全缺失[18]。Gambelunghe G等发现,MICA-A5.1基因与SLE易感正相关[19]。邢永华等人通过对青海回族胃癌人群的MICA-TM等位基因的分型研究发现,MICA-A5.1基因是胃癌易感相关基因[20]。Zhao J等人近来研究表明,功能性的MICA-129基因多态性与溃疡性结肠炎的发病呈正相关[21]。Garcia G等人发现MICA*008型别为登革热发病的易感基因[22],MICA-A5.1与多种疾病的易感之间具有关联性[23]。
我们采用PCR-SSP及PCR-SBT方法检测了结直肠癌患者中MICA等位基因分布的情况,首次报道了MICA等位基因在中国南方人群结直肠癌患者中的分布频率。我们的研究发现,结直肠癌患者中共检出7种MICA等位基因,其中MICA *010、MICA*019、MICA*002是患者组中分布频率最高的3种等位基因。MICA*008和MICA*045等位基因在结直肠癌患者组分布频率较少,提示为结直肠癌的保护性等位基因(OR<1,Pc<0.05)。MICA*010等位基因在结直肠癌患者组分布较多,提示为结直肠癌的易感性等位基因(OR>1,Pc<0.05)。结直肠癌患者中共检出5种MICA-STR等位基因,其中MICA-A5在直结肠癌患者组中分布频率最高,提示为结直肠癌的易感性等位基因OR>1,Pc<0.05);MICA-A5.1在结直肠癌患者中分布较少,提示为结直肠癌的保护性等位基因(OR<1,Pc<0.05);这些结果提示结直肠癌的发生发展与MICA基因的多态性之间存在关联。推测可能的致病机制是由于某些型别的MICA基因编码的蛋白质分子与NK细胞、CD8+T细胞上的NKG2D受体亲和力低,导致这些免疫细胞不能有效活化,对肿瘤细胞不能发挥正常的免疫监视功能所致。特别的是,在本次研究中我们发现,结直肠癌患者人群中MICA-A5.1分布率低,可能原因有二,一是标本数量偏少,二是直结肠癌肿瘤细胞表面MICA的α3区域与ERp5形成复合物,使得MICA可以被ADAM裂解,诱生可溶性的MICA(sMICA),即“MICA脱落”现象[24]。裂解下来的sMICA与NKG2D相互作用,然后诱导其内化及降解,并刺激免疫抑制性T细胞的增殖,使得MICA-A5.1等位基因表现出对结直肠癌不易感。然而结直肠癌的发生是环境和遗传因素交互作用的结果,是一种多因素、多阶段、多基因导致的疾病,目前仍不清楚MICA基因是如何独立于其他基因对结直肠癌的发生发展起作用的机制,且不同人群中MICA基因型分布不完全相同。因此,我们将对不同地区及种族之间多个基因的多态性与结直肠癌易感性之间的关系进行进一步研究。
[1]Bahram S,Bresnahan M,Geraghty DE,et al.A second lineage of mammalian major histocompatibility complex class I genes[J].Proc Natl Acad Sci USA,1994,91(14):6259-6263.
[2]Chen D,Gyllensten U.MICA polymorphism:biology and importance in cancer[J].Carcinogenesis,2014,35(12):2633-2642.
[3]Wang YJ,Zhang NJ,Chen E,et al.Allele polymorphism and haplotype diversity of MICA/B in Tujia nationality of Zhangjiajie,Hunan Province,China[J].Hum Immunol,2016,77(5):411-417.
[4]姜孝新.MICA与感染性疾病、肝硬化、肝癌的相关性研究[D].中南大学,2012.
[5]侯成荣,王明宁,邢永华,等.青海土族和藏族MICA基因多态性与RA相关性分析[J].青海医学院学报,2013,(1):15-19.
[6]Ayo CM,Oliveira AP,Camargo AV,et al.Association of the Functional MICA-129 Polymorphism With the Severity of Chronic Chagas Heart Disease[J].Clin Infect Dis,2015,61(8):1310-1313.
[7]Kamoun A,Bouzid D,Mahfoudh N,et al.Association study of MICA-TM polymorphism with inflammatory bowel disease in theSouth Tunisian population[J].Genet Test Mol Biomarkers,2013,17(8):615-619.
[8]Gong Z,Luo QZ,Lin L,et al.Association of MICA gene polymorphisms with liver fibrosis in schistosomiasis patients in the Dongting Lake region[J].Braz J Med Biol Res,2012,45(3):222-229.
[9]Luo QZ,Lin L,Gong Z,et al.Positive association of major histocompatibility complex class I chain-related gene A polymorphism with leukemia susceptibility in the people of Han nationality of Southern China[J].Tissue Antigens,2011,78(3):178-184.
[10]Chen E,Lin L,Chen CJ,et al.MIC gene polymorphism and haplotype diversity in Zhuang nationality of Southern China[J].Hum Immunol,2014,75(9):953-959.
[11]Lin L,Yang W,Chen E,et al.MIC gene polymorphism and haplotype diversity in Li nationality of Southern China[J].Tissue Antigens,2015,85(1):45-49.
[12]龚拯.MICA/B基因多态性与血吸虫病和白血病相关性研究[D].中南大学,2012.
[13]邹义洲.主要组织相容性复合体I类相关基因A(MICA)在人体器官移植免疫中作用研究[D].中南大学,2010.
[14]杨雪梅,左向华,孙士欣,等.3项血清肿瘤标志物检测在结直肠癌诊断中的意义[J].国际检验医学杂志,2013,(16):2107-2108.
[15]欧玉荣,景桂英,吴琼,等.结直肠癌组织Tcf-4表达与MMP7和survivin表达的关系及临床意义[J].四川大学学报(医学版),2015,(4):554-559.
[16]彭浩洋.IGFBP7基因多态性与结直肠癌发病风险的关联研究[D].河北医科大学,2014.
[17]谭晓龙.XRCC2基因多态性与结直肠癌发病风险的关联研究[D].河北医科大学,2014.
[18]Bahram S,Mizuki N,Inoko H,et al.Nucleotide sequence of the human MHC class I MICA gene[J].Immunogenetics,1996,44(1):80-81.
[19]Gambelunghe G,Gerli R,Bocci EB,et al.Contribution of MHC class I chain-related A(MICA)gene polymorphism to genetic susceptibility for systemic lupus erythematosus[J].Rheumatology(Oxford),2005,44(3):287-292.
[20]邢永华,杨生玺,吕同德,等.青海汉族、回族、藏族MICA-TM基因多态性与胃癌相关性[J].青海医学院学报,2011,(1):1-4.
[21]Zhao J,Jiang Y,Lei Y,et al.Functional MICA-129 polymorphism and serum levels of soluble MICA are correlated with ulcerative colitis in Chinese patients[J].J Gastroenterol Hepatol,2011,26(3):593-598.
[22]Garcia G,Del PF,Perez AB,et al.Association of MICA and MICB alleles with symptomatic dengue infection[J].Hum Immunol,2011,72(10):904-907.
[23]Zhao S,Wang H,Nie Y,et al.Midkine upregulates MICA/B expression in human gastric cancer cells and decreases natural killer cell cytotoxicity[J].Cancer Immunol Immunother,2012,61(10):1745-1753.
[24]Kaiser BK,Yim D,Chow IT,et al.Disulphide-isomerase-enabled shedding of tumour-associated NKG2D ligands[J].Nature,2007,447(7143):482-486.
Study on the association between MICA gene polymorphism and colorectal cancer
CHEN En1,ZOU Xuesen1,NIE Dekui2,WANG Chunyang1,LV Saiping1,CHEN Hui1,CHEN Chunjing3,LIN Lin4.
1.Clincal Laboratory,Jiangxi Province Tumor Hospital,Nanchang 330029,China;2.Maternal And Child Health Care Family Planning Service Center of Fengcheng,Fengcheng Jiangxi 331100,China;3.Department of Immunology,College of Basic Medical Sciences,Central South University,Changsha 410078,China;4.Faculty of Basic Medical Sciences,Xiamen Medical College,Xiamen Fujian 361008,China.
Objective To study the association between the MICA gene polymorphism and susceptibility to colorectal cancer. Methods PCR-SSP and PCR-SBT were used to analyze the gene polymorphism of MICA in 100 colorectal cancer patients and 120 healthy individuals.Results Seven allele genes were found in the participants,the phenotype frequency of MICA*010 was higher in colorectal cancer patients when compared with healthy controls,presenting genic susceptibility to colorectal cancer(30. 0%vs 6.2%,OR=6.43,95%CI:3.51-11.76,Pc<0.05).Additionally,MICA*008 and MICA*045 were less frequent among patients(MICA*008:14%vs 25.4%in healthy controls,Pc<0.05,OR=0.48,95%CI:0.29-0.78;MICA*045:2%vs 12.9%in healthy controls,Pc<0.05,OR=0.14,95%CI:0.05-0.40),presenting genic protection to colorectal cancer.Conclusions These results suggest that the MICA allele gene polymorphism may be associated with susceptibility to colorectal cancer.
MICA alleles;Gene polymorphism;Colorectal cancer
R574.63,R446.62
A
1674-1129(2016)05-0545-05
10.3969/j.issn.1674-1129.2016.05.003
2016-05-18;
2016-07-07)
江西省卫生计生委科技计划项目(20165393)
陈恩,1982年11月生,男,主管检验师,医学博士,中南大学免疫学专业毕业,主要从事遗传免疫研究。TEL:079188313884;E-mail:cheneng3821@sina.com.
林琳,1979年6月生,女,讲师,医学博士,中南大学免疫学专业毕业,主要从事遗传免疫研究。TEL:05922110642;E-mail:lynnvenn@sina.com.
