口服轮状病毒减毒活疫苗与麻疹-风疹联合减毒活疫苗联合接种的免疫原性和安全性研究
2016-11-15唐伟甘霖黄毅宾冬梅杨艳芳
唐伟,甘霖,黄毅,宾冬梅,杨艳芳
(1.四川大学华西公共卫生学院,四川 成都 610041;2.南充市疾病预防控制中心;3.南充市妇幼保健院,四川 南充 637000)
口服轮状病毒减毒活疫苗与麻疹-风疹联合减毒活疫苗联合接种的免疫原性和安全性研究
唐伟1,2,甘霖1,黄毅1,宾冬梅3,杨艳芳1
(1.四川大学华西公共卫生学院,四川 成都610041;2.南充市疾病预防控制中心;3.南充市妇幼保健院,四川 南充637000)
目的:探讨口服轮状病毒减毒活疫苗(oral live attenuated rotavirus vaccine,ORV)与麻疹-风疹联合减毒活疫苗(measles and rubella combined attenuated live vaccine,MR)联合接种的可行性,为制定免疫规划程序提供可靠的科学依据。方法:设两种疫苗同时接种组和单苗接种组,观察疑似预防接种异常反应(AEFI)发生情况,接种前后、联合接种与单独接种组之间抗体几何平均滴度/浓度(GMT/GMC)、抗体阳性率和阳转率的差异。结果:各接种组临床反应都轻微,实验组与各对照组免前免后同种抗体GMT/GMC、阳性率,以及免后抗体阳转率,其差异均无显著意义(P>0.05)。结论:ORV与MR同时接种未发现严重异常反应和相互干扰免疫应答,可以同时接种。
口服轮状病毒减毒活疫苗;麻疹-风疹联合减毒活疫苗;联合接种;免疫原性;安全性
根据口服轮状病毒减毒活疫苗(oral live attenuated rotavirus vaccine,ORV)与麻疹-风疹联合减毒活疫苗(measles and rubella combined attenuated live vaccine,MR)两种疫苗的免疫程序,这两种疫苗存在同时接种的可能性。目前,所有的研究均表明这两种疫苗单独使用有良好的免疫原性和安全性[1-3],但国内还没有对ORV与MR同时接种的研究报道。鉴于此,为探讨ORV与MR联合接种的免疫原性和安全性变化开展本次研究。
1 对象与方法
1.1研究对象
以知情同意、自愿参加、免费接种为原则,2013年11月至2014年5月,在南部县4个乡镇选择8~9月龄没有接种过轮状病毒、麻疹、风疹疫苗的健康幼儿作为研究对象,共计280名。运用《随机数字表》以4∶4∶2的比例随机分为3组,实验组联合接种ORV和MR,对照1组单独接种ORV,对照2组单独接种MR。
1. 2疫苗及接种方法
ORV由中国生物技术股份有限公司(以下简称中生股份)兰州生物制品研究所有限责任公司生产,批号:201304042,有效期至2014年4月25日;ORV为口服疫苗,剂量3 mL,用吸管吸取后,直接喂于受种者,看服下肚。MR由中生集团公司北京天坛生物制品股份有限公司生产,批号:201304104,有效期至2014年10月27日,MR为冻干疫苗,剂量0.5 mL,冻干疫苗复溶后,每瓶0.5 mL,于上臂外侧三角肌下缘附着处皮下注射。
所有研究对象在接种前采静脉血3 mL,接种完成后35~42 d开展免疫后采血。MR抗体检测采用微量血凝抑制试验(HI),采用德国维润赛润麻疹、风疹IgG抗体定量检测试剂盒,轮状病毒疫苗免疫后采用血清中和试验检测抗RV-IgA。麻疹IgG抗体活性>200 U/mL为阳性、150~200 U/mL为灰区(本研究作为阳性处理)、<150 U/mL为阴性;风疹IgG抗体活性>20 U/mL为阳性、10~20 U/mL为灰区(本研究作为阳性处理)、<10 U/mL为阴性;轮状病毒IgA抗体滴度达到1∶50为阳性。抗体阳性率为抗体水平达到或高于阳性判定标准的人数占观察对象的比例;抗体阳转率为抗体免疫前阴性免疫后为阳性和免疫前为阳性免疫后抗体滴度/浓度增长≥4倍的人数占观察对象的比例。
1.4安全性观察
每个观察对象接种后30 min观察即时反应,确认无异常即可离开现场,并于24、48、72 h测量体温并观察局部反应(接种部位疼痛、红晕、浸润、肿胀、硬结及其大小程度和机体活动障碍等)。硬结、红肿直径<15 mm为轻度反应;15~30 mm为中度反应;>30 mm为重度反应;坏疽或剥脱性皮炎为潜在的生命危险。腋下体温37.1~37.5 ℃为轻度反应;37.6~39 ℃为中度反应;>39 ℃为重度反应。
1.5统计学分析
采用Epidata 3.1软件录入现场监测表格,SPSS 17.0统计软件进行数据统计分析。血清抗体水平用抗体滴度或浓度的几何平均数和95%可信区间表示,抗体滴度倒数、抗体浓度经对数转换后,组间比较用方差分析或t检验,组内免疫接种前后比较用配对t检验;抗体阳性率、阳转率、不良反应发生率比较用检验或Fisher确切概率法。
2 结果
2.1基本情况
选择研究对象280名,失访21名,血清检测结果不全36名,获得有效研究对象223名,有效率为79.64%。其中ORV+MR组84名,ORV组90名,MR组49名,男女性别比分别为1.21∶1、0.65∶1、0.92∶1,性别差异无统计学意义(χ2=3.801,P=0.150)。
2. 2抗体检测结果分析
2.2.1对照组免疫前、后抗体检测结果分析麻疹GMC由免疫前12.82 U/mL上升至免疫后1 178.61 U/mL,增长了92倍,二者差异有统计学意义(t=7.010,P﹤0.001);阳性率由免疫前32.65%上升至97.96%,二者差异有统计学意义(χ2=46.118,P﹤0.001);阳转率为75.51%。风疹GMC由免疫前2.93 U/mL上升至免疫后50.38 U/mL,增长了17倍,二者差异有统计学意义(t=10.938,P﹤0.001);阳性率由免疫前28.57%上升至95.92%,二者差异有统计学意义(χ2=47.285,P﹤0.001);阳转率为75.51%。轮状病毒GMT由免疫前1∶39.99上升至免疫后1∶117.55,二者差异有统计学意义(t=1.549,P﹤0.001);阳性率由免疫前52.22%上升至78.89%,二者差异有统计学意义(χ2=9.378,P=0.002);阳转率为44.44%,见表1。
9月25日下午,第五届黄河国际论坛水领导人高层论坛举行。水利部部长陈雷在论坛讲话并回答现场提问。水利部副部长胡四一,联合国教科文组织前副总干事、联合国教科文组织水教育学院院长纳吉共同主持论坛。水利部副部长李国英,水利部黄河水利委员会主任陈小江,水利部总工程师汪洪、总规划师周学文等出席。
2.2.2实验组免疫前、后抗体检测结果分析麻疹GMC由免疫前5.32 U/mL上升至免疫后943.36 U/mL,增长了177倍,二者差异有统计学意义(t=12.031,P﹤0.001);阳性率由免疫前14.29%上升至97.62%,二者差异有统计学意义(χ2=118.344,P﹤0.001);阳转率为84.52%。风疹GMC由免疫前1.36 U/mL上升至免疫后34.39 U/mL,增长了25倍,二者差异有统计学意义(t=17.579,P﹤0.001);阳性率由免疫前13.10%上升至90.48%,二者差异有统计学意义(χ2=100.724,P﹤0.001);阳转率为77.38%。轮状病毒GMT由免疫前1∶32.02上升至免疫后1∶97.55,二者差异有统计学意义(t=2.949,P﹤0.001);阳性率由免疫前48.81%上升至69.05%,二者差异有统计学意义(χ2=13.185,P﹤0.001);阳转率为38.89%。见表1。
2.2.3实验组与对照组抗体比较(1)免疫前比较:两组麻疹GMC差异无统计学意义(t=1.210,P=0.229);阳性率差异有统计学意义(χ2=6.282,P=0.012)。两组风疹GMC差异有统计学意义(t=2.539,P=0.012),阳性率差异有统计学意义(χ2=4.856,P=0.028)。两组轮状病毒GMT差异无统计学意义(t=0.771,P=0.441);阳性率差异无统计学意义(χ2=0.202,P=0.653)。(2)免疫后比较:两组麻疹GMC差异无统计学意义(t=1.336,P=0.184),阳性率差异无统计学意义(P=0.694),抗体阳转率差异无统计学意义(χ2=1.647,P=0.199)。两组风疹GMC差异有统计学意义(t=2.217,P=0.028),阳性率差异无统计学意义(P=0.214),阳转率差异无统计学意义(χ2=0.061,P=0.806)。两组轮状病毒GMT差异无统计学意义(t=0.695,P=0.488),阳性率(χ2=0.006,P=0.937)和阳转率(χ2=0.003,P=0.958)差异均无统计学意义。
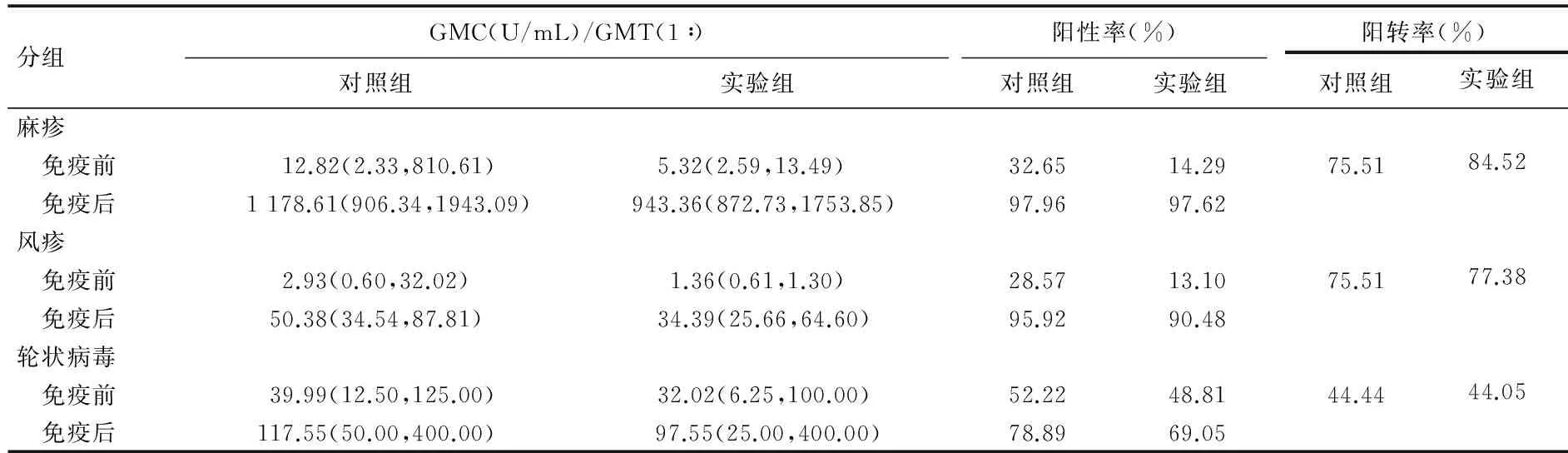
表1 免疫前、后抗体检测结果
2.3安全性观察
报告不良反应15例,不良反应发生率为5.35%,其中中度发热7例,轻度硬结7例,中度发热合并轻度硬结1例,无异常反应和其他严重反应发生。按组别分实验组报告6例,不良反应发生率5.36%,对照1组报告2例,不良反应发生率1.79%,对照2组报告7例,不良反应发生率12.50%。实验组分别与两个对照组采用Fisher确切概率法比较,检验水准调整为α’=0.012 5[4],实验组与对照1组(P=0.280)、2组(P=0.128)均无差异,见表2。

表2 接种后不良反应发生情况
3 讨论
本文实验组(两苗联合接种组)与对照组(单苗接种组)都为同一地点的年龄、性别大致相符的儿童,特别是免疫前比较两组同种抗体GMC/GMT均接近,除风疹抗体外,其余两种抗体差异均无统计学意义,说明两组的可比性好。
联合免疫的原则是:不产生免疫干扰,不加重反应或提高制剂的免疫效果[5]。观察结果表明,ORV与MR单独接种均可产生较好的免疫效果,麻疹、风疹、轮状病毒抗体水平、阳性率均显著增长,能够预防相应的传染病。免后两组轮状病毒抗体之间的差异无统计学意义,且阳转率、抗体水平增长倍数与龚富强等[3]在广东惠州开展的口服轮状病毒活疫苗安全性和免疫原性观察结果基本一致。免疫后两组麻疹抗体之间的差异无统计学意义,阳性率与周绍英等[2]的观察结果基本一致(97.34%),低于王海明等[6]的研究结果(100%),这可能与王海明的研究中选择的对象均有两次以上麻疹疫苗免疫史有关。免疫后实验组风疹GMC低于对照组,可能与免疫前两组的差异有关系,但两组阳性率与周绍英等[2]的观察结果基本一致(95.25%)。
本研究中不良反应发生率为5.35%。其中,单独接种MR的不良反应发生率为12.50%,低于梁祁等[7]报道的结果(27.86%)。单独接种ORV的不良反应发生率为1.82%,与龚富强等[3]对惠州市63例6个月~3岁的儿童口服轮状病毒活疫苗后的不良反应发生率(6.34%)比较略低。本研究中,试验组不良反应发生率分别与对照组进行分析,差异均无统计学意义,表明ORV与MR联合接种与两种疫苗单独接种的安全性相似,均具有较好的安全性。
另外,接种前麻疹IgG抗体阳性率(32.65%,14.29%)低于四川省2010年小于8月龄婴儿的阳性率(64.51%)[8],高于常州市武进区2013年无麻疹疫苗免疫史婴儿的抗体阳性率(12.00%)[9],属于中等水平。未接种婴儿体内抗体的主要来源是母传抗体,其高低受其母亲抗体高低的影响[10]。根据2010年四川省的调查数据[11],育龄妇女的麻疹IgG抗体几何平均浓度为1 879.90 mIU/mL,阳性率为92.05%,已经维持在较高的水平,这可能是四川省未接种婴儿抗体阳性率较高的原因。研究中发现接种前联合接种ORV和MR的实验组麻疹、风疹的阳性率低于单独接种MR的对照组,但是接种后实验组和对照组的阳性率反而没有了差异,ORV和MR联合接种是否可以促进麻疹、风疹抗体的产生有待进一步的研究。
由于研究中血清抗体的检测方法并不统一,抗体水平存在抗体几何平均滴度和抗体几何平均浓度两种检测结果,在比较时具有一定局限性。
[1]黄长江,王尚舜.国产冻干麻疹风疹二联活疫苗临床安全性研究[J].安徽预防医学杂志,2000,6(4):262-263.
[2]周绍英,方挺,马瑞,等.儿童接种麻疹风疹联合减毒活疫苗的免疫效果观察[J].浙江预防医学,2012,24(12):10-12.
[3]龚富强,朱秀兰.口服轮状病毒活疫苗安全性和免疫原性观察[J].微生物学免疫学进展,2005,33(3):10-11.
[4]孙振球.医学统计学[M].第2版,北京:人民卫生出版社,2005:150.
[5]王益寿.医用生物制品学[M].杭州: 浙江科学技术出版社,1992:440-453.
[6]王海明,徐永范,竺稽定,等.麻疹风疹联合减毒活疫苗的安全性及免疫原性观察[J].中国疫苗和免疫杂志,2011,17(5):425-480.
[7]梁祁,周伟忠,李靖欣,等.麻疹风疹联合减毒活疫苗的安全性及免疫原性观察[J].中国生物制品学杂志,2011,24(12):1490-1493.
[8]敖睿,张菊英,付清培,等.2010年四川省麻疹抗体水平监测[J].预防医学情报杂志,2012,28(12):969-972.
[9]朱洪鸣,潘英姿,薛曼,等.常州市武进区人群麻疹风疹及流行性腮腺炎抗体水平调查[J].浙江预防医学杂志,2015,27(1):55-59.
[10]Plans P,Costa J,Domínguez A,etal.Prevalence of protective measles virus antibody levels in umbilical cord blood samples in Catalonia,Spain[J].Clinical and vaccine immunology,2010,17(4):691-694.
[11]魏兴武,苏黎,叶永青,等.婚前育龄妇女接种麻疹疫苗免疫效果观察[J].中国公共卫生,2005,21(8):924-925.
(学术编辑:潘池梅)
本刊网址:http://www.nsmc.edu.cn作者投稿系统:http://noth.cbpt.cnki.net邮箱:xuebao@nsmc.edu.cn
本刊网址:http://www.nsmc.edu.cn作者投稿系统:http://noth.cbpt.cnki.net邮箱:xuebao@nsmc.edu.cn
Study on immunogenicity and safety of oral live attenuated rotavirus vaccine combined with measles and rubella combined attenuated live vaccine
TANG Wei1,2,GAN Lin1,HUANG Yi1,BIN Dong-mei3,YANG Yan-fang1
(1.CollegeofPublicHealth,SichuanUniversity,Chengdu610041;2.NanchongCenterforDiseaseControlandPrevention,Nanchong637000;3.NanchongMaternalandChildHealth-CareHospital,Nanchong637000,Sichuan,China)
Objective:To explore the applied feasibility of oral live attenuated rotavirus vaccine(ORV) and measles and rubella combined attenuated live vaccine(MR),and provide reliable science data for setting the immune planning process.Methods:Set up two kinds of vaccine inoculation group simultaneously and respectively inoculation group,observe Adverse Events Following Immunization (AEFI) development on this matter,the difference between the pre and post of immunization,simultaneously or respectively inoculated,geometrical mean titer,concentrations(GMT/GMC),differences among protection rate and serum conversion?rate.Results:The clinical reactions of each group was mild,the experimental group and the control group,before and after immunization the iso-antibody GMT/GMC,positive rate,and free after seroconversion rate,the difference was not significant(P>0.05).Conclusion:Concurrent vaccination of ORV and MR vaccines did not have severe adverse events and interfere with antibody response neither.They can be administered at the same time.
Oral live attenuated rotavirus vaccine;Measles and rubella combined attenuated live vaccine;Combined immunization;Immunogenicity;Safety
10.3969/j.issn.1005-3697.2016.05.025
2015-12-17
唐伟(1980-),男,主管医师。E-mail:11021477@qq.com
杨艳芳,E-mail:yang2009@scu.edu.cn
时间:2016-10-2511∶31
http://www.cnki.net/kcms/detail/51.1254.R.20161014.1716.050.html
1005-3697(2016)05-0710-04
R186.2
A
