培门冬酶在儿童急性淋巴细胞白血病中作为一线药物的疗效及安全性评价
2016-11-15夏利平
夏利平
(武汉大学人民医院儿科,湖北 武汉 430060)
培门冬酶在儿童急性淋巴细胞白血病中作为一线药物的疗效及安全性评价
夏利平
(武汉大学人民医院儿科,湖北 武汉430060)
目的:对培门冬酶(pegaspargase-asparaginase,PEG-ASP)一线治疗不良反应事件发生率和近期疗效进行评价。方法:选择2014年6月至2016年1月在本院住院的儿童急性淋巴细胞白血病 (acute lymphoblastic leukemia,ALL)48例。其中,PEG-ASP一线治疗患儿10例为A组;左旋门冬酰胺酶(L-asparaginase,L-ASP)一线治疗患儿25例为B组;诱导期使用L-ASP,巩固期使用PEG-ASP患儿13例为C组。观察各组疗效以及不良反应发生情况。结果:(1)48例ALL患儿1个疗程后完全缓解34例(70.8%),复发8例(16.7%),死亡6例(12.5%);(2)3组不良反应除过敏反应差异具有统计学意义(P<0.05),其它不良反应如:Ⅲ-Ⅳ级严重不良反应、消化道反应、肝功能异常、血糖升高以及凝血功能异常均无统计学差异(P>0.05)。结论:PEG-ASP可以作为一线药物治疗ALL患儿,其过敏反应发生率低,治疗期间密切监测不良反应指标可增加用药安全性,值得临床推广与应用。
培门冬酶;药物治疗;急性淋巴细胞白血病;儿童
左旋门冬酰胺酶(L-asparaginase,L-ASP) 广泛应用于儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL) 的治疗,能显著提高其治愈率,长期生存率可达80%~90%。然而,L-ASP 在发挥治疗作用的同时还会产生多种毒副作用,如肝功能损害、血栓形成、过敏性休克、胰腺炎、凝血功能障碍等,且静脉注射的变态反应发生率高[1-2]。培门冬酶(pegaspargase-asparaginase,PEG-ASP)是一种长效的新型门冬酰胺酶制剂,不仅保留了L-ASP生物活性,并且外源性细菌蛋白质的免疫原性大幅降低,同时延长人体内的半衰期,其不良反应与L-ASP相似[3-6]。因此,PEG-ASP目前已逐渐应用于临床,尤其是对L-ASP过敏的ALL患者使用更为适合。本研究旨在探讨对PEG-ASP作为一线药物治疗ALL的不良反应事件发生率和疗效评价。
1 资料及方法
1.1一般资料
选择2014年6月至2016年1月在我院住院的ALL儿童48例。其中,PEG-ASP一线治疗患儿10例为A组; L-ASP一线治疗患儿25例为B组;诱导期使用L-ASP、巩固期使用PEG-ASP患儿13例为C组。纳入标准:根据WHO淋巴系统肿瘤病理诊断标准(2008版)和《血液病诊断与疗效标准(第三版)》,证实患有ALL。依照BFM临床分组方案,将48例ALL患儿分为高危(high risk,HR)、中危(intermediate risk,IR)和标危(standard risk,SR)3组,依次为10例、17例和21例。排除标准:脑血管疾病或功能障碍者;肿瘤有转移或转移迹象者;有严重内科疾病者;正在接受其他抗癌治疗方案者;意识不清且精神状态差者。采用卡方检验或秩和检验对各项指标进行组间分析。结果显示,各组一般资料均无统计学差异(P>0.05),具有可比性。患者和(或)监护人均签署知情同意书。见表1。

表1 3组患者一般资料比较[M(QL,QU)]
1.2研究方法
1.2.1治疗方案根据德国BFM协作组CCLG-ALL 2008化疗方案对ALL患儿进行治疗。见表2。
1.2.2不良反应监测及干预方法根据WHO化疗药物不良反应标准对患儿不良反应进行评价。整个治疗过程需密切观察变态反应等不良症状发生情况,常规随访空腹血糖、尿糖、血和尿淀粉酶、胆红素、血浆蛋白、凝血功能、血脂肪酶和肝肾功能等1~2次/周。如发生呕吐、腹痛等疑似胰腺炎性反应症状时则加做腹部影像学检查,如CT、B超等;如发生凝血功能异常则采取补充冷沉淀、血浆等;如发现有胰腺炎表现则采取禁食、垂体后叶素和营养支持治疗;如发生变态反应则加用抗组胺药物及肾上腺皮质激素;如出现黄疸、肝功能异常则采取保肝退黄治疗。其他不良反应视情况及时处理。
1.3统计学分析
应用SPSS 17.0统计软件分析。采用卡方检验对计量资料进行组间比较,秩和检验法对非正态分布数据进行组间比较。P<0.05时认为差异具有统计学意义。

表2 ALL患儿治疗方案
注:*表示只对IR和HR患儿进行。
2 结果
2.1疗效观察
48例ALL患儿中,1个疗程后完全缓解34例,占70.8%。其中,A组8例(80.0%);B组17例(68.0%);C组9例(69.2)。A组SR、IR、HR分别为:4例(100%)、2例(50.0%)、2例(100%);B组为10(76.9%)、5例(62.5%)、2例(50.0%);C组为3例(75.0%)、3例(60.0%)、3例(75.0%),差异均无统计学意义(P>0.05)。48例ALL患儿中复发8例(16.7%),复发例数A组SR、IR、HR分别为0(0%)、1例(25.0%)、0(0%);B组为2例(15.4%)、1例(12.5%)、1例(25%);C组为1例(25.0%)、1例(20.0%)、1例(25.0%),差异均无统计学意义(P>0.05)。患儿中死亡6例(12.5%),死亡例数A组SR、IR、HR分别为0(0%)、1例(25.0%)、0(0%);B组为1例(7.7%)、2例(25.0%)、1例(25.0%);C组为0(0%)、1例(20.0%)、0(0%),差异均无统计学意义(P>0.05)。见表3。

表3 3组疗效比较
2.2PEG-ASP安全性评价
A、B、C 3组发生不良反应的例数分别为6例(60.0%)、20例(80.0%)、8例(61.5%),差异无统计学意义(P>0.05);发生Ⅲ-Ⅳ级严重不良反应的例数分别为1例(10.0%)、3例(12.0%)、2例(15.4%),差异无统计学意义(P>0.05);发生过敏反应的例数分别为1例(10.0%)、16例(64.0%)、7例(53.8%),差异具有统计学意义(P<0.05);发生消化道反应的例数分别为3例(30.0%)、9例(36.0%)、4例(30.8%),差异无统计学意义(P>0.05);发生肝功能异常的例数分别为1例(10.0%)、5例(20.0%)、2例(15.4%),差异无统计学意义(P>0.05);发生血糖升高的例数分别为0(0%)、1例(4.0%)、1例(7.7%),差异无统计学意义(P>0.05);发生凝血功能异常的例数分别为4例(40.0%)、16例(64.0%)、7例(53.8%),差异无统计学意义(P>0.05);发生胰腺炎的例数分别为1例(10.0%)、1例(4.0%)、0(0%),差异无统计学意义(P>0.05)。见表4。
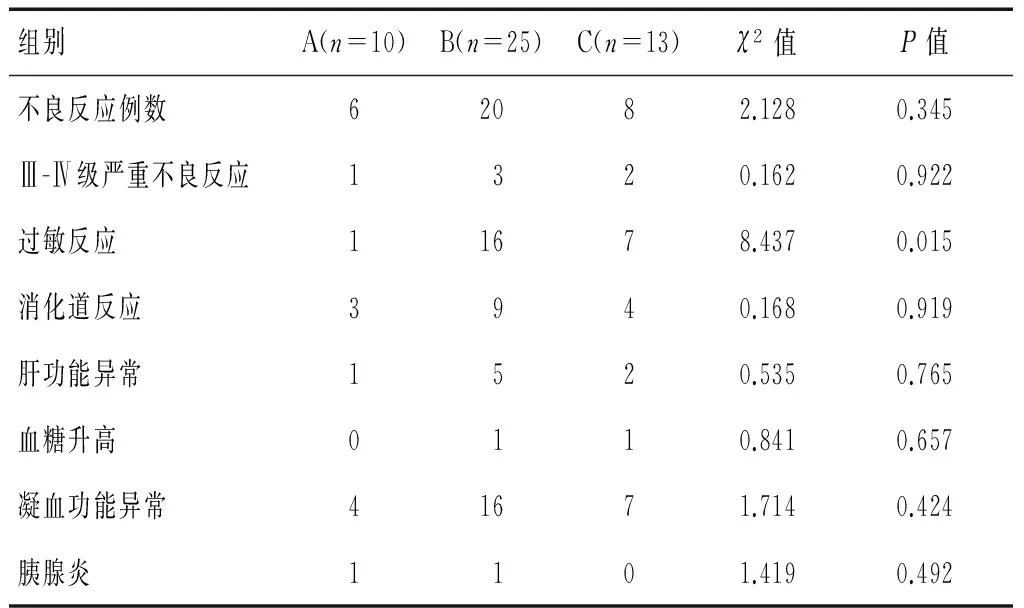
表4 3组不良反应比较
3 讨论
3.1PEG-ASP与ALL
ALL是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病[7]。异常增生的原始细胞可在骨髓聚集并抑制正常造血功能,同时也可侵及骨髓外的组织,如性腺、肝、脑膜、淋巴结等[8-10]。调查表明,我国ALL发病率约为0.67/10万[11],ALL发病高峰为儿童,占儿童白血病的70%以上[12-14]。
研究表明,L-ASP可作为治疗儿童初发ALL的一种基础性药物,由其联合的化疗方案可刺激患者耗竭体内L-天冬酰胺,特异性地阻断外源L-天冬酰胺供给其蛋白质的合成,从未抑制肿瘤细胞蛋白质合成,达到抗肿瘤目的,可提高初发ALL患儿的临床治愈率。然而,研究指出,由于L-ASP外源性细菌性蛋白质的特殊性,机体易被诱发产生急性过敏反应,干扰患者免疫识别,减少酶活性[15],降低L-Asp疗效。过敏反应严重时危及生命,因而其临床推广需慎重。
PEG-ASP是ASP与聚乙二醇化学偶联合成的人工复合物,不仅保持L-ASP的酶活性,而且药物在到达肿瘤组织前保持脂质体形态,减少了蛋白质酶解及肾脏排泄,并且减少蛋白质的免疫原性,从而降低过敏反应的发生率。此外,研究表明PEG-ASP在人体抗蛋白酶水解的能力能比L-ASP提高10倍以上,其半衰期相对较长,从而使PEG-ASP的用药剂量和频率大幅减低,可减缓患者接受反复注射的痛苦[16]。
3.2PEG-ASP疗效及安全性评价
本研究结果显示,48例ALL患儿中,1个疗程后完全缓解34例,占70.8%;复发8例,占16.7%;死亡6例,占12.5%。其中,A、B、C 3组患者完全缓解、复发、死亡病例差异均无统计学意义(P>0.05)。由此可见, PEG-ASP一线治疗、L-ASP一线治疗以及诱导期使用L-ASP,巩固期使PEG-ASP对ALL患儿的治疗效果相似,PEG-ASP可以作为一线药物治疗ALL患儿。
另外,3组过敏反应的例数分别为1例(10.0%)、16例(64.0%)、7例(53.8%),差异具有统计学意义(P<0.05),说明以PEG-ASP为一线治疗患儿发生过敏的概率明显低于诱导期使用L-ASP巩固期使PEG-ASP,低于L-ASP为一线治疗的治疗方案。其他不良反应如:Ⅲ-Ⅳ级严重不良反应、消化道反应、肝功能异常、血糖升高以及凝血功能异常在3组中均无统计学差异(P>0.05)。这说明虽然PEG-ASP在过敏反应的发生率上好于L-ASP,但依然存在Ⅲ-Ⅳ级严重不良反应、消化道反应、肝功能异常、血糖升高以及凝血功能异常等不良反应。因此,对患儿的临床观察仍需密切观察上述不良症状发生情况,常规随访空腹血糖、尿糖、血和尿淀粉酶、胆红素、血浆蛋白、凝血功能、血脂肪酶和肝肾功能等指标,如出现异常反应则及时采取有效干预手段,减少严重不良反应以及死亡的发生。
综上,PEG-ASP可以作为一线药物治疗ALL患儿,其过敏反应发生率低,治疗期间密切监测可能出现的不良反应相应生物指标可增加用药安全性,值得临床推广与应用。
[1]王淑红,尹千里.左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病出凝血功能障碍的临床疗效分析[J].黑龙江医药,2015,(4):817-818.
[2]王芊入,肖桂荣,徐珽,等.临床药师参与1例左旋门冬酰胺酶致血糖升高的药学实践[J].中国药师,2015,18(7):1185-1187.
[3]覃海园,刘汉锋,甘廷庆,等.培门冬酶抗人套细胞淋巴瘤细胞株Jeko-1细胞作用机制的研究[J].广西医科大学学报,2012,29(2):213-215.
[4]廖宁,莫武宁,李山,等.广西地区儿童急性白血病流式细胞术免疫分型研究[J].广西医科大学学报,2006,23(2):250-251.
[5]张世恒.培门冬酶诱导治疗儿童初发急性淋巴细胞白血病临床分析[J].中国伤残医学,2015,(4):32-33.
[6]欧阳周,易平勇,孙中义,等.培门冬酶治疗结外NK/T细胞淋巴瘤的疗效及安全性分析[J].中国全科医学,2014,(18):2136-2138.
[7]Abbott LS,Zakova M,Shaikh F,etal.Allergic Reactions Associated with Intravenous Versus Intramuscular Pegaspargase:A Retrospective Chart Review[J].Paediatr Drugs,2015,17(4):315-321.
[8]Li Y,Zhang X,Hu T,etal.Asparagine synthetase expression and its potential prognostic value in patients with NK/T cell lymphoma[J].Oncol Rep,2014,32 (2):853-859.
[9]Buie LW,Moore J,Deventer H.Successful Use of Octreotide as a Chemoprotectant for Prevention of PEG-Asparaginase-Induced Pancreatitis[J].Pharmacotherapy,2014,34 (8):e149-e151.
[10]刘芳,万扬,常丽贤,等.培门冬酶诱导治疗儿童初发急性淋巴细胞白血病的疗效观察[J].中华儿科杂志,2014,52(3):215-217.
[11]曹欣欣,李剑,张薇,等.培门冬酶联合化疗治疗急性淋巴细胞白血病与T细胞非霍奇金淋巴瘤的安全性分析[J].中华血液学杂志,2015,36(3):177-180.
[12]Liu F,Wan Y,Chang L,etal.Efficacy observation of polyethylene glycol conjugated asparaginase for induction treatment of children with newly diagnosed acute lymphoblastic leukemia[J].Zhonghua Er Ke Za Zhi,2014,52 (3):215-217.
[13]Liu L,Xie XT.Advances on the role of pegaspargase in the treatment of childhood leukemia[J].Zhongguo Dang Dai Er Ke Za Zhi,2014,16(2):155-160.
[14]Wen JY,Li M,Li X,etal.Efficacy and tolerance of pegaspargase-based chemotherapy in patients with nasal-type extranodal NK/T-cell lymphoma:a pilot study[J].Asian Pac J Cancer Prev,2014,15(15):6275-6281.
[15]August KJ,Miller WP,Dalton A,etal.Comparison of hypersensitivity reactions to PEG-asparaginase in children after intravenous and intramuscular administration[J].J Pediatr Hematol Oncol,2013,35 (7):e283-e286.
[16]Escherich G,Stadt U,Zimmermann M,etal.Clofarabine in combination with pegylated asparaginase in the frontline treatment of childhood acute lymphoblastic leukaemia:a feasibility report from the CoALL 08-09 trial[J].Br J Haematol,2013,163(2):240-247.
(学术编辑:王怡)
本刊网址:http://www.nsmc.edu.cn作者投稿系统:http://noth.cbpt.cnki.net邮箱:xuebao@nsmc.edu.cn
The curative effects and safety of pegaspargase-asparaginase on acute lymphoblastic leukemia in children
XIA Li-ping
(DepartmentofPediatrics,People’sHospitalofWuhanUniversity,Wuhan430060,Hubei,China)
Objective:To evaluate the incidence of adverse events and the recent curative effects on pegaspargase-asparaginase(PEG-ASP).Methods:From June 2014 to January 2016,48 children with acute lymphoblastic leukemia (ALL) in our hospital were divided into 3 groups (Group A:10 patients with PEG-ASP,Group B:25 patients with L-ASP,Group C:13 patients with L-ASP+PEG-ASP),and their curative effects and adverse reactions were observed.Results:(1)In 48 children with ALL,34 cases(70.8%) were complete remission,8 cases(16.7%) relapsed,6 cases(12.5%) died;(2)The difference of the allergic reaction in three groups was statistically significant (P<0.05),other reactions as:Ⅲ-Ⅳ serious adverse reactions,digestive tract reaction,abnormal liver function,blood glucose and blood coagulation dysfunction were not statistical different(P>0.05).Conclusion:PEG-ASP can be used as a treatment for children with ALL,the incidence of allergic reactions is low,and close monitoring of adverse reactions during treatment index can increase the drug safety.
Pegaspargase-asparaginase(PEG-ASP);Drug treatment;Acute lymphoblastic leukemia (ALL);Children
10.3969/j.issn.1005-3697.2016.05.06
2016-04-02
夏利平(1975-),女,博士,主治医师。E-mail:xialipings@sina.com
时间:2016-10-2511∶31
http://www.cnki.net/kcms/detail/51.1254.R.20161014.1716.012.html
1005-3697(2016)05-0644-04
R733.1
A
