棉酚对小鼠肝脏SOD GSH-Px和MDA的影响
2016-11-15王海涛赵树臣侯振中
王海涛,梁 璐,赵树臣,侯振中
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
棉酚对小鼠肝脏SOD GSH-Px和MDA的影响
王海涛,梁璐,赵树臣,侯振中
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
为了探讨不同浓度棉酚对小鼠体重及肝脏组织抗氧化能力的影响,将32只小鼠随机分成4组(对照组和低中高剂量棉酚组),连续灌胃20 d后处死并取肝脏称重计算脏器指数,用分光光度法测定肝脏组织超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)或活性及丙二醛(MDA)含量。结果随着灌胃天数的增加,对照组和低剂量组体重呈上升趋势,中、高剂量组体重呈下降趋势;各剂量组肝脏脏器指数明显增加,低、中剂量组显著高于对照组(P<0.05或P<0.01),高剂量组高于对照组(P>0.05)。随着棉酚剂量的增加,中、高剂量组SOD活力显著低于对照组(P<0.01),低剂量组和中高剂量组GSH-Px活力显著低于对照组(P<0.05或P<0.01),中、高剂量组MDA含量显著高于对照组(P<0.05或P<0.01),表明口服中、高剂量的棉酚可抑制小鼠体重的增加,降低肝脏的抗氧化能力,使脂质过氧化反应增强,导致肝脏氧化损伤,使肝脏功能受损。
棉酚;小鼠;体重;肝脏;抗氧化能力
棉酚(GOS)是锦葵科植物棉花的根、茎和种子所含的一种黄色多元酚类有毒化合物[1]。棉酚的毒性主要由活性醛基和活性羟基引起。动物摄入棉酚后,棉酚在体内各器官中的分布是不均匀的,肝脏含量最多,其次是胆汁、血清和肾,而淋巴结、脾、心、肺、膈肌和胰中的含量较低[2]。动物机体的酶促抗氧化系统包括:超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)[3];而机体脂质过氧化损伤的程度及氧自由基的水平用丙二醛(MDA)含量的高低来表示[4]。
棉酚的毒性作用成为国内外研究人员的研究热点,但棉酚对小鼠肝脏的氧化应激损伤作用相对少见,本文主要探讨棉酚对小鼠体增重的影响及肝脏组织SOD、GSH-Px活性及MDA含量的影响,旨在进一步了解棉酚的氧化损伤作用机制。
1 材料与方法
1.1试验材料
1.1.1实验动物普通级昆明系小鼠32只,雄性,8周龄,体重20±2 g,购自东北农业大学实验动物中心。饲养于鼠笼中,适应期为一周。在适应期和试验阶段温度控制在22℃±2℃,湿度50%±2%,确保室内通风良好,每天光照12 h,给予自由采食和饮水。
1.1.2试验药品醋酸棉酚,购自大连美仑生物技术有限公司,纯度>97.5%。CMC-Na,分析纯,购自天津市永大化学试剂有限公司,溶于蒸馏水中配成1%CMC-Na溶液。SOD测试盒,MDA测试盒,GSH-Px测试盒,总蛋白定量测试盒,均购自南京建成生物工程研究所。
1.2试验方法
1.2.1动物分组和给药饲养一周后将32只小鼠随机分为4组,每组8只,分别为对照组(1% CMC-Na)和低、中、高剂量组(40 mg/kg、80 mg/kg、120 mg/kg体重的GOS),其中对照组每天按0.01 mL/g 1%CMC-Na灌胃;试验组用1%CMC-Na将棉酚稀释成4 mg/mL、8 mg/mL和12 mg/mL的棉酚稀释液,每天按0.01 mL/g给小鼠灌胃20 d。
1.2.2称重在每天早上7:30至8:30给空腹后的小鼠进行称重。
1.2.3动物组织样品的处理及指标检测在第21天时将小鼠断颈处死,迅速取出小鼠肝脏,称重,计算脏器指数;冰水浴条件匀浆,2 500 r/min低温离心10 min,制成10%,5%和0.25%的匀浆。采用南京建成生物工程研究所提供的试剂盒检测SOD、GSH-Px活性及MDA和总蛋白含量。
1.3统计分析用GraphPad Prism 5.0作图软件进行作图,试验数据用SPSS 19.0统计学软件进行记录,多组间差异比较采用One-Way ANOVA分析,两两比较采用LSD-t检验。检验结果用表示。
2 结果与分析
2.1不同浓度的棉酚对小鼠体重及肝脏脏器指数的影响
2.1.1不同浓度的棉酚对小鼠体重影响由图1可知,随着灌胃天数的增加,对照组和低剂量组体重呈上升趋势,中、高剂量组体重呈下降趋势;与第0天同组体重相比,给小鼠灌胃6 d后,高剂量组显著降低(P<0.05);给小鼠灌胃14 d后,与第0天同组体重相比,对照组体重显著上升(P<0.05),中、高剂量组显著低于第0天同组体重(P<0.05或P<0.01);给小鼠灌胃20 d后,对照组和低剂量组显著高于第0天同组体重(P<0.01或P<0.05),中高剂量组极显著低于第0天同组体重(P<0.01)。
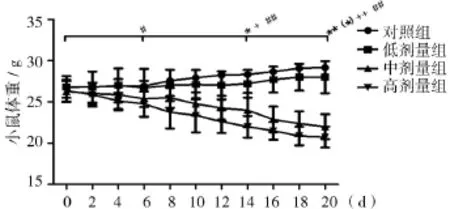
图1 不同浓度的棉酚对小鼠体重的影响
2.1.2棉酚对肝脏脏器指数的影响由图2可知,给小鼠灌胃20 d后,与对照组相比,脏器指数有所增高,但低剂量组差异极显著(P<0.01),中剂量组差异显著(P<0.05)。高剂量组差异不显著(P>0.05)。
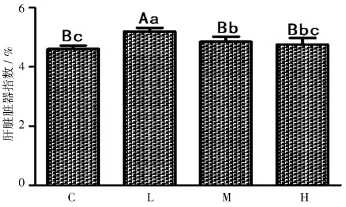
图2 不同浓度的棉酚对小鼠脏器指数的影响
通过以上可以说明,棉酚可以使小鼠体重降低和肝脏脏器指数增加。
2.2棉酚对肝脏组织氧化应激有关酶活性的影响棉酚对肝脏组织SOD、GSH-Px活力和MDA含量的影响由表1可知,随着棉酚浓度的增加,SOD、GSH-Px的活力逐渐降低,MDA的含量逐渐升高。中、高剂量组SOD的活力极显著低于对照组(P<0.01);低剂量组和中、高剂量组GSH-Px活力显著低于对照组(P<0.05或P<0.01);中、高剂量组MDA的含量显著高于对照组(P<0.05或P<0.01)。与对照组相比,低剂量组SOD活力降低和MDA含量增加差异不显著(P>0.05)。
通过以上可以说明,每天给小鼠灌胃高于80 mg/kg体重的棉酚可以使SOD活力降低、MDA含量增加,每天灌胃高于40 mg/kg体重的棉酚可以使GSH-Px活力降低。
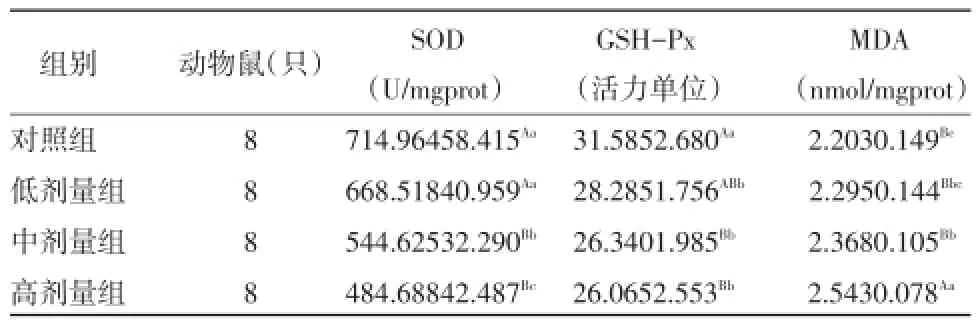
表1 不同浓度的棉酚对肝脏组织SOD、GSH-Px活性MDA含量的影响
3 讨论
有报道表明,在兔饲料中添加20%棉籽饼,试验兔出现了中毒的症状,表现为精神不振、食欲减退、被毛无光泽、消瘦和粪尿带血等症状[5]。本试验给小鼠棉酚灌胃后,动物逐渐出现行动缓慢,精神沉郁,并且出现饮食饮水减少。高剂量组体重下降明显,在灌胃两周后四肢末端和尾根发凉,腹部胀气明显,出现腹泻和血便,嘴角发黑。对小鼠进行剖检,肺淤血、水肿、肝充血,打开腹腔,有难闻的恶臭气体,腹腔积液,盲肠胀气明显,肠道血管充血,这一结果与上面的报道有相似性,同时也与袁彦波等[6]研究基本一致。
体重减轻是慢性中毒的标志之一,此试验表明,中、高剂量的棉酚可使小鼠体重迅速下降,说明大于80 mg/kg体重浓度的棉酚对小鼠有毒性作用。脏器指数是毒理试验中常用的指标,脏器指数增大,表明脏器充血、水肿或增生肥大[7]。该试验结果表明,虽然低、中、高剂量组的脏器指数逐渐降低,但都高于对照组,分析其原因可能是低剂量组棉酚导致小鼠肝脏代偿性肥大,但对于中、高剂量组来说,随着灌胃时间的增加,肝脏组织可能失去代偿能力,向萎缩方向发展。
在细胞内,棉酚可以结合在内质网和线粒体膜,同时棉酚与氨基酸非特异性共价结合使棉酚成为普遍的酶抑制剂[8]。SOD在细胞浆中和线粒体基质中起重要的防御作用[9],SOD是机体抗脂质过氧化酶促防御系统中的一个重要酶,能有效清除氧自由基。GSH-Px是一种抗氧化酶,可清除线粒体及胞浆中所产生的H2O2和脂类中的H2O2。而MDA为脂质过氧化终产物之一,其水平的高低与机体脂质过氧化程度成正比[10]。de Carvalho W L等人以40 mg/kg体重剂量的棉酚给Wistar大鼠灌胃15 d,造成大鼠肝脏GSH含量减少,GSSG含量增加[11]。有研究发现,低浓度的棉酚引起大鼠繁殖能力降低,而GSH-Px活性和GSSG含量显著增加,MDA水平增加[12]。本试验表明,随着棉酚剂量的增加,肝脏中SOD、GSH-Px活性逐渐降低,MDA含量逐渐升高,且呈一定的剂量-效应关系,这说明一定剂量的棉酚可以造成肝脏组织脂质过氧化反应增强,抗氧化能力降低,从而导致肝脏氧化损伤。这一结果与Bender H S等[13]的报道相一致。然而EI-sharaky A S等[14]通过给大鼠每天注射低于20 mg/kg体重浓度的棉酚2周,结果发现GSH-Px和SOD活性升高,造成与本试验的不同,主要可能与棉酚的剂量和在体内作用的时间有关,而此试验造成的SOD、GSH-Px活性下降,可能是棉酚对两种酶的直接作用或是SOD、GSH-Px在清除自由基的过程中导致自身活性的下降,具体机制还有待于进一步深入探讨。
4 结论
口服80 mg/kg体重以上剂量的棉酚可抑制小鼠体重的增加,降低肝脏的抗氧化能力,引起肝脏氧化应激,造成肝脏功能受损。本试验为棉酚引起肝脏氧化损伤提供一定的参考,具体机制还有待于进一步研究。
[1]邵仕香,董庆洁,郭星,等.棉酚及其衍生物的医药研究进展[J].天津理工学院学报,2002,18(1):87-92.
[2]王利,汪开毓.动物棉酚中毒的研究进展[J].畜禽业,2002,(5):26-28.
[3]侯楠楠.棉酚对蛋鸡肝细胞脂质代谢和抗氧化功能的影响[D].泰安:山东农业大学,2014.
[4]桑琛,李明学.衰老自由基学说和运动对抗自由基损伤的作用[J].吉林体育学院学报,2007,23(1):80-81.
[5]刘芳,潘晓亮.棉籽饼和棉籽壳对育肥羊尿结石发病率的影响[J].中国畜牧兽医,2008,35(4):92-94.
[6]袁彦波,赵树臣,侯振中.棉酚对雄性小鼠的生殖毒性作用[J].中国兽医杂志,2015,51(7):83-85.
[7]Dahamna S,Bencheikh F,Harzallah D,et al.Cypermethrin toxic effects on spermatogenesis and male mouse reproductive organs[J].Commun Agric Appl Biol Sci,2010,75(2):209-216.
[8]吴高风.棉酚对细毛羊睾丸间质细胞和精液品质影响的研究[D].石河子:石河子大学,2010.
[9]赵云罡,徐建兴,线粒体.活性氧和细胞凋亡[J].生物化学与生物物理进展,2001,28(2):168-171.
[10]李艳飞,赵汉嵩,罗继龙,等.长期铝暴露对大鼠肝脏功能的影响[J].中国兽医杂志,2012,48(3):12-14.
[11]de Carvalho W L,Maioli M A,Mendes L C N,et al.Mechanisms of the intoxication of rat liver caused by gossypol[J].Pesquisa Veterinria Brasileira,2013,33(3):339-344.
[12]Santana A T,Guelfi M,Medeiros H C,et al.Mechanisms involved in reproductive damage caused by gossypol in rats and protective effects of vitamin E[J].Biological Research,2015,48(1):1-8.
[13]Bender H S,Derolf S Z,Misra H P.effects of Gossypol on the Antioxidant Defense System of the Rat Testis[J].Systems Biology in Reproductive Medicine,1988,21(1):59-70.
[14]El-Sharaky A S,Newairy A A,Elguindy N M,et al.Spermatotoxicity,biochemical changes and histological alteration induced by gossypol in testicular and hepatic tissues of male rats[J].Food and Chemical Toxicology,2010,48(12):3354-3361.
S859.82
B
0529-6005(2016)09-0096-03
2016-03-16
王海涛(1990-),男,硕士生,研究方向为临床兽医学,E-mail:haitao19901008@163.com
赵树臣,E-mail:zscrichard@163.com;侯振中,E-mail:houzz_1963@163.com
