顺铂诱导体外犬乳腺肿瘤细胞凋亡影响
2016-11-15孙思超孙东东王英雪常宏建
孙思超,孙东东,王英雪,常宏建,刘 云
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
顺铂诱导体外犬乳腺肿瘤细胞凋亡影响
孙思超,孙东东,王英雪,常宏建,刘云
(东北农业大学动物医学学院,黑龙江 哈尔滨 150030)
为研究顺铂诱导体外犬乳腺肿瘤细胞CHMp凋亡影响,本试验采用不同浓度的顺铂以不同作用时间处理细胞,用MTT法检测细胞活性,通过透射电镜观察CHMp细胞形态学变化,用流式细胞仪研究CHMp细胞凋亡和周期。结果显示,CHMp细胞生长受浓度和时间双重依赖,浓度越高,时间越长,抑制越明显,在电镜下观察细胞出现明显的凋亡形态,同时5 μmol/L顺铂作用24 h后细胞阻滞于G1/S期,比例高达75.12%。结果表明,顺铂能抑制CHMp增殖,诱导细胞凋亡,阻滞细胞G1/S期。
顺铂;犬乳腺肿瘤细胞;细胞凋亡
顺铂应用于多种肿瘤的一线联合化疗方案中。自美国密执安州立大学教授BRos即berg和vCamp发现顺铂具有抗癌活性以来,铂族金属抗癌药物的应用和研究得到了迅速的发展。顺铂已成为癌症化疗不可缺少的药物[1]。1995年WHO对上百种治癌药物进行排名,顺铂的综合评价(疗效,市场等)位居榜前列第2位[2]。另据统计,在我国以顺铂为主或有顺铂参加配伍的化疗方案占所有化疗方案的70%~80%。而关于顺铂对犬乳腺肿瘤的国内外报道较少,其相关机制研究也不是很明确。
本试验以体外培养犬乳腺肿瘤细胞系CHMp株为模型,以不同浓度的顺铂在不同时间、时间点药物作用下,对CHMp细胞增殖、细胞毒性作用和细胞形态学变化及周期阻滞进行分析,探讨顺铂诱导细胞凋亡的形态学变化,为更进一步研究顺铂诱导犬乳腺肿瘤细胞凋亡机制以及犬乳腺肿瘤的临床治疗提供了部分理论依据。
1 材料与方法
1.1细胞系及主要试剂细胞系CHMp是由日本东京大学农学部生命科学学科犬学院兽医外科研究室馈赠。胎牛血清为美国Gibco公司产品。细胞凋亡和周期检测均有凯基生物公司提供。顺铂、MTT,均购自Sigma公司。
1.2细胞培养从液氮中取出细胞系CHMp进行复苏,用含10%Gibco胎牛血清的DMEM培养液于CO2传代培养,所设条件为37℃、95%湿度、5% CO2,待细胞形态和活力处于最佳状态时进行下一步试验。必要时可加入100 U/mL青霉素,100 μg/mL链霉素防止真菌感染。
1.3细胞干预试验通过查看相关文献最终确定以终浓度为1~7 μmol/L7个浓度阶梯的顺铂处理密度为1×106个/mL对数生长期细胞,分别培养12、24、48 h后对细胞进行检测。
1.4四唑盐比色法(MTT法)将密度为5×104/ mL的细胞悬液接种于96孔板,以1~7 μmol/L顺铂7个浓度阶梯,6个平行样进行细胞培养。并按MTT法试剂盒说明书以6 h为时间间隔检测顺铂的抑制率,并计算IC50(半数致死量)。抑制率=1-加药组OD值/对照组OD值,lgIC50=Xm-I(P-(3-Pm-Pn)/4),(Xm:lg最大剂量;I:lg最大剂量/相临剂量;P:阳性反应率之和;Pm:最大阳性反应率;Pn:最小阳性反应率)。
1.5透射电镜观察选取终浓度为0 μmol/L、2.5 μmol/L、5 μmol/L、10 μmol/L顺铂 处 理 细 胞CHMp,先后用2.5%戊二醛固定液和1%锇酸固定细胞团,丙酮/醋酸异戊酯脱水,环氧树脂包埋后切片,在石蜡片上先后滴加醋酸钠和柠檬酸铅双染色并清洗,透射电镜观察细胞凋亡形态及细胞器的变化。
1.6细胞凋亡的检测选取终浓度为0 μmol/L、5 μmol/L顺铂处理细胞CHMp,用不含EDTA的胰酶消化收集细胞,经2次PBS洗涤后(2 000 r/min离心5 min),加入500 μL的Binding Buffer悬浮细胞,在避光条件下先后加入5 μL Annexin V-FITC和5 μL Propidium lodide混匀,进行流式细胞仪的观察和检测。
1.7细胞周期的检测选取终浓度为0 μmol/L、5 μmol/L顺铂处理细胞CHMp,用胰酶消化细胞,经2次PBS洗涤后,1 000 r/min(4℃)离心10 min,加入1 mL预冷的70%乙醇过夜。次日检测前用PBS洗涤2次,1 000 r/min离心10 min,每管加入的PI配比为500 μL PBS、25 μL PI和2.5 μL RNase A,在避光条件下用流式细胞仪观察和检测。
2 结果
2.1MTT法检测细胞活性用MTT比色法检测顺铂在不同浓度梯度和时间梯度对CHMp细胞的抑制率的影响。结果显示,随着药物浓度的增加,抑制率稳步上升,且上升趋势逐渐变缓,经公式计算该细胞株的IC50为5.58 μmol/L(图1)。用浓度为5.58 μmol/L的顺铂以不同时间梯度作用于该细胞株,结果显示,随着时间的增加,细胞的活性逐渐下降,药物抑制率缓慢上升(图2)。顺铂对CHMp细胞具有一定的抑制作用,且抑制效果随着药物浓度和时间的增加而增加,具有浓度依赖性和时间依赖性。

图1 不同浓度顺铂对CHMp的抑制率(24 h)
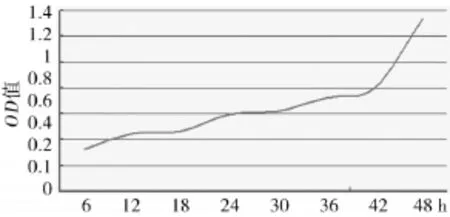
图2 顺铂对CHMp的抑制趋势时间分布
2.2电镜观察细胞的凋亡形态用电镜观察24 h后不同浓度的顺铂对CHMp细胞生长的影响,发现在正常状态下,细胞结构完整,胞体清晰,胞核和胞浆界限分明,多数细胞处于对数生长期,核分裂,细胞活力强(图3A)。加入CDDP 2.5 μmol/ L后细胞结构完整,体积变小,偶尔也能见到核分裂现象,胞核和胞浆界限较分明,有些细胞表面出现芽状突起,细胞活性比对照组弱(图3B),加入CDDP 5.0 μmol/L后可明显看到胞核内有空泡样变化,核仁发生碎裂或消失,细胞大小不一,细胞活性弱(图3C),加入CDDP10 μmol/L后细胞空泡样加剧,胞浆内细胞器溶解消失,出现许多凋亡小体,细胞基本功能丧失,活性很低(图3D)。
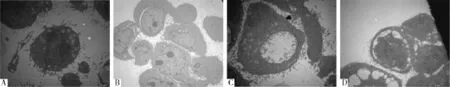
图3 透射电镜下顺铂对犬乳腺肿瘤细胞的形态学变化 (6 000×)
2.3细胞凋亡和周期分布将对照组和加药组(顺铂5.0 μmol/L)细胞培养24 h后,用胰酶消化与PI染料混合送往生科楼进行流式细胞仪检测。结果可以看出对照组凋亡率低,为2.3%,细胞主要集中在Q3象限内,加药组细胞凋亡率上升,为13.1%,Q2和Q4象限内明显看到细胞团,细胞凋亡明显,且Q3象限的细胞团均往右移;对照组细胞以G1期为主,S期次之,G2期相对较少,加药组细胞G1期比例明显下降,且S期所占比例最多,高达73.67%。由此可见,顺铂能诱导CHMp细胞发生凋亡,且阻滞细胞生长于G1/S期。见图4及中插彩版图5。
3 讨论
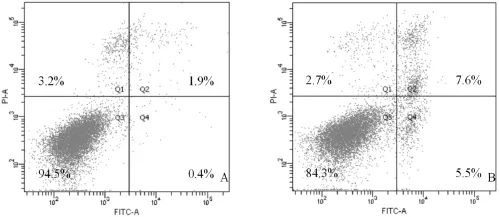
图4 流式细胞仪检测细胞凋亡分布
犬乳腺肿瘤的研究越来越受到国内外学者的重视,一方面因为它是兽医临床中的常见病,约占母犬所有肿瘤的50%,占母犬生殖系统疾病的82%[3],是犬肿瘤性疾病中最为重要的类型之一;另一方面,因为犬乳腺肿瘤在发病原因、组织学来源、分类以及转移等方面都与人乳腺肿瘤相似,是很好的人乳腺癌的动物模型。
顺铂目前被广泛运用与实力肿瘤的临床治疗,可抑制癌细胞的DNA复制过程,并损伤其细胞膜上结构,有较强的广谱抗癌作用[4]。研究表明,顺铂在体外也可抑制细胞增殖,诱导细胞凋亡[5]。本试验MTT检测中,顺铂对CHMp细胞具有明显的抑制作用,且存在时间依赖性和浓度依赖性。在电镜下观察细胞可看到细胞凋亡明显,胞质内空泡样变化,核碎裂甚至消失。本试验结果与有关顺铂抗癌机制研究一致[6],对犬乳腺肿瘤的治疗具有一定的理论依据。
促进细胞凋亡是治疗肿瘤细胞的一个有效途径,有研究表明,顺铂等铂类化疗药物能够阻滞细胞于G1/S期[7]。由于顺铂作用的靶点之一是细胞DNA。当顺铂进入细胞后,可与胞内DNA结合,使DNA发生结构扭曲,而使细胞DNA损伤,发生凋亡现象,这一损伤主要发生于S期。因为顺铂本身是细胞周期特异的药物(S期特异的杀伤药物),可将细胞阻滞于G1/S期[8]。本试验结果发现,顺铂能够促进犬乳腺肿瘤细胞CHMp凋亡,但从结果看凋亡并不十分明显,对照组和试验组凋亡率相差10%左右,而图中确实存在一部分细胞发生凋亡,其原因可能是顺铂不仅促进该细胞株细胞凋亡,而且能抑制细胞增殖,两者作用使细胞活性降低。其有关抗癌作用机制还有待进一步研究。而细胞周期检测结果发现,试验组G1/S期细胞占总细胞周期的一半以上,明显高于对照组,与有关研究一致。由此可见,顺铂确实诱导CHMp细胞凋亡,并阻滞细胞生长于G1/S期。
本试验证实顺铂对犬乳腺肿瘤细胞CHMp具有抑制作用,阻滞细胞于G1/S期,促进细胞调亡。然而,顺铂在犬乳腺肿瘤临床治疗上的运用,还需动物试验进一步对其进行研究。
[1]Depierre A.Efficacy of ondansetron in acute and delayed cisplatin induced nausea and vomiting[J].Bull Cancer,1996,83(2):147.
[2]Lebwohl D,Canctta R.Clinical development of platinum complexes in cancer therapy:an historical perspective and an update[J]. Eur Cancer,1998,34(10):1522.
[3]Senger D R,Brown L F,Claffey K P,et al.Vascular permeability factor,tumor angiogenesis and stroma generation[J].Invasion Metastasis,1994,14(1/6):385-394.
[4]唐棣华.抗癌药物顺铂抗癌机制的线索[J].化学研究与应用,2010(1):96.
[5]庞荣清,刘春生,张步振,等.顺铂对宫颈癌HeLa细胞增殖的抑制作用[J].现代实用医学,2003,15(10):618-620.
[6]庞荣清,刘春生,潘兴华,等.顺铂对人肺腺癌细胞SLC-89作用的机理探讨[J].中国肺癌杂志,2003,12(6):469-472.
[7]蒋丽媛.胃癌顺铂耐药机制的研究进展[J].实用肿瘤学杂志,2010,24(2):194-197.
[8]Liu J,Yang G,ThompsonOLanza J A,et al.A genetically defined model for human ovarian cancer[J].Cancer Res,2004,64(5):1655.
Apoptosis with CDDP induced in caninebreast cancer cells
SUN Si-chao,SUN Dong-dong,WANG Ying-xue,CHANG Hong-jian,LIU Yun
(College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
To explore the effects of cisplatin on the induction of apoptosis in CHMp cells,we treated cells with different concentrations of cisplatin at different times.The cell activity was detected by MTT assay and by transmission electron microscopy observation of CHMP morphological changes.We analyzed CHMP apoptosis and cell cycle using flow cytometry.Results showed that CHMP cell growth was the concentration and time dependent.When the concentration was higheer,the time was longer,and the inhibition was more obvious.The cells exhibited apoptotic morphology,and were arrested at the G1/S phase,up to 75.12%.The results showed that cisplatin could inhibit the proliferation of CHMp,induce apoptosis,and arrest cell G1/S phase.
cisplatin;CHMp;apoptosis;Gene downregulation
LIU Yun
S858.292
A
0529-6005(2016)09-0007-02
2016-01-22
孙思超(1991-),男,硕士,主要从事犬乳腺肿瘤细胞研究,E-mail:695223356@qq.com
刘云,E-mail:abliuyun@yeah.net
