降胆固醇乳酸杆菌的筛选及对小鼠血清胆固醇的影响
2016-11-14丁盼盼余祖华李元晓刘一尘何万领赵战勤王玉琴程相朝张春杰
丁盼盼,丁 轲,,*,余祖华,李 旺,李元晓,刘一尘,何万领,赵战勤,王玉琴,3,程相朝,张春杰
(1.河南科技大学宏翔发酵饲料实验室,河南 洛阳 471003;2.河南省动物疫病与公共卫生重点实验室,
河南 洛阳 471003;3.河南省肉羊繁育工程技术研究中心,河南 洛阳 471003)
降胆固醇乳酸杆菌的筛选及对小鼠血清胆固醇的影响
丁盼盼1,丁 轲1,2,*,余祖华2,李 旺1,李元晓1,刘一尘1,何万领1,赵战勤2,王玉琴1,3,程相朝2,张春杰2
(1.河南科技大学宏翔发酵饲料实验室,河南 洛阳 471003;2.河南省动物疫病与公共卫生重点实验室,
河南 洛阳 471003;3.河南省肉羊繁育工程技术研究中心,河南 洛阳 471003)
目的:从羊新鲜粪便中分离筛选具有降胆固醇能力的乳酸杆菌,探讨其对小鼠血清 胆固醇含量的影响。方法:以碳酸钙-MRS培养基和胆固 醇-MRS培养基筛选具有高效降胆固醇能力的乳酸杆菌;利用形态特征、生理生化特性和16S rDNA序列分析鉴定分离菌株L-3。为了验证其效果,将40 只8 周龄雄性BALB/c小鼠随机分为基础饲料组(A)、高脂模型组(B)、高脂模型+生理盐水组(C)、高脂模型+菌株L-3组(D)。分别饲喂第15、30天,采血,测定总胆固醇(total cholesterol,TC)、总甘油三酯(triglyceride,TG)和高密度脂蛋白胆 固醇(high density lipoprotein-cholesterol,HDL-C)的含量。结果:筛选得到一株能够高效降解胆固醇的菌株L-3,胆固醇降解率达到(35.93±0.43)%,经鉴定为植物乳杆菌。饲喂第15天,成功构建出高脂血症小鼠模型。灌胃第 30天,与B组相比,D组TC、TG、动脉硬化指数水平均极显著降低(P<0.01),HDL-C水平显著升高(P<0.05),HDL-C/TC水平极显著升高(P<0.01),而对照组几乎无降胆固醇效果(P>0.05)。结论:实验获得了1株在体内外均具有高效降胆固醇能力的植物乳杆菌Lactobacillus plantarum L-3,为进一步开发其为功能性微生态制剂提供了可能。
乳酸杆菌;降胆固醇;小鼠;筛选
丁盼盼, 丁轲, 余祖华, 等. 降胆固醇乳酸杆菌的筛选及对小鼠血清胆固醇的影响[J]. 食品科学, 2016, 37(15): 192-197. DOI:10.7506/spkx1002-6630-201615032. http://www.spkx.net.cn
DING Panpan, DING Ke, YU Zuhua, et al. Screening of Lactobacillus with cholesterol-degrading property and its effect on serum cholesterol in mice[J]. Food Science, 2016, 37(15): 192-197. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201615032. http://www.spkx.net.cn
高胆固醇血症是引起冠心病、高血压、动脉粥样硬化等心血管疾病的最主要因素之一,已成为威胁人类健康的首要因素,患病率和死亡率呈逐年上升趋势[1]。研究表明人体血清胆固醇每高出正常水平1 mmol,心血管疾病的患病风险增加35%,血清总胆固醇每降低1%,发生冠心病的危险性可减少2%~3%[2]。因此,降低血清胆固醇,可有效防止心血管疾病的发生。目前临床上主要是靠药物降解血清胆固醇,虽然快速有效,但具有一定的副作用,而且价格昂贵[3]。所以通过非药物途径降解血清胆固醇已成为当前研究热点之一。已有研究证明,乳酸菌及其发酵乳制品可有效降低血清胆固醇水平[4]。Mann[5]发现非洲MASAI部落因长期饮用乳酸菌发酵的乳制品,血清胆固醇呈较低水平。Harrison等[6]用嗜酸乳杆菌发酵的酸奶喂养婴儿后发现婴儿血清胆固醇水平明显降低。这些结果引起了国内外营养学、微生物学等各界人士的普遍关注,从而掀起了微生物降胆固醇作用的研究热 潮。目前,降胆固醇包括乳酸杆菌在内的乳酸菌研究并不多,而相对于其他乳酸菌,乳酸杆菌应用更为普遍。据报道,羊肉与其他畜禽肉相比,胆固醇含量相对较少,考虑到是否肠道微生物在起调节作用,所以选择从羊体内分离。因此本实验旨在从羊新鲜粪便中分离筛选高效降解胆固醇的乳酸杆菌,通过饲喂高血脂动物模型小鼠,检测分离菌对小鼠血清胆固醇的降解情况,以期寻找有效降胆固醇的乳酸杆菌菌种,对于开发新型微生态制剂和功能性健康食品具有重要意义。
1 材料与方法
1.1材料、试剂与培养基
采自洛阳地区不同羊场羊的新鲜粪便20 份。
实验动物及饲料:40 只雄性健康的BALB/c小鼠(8 周龄),体质量约为27~30 g,购自河南科技大学实验牧场。
胆固醇(分析纯)、邻苯二甲醛、正己烷(分析纯) 北京澳博星生物技术有限公司;总胆固醇(total cholesterol,TC)试剂盒、高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)试剂盒、甘油三酯(triglyceride,TG)试剂盒 南京建成生物工程研究所;细菌全基因组DNA提取试剂盒 天根生化科技(北京)有限公司;Tks Gflexx DNA Polymerase、DNA Marker、dNTP、10×PCR Buffer 日本TaKaRa公司;高脂饲料(猪油10%、蔗糖5%、胆固醇1%、胆盐0.3%、基础饲料83.7%)。
MRS培养基:蛋白胨1 g、牛肉膏0.5 g、酵母浸粉0.5 g、吐温-80 0.1 mL、葡萄糖2.0 g、磷酸氢二钾0.2 g、柠檬酸二铵0.2 g、乙酸钠0.5 g、硫酸镁0.058 g、硫酸锰0.025 g,加蒸馏水定容至100 mL;碳酸钙-MRS培养基:在MRS培养基中加入0.2 g/100 mL的CaCO3;降胆固醇筛选培养基(MRS-CHOL-THIO):在MRS培养基中加入0.2 g/100 mL的巯基乙酸钠、0.3 g/100 mL胆盐,加热溶解,121 ℃灭菌20 min后按体积分数1%加入10 mg/mL胆固醇。
1.2仪器与设备
ND100-1型氮气吹扫仪 杭州瑞诚仪器有限公司;UV-1200紫外分光光度计 上海翱艺仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;电热恒温培养箱 上海新苗医疗器械制造有限公司;SW-CJIFD型单人单面净化工作台 苏州净化设备有限公司;Thermo 4 ℃离心机 中国赛默飞世尔科技有限公司。
1.3方法
1.3.1降胆固醇菌株的初筛
每个粪便样品称取约1.0 g,分别加入装有9.0 mL无菌生理盐水的锥形瓶中,漩涡振荡5 min。静止片刻后吸取0.2 mL上清液涂布于碳酸钙-MRS琼脂平板,37 ℃厌氧培养48 h。挑取有溶钙圈的菌落,在MRS琼脂平板上划线纯化,连续划线纯化3 次,观察菌落形态,采用革兰氏染色法对菌株进行染色,光学显微镜下观察菌体形态。挑选革兰氏阳性无芽孢的杆状菌株,-20 ℃冰箱保存备用。
1.3.2降胆固醇菌株的复筛
将初筛分离的菌株接种到MRS培养基中活化后,按体积分数2%的接种量接种于10 mL降胆固醇筛选培养基中,37 ℃厌氧静止培养,每隔12 h摇匀1 次,培养48 h后,吸取混匀的菌液1 mL,5 000 r/min离心10 min,参照文献[7]采用邻苯二甲醛(o-phthalaldehyde,OPA)比色法测定胆固醇含量。
标准曲线的绘制:取1 mg/mL的胆固醇标准液,分别配制成5 个不同质量浓度(20、40、60、80、100 μg/mL)的工作液,然后各取1 mL工作液进行实验,空白为1 mL无水乙醇,实验平行3 次,测定方法同上。胆固醇溶液标准曲线y=0.006 0x-0.012 1(R2=0.990 0),回归方程拟合后相关性较好,说明用此法测定胆固醇含量是可行的。
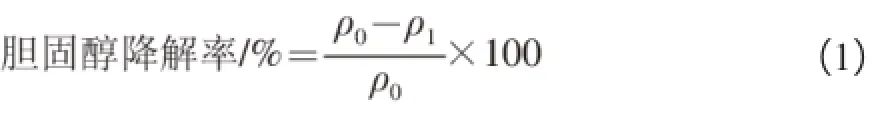
式中:ρ0为未接种菌株培养上清液550 nm波长处吸光度在标准曲线中对应的胆固醇质量浓度;ρ1为分离菌株发酵后培养上清液550 nm波长处吸光度在标准曲线中对应的胆固醇质量浓度。
1.3.3菌种鉴定
生理生化鉴定:对菌株按照《常用细菌系统鉴定手册》[8]和《伯杰细菌鉴定手册》[9]进行部分生理生化指标测定,包括明胶液化、过氧化氢酶实验、硝酸盐还原实验、吲哚实验、苹果酸产气实验、硫化氢实验、葡萄糖产气、运动性、温度实验(15、45 ℃)、7 g/100 mL NaCl、糖发酵产酸实验(葡萄糖、麦芽糖、核糖、蜜二糖、木糖、松三糖、阿拉伯糖、果糖、半乳糖、乳糖、蔗糖、甘露糖、鼠李糖、纤维二糖)。
16S rDNA分子鉴定:利用细菌全基因组DNA提取剂盒抽提分离菌株的全基因组DNA,并以此为模板,采用杆菌科16S rDNA基因的通用引物[10]P1(5’-AACTGAAGAGTTTGATCCTGGCTC-3’),P2(5’-TACGGTTACCTTGTTACGACTT-3’)进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR反应体系(25 ☒L)为:10×PCR Buffer 2.5 ☒L,dNTP mixture 2 ☒L,Tks Gflexx DNA Polymerase 0.5 ☒L,P1、P2各0.5 ☒L,模板1 ☒L,加ddH2O至25 ☒L。PCR扩增程序为:94 ℃预变性5 min,94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸90 s,进行35个循环,72 ℃延伸10 min,最后4 ℃保存。取4 ☒L PCR产物经1.0%的琼脂糖凝胶电泳检测后,送生工生物工程(上海)股份有限公司测序。将测序结果通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)的BLAST程序在GenBank基因库中进行比对,选取相似性较高菌株的16S rDNA序列,利用MEGA5.0软件进行系统进化树分析。
1.3.4小鼠分组及饲喂方式
取培养后的Lactobacillus plantarum L-3,用生理盐水洗涤2 次,将菌体浓度调整到1.0×109CFU/mL,用于小鼠灌胃实验。将40 只8 周龄BALB/c小鼠按各组间平均体质量无显著差异重新分为4 组:A组饲喂基础饲料,B组饲喂高脂饲料,C组饲喂高脂饲料+生理盐水,D组饲喂高脂饲料+菌株L-3,每组10 只。每只小鼠灌胃1 mL/次,连续灌胃30 d。
1.3.5血清中TC、TG、HDL-C含量的测定
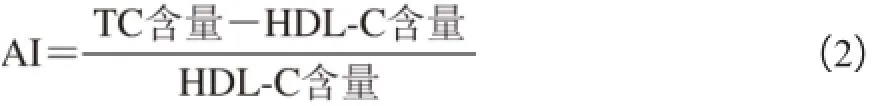
在实验第15、30天分别采血(采血前禁食12 h),分离血清,2 500 r/min离心10 min取血清。分别参照试剂盒说明,采用酶标仪测定血清中TC、TG和HDL-C的含量并对比各组间血清指标的差异,计算动脉粥样硬化指数(arteriosclerosis index,AI)[11]。
1.4数据处理
采用SPSS 17.0统计软件,用方差分析检验显著性,多重比较用最小显著性差异法(least significant difference,LSD)检验,P<0.01为极显著性差异,P<0.05为显著性差异。
2 结果与分析
2.1 乳酸杆菌的初筛结果
从碳酸钙-MRS琼脂平板挑取菌落周围有明显溶钙圈,边缘整齐,正面凸起,乳白色,不透明,表面湿润光滑的单菌落,MRS琼脂平板划线纯化后,且革兰氏染色阳性,不能形成芽孢,菌体呈直或弯的杆状,单个、成对或呈链状。初步共挑选35 株疑似菌株,部分菌株显微形态见图1。

图1 部分分离菌株的革兰氏染色形态(1 000×)Fig. 1 Morphology of isolated strains by Gram-staining (1 000 ×)
2.2菌株的胆固醇降解率
菌株体外降胆固醇能力是以菌体在含胆固醇的培养基中培养前后的胆固醇量的变化差值来评价的,以不接种的培养基作为空白对照。经筛选得到35 株菌株中14 株具有降胆固醇能力,菌株对胆固醇降解率从17.50%~35.93%不等,结果见表1,其中菌株L-3的体外胆固醇降解率最高可达35.93%,因此,将该菌株用于下一步实验。
表1 分离菌株降解胆固醇能力Table 1 Cholesterol-reducing capacity of the screened bacteria
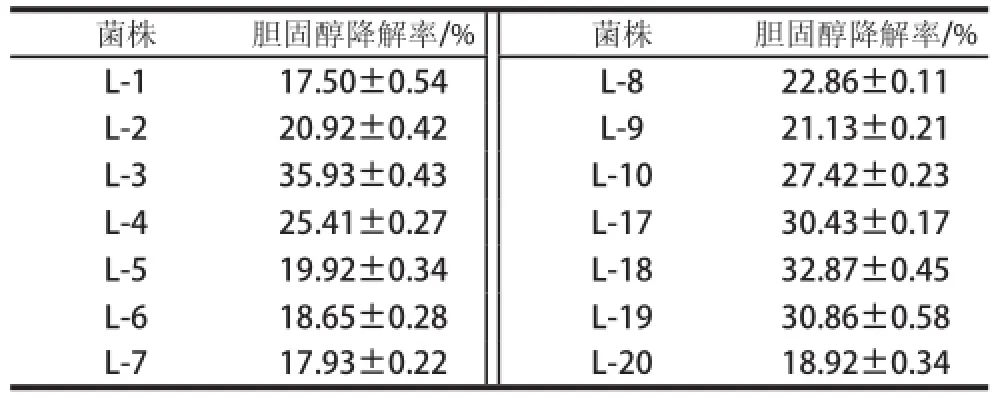
表1 分离菌株降解胆固醇能力Table 1 Cholesterol-reducing capacity of the screened bacteria
菌株胆固醇降解率/%菌株胆固醇降解率/% L-117.50±0.54 L-822.86±0.11 L-220.92±0.42L-921.13±0.21 L-335.93±0.43L-1027.42±0.23 L-425.41±0.27L-1730.43±0.17 L-519.92±0.34L-1832.87±0.45 L-618.65±0.28L-1930.86±0.58 L-717.93±0.22L-2018.92±0.34
2.3菌株鉴定
2.3.1生理生化鉴定
菌株L-3过氧化氢酶实验、硝酸盐还原实验、吲哚实验均为阴性,不液化明胶,不产生硫化氢气体,无运动性,可以在15 ℃和7 g/100 mL NaCl环境中生长,但不能在45 ℃环境中生长,并且可以利用葡萄糖、麦芽糖、核糖、蜜二糖、木糖、松三糖、阿拉伯糖、果糖、半乳糖、乳糖、蔗糖产酸,但不能利用纤维二糖、甘露糖、鼠李糖产酸。与《伯杰细菌鉴定手册》[9]中植物乳杆菌的生理生化特性基本相符,因此初步鉴定菌株L-3为植物乳杆菌(L. plantarum)。
2.3.2菌株的16S rDNA鉴定结果
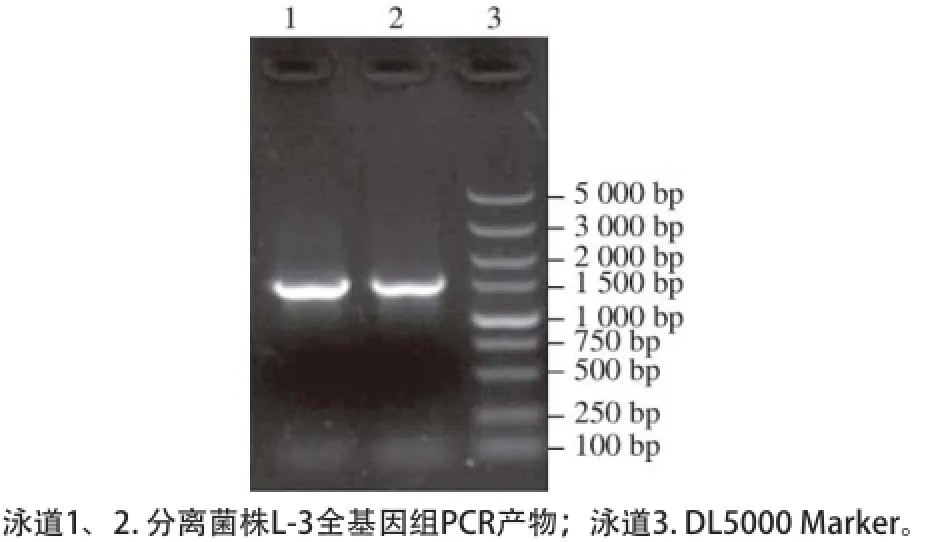
图2 分离菌株L-3 16S rDNA琼脂糖凝胶电泳结果Fig. 2 Agarose gel electrophoresis of 16S rDNA fragment from strain L-3
以菌株L-3基因组DNA为模板,经PCR扩增后,产物在1%的琼脂糖凝胶上电泳,如图2所示,在约1 500 bp处有一条特异性条带,与预期大小相符。经测序获得该序列大小为1 487 bp(GenBank登录号为KR824936),利用NCBI上的BLAST程序与GenBank数据库中的序列进行比对,发现菌株L-3和植物乳杆菌的相似性超过99%,挑选出与该菌株亲缘性较近的序列,通过MEGA5.0软件中的“邻接法(neighbor-joining,N-J)”模块对该序列进行系统进化树分析。由图3可知,菌株L. plantarum L-3与植物乳杆菌(Lactobacillus plantarum ATCC 14917)在进化树上处于同一个分支,亲缘关系最近,因此,可确定菌株L-3为植物乳杆菌。
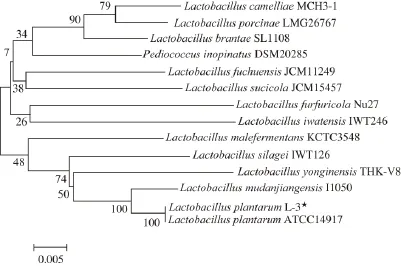
图3 基于分离菌株L-3分子系统进化树Fig. 3 Phylogenetic tree derived from the 16S rDNA sequence of Lactobacillus plantarum L-3
2.4菌株L-3对高血脂症小鼠血脂的影响
表2 植物乳杆菌L-3对小鼠血清TC、TG和HDL-C含量的影响Table 2 Effect of Lactobacillus plantaarruumm L-3 on serum TC, TG and HDLL--CCmmol/L

表2 植物乳杆菌L-3对小鼠血清TC、TG和HDL-C含量的影响Table 2 Effect of Lactobacillus plantaarruumm L-3 on serum TC, TG and HDLL--CCmmol/L
注:同列小写字母不同表示差异显著(P<0.05);同列大写字母不同表示差异极显著(P<0.01)。下同。
组别TCTGHDL-C 15 d30 d15 d30 d15 d30 d A组1.75±0.17cB1.82±0.15cB1.20±0.09bBC1.28±0.07cB1.45±0.14aA1.56±0.17acAB组3.38±0.26aA3.71±0.24aA1.64±0.13aA1.81±0.11aA1.61±0.11aA1.37±0.07bcAC组3.24±0.23abA3.50±0.29aA1.60±0.14aAC1.65±0.09abAC1.53±0.17aA1.47±0.11acAD组2.72±0.22bA2.55±0.08bB1.57±0.11aAC1.44±0.10bcBC1.49±0.17aA1.75±0.11aA
由表2可知,小鼠饲喂高脂饲料第15天,与A组相比,B、C、D组小鼠血清TC水平均极显著升高(P<0.01),D组较B组TC水平显著降低(P<0.05),B组TG水平较A组极显著升高(P<0.01),C、D组TG水平显著升高(P<0.05)。实验第30天,与A组相比,B、C组小鼠血清中TC和TG含量均极显著升高(P<0.0 1),D组T C和T G水平分别显著升高(P<0.05)和无显著差异(P>0.05);B、C、D组HDL-C水平无显著差异(P>0.05);与B组相比,C组TC、TG、HDL-C水平均无显著差异(P>0.05),D组TC、TG水平均极显著降低(P<0.01),HDL-C水平显著升高(P<0.05);与C组相比,D组TC水平极显著降低(P<0.01),TG、HDL-C水平均无显著差异(P>0.05)。
2.5小鼠体质量、AI及HDL-C/TC变化
表3 植物乳杆菌L-3对小鼠体质量、AI及HDL-C/TC的影响Table 3 Effect of Lactobacillus plantarruumm L-3 on body weight and atherogenic indeex (x

表3 植物乳杆菌L-3对小鼠体质量、AI及HDL-C/TC的影响Table 3 Effect of Lactobacillus plantarruumm L-3 on body weight and atherogenic indeex (x
组别体质量/gAIHDL-C/TC 15 d30 d15 d30 d15 d30 d A组30.94±1.14aA41.73±0.81aA0.22±0.05bB0.22±0.07bB0.83±0.33aA0.84±0.04aAB组31.00±1.38aA45.06±2.40aA1.14±0.13aA1.98±0.86aA0.49±0.04bB0.38±0.02cCC组31.32±1.89aA43.43±1.39aA1.26±0.24aA1.48±0.25aA0.48±0.05bB0.44±0.04cCD组29.52±1.16aA39.60±2.65aA0.94±0.20aA0.62±0.11bB0.56±0.05bB0.68±0.32bB
由表3可知,各组小鼠体质量在实验期间无显著差异(P>0.05)。第15天,与A组相比,B、C、D组AI均极显著升高(P<0.01),HDL-C/TC值均极显著降低(P<0.01)。第30天,与A组相比,B、C组AI值均极显著升高(P<0.01),B、C、D组HDL-C/TC值均极显著降低(P<0.01);与B组相比,C组AI和HDL-C/TC值变化不明显(P>0.05),D组AI和HDL-C/TC值分别极显著降低和升高(P<0.01);与C组相比,D组AI值极显著降低(P<0.01)。
3 讨 论
乳酸菌源具有多样性,降胆固醇乳酸菌主要是从乳制品、发酵制品中筛选[12-13]。与文献报道比较,本实验成功从新鲜羊粪中筛选出一株体外胆固醇降解率达到35.93%的菌株,经鉴定为植物乳杆菌,是相关报道来源于羊粪不多见的菌株。与已报道的菌株相比,菌株的降胆固醇能力之间存在一定差异。王今雨等[14]从酸奶中分离筛选出Lactobacillus plantarum NDC75017,其体外胆固醇降解率达到16.43%。Yildiz等[15]从婴儿粪便中分离筛选的Lactobacillus plantarum GD2、Lactobacillus rhamnosus LP1、Lactobacillus rhamnosus E3和Lactobacillus rhamnosus E9胆固醇降解率分别为42.3%、30.3%、16.3%和30.8%。这种差异可能与菌株[15]、测定方法或者胆固醇源有一定的关系[16-17]。同时,本实验将分离出的菌株应用到动物模型中进行了验证,结果进一步证明了菌株L. plantarum L-3具有降胆固醇功能。
人们通常认为血清中高浓度的TC是引起心血管疾病的主要因素之一,降低高胆固醇人群的TC及低密度脂蛋白胆固醇(low density lipoprotein-cholesterol,LDL-C)浓度或升高HDL-C浓度可以减少心血管疾病的发病率。近年来,越来越多的学者开始将目光聚集到降胆固醇乳酸菌体内效果评价上[18-21]。本实验通过灌胃L. plantarum L-3,15 d后,成功构建高血脂症小鼠动物模型。与A组相比,各组小鼠血清TC、AI、TG和HDL-C/TC水平均显著升高,HDL-C水平变化不明显。通过灌胃L. plantarum L-3,30 d后,与高胆固醇模型B组相比,阴性对照C组TC、TG、HDL-C、AI水平均无显著差异,D组TC、TG、AI水平均极显著降低,分别降低了31.3%、20.44%和68.7%,D组HDL-C和HDL-C/TC水平分别升高了27.7%、44.11%,这与已报道的研究结果相似。Wang Yanping等[22]将Lactobacillus plantarum MA2饲喂大鼠35 d后,与对照组相比,实验组TG 、TC和HDL-C含量最高分别降低了25.03%、25.14%和14.11%。Huang Ying等[23]以大鼠为模型,将植物乳杆菌LP27以109CFU/d的剂量喂食小鼠28 d后,与对照组相比,小鼠血清中的TC和TG含量分别下降了37.2%和53.8%。Nguyen等[24]以小鼠为模型,将Lactobacillus plantarum PH04以107CFU/只的剂量喂食小鼠14 d后,与对照组相比,小鼠血清中的TC和TG含量仅分别下降了7%和10%。然而也有报道称乳酸菌无降低血清脂质的作用,Fak等[25]在研究罗伊乳酸杆菌对Apoe-/-小鼠代谢综合征影响时发现该菌没有降低小鼠TC和TG的作用。这可能是因为胆固醇生物降解虽然机理是多方面的,但是对于菌株本身来说是特异性的,如菌株要降解胆固醇,其本身可能产生胆盐水解酶,或者菌体本身对胆固醇具有吸附作用,或与菌株的剂量、饲料中胆固醇的含量,同时与动物对菌株的摄取量和实验周期等相关[22]。
本实验结果表明经体外筛选到L. plantarum L-3对患有高脂血症的小鼠具有显著的降血脂作用,为进一步开发其为功能性微生态饲料添加剂奠定了理论基础,为生产低胆固醇肉、蛋、奶等高品质畜产品提供了可能,但是其降胆固醇的机制还有待进一步研究。
[1] XI Bo, LIU Fangchao, HAO Yongchen, et al. The growing burden of cardiovascular diseases in China[J]. International Journal of Cardiology, 2014, 174(3): 736-737. DOI:10.1016/j.ijcard.2014.04.098.
[2] HANSEN G, JELSING J, VRANG N. Effects of liraglutide and sibutramine on food intake, palatability, body weight and glucose tolerance in the gubra DIO-rats[J]. Acta Pharmacologica Sinica, 2012,33(2): 194-200. DOI:10.1038/aps.2015.74.
[3] ANANDHARAJ M, SIVASANKARI B. Isolation of potential probiotic Lactobacillus oris HMI68 from mother’s milk with cholesterol-reducing property[J]. Journal of Bioscience and Bioengineering, 2014, 118(2): 153-159. DOI:10.1016/ j.jbiosc.2014.01.015.
[4] LYE H S, RUSUL G, LIONG M T. Removal of cholesterol by lactobacilli via incorporation and conversion to coprostanol[J]. Journal of Dairy Science, 2010, 93(4): 1383-1392. DOI:10.3168/jds.2009-2574.
[5] MANN G V. Studies of a surfactant and cholesteremia in the Maasai[J]. American Journal of Clinical Nutrition, 1974, 27(5): 464-469.
[6] HARRISON V C, PEAT G. Serum-cholesterol and bowel flora in the newborn[J]. American Journal of Clinical Nutrition, 1975, 28(12): 1351-1355.
[7] RUDEL L L, MORRIS M D. Determination of cholesterol using o-phthalaldehyde[J]. Journal of Lipid Research, 1973, 14(3): 364-366.
[8] 东秀珠, 蔡妙英. 常用细菌系统鉴定手册[M]. 北京: 科学出版社,2001: 267-295.
[9] BUCHANAN R E, GIBBONS N E. 伯杰细菌鉴定手册[M]. 中国农科院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 8版. 北京:科学出版社, 1984: 797-822. DOI:10.3109/08923973.2010.518617.
[10] 曾小群, 潘道东, 杨瑶, 等. 一株高效降解胆固醇乳酸菌的筛选鉴定及其益生潜能初探[J]. 食品科学, 2009, 30(21): 241-245. DOI:10.3321/j.issn:1002-6630.2009.21.057.
[11] 李婷婷. 降胆固醇益生乳酸菌的筛选及其在大鼠体内的应用研究[D].哈尔滨: 东北农业大学, 2013: 20.
[12] KUDA T, YAZAKI T, ONO M, et al. In vitro cholesterol-lowering properties of Lactobacillus plantarum AN6 isolated from ajinarezushi[J]. Letters in Applied Microbiology, 2013, 57(3): 187-192. DOI:10.1111/lam.12094.
[13] 汪晓辉, 于平, 励建荣. 泡菜、传统腊肠中降胆固醇乳酸菌的筛选及鉴定[J]. 微生物学报, 2009, 49(11): 1438-1444. DOI:10.3321/ j.issn:0001-6209.2009.11.005.
[14] 王今雨, 满朝新, 杨相宜, 等. 植物乳杆菌NDC 75017的降胆固醇作用[J]. 食品科学, 2013, 34(3): 243-247.
[15] YILDIZ G G, OZTURK M, ASLIM B. Identification of Lactobacillus strains from breast-fed infant and investigation of their cholesterolreducing effects[J]. World Journal of Microbiology and Biotechnology,2011, 27(10): 2397-2406. DOI:10.1007/s11274-011-0710-x.
[16] 居华, 刘书亮, 敖灵, 等. 降胆固醇乳酸菌的筛选,鉴定及生长特性[J]. 中国乳品工业, 2007, 35(8): 7-10. DOI:10.3969/ j.issn.1001-2230.2007.08.002.
[17] 吴超, 李润航, 于中英, 等. 鸡蛋胆固醇含量测定方法比较研究[J]. 家畜生态学报, 2013, 34(11): 57-60. DOI:10.3969/ j.issn.1673-1182.2013.11.014.
[18] FUENTES M C, LAJO T, CARRIO J M, et al. Cholesterol-lowering efficacy of Lactobacillus plantarum CECT 7527, 7528 and 7529 in hypercholesterolaemic adults[J]. British Journal of Nutrition, 2013,109(10): 1866-1872. DOI:10.1017/S000711451200373X.
[19] ZHANG Li, ZHANG Xue, LIU Chunhong, et al. Manufacture of cheddar cheese using probiotic Lactobacillus plantarum K25 and its cholesterol-lowering effects in a mice model[J]. World Journal of Microbiology and Biotechnology, 2013, 29(1): 127-135. DOI:10.1007/ s11274-012-1165-4.
[20] JEUN J, KIM S, CHO S Y, et al. Hypocholesterolemic effects of Lactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice[J]. Nutrition, 2010, 26(3): 321-330. DOI:10.1016/ j.nut.2009.04.011.
[21] OOI L G, AHMAD R, YUEN K H, et al. Lactobacillus acidophilus CHO-220 and inulin reduced plasma total cholesterol and low-density lipoprotein cholesterol via alteration of lipid transporters[J]. Journal of Dairy Science, 2010, 93(11): 5048-5058. DOI:10.3168/jds.2010-3311.
[22] WANG Yanping, XU Nu, XI Aodeng, et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet[J]. Applied Microbiology and Biotechnology, 2009, 84(2): 341-347. DOI:10.1007/ s00253-009-2012-x.
[23] HUANG Ying, WU Fei, WANG Xiaojun, et al. Characterization of Lactobacillus plantarum Lp27 isolated from Tibetan kefir grains: a potential probiotic bacterium with cholesterol-lowering effects[J]. Journal of Dairy Science, 2013, 96(5): 2816-2825. DOI:10.3168/ jds.2012-6371.
[24] NGUYEN T D, KANG J H, LEE M S. Characterization of Lactobacillus plantarum PH04, a potential probiotic bacterium with cholesterol-lowering effects[J]. International Journal of Food Microbiology, 2007, 113(3): 358-361. DOI:10.1016/ j.ijfoodmicro.2006.08.015.
[25] FAK F, BACKHED F. Lactobacillus reuteri prevents diet-induced obesity, but not atherosclerosis, in a strain dependent fashion in Apoe-/-mice[J]. PLoS ONE, 2012, 7(10): e46837. DOI:10.1371/journal. pone.0046837.
Screening of Lactobacillus with Cholesterol-Degrading Property and Its Effect on Serum Cholesterol in Mice
DING Panpan1, DING Ke1,2,*, YU Zuhua2, LI Wang1, LI Yuanxiao1, LIU Yichen1, HE Wanling1, ZHAO Zhanqin2, WANG Yuqin1,3,CHENG Xiangchao2, ZHANG Chunjie2
(1. Hongxiang Biological Feed Laboratory, Henan University of Science and Technology, Luoyang 471003, China;2. Key Laboratory of Animal Disease and Public Health of Henan Province, Luoyang 471003, China;3. Research Center of Breeding Engineering Technology for Meat Sheep of Henan Province, Luoya ng 471003, China)
Objective: To screen Lactobacillus with high cholesterol-degrading capacity from fresh sheep feces and explore the effect of the screened strain on serum cholesterol level in hypercholesterolemic mice. Methods: We screened Lactobacillus with high cholesterol-reducing capacity using Calcium Carbonate-Man-Rogosa-Sharp (MRS) medium and cholesterol-MRS medium. The screened strain, named as L-3, was identified by colony morphology, physiological and biochemical tests and 16S rDNA sequencing. A feeding experiment was conducted on forty Kunming male mice(eight weeks old). The mice were randomly divided 4 groups: A, B, C and D, which were fed with normal diet, high fat diet (HFD), HFD plus normal saline and HFD plus strain L-3, respectively. The serum levels of total cholesterol(TC), triglyceride (TG), and high density lipoprotein-cholesterol (HDL-C) were determined on the 15thand 30thday of the experiment. Results: This selected strain was identifie d as Lactobacillus plantarum L-3 and the degradation rate of cholesterol by the stain could reach up to (35.93 ± 0.43)%. A hypercholesterolemic mice model was successfully constructed after feeding a high-cholesterol diet for 15 days. Compared with group B, serum TC, TG and AI levels were extremely significantly decreased in group D after 30 days of oral administration of strain L-3 (P < 0.01), HDL-C levels of group D was significantly increased (P < 0.05), and HDL-C/TC levels were extremely significantly increased(P < 0.01). However, the negative control group did not show cholesterol degradation (P > 0.05). Conclusion: L. plantarum L-3 has probiotic potential as indicated by its hypocholesterolemic effect both in vivo and in vitro.
Lactobacillus; cholesterol degradation; mice; screening
2015-09-25
河南省科技厅科技攻关项目(162102110064);河南省教育厅科学技术研究重点项目(14B230002)
丁盼盼(1987—),女,硕士研究生,主要从事动物微生态学研究。E-mail:dpl1021@163.com
丁轲(1977—),男,副教授,博士,主要从事动物微生态与动物传染病学研究。E-mail:keding19@163.com
10.7506/spkx1002-6630-201615032
Q939.99
A
1002-6630(2016)15-0192-06
引文格式:
