柿单宁的体外降胆固醇作用
2016-11-14葛珍珍李春美
朱 维,邹 波,葛珍珍,张 颖,李春美,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610)
柿单宁的体外降胆固醇作用
朱 维1,邹 波2,葛珍珍1,张 颖1,李春美1,*
(1.华中农业大学食品科学技术学院,湖北 武汉 430070;2.广东省农业科学院蚕业与农产品加工研究所,广东 广州 510610)
采用分光光度法和气相色谱法研究了柿单宁对胰脂酶活性和胆固醇酯酶活性的抑制作用,以及柿单宁与胆汁酸、胆固醇的结合能力。结果表明:柿单宁对胰脂酶具有显著的抑制效果,其半数抑制浓度(half inhibitory concentration,IC50)为(0.445±0.021) mg/mL;抑制类型为非竞争性抑制,抑制常数Ki为0.406 mg/mL;柿单宁对胆固醇酯酶也具有显著的抑制作用,其半数抑制浓度IC50为(0.442±0.017)mg/mL,抑制类型为非竞争性抑制,抑制常数Ki为0.488 mg/mL。不同质量浓度的柿单宁对胆酸(cholic acid,CA)、脱氧胆酸(deoxycholic acid,DCA)都有一定的结合能力,10 mg/mL的单宁与CA、DCA的结合率分别为58%和94%;柿单宁对胆固醇胶束化溶液有较强的结合能力,0.20 mg/mL的单宁对其抑制率达到了67%。另外,在不同的pH值下,柿单宁对胆固醇都有一定的结合作用,其中pH 7.0时的结合能力明显强于pH 2.0时的结合能力。总之,柿单宁可抑制胰脂酶活性和胆固醇酯酶活性,并与胆固醇和胆汁酸结合,减少胃肠道对脂肪的吸收,这可能是柿单宁在体内发挥强降胆固醇作用的原因之一。
柿单宁;胰脂酶;胆固醇酯酶;胆汁酸;胆固醇胶束化
随着生活水平的不断提高,人们的饮食结构也发生了巨大的变化,富含高能量的食物如肉制品、油炸食品已经成为人们经常食用的食物之一。而长期高能量食物的摄取和锻炼的缺乏是导致脂质代谢紊乱的主要因素之一[1]。减少脂质吸收,促进脂肪排泄,对于调节脂质代谢有着重要的作用。
众多研究表明,多酚类化合物如苹果原花青素,葡萄籽原花青素能有效的抑制胰脂酶活性[2-3],原花青素二聚体可通过抑制胆固醇胶束的形成从而抑制胆固醇的吸收、促进其排泄[4],从而起到降脂作用。我国柿分布广泛,栽培面积和产量均占世界之首。随着人们生活水平的提高,柿的保健作用也被越来越多的人认识。近年来的研究发现,柿果[5-8]及其提取物[9-10]在高血脂动物模型中具有显著的降脂效果。而且日本学者进行的一项人群调查也证实,柿单宁提取物对脂质代谢异常病人具有显著的干预作用[11]。以上研究表明,在我国极具资源优势的柿极有可能是一种干预脂质代谢的优良膳食因子。鉴于柿单宁聚合度大,在肠道内难以被吸收的特点,本实验在模拟的胃肠道环境中,对其降脂作用机制进行了探讨,旨在为促进我国柿资源的综合利用,提高产品附加值提供依据。
1 材料与方法
1.1 材料与试剂
恭城月柿(Diospyros kaki Thunb.)购于武汉沙湖水果批发市场。
猪胰脂酶、猪胆固醇酯酶、胆固醇、磷脂酰胆碱、牛黄胆酸钠、棕榈酸酯 美国Sigma公司;六氟异丙醇(hexafluoroisopropanol,HFIP)、三氟醋酐(trifluoro acetic anhydride,TFAA) 日本TCI公司;胆酸(cholic acid,CA)、脱氧胆酸(deoxycholic acid,DCA)上海Aladdin公司;甘油三酯、油酸、胆固醇测定试剂盒、聚乙烯醇(polyvinyl alcohol,PVA)、乙酸铜、吡啶、无水乙醚、甲苯 上海国药集团化学试剂公司;乙腈 美国Tedia公司;其他试剂均为国产分析纯。
1.2 仪器与设备
N-1001型旋转蒸发仪 上海爱郎科技有限公司;AB-8大孔树脂 南开大学化工厂;冷冻干燥机 北京松源华兴科技有限公司;NDK200-2型氮气吹干仪杭州米欧仪器有限公司;MK3型酶标仪 美国赛默飞世尔公司;UV-1800 型分光光度计 日本岛津公司;PB-10型pH计 赛多利斯公司;Biofuge Stratos Sorvall 型台式高速冷冻离心机 美国Thermo Fisher Scientific公司;HWS24型电热恒温水浴锅 上海一恒科技有限公司;6890N气相色谱仪 美国安捷伦科技有限公司。
1.3 方法
1.3.1 柿单宁的制备
成熟涩柿(恭城月柿)采收于11月,采收后的柿果于100 ℃热烫5 min使多酚氧化酶失活,之后置于-20 ℃冷冻保存备用。柿单宁的制备方法参照食品化学柿子研究实验室工艺[12]并略加改动。以含体积分数为1%的盐酸甲醇溶液作为溶剂,料液比1∶8(m/V),于80 ℃冷凝回流提取3 次,每次40 min,合并提取液,35 ℃旋蒸浓缩,置于AB-8大孔树脂吸附40 min,纯水洗至苯酚-硫酸法检测无糖[13]后,再用体积分数为10%的乙醇水溶液去掉低分子质量酚类化合物,最后用95%的乙醇洗脱,收集洗脱液,旋蒸浓缩去掉有机溶剂,冷冻干燥得到单宁样品。柿单宁末端基团含有儿茶素(catechin,C)、表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)和杨梅素,特别是非常罕见地以杨梅素作为末端基团;延伸端结构为表没食子儿茶素(epigallocatechin,EGC)、EGCG、表儿茶素(epicatechin,EC);分子中原翠雀定结构含量高达58.68%;棓酰化程度高达72.4%;除了含有B型连接外还存在A型连接,重均分子质量范围为1.16×104~1.54×104。
1.3.2 柿单宁对胰脂酶活性的影响
胰脂酶催化甘油三酯水解生成游离脂肪酸和甘油,本实验以三油酸甘油酯为底物,测定胰脂酶在一定时间内酶解三油酸甘油酯生成油酸的量。油酸在pH 6.0~6.2之间能与乙酸铜溶液形成绿色络合物,该络合物在710 nm波长处有一较强的吸收峰,因此根据该络合物的吸光度计算油酸的生成量,从而计算胰脂酶活力。胰脂酶活力单位[14-15]:在实验条件下(pH 7.4、37 ℃)1 min释放出1 μmol脂肪酸的酶量定义为1 个脂肪酶活力单位(U)。计算方法见下式。

式中:X为脂肪酶活力/(U/mL);c为脂肪酸浓度/(μmol/mL);V为脂肪酸溶液的体积/mL;V'为酶液的用量/mL;t为作用时间/min。
胰脂酶液:称取7.5 mg胰脂酶,溶于10 mL pH 7.4的磷酸盐缓冲液 (phosphate buffer solution,PBS)中,混匀后,于10 000×g条件下冷冻离心5 min,取上清液,置于4 ℃冰箱备用。酶液质量浓度为0.75 mg/mL。
底物乳化液:将三油酸甘油酯与4%的PVA溶液按一定的比例混合,配制质量浓度为0.21 g/mL和0.14 g/mL的底物乳液,在漩涡混匀器上振荡3 min,形成乳白色的PVA-油乳化液。
胰脂酶的测定方法参考[14-16]进行。取1.9 mL底物,0.5 mL样品,0.5 mL酶液于15 mL离心管中,37 ℃恒温振荡15 min,立即加入4 mL甲苯,振荡2 min,终止反应,同时萃取生成的脂肪酸,将其转移至玻璃离心试管中,3 000 r/min离心10 min,取上层有机相加入乙酸铜显色剂,振荡3 min,即生成绿色络合物。之后在3 000 r/min离心10 min,取上层液体检测710 nm波长处的吸光度。以相同方法制备不含脂肪酶的空白溶液为对照组,每个浓度平行3 次。参照油酸标准工作曲线,计算脂肪酸的浓度。另外取不同质量浓度的底物乳液,分别加入0.5 mL,0.75 mg/mL的胰脂酶和不同质量浓度的柿单宁,测定酶反应速率,按Dixon作图法作图求解抑制常数,按Lineweaver-Burk的双倒数作图法作图,确定抑制作用的类型。

式中:v为反应速率/(μmol/(min·mL));Km为米氏常数/(g/mL);[S]为底物质量浓度/(g/mL);vmax为最大反应速率/(μmol/(min·mL))。
1.3.3 柿单宁对胆固醇酯酶活性的影响
本实验以胆固醇棕榈酸酯为底物,采用分光光度法测定胆固醇酯酶的活力[17]。不同质量浓度的柿单宁加入到37 ℃预温底物缓冲液(胆固醇棕榈酸酯5.16 mmol/L,PBS 100 mmol/L,NaCl 100 mmol/L,pH 7.0),混合均匀,加入猪胆固醇酯酶(1 mg/mL,35 U/g)后开始计算反应时间。采用游离胆固醇试剂盒检测反应生成的游离胆固醇。同理,另外取不同质量浓度(0.032、0.064 g/mL)的底物缓冲液,分别加入胆固醇酯酶和不同质量浓度的柿单宁,测定酶反应速率,按Dixon作图法作图求解抑制常数,按Lineweaver-Burk的双倒数作图法作图,确定抑制作用的类型。
1.3.4 柿单宁与胆固醇胶束化溶液、胆汁酸结合的能力
参考Kirana等[18]的方法制备胆固醇胶束化溶液。分别取不同质量浓度的柿单宁溶液与胆固醇胶束化溶液混合,于37 ℃反应1 h,3 000 r/min离心10 min,取上清液,采用总胆固醇(total cholesterol,TC)测定试剂盒测定上清液中胆固醇的含量。
通过一个典型的食品体系鸡蛋蛋黄改变pH值模拟肠胃环境来检测单宁结合胆固醇的能力[19]。在人类的膳食中,游离胆固醇的摄入主要来源于蛋黄与鱼子,日常生活中,鸡蛋的摄入量较多,且蛋黄本身成分复杂,为研究柿单宁在复杂的食品体系中是否具有较强的结合胆固醇的能力,本实验研究了柿单宁对蛋黄中胆固醇含量的影响。
称取部分新鲜蛋黄,加入9 倍体积(即料液比为1∶9(m/V))蒸馏水搅拌至体系均匀,平均分成2 份,分别用6 mol/L的HCl和1 mol/L的NaOH调节pH值为2.0和7.0。另取若干100 mL的锥形瓶,每个锥形瓶加入15 mL蛋黄乳化液,然后加入不同质量浓度的柿单宁(0.10~0.40 mg/mL),37 ℃摇床孵育2 h,转速为80 r/min。孵育结束后3 000 r/min离心10 min,取上清液,TC测定试剂盒测定胆固醇含量。
在肠道中柿单宁与胆汁酸结合,促进胆汁酸的排泄,可以增加肝脏中胆固醇向胆汁酸转化,减少血液中胆固醇的含量[8]。本实验采用体外模拟肠道环境,研究了柿单宁对胆酸和脱氧胆酸的结合能力。柿单宁与胆汁酸结合能力的测定参考Adisakwattana[20]和Imai[21]等的方法并略作改动:选用胆酸和脱氧胆酸,研究柿单宁与2 种胆汁酸的结合能力。将柿单宁分别加入到2 mmol/L的胆酸和脱氧胆酸溶液中(100 mmol/L PBS,pH 7.0),于37 ℃孵育90 min,6 mol/L的HCl调节pH值至3.0,室温静置10 min,3 000 r/min离心10 min,上层液体0.45 μm滤膜过滤以除去溶液中的不溶物,再用乙醚萃取2 次,合并有机层萃取液,用氮气吹干仪吹干,加入HFIP和TFAA将胆酸或脱氧胆酸衍生化,气相色谱法检测胆汁酸的含量。气相色谱条件如下:色谱柱HP-5弹性石英毛细管柱(30 m×0.32 mm,0.5 µm);载气(N2)流速1.0 mL/min;程序升温,60 ℃保持2 min,以10 ℃/min速率升至180 ℃,再以5 ℃/min速率升至235 ℃,保持15 min;进样温度250 ℃;检测温度250 ℃;氢火焰离子化检测器(hydrogen flame detector,FID)检测器;不分流进样,进样体积1 μL。
1.4 数据分析
数据采用SPSS 18.0软件进行统计分析,实验重复3 次,结果以x±s表示,采用Origin 8.5和Excel软件进行线性拟合。
2 结果与分析
2.1 柿单宁抑制胰脂酶活性
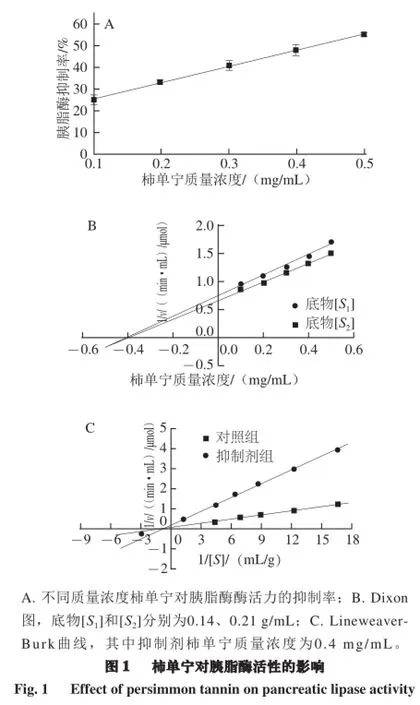
食物中的甘油三酯在被吸收前必须被水解[22],而胰脂酶能将甘油三酯水解生成二酰甘油,随后继续水解生成甘油和游离脂肪酸,在脂肪的吸收中发挥着重要的作用[23]。为探讨柿单宁抑制脂肪吸收的可能机制,实验对柿单宁对胰脂酶活性的影响进行检测。由图1可知,柿单宁在质量浓度为0.10、0.20、0.30、0.40、0.50 mg/mL时对胰脂酶的抑制作用呈剂量-依赖效应关系,其半数抑制浓度(half inhibitory concentration,IC50)为(0.445±0.021) mg/mL,明显高于葡萄籽提取物(IC50为(3.71±0.03) mg/mL)[24]。在反应体系中给定底物浓度,加入定量胰脂酶,测定不同抑制剂浓度下酶反应的吸光度,作图得Dixon图(图1B)。根据图中两直线的交点,得到抑制常数Ki=0.406 mg/mL。给定抑制剂浓度,定量胰脂酶,测定底物浓度不同时酶反应的残余酶活力,求出相应的反应速率,按Lineweaver-Burk的双倒数法作图(图1C),两条直线相交于横轴上。从Dixon图和Lineweaver-Burk图的特征表明,柿单宁对胰脂酶的抑制类型是非竞争性抑制。此抑制类型与单宁结合蛋白质的机理一致,单宁与蛋白质的结合主要是通过单宁酚羟基群与蛋白质的羰基发生氢键相互作用,以及单宁与蛋白质通过疏水相互作用使酶与基质隔离[25-26]。
2.2 柿单宁抑制胆固醇酯酶活性
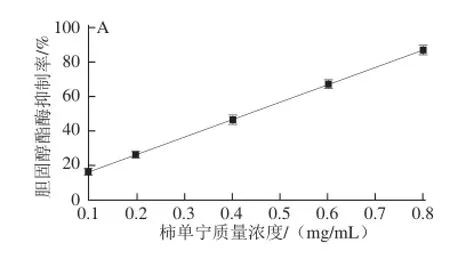
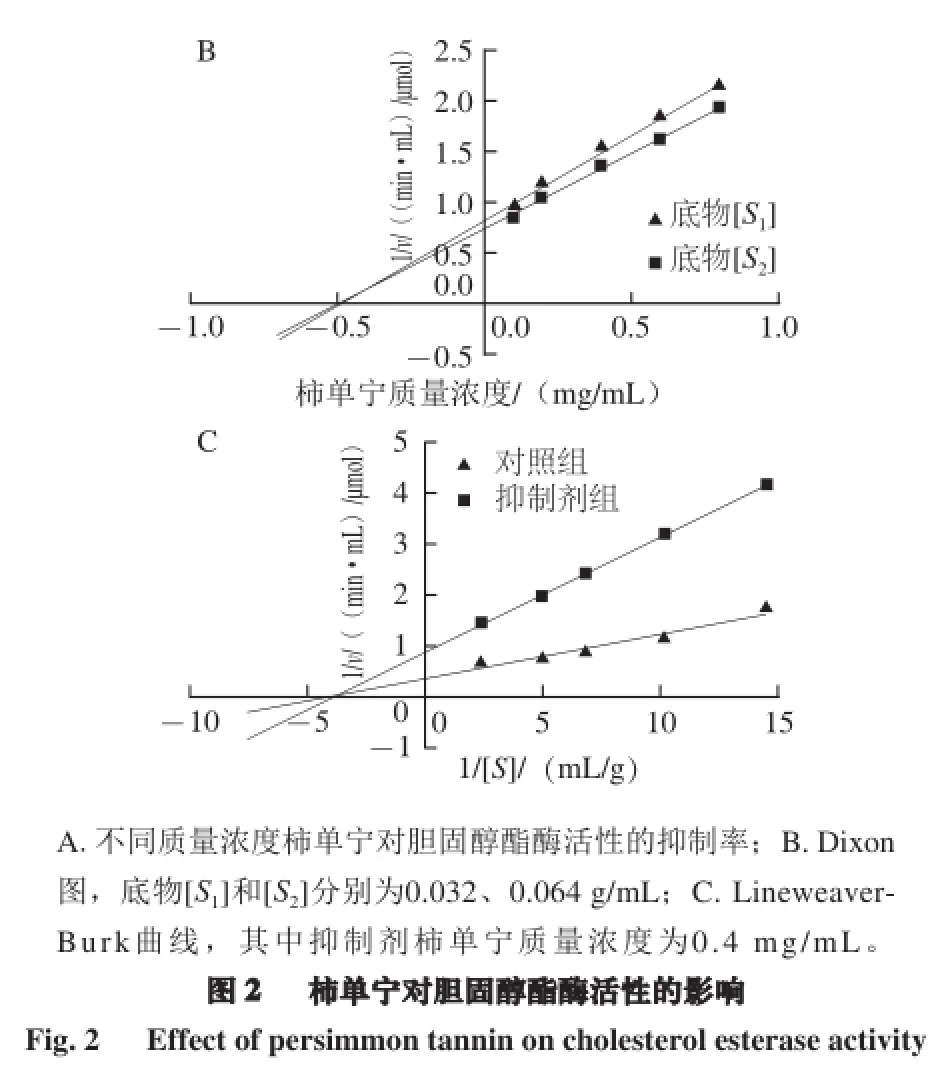
胆固醇酯在吸收前需先水解成游离胆固醇,而胆固醇酯酶在水解过程发挥着重要作用[20],因此抑制胆固醇酯酶的活性,可在一定程度上限制胆固醇的吸收。柿单宁对胆固醇酯酶的抑制呈剂量-依赖效应关系(图2A),其IC50值为(0.442±0.017) mg/mL。根据Dixon图(图2B)中两直线的交点,得到抑制常数Ki=0.488 mg/mL。按Lineweaver-Burk的双倒数法作图(图2C),得到两条直线相交于横轴上。从Dixon图和Lineweaver-Burk图的特征表明,柿单宁对胆固醇酯酶的抑制类型是非竞争性抑制。
2.3 柿单宁抑制胆固醇胶束化、结合胆固醇
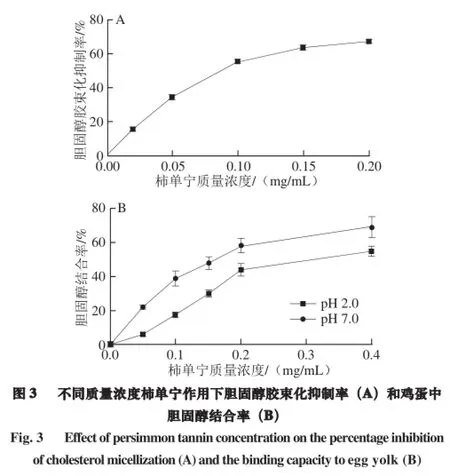
由图3A可知,柿单宁质量浓度为0.10 mg/mL时对胆固醇胶束化的抑制率达到了55%,0.20 mg/mL的单宁对其抑制率达到了67%。与之相比,0.20 mg/mL没食子酸对胆固醇胶束化的抑制率仅为27%[24]。这说明柿单宁能明显抑制胆固醇胶束化溶液的形成。
由图3B可知,随着柿单宁质量浓度的增加,其对蛋黄中胆固醇的结合率也逐渐加升高。并且,柿单宁在pH 7.0时对蛋黄中胆固醇的结合能力强于pH 2.0时。
2.4 柿单宁结合胆汁酸
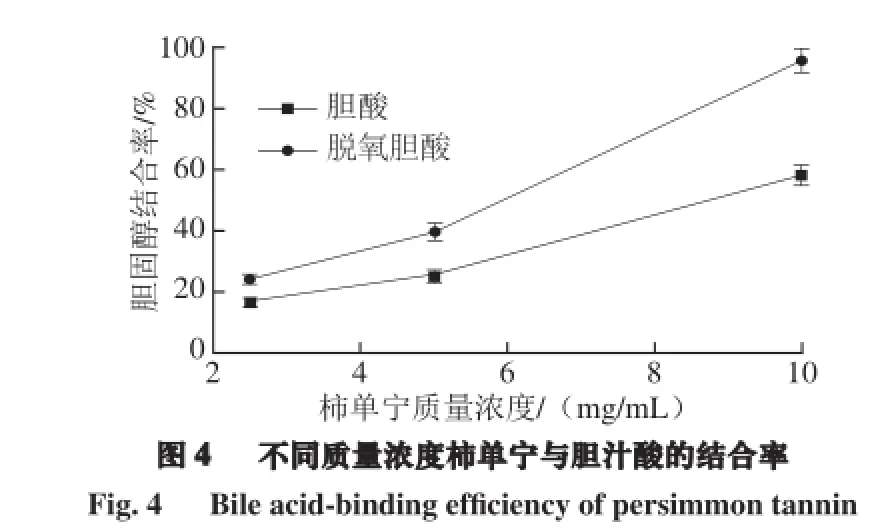
由图4可知,柿单宁具有较强的结合胆酸和脱氧胆酸的能力,且呈剂量-依赖效应关系,在柿单宁质量浓度为5.0 mg/mL时,对胆酸和脱氧胆酸的结合率分别为26%和40%,当柿单宁质量浓度增加至10 mg/mL时,单宁对胆酸的结合率达到58%,对脱氧胆酸的结合率达到94%。与红花多酚提取物相比[20],柿单宁对胆汁酸的结合能力更强。
3 讨 论
酚类化合物的功能活性往往与其化学结构、生物利用率和生物转化相关,高聚合度柿单宁在小肠内很难被吸收[27],尽管柿单宁是一种高聚物,但在之前的研究表明柿单宁在高脂动物模型中具有较强的降血脂作用[28],因此,推测柿单宁的降脂作用可能与其干扰脂质的吸收有关。为了证实本实验推测,采用体外实验,研究柿单宁与脂质吸收有关酶的抑制作用,并探讨柿单宁和胆固醇、胆汁酸的结合能力,结果显示,柿单宁可抑制胰脂酶、胆固醇酯酶活性,结合胆汁酸,抑制胆固醇胶束化形成。且其对胰脂酶的抑制作用比苹果多酚(IC50=0.501 mg/mL)要强,但比葡萄籽提取物(IC50=(3.71±0.03) mg/mL)要弱,与荷叶提取物的抑制效果(IC50=0.46 mg/mL)相当,而对胆固醇胶束化的抑制能力也比同浓度的银杏提取物、桑葚提取物要强(10 mg/mL的银杏提取物、桑葚提取物对胆固醇胶束化溶液的抑制率分别为27.26%、57.61%)[20]。总体来说,体外实验证明柿单宁在体外具有较强的降胆固醇效果,这可以从一定程度上解释柿单宁在动物体系中的强降脂作用,这也为柿子的开发利用提供了一定依据。
原花青素的结构如黄烷醇单体结构、连接方式、聚合度和没食子酰基化程度等与蛋白质和酶的结合能力密切相关。有研究表明,原花青素没食子化程度越高,聚合越大[29-31],对胰脂酶活性抑制作用越强。Nakai等[29]的研究表明,含有没食子酸酯的EGCG和ECG比非酯化的C和EC对胰脂酶活性的抑制作用更强。此外,Kimura等[32]的研究表明,A型连接的原花青素对胰脂酶的抑制作用强于B型连接的原花青素。而柿单宁的没食子酰化程度高,聚合度大,且含有大量A型连接构型,其具有较强的抑制胰脂酶和胆固醇酯酶的能力可能归因于其特殊的结构特点。
Ikeda[33]和Kirana[18]等的研究表明,原花青素中没食子酸的含量是决定胆固醇胶束化溶解度的关键因素,而儿茶素没食子酸酯化后,使得分子中含有疏水结构域,拥有比游离儿茶素更强的与疏水脂质双分子层的亲合力,更容易与胆固醇发生疏水结合,增加胆固醇的排泄[34]。最新研究表明,在pH 6.8时,磷脂酰胆碱的三甲胺群能与EGCG的没食子酰基发生离子-π键相互作用EGCG,从而形成EGCG-磷脂酰胆碱复合物,降低胆固醇胶束化溶液的溶解性[35]。这也可能是柿单宁在pH 7.0条件下具有比pH 2.0更强的结合胆固醇的能力的原因。此外,Osakabe等[36]的研究发现,原花青素对胆固醇胶束化的沉淀作用与聚合度正相关。
柿单宁可能在动物或人体肠道内通过抑制胰脂酶、胆固醇酯酶活性,结合胆汁酸,抑制胆固醇胶束化形成,以及结合胆固醇至共沉淀起到体内降胆固醇的效果。柿单宁由于含有较多A型连接的(表)儿茶素结构,具有较多的酚羟基,可以与蛋白质通过氢键结合,从而封闭酶的活性部分,起到抑制酶活性的作用。而且,研究表明儿茶素结构中疏水的没食子酰基可以通过疏水相互作用与疏水的胆固醇结合[33]。而90%的柿单宁是没食子酰基化的,且含有较多A型连接。这也可以解释柿单宁显著结合胆固醇的能力。
[1] TINIAKOS D G, VOS M B, BRUNT E M. Nonalcoholic fatty liver disease: pathology and pathogenesis[J]. The Annual Review of Pathology(Mechanisms of Disease), 2010, 5: 145-171. DOI:10.1146/ annurev-pathol-121808-102132.
[2] HIROSHI S Y A, TOSHIHIKO S, ATSUKO Y, et al. Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 4604-4609. DOI:10.1021/jf070569k.
[3] SIRICHAI A, JEERASUK M, SUPATRA S, et al. Lowering mechanisms of grape seed extract (Vitis vinifera L.) and its antihyperlidemic activity[J]. Journal of Medicinal Plants Research,2010, 4(20): 2113-2120. DOI:10.5897/JMPR2010.6043.
[4] YASUDA A, NATSUME M, SASAKI K, et al. Cacao procyanidins reduce plasma cholesterol and increase fecal steroid excretion in rats fed a high-cholesterol diet[J]. Biofactors, 2008, 33(3): 211-223. DOI:10.1002/biof.5520330307.
[5] GORINSTEIN S, BARTNIKOWSKA E, KULASEK G, et al. Dietary persimmon improves lipid metabolism in rats fed diets containing cholesterol[J]. The Journal of Nutrition, 1998, 128(11): 2023-2027.
[6] MATSUMOTO K, WATANABE Y, OHYA M A, et al. Young persimmon fruits prevent the rise in plasma lipids in a diet-induced murine obesity model[J]. Biological & Pharmaceutical Bulletin, 2006,29(12): 2532-2535. DOI:10.1248/bpb.29.2532.
[7] MATSUMOTO K, YOKOYAMA S, GATO N. Hypolipidemic effect of young persimmon fruit in C57bl/6.KOR-ApoEshl mice[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(10): 2651-2659. DOI:10.1271/bbb.80319.
[8] MATSUMOTO K, YOKOYAMA S, GATO N. Bile acidbinding activity of young persimmon (Diospyros kaki) fruit and its hypolipidemic effect in mice[J]. Phytotherapy Research, 2010, 24(2):205-210. DOI:10.1002/Ptr.2911.
[9] LEE Y A, CHO E J, YOKOZAWA T. Effects of proanthocyanidin preparations on hyperlipidemia and other biomarkers in mouse model of type 2 diabetes[J]. Journal of Agricultural and Food Chemistry,2008, 56(17): 7781-7789. DOI:10.1021/jf800639m.
[10] MATSUMOTO K, KADOWAKI A, OZAKI N, et al. Bile acidbinding ability of kaki-tannin from young fruits of persimmon(Diospyros kaki) in vitro and in vivo[J]. Phytotherapy Research, 2011,25(4): 624-628. DOI:10.1002/Ptr.3306.
[11] GATO N, KADOWAKI A, HASHIMOTO N, et al. Persimmon fruit tannin-rich fiber reduces cholesterol levels in humans[J]. Annals of Nutrition and Metabolism, 2013, 62(1): 1-6. DOI:10.1159/000343787.
[12] GU H F, LI C M, XU Y J, et al. Structural features and antioxidant activity of tannin from persimmon pulp[J]. Food Research International, 2008, 41(2): 208-217. DOI:10.1016/ j.foodres.2007.11.011.
[13] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ ac60111a017.
[14] 尹瑞卿, 丁玉, 陈明达, 等. 黄芩苷对胰脂肪酶的抑制机理研究[J].安徽农业科学, 2009, 37(24): 11534-11536. DOI:10.3969/ j.issn.0517-6611.2009.24.078.
[15] 江慧芳, 王雅琴, 刘春国. 三种脂肪酶活力测定方法的比较及改进[J]. 化学与生物工程, 2007, 24(8): 72-75. DOI:10.3969/ j.issn.1672-5425.2007.08.022.
[16] 纪建业. 脂肪酶活力测定方法的改进[J]. 通化师范学院学报, 2005,26(6): 51-53. DOI:10.3969/j.issn.1008-7974.2005.06.023.
[17] GANDARIAS J M, LACORT M, MARTINEZ M J, et al. Kinetic properties and solubilization of microsomal cholesterol ester hydrolase from rat liver[J]. Steroids, 1987, 49(4/5): 403-417. DOI:10.1016/0039-128X(87)90014-6.
[18] KIRANA C, ROGERS P F, BENNETT L E, et al. Naturally derived micelles for rapid in vitro screening of potential cholesterol-lowering bioactives[J]. Journal of Agricultural and Food Chemistry, 2005,53(11): 4623-4627. DOI:10.1021/jf050447x.
[19] NSOR A J, ZHONG F, MOTHIBE K J. In vitro hypoglycemic and cholesterol lowering effects of dietary fiber prepared from cocoa(Theobroma cacao L.) shells[J]. Food & Function, 2012, 3(10): 1044-1050. DOI:10.1039/c2fo30091e.
[20] ADISAKWATTANA S, INTRAWANGSO J, HEMRID A, et al. Extracts of edible plants inhibit pancreatic lipase, cholesterol esterase and cholesterol micellization, and bind bile acids[J]. Food Technology and Biotechnology, 2012, 50(1): 11-16. DOI:10.17113/ ftb.50.01.16.4033.
[21] IMAI K, TAMURA Z, MASHIGE F, et al. Gas chromatography of bile acids as their hexafluoroisopropyl ester-trifluoroacetyl derivatives[J]. Journal of Chromatography, 1976, 120(1): 181-186. DOI:10.1016/s0021-9673(01)99010-7.
[22] BLADÉ C, AROLA L, SALVADÓ M J. Hypolipidemic effects of proanthocyanidins and their underlying biochemical and molecular mechanisms[J]. Molecular Nutrition & Food Research, 2010, 54(1):37-59. DOI:10.1002/mnfr.200900476.
[23] WINKLER F K, D'ARCY A, HUNZIKER W. Structure of human pancreatic lipase[J]. Nature, 1990, 343: 771-774. DOI:10.1038/343771a0.
[24] ADISAKWATTANA S, MOONRAT J, SRICHAIRAT S, et al. Lowering mechanisms of grape seed extract (Vitis vinifera L.) and its antihyperlidemic activity[J]. Journal of Medicinal Plants Research,2010, 4(20): 2113-2120. DOI:10.5897/JMPR2010.6043.
[25] HAGERMAN A E, BUTLER L G. The specificity of proanthocyanidin-protein interactions[J]. Journal of Biological Chemistry, 1981, 256(9): 4494-4497.
[26] OH H I, HOFF J E, ARMSTRONG G S, et al. Hydrophobic interaction in tannin-protein complexes[J]. Journal of Agricultural and Food Chemistry, 1980, 28(2): 394-398. DOI:10.1021/jf60228a020.
[27] SERRANO J, PUUPPONEN P R, DAUER A, et al. Tannins: current knowledge of food sources, intake, bioavailability and biological effects[J]. Molecular Nutrition & Food Research, 2009, 53(Suppl 2):310-329. DOI:10.1002/mnfr.200900039.
[28] ZOU B, LI C, CHEN J, et al. High molecular weight persimmon tannin is a potent hypolipidemic in high-cholesterol diet fed rats[J]. Food Research International, 2012, 48(2): 970-977. DOI:10.1016/ j.foodres.2012.05.024.
[29] NAKAI M, FUKUI Y, ASAMI S, et al. Inhibitory effects of oolong tea polyphenols on pancreatic lipase in vitro[J]. Journal of Agricultural and Food Chemistry, 2005, 53(11): 4593-4598. DOI:10.1021/ jf047814.
[30] KIMURA H, OGAWA S, NIIMI A, et al. Inhibition of fat digestion by highly polymeric proanthocyanidins from seed shells of japanese horse chestnut (Aesculus turbinata Blume)[J]. Journal of the Japanese Society for Food Science and Technology(Nippon Shokuhin Kagaku Kogaku Kaishi), 2009, 56(9): 483-489. DOI:10.3136/nskkk.56.483.
[31] SUGIYAMA H, AKAZOME Y, SHOJI T, et al. Oligomeric procyanidins in apple polyphenol are main active components for inhibition of pancreatic lipase and triglyceride absorption[J]. Journal of Agricultural and Food Chemistry, 2007, 55(11): 4604-4609. DOI:10.1021/jf070569k.
[32] KIMURA H, OGAWA S, AKIHIRO T, et al. Structural analysis of a-type or b-type highly polymeric proanthocyanidins by thiolytic degradation and the implication in their inhibitory effects on pancreatic lipase[J]. Journal of Chromatography A, 2011, 1218(42): 7704-7712. DOI:10.1016/j.chroma.2011.07.024.
[33] IKEDA I, IMASATO Y, SASAKI E, et al. Tea catechins decrease micellar solubility and intestinal absorption of cholesterol in rats[J]. Biochimica et Biophysica Acta(BBA)-Lipids and Lipid Metabolism,1992, 1127(2): 141-146. DOI:10.1016/0005-2760(92)90269-2.
[34] KAJIYA K, KUMAZAWA S, NAKAYAMA T. Steric effects on interaction of tea catechins with lipid bilayers[J]. Bioscience,Biotechnology and Biochemistry, 2001, 65(12): 2638-2643. DOI:10.1271/bbb.65.2638.
[35] KOBAYASHI M, NISHIZAWA M, INOUE N, et al. Epigallocatechin gallate decreases the micellar solubility of cholesterol via specific interaction with phosphatidylcholine[J]. Journal of Agricultural and Food Chemistry, 2014, 62(13): 2881-2890. DOI:10.1021/jf405591g.
[36] OSAKABE N, YAMAGISHI M. Procyanidins in theobroma cacao reduce plasma cholesterol levels in high cholesterol-fed rats[J]. Journal of Clinical Biochemistry and Nutrition, 2009, 45(2): 131-136. DOI:10.3164/jcbn.07-34.
Cholesterol-Lowering Effect of Persimmon Tannin in Vitro
ZHU Wei1, ZOU Bo2, GE Zhenzhen1, ZHANG Ying1, LI Chunmei1,*
(1. College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;2. Sericultural & Agri-food Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510610, China)
This study investigated the inhibitory effect of persimmon tannin on pancreatic lipase and pancreatic cholesterol esterase activities. The binding capacity of persimmon tannin to cholesterol and bile acids was also determined by spectrophotometry and gas chromatography. The results indicated that persimmon tannin significantly inhibited the activity of pancreatic lipase with an IC50value of (0.445 ± 0.021) mg/mL in an un-competitive manner, and the inhibitory constant(Ki) was 0.406 mg/mL. Meanwhile, it also showed a strong inhibitory effect on pancreatic cholesterol esterase in an un-competitive manner with an IC50value of (0.442 ± 0.017) mg/mL and a Kivalue of 0.488 mg/mL. At the concentration of 10 mg/mL, the binding rates of persimmon tannin to cholic acid (CA) and deoxycholic acid (DCA) were 58% and 94%,respectively. Persimmon tannin also could inhibit cholesterol micellization effectively, and the percentage inhibition was found to be 67% when the concentration was 0.20 mg/mL. In addition, the cholesterol binding ability of persimmon tannin was stronger at pH 7.0 than pH 2.0. These results suggested that persimmon tannin might decrease lipid absorption through inhibiting the activities of pancreatic lipase and pancreatic cholesterol esterase, and binding cholesterol and bile acids. This may explain the strong cholesterol-lowering effect of persimmon tannin in vivo.
persimmon tannin (PT); pancreatic lipase; pancreatic cholesterol esterase; bile acids; cholesterol micellization
10.7506/spkx1002-6630-201609014
TS201.4
A
1002-6630(2016)09-0071-06
朱维, 邹波, 葛珍珍, 等. 柿单宁的体外降胆固醇作用[J]. 食品科学, 2016, 37(9): 71-76. DOI:10.7506/spkx1002-6630-201609014. http://www.spkx.net.cn
ZHU Wei, ZOU Bo, GE Zhenzhen, et al. Cholesterol-lowering effect of persimmon tannin in vitro[J]. Food Science, 2016,37(9): 71-76. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609014. http://www.spkx.net.cn
2015-07-12
教育部“新世纪优秀人才支持计划”项目(NCET-12-0865);公益性行业(农业)科研专项(201203047)
朱维(1990—),女,博士研究生,研究方向为食品科学。E-mail:Katherine@webmail.hzau.edu.cn
*通信作者:李春美(1973—),女,教授,博士,研究方向为天然产物化学。E-mail:lichmyl@mail.hzau.edu.cn
