探究用导线代替盐桥能产生电流的原因
2016-11-14江西明正球
◇ 江西 明正球
(作者单位:江西师大附中)
探究用导线代替盐桥能产生电流的原因
◇江西明正球
为什么用导线代替盐桥后还能产生电流?本文对此展开了一系列探究,得出了产生电流的原因,并将结论迁移为解题能力.
图1是1个双液原电池,如果将双液原电池中的盐桥换成1根导线(如图2),电流表中有无电流通过?
因为电子只能从导线通过,阴、阳离子只能从电解质溶液中通过,而盐桥起到的是接通内电路的作用,只能用溶液来联通,基于这些理论,很多学生一度认为把盐桥换成导线后内电路发生了断路,是不会产生电流的,事实果真如此吗?
1 问题的产生
那一天课堂上,在讲解双液原电池时,笔者问学生,可否用导线连接2个半电池,学生异口同声的回答说不能,笔者没有立刻评价他们的回答,而是将一根铜导线连在了本应放置盐桥的位置,出乎意料的事情发生了,当把铜导线放上去时,电流表的指针有了很大幅度的偏转,说明此时电路中产生了可观的电流,学生惊呆了,用非常期待的眼神看着,希望给出解释,其实这个现象也出乎笔者的意料,本着探索真理的精神,提议课后大家一起去实验室探究.
2 实验探究

图3
为什么将盐桥换成导线后,电流表指针也会偏转呢?课后,很多学生跟随笔者走进化学实验室,又重新实验了一遍,确实能产生电流,我们盯着这套装置(图2)目不转睛的看了很久,终于有了想法,当把盐桥换成导线后,是不是乙池本身就构成了一个原电池?如果乙池构成了原电池,那甲池就是电解池了,问题来了,观察乙池,铜导线的末端和铁片确实构成了活泼性不同的两极,硫酸亚铁是电解质溶液,也能构成闭合回路,可是,自发的氧化还原反应在哪呢?为了一探究竟,大家取了一个单独的小烧杯,搭建了如图3所示的装置.

图4
电流表的指针微微偏转,说明此处的确有自发的氧化还原反应在进行,考虑到亚铁离子很容易被空气中的氧气氧化,如果被氧化成铁离子后,铁电极与铁离子就会发生Fe+2Fe3+=3Fe2+的反应了,是这个原因吗?我们将硫酸亚铁溶液换成氯化钠溶液,如图4所示.
电流表的指针依然偏转!说明即便不发生Fe+2Fe3+=3Fe2+的反应,也能发生其他氧化还原反应,同学们联想到铁在盐溶液中的生锈,分析此处可能发生了金属的吸氧腐蚀,为了证明是吸氧腐蚀,大家将如图4所示的装置放置在实验室,一段时间后再去看,发现在烧杯里,出现了少许红褐色沉淀,往沉淀里加盐酸,沉淀溶解了,再滴加几滴硫氰化钾溶液,立刻变成血红色,证明沉淀就是氢氧化铁,说明在这个过程中确实发生了吸氧腐蚀.
3 结论
原来,将盐桥用导线代替后,整个装置已经不再是1个双液原电池,而是构成了1个原电池和1个电
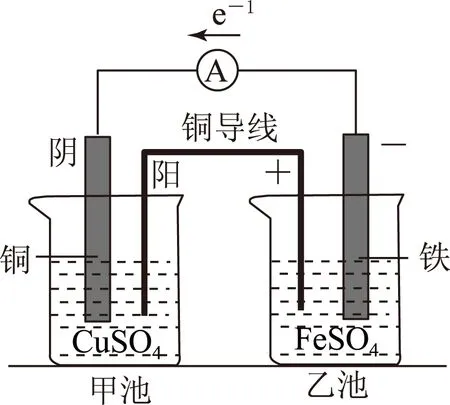
图5
解池,以图2所示装置为例,乙池中的铁片为电源的负极,铜导线右侧为电源正极,甲池中的铜片为电解池的阴极,铜导线左侧为电解池的阳极,如图5所示.
随着实验时间的延长,我们发现甲池中的铜导线有了明显的腐蚀,这也进一步验证了之前的结论.
4 从理论到解题
后来,在整理原电池的相关考题时,笔者发现,此次探究不仅纠正了大家的认知错误,还能更加从容的应对一类电化学的考题.


图6
A甲同学实验过程中,ZnSO4溶液中阴离子总浓度不会发生改变;
B甲同学实验过程中,Zn片被氧化,铜片被还原;
C乙同学将盐桥换成铜导线后,U形铜导线的两端电极反应类型一致;
D乙同学将盐桥换成铜导线后,导线中电流方向不会发生变化
分析将盐桥换成导线后,烧杯A构成原电池,锌为负极,铜导线为正极,电子从锌流出,与原来的电子流动方向一致,所以电流方向也一致,故选项D是正确的.


图7
A电子通过盐桥从乙池流向甲池;
B将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同;
C开始时,银片上发生的反应是:
Ag-e-=Ag+;
D铜导线替换盐桥,原电池仍继续工作
分析本题中,若用铜导线代替盐桥,乙池成为原电池,而甲池则成为一个电镀池,甲池中的铜片会不断溶解,铜导线表面则会析出铜,整套装置已不再是一个简单的原电池,自然也无法和之前一样工作,可以排除选项D.答案为B.
若将原理推广,如果用石墨棒来代替盐桥,也会起到类似的效果,只是要注意石墨棒本身不会发生化学反应,如例3.


图8 图9
A图8盐桥中的阳离子移向甲装置;
B两图都是将化学能转变成电能的装置;
C图9中乙装置总反应的离子方程式:
D图9中电子流向为Fe→电流计→石墨a→石墨b→铜丝→石墨c→Fe
分析显然,在图9中,甲池是原电池,乙池是电解池,在乙池中CuCl2溶液被电解,会生成铜和氯气,所以,此题可以选择选项C,但要特别注意选项D,电子只能通过导线,是不能通过溶液的,故电子的流动方向应是Fe→电流计→石墨a,石墨b→铜丝→石墨c.


图10 图11
其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如图11所示,电流计指针偏转方向与先前一样,但偏转角度明显减小.一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH________(填“减小”“增大”或“不变”),乙池中石墨为________极(填“正”“负”“阴”或“阳”).
分析本题有一定难度,先看前2问,铁在不断溶解,氯化铜中的铜离子得电子后在石墨电极表面析出,若设转移电子的物质的量为amol,可以依据质量差为6g列方程为:56×0.5a+64×0.5a=6,解得a=0.1,也即转移电子0.1mol,下一问,问反应前后溶液质量差, 除了要注意甲池中Fe2+会多0.05mol、 乙池中Cu2+会少0.05mol外,还要特别注意为了平衡电荷,盐桥中的Cl-会往甲池中移入0.1mol,K+会往乙池中移入0.1mol,故反应后的质量和反应前相比,质量增加35.5×0.1+39×0.1+56×0.05-64×0.05=7.05,即质量相差7.05g.当盐桥换成导线后,甲池变成一个原电池,铜丝是正极,氧气在此处放电变成OH-,所以pH增大,此时乙池为电解池,石墨相当于接了电源负极,所以为阴极.
题目很多,不再一一列举,只要掌握了原理,在遇到此类题时,有条理的分析,就能较快的得到正确答案.
在化学实验中,可能只是一个微小的改动,却会造成完全不一样的结果,对于这些未知的情况,不能忽略不管,更不能想当然,而是应该用严谨的态度,去探究事物的真面目,这既是对科学的尊重,也是让我们成长的具体方法.
(作者单位:江西师大附中)
