高考“宠儿”——化学能与电能的命题特点及解决对策
2016-11-14河北颜建河
◇ 河北 颜建河
(作者单位:河北省衡水市故城县教育局教研室)
高考“宠儿”
——化学能与电能的命题特点及解决对策
◇河北颜建河
电化学是高考命题的热点之一,试题多以选择题为主,同时也穿插在非选择题中.电化学的知识内容既可以涉及物理知识的应用,也可以与生产生活、新科技及新技术等问题相联系,是不可忽略的一个知识点.所考查的内容多以原电池的工作原理、电解产物判断、电池反应方程式的书写、离子的移动方向、溶液的pH变化、金属的腐蚀和防护为热点.特别是可充电电池方面的信息迁移题更是高考的一大亮点,这类试题情境新、陌生度高,且知识切入点低、综合性强,充分体现了高考化学科目考能力这一指导思想.为此,一定要立足基础、重视课本核心知识的梳理与总结,充分利用典型例(习)题的讲评,最终实现在运用(训练)中掌握知识、提升能力.
1 原电池与电解池判断方法
由于原电池与电解池的组成相似,电极反应的类型相同(均为氧化还原反应),以至于学生不能正确判断哪种是原电池,哪种是电解池,如何区别呢?其方法如下:
1) 从能量转化判断.
原电池是把化学能转化为电能的装置,而电解池是把电能转化为化学能的装置.尽管它们的组成类似,但作用不同,原电池可用来产生电流,而电解池却要消耗电能.
2) 从电极名称判断.
原电池的两极分别叫正、负极,两极名称由电极材料决定,电极材料多为2种活动性不同的金属(其中一种也可以是非金属或某些氧化物),相对活动性强的金属易失去电子为负极,活动性弱的难失去电子的为正极.例如,铜锌原电池,活泼金属锌为负极,不活泼金属铜为正极.
电解池的两极分别叫阴、阳极,两极名称由外接直流电源决定,与外接直流电源负极相接的一极叫阴极,与外接直流电源正极相接的一极叫阳极.
3) 从电极反应判断.
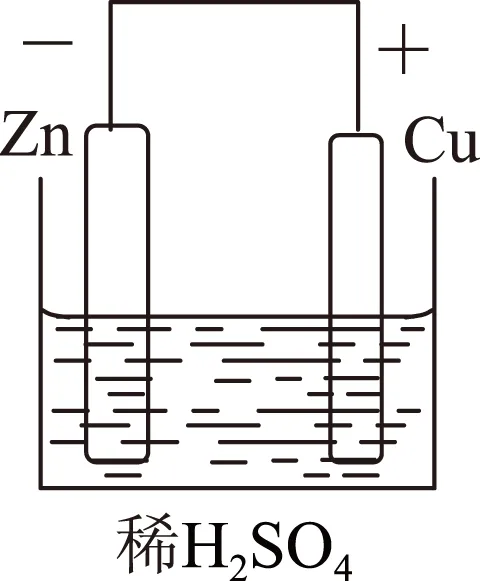
图1
以铜锌原电池和电解氯化铜溶液为例说明:
a)铜锌原电池如图1所示.
负极(锌片):电子流出的一极,其电极反应式为Zn-2e-=Zn2+(氧化反应);
正极(铜片):电子流入的一极,其电极反应式为2H++2e-=H2↑ (还原反应).
为了便于记忆可归纳为4个字:负氧正还.
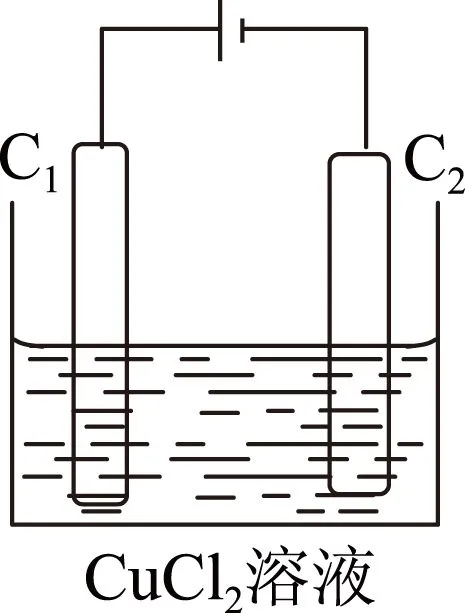
图2
b)氯化铜电解池(石墨作电极)如图2所示.
阳极(C1):与直流电源正极相接,其电极反应式为2Cl--2e-=Cl2↑(氧化反应);
阴极(C2):与直流电源负极相接,其电极反应式为Cu2++2e-=Cu(还原反应).
为了便于记忆可归纳为4个字:阳氧阴还.
4) 从电子流动方向判断.
在原电池中,电子从负极流入正极.在电解池中,电子从直流电源负极流入阴极,通过电解质溶液到阳极,从阳极再回到直流电源的正极.
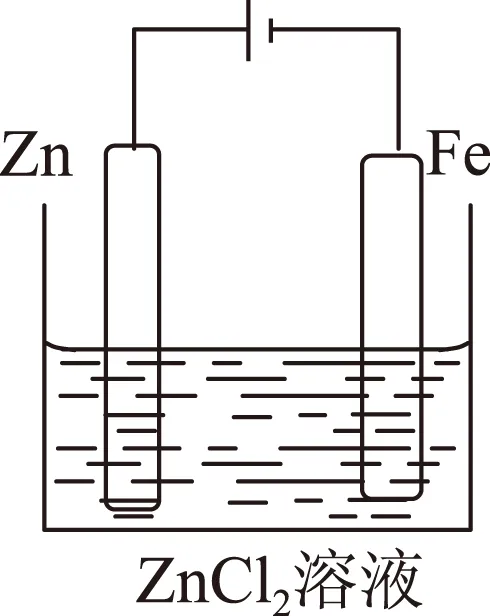
图3
电解氯化铜溶液时,用石墨作电极,它在一般条件下不参加反应,故叫惰性电极.若把电极换成某种金属,情况就不同了,电极本身要参加反应,如在氯化锌溶液中,用铁、锌作电极如图3所示.
阳极(锌片):与直流电源正极相接,电极反应式为Zn-2e-=Zn2+(氧化反应);
阴极(铁片):与直流电源负极相接,其电极反应式为Zn2++2e-=Zn(还原反应).
经过一段时间的反应,锌就沉积在铁片的表面上,这就是电镀.电镀是电解原理的一种运用,电解和电镀虽然阳极发生的都是氧化反应,但前者是电解质溶液的离子发生氧化反应,而后者是阳极本身发生的氧化反应,反应结果是消耗了阳极,而电解质溶液无变化.
综上所述,原电池、电解池、电镀池3种装置的区别搞清楚了,判断方法就可迎刃而解.
1) 单一装置:a) 凡有外加直流电源的装置,该装置为电解池.若电极本身参加反应,则可能是电镀池或电解精炼(需具体分析).b) 无外加直流电源,两电极用金属(或一种非金属或某些氧化物)放在电解质溶液里的装置,就是原电池.用导线把两极连接,该原电池开始工作,即产生电流.若不用导线把两极连接,该原电池没有工作,即不产生电流.如干电池没有用导线把两极连接起来,就没有工作,即不产生电流,它仍然是原电池.
2) 复合装置:a) 若有外加直流电源与几个装置串联或并联,则各个装置都是电解池,若电极本身参加反应,则可能是电镀池或电解精炼(需具体分析).b) 若无外加直流电源,而是用导线把各池的电极串联或并联起来,要根据电极材料本身的相对活动性来决定.由于中学阶段不学电极电位,一般活动性大的金属作电极的装置为原电池,与原电池相连的各池是电解池,若电极参加反应者,情况如前所述.如图4所示,从电极材料本身看,铝相对活动性大,B池为原电池,负极(Al):2Al-6e-=2Al3+;正极(Cu):3Cu2++6e-=3Cu.A池为电解池,阳极(Cu):Cu-2e-=Cu2+;阴极(Fe):2H++2e-=H2↑.电子由Al流到Fe,再由A池的Cu流到B池的Cu.再如图5所示,电极材料中铁的相对活动性大,所以A池为原电池.电极反应如下,负极(Fe):Fe-2e-=Fe2+;正极(Cu):2H++2e-=H2↑.电子由Fe流到C,再由B池的Cu流到A池的Cu.B池为电解池,电极反应如下,阳极(Cu):Cu-2e-=Cu2+;阴极(C):Cu2++2e-=Cu.经过一段时间,C电极上沉积一层铜.
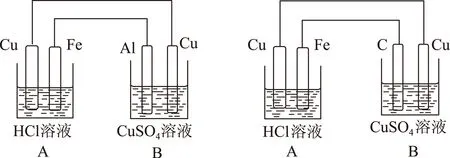
图4 图5
2 可充电电池核心知识分析
1) 可充电电池分为放电和充电2个过程.放电是原电池反应,其相关知识可依据原电池原理进行分析;充电是电解池反应,其相关知识可依据电解原理进行分析.
2) 判断电池放电时的电极极性和材料,可先标出放电(原电池)总反应式电子转移的方向和数目,失去电子的一极为负极,该物质为负极材料;得到电子的一极为正极,该物质为正极材料.判断电池充电时的电极极性和材料,方法同前,失去电子的一极为阳极,该物质即为阳极材料;得到电子的一极为阴极,该物质即为阴极材料.
3) 书写可充电电池电极反应时,一般都是先书写放电的电极反应式.书写时要遵循以下步骤:a)先标出原电池总反应式电子转移的方向和数目,指出参与负极和正极反应的物质;b)写出一个比较容易书写的电极反应式(要注意电极产物是否与电解质溶液共存);c)要在遵循电子守恒的基础上,用总反应式减去写出的电极反应式即得另一电极反应式.对于充电的电极反应来说,其书写方法与放电的电极反应过程相反,即充电的阳极反应为放电正极反应的逆过程,充电的阴极反应为放电负极反应的逆过程.
4) 判断可充电电池的氧化还原过程,可根据电极反应式进行分析,放电(原电池)的负极及充电(电解池)的阳极均失去电子,其变价元素被氧化,发生了氧化反应,放电(原电池)的正极及充电(电解池)的阴极均得到电子,其变价元素被还原,发生了还原反应.
5) 对溶液中离子移动方向的判断.放电时,阴离子移向负极,阳离子移向正极;充电时,阴离子移向阳极,阳离子移向阴极.
6) 可充电电池充电时与电源的连接关系.可充电电池用完后充电时,原电池的负极与外电源的负极相连,原电池的正极与外电源的正极相连.
(负极)(正极)
(阴极)(阳极)
根据上述电子转移情况及电池相关知识,即可迅速写出原电池和电解池的反应式.
当然,要解决好可充电电池方面的问题,其关键是必须认真阅读题干、理解题示信息,切实把握好以下几点:
1) 放电时按原电池原理进行分析,充电时按电解原理分析.
2) 充放电时电极与电源的连接不能错位,即放电时的负极板,在充电时必须连接电源负极,作为阴极发生还原反应;放电时的正极板,在充电时连接电源正极,作为阳极发生氧化反应.这样,才能达到两块极板经充电复原,成为可重复使用的充电电池.
3) 溶液中阴、阳离子移动方向是:a) 放电时阳离子移向正极,阴离子移向负极;b) 充电时阳离子移向阴极(-),阴离子移向阳极(+).
4) 要注意电池所处的环境.
3 运用
涉及有关可充电电池方面的试题,是历年高考化学学科的必考题型之一.为此,要解答好这方面的题目,其关键就在于能否正确书写电极反应式,而电极反应式书写的切入点则是放电时的电极反应式的书写.倘若学生能熟练掌握上述相关知识,这方面的问题便可迅速解决.

请回答下列问题(不考虑氢、氧的氧化还原):
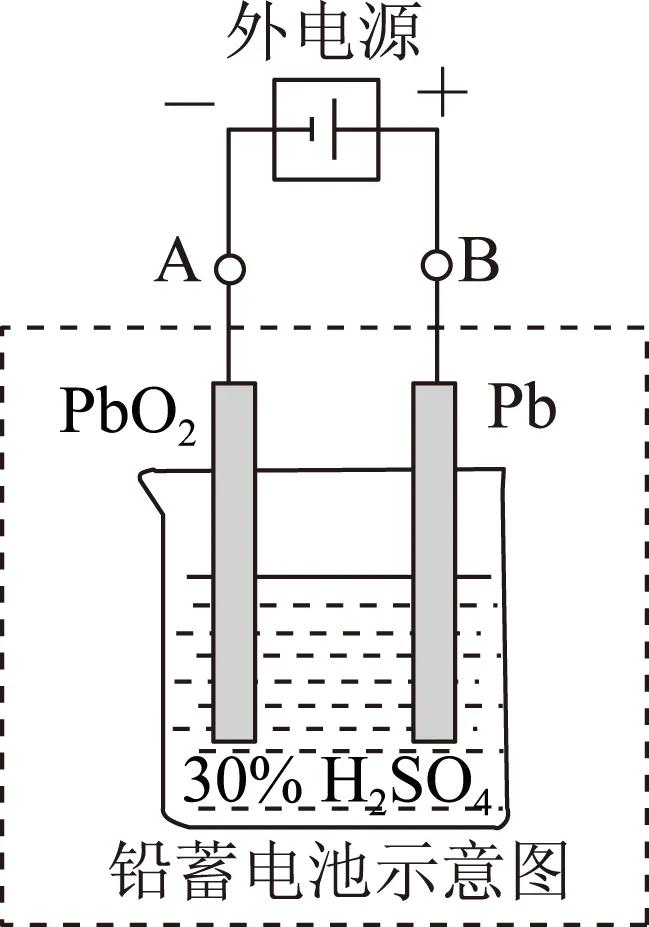
图6
(1) 放电时:正极的电极反应式是________;电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g.
(2) 在完全放电耗尽PbO2和Pb时,若按图6连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________.

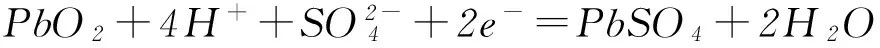
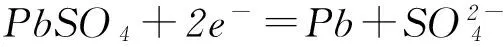

(1) 关于蓄电池的下列说法,不正确的是________.
① 放电时,Fe为负极; ② 充电时阳极电极反应式为Fe(OH)2+2e-=Fe+2OH-; ③ 放电时,电解质溶液中的阳离子向负极移动; ④ 充电时,Ni(OH)2的电极反应式为Ni(OH)2-2e-=NiO2+2H+; ⑤ 蓄电池的电极必须浸在碱性电解质溶液中.
(2) 以此蓄电池为电源,用铂电极电解CuSO4溶液500mL.当蓄电池中电解质溶液质量减轻0.9g时,电解池(不考虑其他损耗)阴极上析出________,其质量为________g.若原CuSO4溶液的pH为5,电解后溶液体积的变化忽略不计,则电解后溶液的pH为________.

(负极)(正极)
(阴极)(阳极)
根据上述整合的信息及题中给予的条件,题中的各个问题便可迎刃而解.
(1) 根据上述电子转移情况,可判断出原电池的正、负极和电解池的阴、阳极,并由此判断出只有①、④、⑤正确.蓄电池的电极必须浸在碱性电解质溶液
中,其原因是放电产生Fe(OH)2、Ni(OH)2必须存在于碱性环境中,且放电过程中产生的H+必须被立即中和掉.
(2) 以上述蓄电池为电源,用惰性电极电解CuSO4溶液,由于蓄电池中消耗的是0.9g水,则由关系式2e-~2H2O,可求出有0.05mol电子转移.又因电解CuSO4溶液,其电极反应为:
(损耗4OH-,余下水电离出的4H+).
当电源输出0.05mol电子时,阴极上析出Cu为0.025mol,其质量为1.6g.则溶液中增加H+0.05mol(损耗0.05mol水电离出的OH-).故c(H+)=(0.05mol+10-5mol·L-1×0.5L)/0.5L=0.1mol·L-1,即pH=1.
(作者单位:河北省衡水市故城县教育局教研室)
