肿瘤相关成纤维细胞对肝癌干细胞的影响*
2016-11-14冯仁鑫宁北芳谢渭芬
冯仁鑫 陈 升 刘 娇 宁北芳 谢渭芬
第二军医大学附属长征医院消化内科(200003)
·论 著·
肿瘤相关成纤维细胞对肝癌干细胞的影响*
冯仁鑫#陈 升#刘 娇 宁北芳 谢渭芬&
第二军医大学附属长征医院消化内科(200003)
背景:肿瘤相关成纤维细胞(CAF)是肿瘤微环境中一类特殊的间质细胞,研究显示CAF在一些恶性肿瘤中可调节肿瘤干细胞(CSC)的干细胞特性和致瘤性。然而在肝细胞癌(HCC)中,CAF对CSC的调控作用尚不清楚。目的:探讨CAF对肝癌干细胞的影响。方法:分别采用免疫组化和免疫荧光技术标记CD44阳性CSC和α-SMA阳性CAF,观察两者在人HCC标本中的位置关系。从HCC手术标本中分离、纯化CAF和癌旁成纤维细胞(PTF),收集相应条件培养基和干细胞条件培养基。以real-time PCR检测CAF或PTF条件培养基培养的人肝癌细胞株HuH-7中的肝癌干细胞相关基因表达。采用流式细胞术分选肝癌干细胞表面标记物EpCAM阳性HuH-7细胞,以CAF或PTF干细胞条件培养基培养细胞,行干细胞成球实验。结果:在HCC标本中,CAF与CSC位置紧邻。与PTF组和对照组HuH-7细胞相比,CAF条件培养基处理组HuH-7细胞肝癌干细胞表面标记物基因和自我更新相关基因表达显著上调(P均<0.05)。CAF干细胞条件培养基处理组未经分选的HuH-7细胞和EpCAM阳性HuH-7细胞,成球率分别显著高于相应PTF组和对照组细胞(19.15%、32.13%对10.89%、19.57%和12.57%、19.77%,P均<0.001)。结论:CAF在肝癌干细胞自我更新能力的维持和促进中起重要作用。
癌,肝细胞; 肿瘤相关成纤维细胞; 肿瘤干细胞; 自我更新; 球形体,细胞
肿瘤干细胞(cancer stem cells, CSC)是肿瘤组织中一小群具有自我更新能力并能分化产生异质性肿瘤细胞的干细胞,在维持肿瘤细胞恶性表型如增殖、转移、复发、耐药性等方面发挥重要作用[1],可为特殊的细胞表面标记物所标记。目前CD133、CD24、CD44、CD90、上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM)、DLK1(delta-like 1 homologue)等表面标记物均被用于肝癌干细胞的分离和鉴定[2-3]。肿瘤微环境中还有一类特殊的间质细胞,即肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAF),对维持肿瘤的标志性特征,如增殖信号的持续活化、诱导血管生成、抵抗细胞死亡、改变细胞能量代谢等具有重要意义[4]。既往研究发现CAF可调节胃癌[5]、结直肠癌[6]、前列腺癌[7]等恶性肿瘤中CSC的干细胞特性和致瘤性。肝细胞癌(hepatocellular carcinoma, HCC)多发生于肝纤维化和肝硬化患者,癌组织和癌旁组织中含有大量成纤维细胞。本课题组前期研究[8]发现,CAF可通过分泌趋化因子CCL2、CCL5、CCL7、CXCL16激活HCC细胞中的Hedgehog(Hh)和转化生长因子-β(TGF-β)信号通路,从而促进肿瘤转移,但CAF对肝癌干细胞的影响尚有待明确,本研究对此进行了探讨。
材料与方法
一、标本来源
用于分离CAF和癌旁成纤维细胞(peritumoral fibroblasts, PTF)的人HCC组织及其配对癌旁组织(取自距癌灶边缘≥5 cm处)来源于上海东方肝胆外科医院原发性HCC手术患者,患者术前签署手术标本使用同意书。
二、细胞株、主要试剂和仪器
人肝癌细胞株HuH-7(中科院上海细胞生物学研究所)培养于含10%胎牛血清(FBS)的DMEM培养基中,37 ℃、5% CO2培养箱中培养。DMEM培养基、DMEM/F12培养基、非必需氨基酸(HyClone, GE Healthcare),FBS、ITS细胞培养添加剂、谷氨酰胺、B-27添加剂(Gibco, Thermo Fisher Scientific Inc.),青-链霉素混合液(Sigma-Aldrich Co.),抗人成纤维细胞磁珠、荧光标记EpCAM抗体(Miltenyi Biotec),表皮生长因子(EGF)、成纤维细胞生长因子(FGF)(R&D Systems),兔抗人CD44抗体(BD Biosciences),小鼠抗人α-平滑肌肌动蛋白(α-SMA)抗体(武汉博士德生物工程有限公司),Alexa Fluor®488驴抗小鼠IgG、TRIzol®试剂、SuperScript®Ⅲ cDNA合成试剂盒(Invitrogen, Thermo Fisher Scien-tific Inc.),SYBR®Premix Ex TaqTMreal-time PCR试剂盒(TAKARA BIO INC.)。免疫磁珠细胞分选仪(Miltenyi Biotec),荧光显微镜(Carl Zeiss AG),real-time PCR系统(Applied Biosystems, Thermo Fisher Scientific Inc.),流式细胞仪(BD Biosciences)。
三、方法
1. CAF、PTF的分离、纯化:采用免疫磁珠细胞分选法(MACS)分离CAF和PTF[8]。以PBS将标本洗净后剪成1 mm3的小块,加入含0.5%胶原酶Ⅳ、1% FBS、1%青-链霉素的DMEM/F12培养基,37 ℃、5% CO2培养箱孵育30 min。待组织完全消化后收集细胞悬液,离心、弃上清,将细胞沉淀重悬于原代成纤维细胞专用培养基(含10% FBS、1% ITS细胞培养添加剂、1%青-链霉素、1%谷氨酰胺的DMEM/F12培养基)。将培养2~3代的原代成纤维细胞消化、计数后重悬于MACS缓冲液中,加入抗人成纤维细胞磁珠后上柱,在免疫磁珠细胞分选仪中进行纯化。纯化后的CAF、PTF培养于含10% FBS的DMEM培养基中,取4~10代纯化的CAF、PTF进行实验。
2. CAF、PTF条件培养基收集
① 3% FBS成纤维细胞条件培养基:将1×105CAF、PTF分别接种于35 mm培养皿中,待贴壁后更换为含3% FBS的DMEM培养基,培养24 h后收集培养上清。
② 成纤维细胞干细胞条件培养基:将1×105CAF、PTF分别接种于35 mm培养皿中,待贴壁后更换为干细胞培养基(含1% ITS细胞培养添加剂、1%非必需氨基酸、1% B-27添加剂、40 ng/mL EGF、20 ng/mL FGF的DMEM培养基),培养24 h后收集培养上清。
收集得到的上述条件培养基以0.22 μm滤膜过滤后直接用于HuH-7细胞培养,或液氮速冻后-80 ℃保存备用。
3. 免疫组化和免疫荧光标记:HCC组织石蜡包埋,5 μm厚连续切片,切片常规脱蜡至水,柠檬酸盐缓冲液煮沸抗原修复,10%山羊血清封闭,依次加入兔抗人CD44抗体(1∶200)和酶标山羊抗兔二抗孵育,DAB显色,阳性染色为棕黄色。苏木精复染细胞核后5%马血清封闭2 h,依次加入小鼠抗人α-SMA抗体(1∶200)和Alexa Fluor®488驴抗小鼠IgG (1∶500)孵育,封片,于正置荧光显微镜下观察并拍照。
4. Real-Time PCR检测肝癌干细胞相关基因表达:将4×105HuH-7细胞接种于35 mm培养皿中,待贴壁后更换为无血清DMEM培养基,培养12 h后更换为3% FBS CAF或PTF条件培养基,对照组更换为3% FBS DMEM培养基,培养24 h后收集细胞。TRIzol®试剂提取细胞总RNA,取1 μg总RNA为模板合成cDNA,以合成的cDNA为模板行real-time PCR扩增,操作步骤均参照试剂盒说明书。PCR引物序列见表1,PCR反应条件:94 ℃ 30 s;94 ℃ 10 s,60 ℃ 34 s,共40个循环。以2-ΔΔCt法计算目的基因mRNA相对表达量。

表1 Real-Time PCR 引物序列
5. 流式细胞分选:将1×107HuH-7细胞重悬于80 μL含0.5% BSA、2 mmol/L EDTA的流式缓冲液,加入10 μL 荧光标记EpCAM抗体或同型对照IgG,充分混匀,冰上避光孵育10 min,加入1~2 mL流式缓冲液重悬细胞,300×g离心5 min,弃上清。将细胞沉淀重悬于150 μL流式缓冲液,上流式细胞仪,收集分选的EpCAM阳性细胞,进行后续实验。
6. 干细胞成球实验:将未经分选的HuH-7细胞或流式细胞术分选的EpCAM阳性HuH-7细胞以约10个/孔的密度加入低吸附96孔板,精确计数每孔加入的细胞数并记录。实验设3个组别:干细胞培养基处理组(对照组)、PTF干细胞条件培养基处理组(PTF组)和CAF干细胞条件培养基处理组(CAF组),培养7 d后计数成球细胞(细胞间边缘发生融合)数,计算成球率。
四、统计学分析
结 果
一、CAF与CSC在HCC标本中位置紧邻
CD44为细胞跨膜糖蛋白之一,参与细胞与细胞外基质间的相互作用,多项研究以CD44为CSC标记物,从多种肝癌细胞株或HCC组织中分选CSC。CD44阳性细胞较CD44阴性细胞具有更强的CSC特征,在体外有更强的成球能力和抵御化疗药物诱导的细胞凋亡的能力,在小鼠体内有更强的致瘤性[9-11]。α-SMA是应用最广泛的成纤维细胞表面标记物[12]。本研究采用免疫组化技术标记CD44阳性CSC,采用免疫荧光技术标记α-SMA阳性CAF,结果显示CAF与CSC在HCC标本中位置紧邻(图1)。作为HCC中含量最丰富的间质细胞之一,CAF与CSC密切的位置关系提示其可能通过直接接触或旁分泌作用影响CSC的生物学特性。
二、CAF促进肝癌干细胞相关基因表达
HuH-7细胞经3% FBS CAF条件培养基培养24 h后,real-time PCR检测显示,肝癌干细胞表面标记物基因CD44、CD90、CD133、EpCAM表达显著高于3% FBS PTF条件培养基处理组和对照组(P均<0.05),PTF组与对照组间差异无统计学意义(P>0.05);此外,自我更新相关基因Oct4、Nanog、Klf4、Bmi1在CAF组HuH-7细胞中的表达亦显著上调(P均<0.05)(图2)。
三、CAF促进肝癌干细胞自我更新
EpCAM是一种钙离子依赖的细胞表面连接蛋白,表达于多种人类上皮细胞,其表达升高常伴随肿瘤早期的变化[13]。研究[14]发现流式细胞术分选出的EpCAM阳性HCC细胞显示出自我更新和分化的CSC样特征,且在NOD-SCID小鼠体内较未经分选的HCC细胞有更强的致瘤性和远处转移能力。为验证CAF对肝癌干细胞自我更新能力的影响,本研究以EpCAM为分选标记物,采用流式细胞术从人肝癌细胞株HuH-7中分选出CSC,检测未经分选的HuH-7细胞与EpCAM阳性HuH-7细胞(肝癌干细胞)的成球能力。检测结果显示,未经分选的HuH-7细胞经CAF干细胞条件培养基处理后,成球率为19.15%,显著高于PTF干细胞条件培养基处理组(10.89%)和对照组(12.57%)(P均<0.001),PTF组与对照组间差异无统计学意义(P>0.05);在EpCAM阳性HuH-7细胞中,CAF组成球率亦显著高于PTF组和对照组(32.13%对19.57%和19.77%,P均<0.001),且三组成球率均明显高于给予相同处理的未经分选的HuH-7细胞。上述结果表明CAF可显著提高肝癌干细胞和HCC细胞的成球能力,促进两者自我更新,而PTF对两种细胞的自我更新能力无明显影响(图3)。
讨 论
CSC是肿瘤组织中一小群具有下述特性的干细胞:①特异的表面标记物;②自我更新和无限增殖;③分化潜能;④高致瘤性;⑤辐射抵抗性;⑥耐药性[1,15]。目前观点认为CSC是肿瘤发生、发展的根本原因,也是导致肿瘤转移、 复发以及耐药的关键因素之一[16-17]。
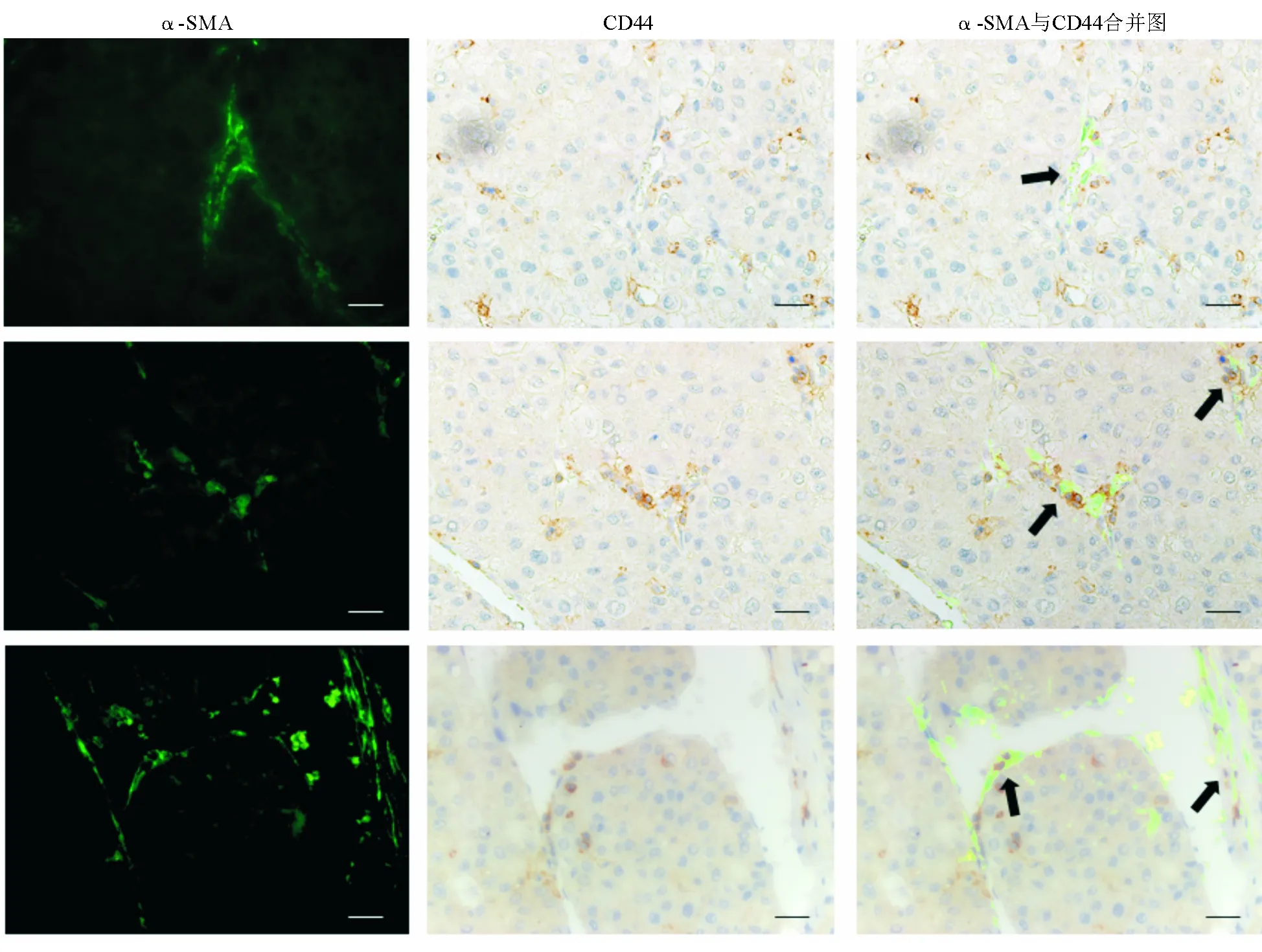
标尺=200 μm
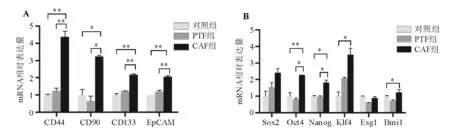
两组间比较,*P<0.05,**P<0.01
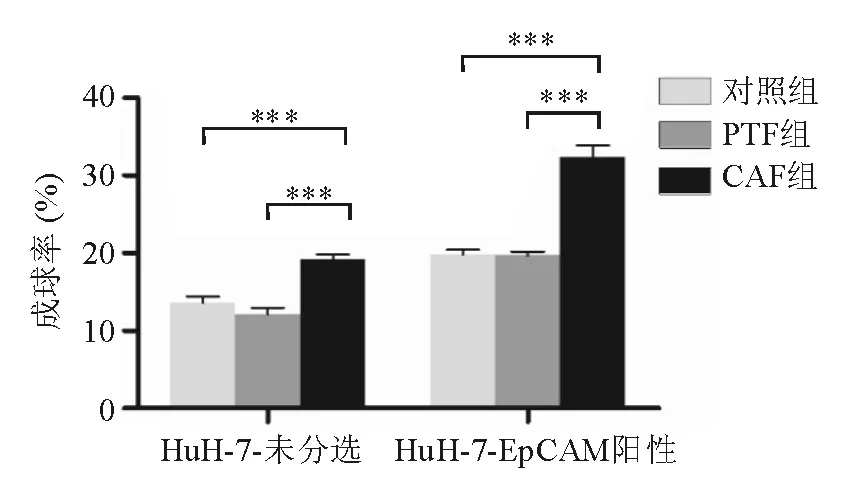
两组间比较,***P<0.001
在众多间质细胞中,CAF作为在肿瘤组织中活化的成纤维细胞,与PTF相比具有更强的促进肿瘤恶性行为的能力[8]。关于CAF与CSC间相互作用的研究显示,化疗药物可促进CAF分泌白细胞介素-17A(IL-17A),进而促进结直肠癌干细胞自我更新和肿瘤生长[6];CAF还可通过激活TGF-β信号通路促进胃癌干细胞的自我更新能力和致瘤性[5];在非小细胞肺癌中,CAF甚至可通过激活胰岛素样生长因子-Ⅱ(IGF-Ⅱ)/IGF1受体(IGF1R)信号通路,诱导自我更新相关基因Nonag表达,使肿瘤细胞去分化成为CSC样细胞[18]。然而在HCC中,CAF对CSC的调控作用尚不清楚。
本研究从人HCC组织及其配对癌旁组织中分离、纯化CAF和PTF,探讨CAF对CSC生物学特性的影响。免疫组化和免疫荧光标记技术显示CAF与CSC在HCC标本中位置紧邻,提示两者间可能存在直接接触或旁分泌关系。以CAF或PTF条件培养基培养人肝癌细胞株HuH-7,real-time PCR检测显示CAF条件培养基可促进肝癌干细胞表面标记物基因表达,其中CD44表达量约为PTF组和对照组的4倍,其他表面标记物表达量亦分别上调 2~3倍。同时,CAF条件培养基还可促进肝癌干细胞自我更新相关基因表达,以Klf4表达上调最为显著,约为对照组的3.5倍。
CSC在特定生长环境下具有很强的自我更新和增殖能力。干细胞成球实验是分离和研究CSC的一种较为成熟的方法,即将单个细胞培养于低吸附培养皿中,以含有特殊细胞因子的无血清干细胞培养基进行培养,观察细胞的自我更新能力,目前已利用该技术在结直肠癌[19]、肺癌[20]、胰腺癌[21]等肿瘤细胞株中成功分离、富集相应CSC。本研究以CAF或PTF干细胞条件培养基培养未经分选的HuH-7细胞和经流式细胞术分选的EpCAM阳性HuH-7细胞(肝癌干细胞),发现CAF可提高肝癌干细胞和HCC细胞的成球能力(成球率分别增高12.36% 和6.58%),而PTF则无此作用,证实CAF可促进肝癌干细胞自我更新。既往研究显示Hh和TGF-β信号通路在CSC干细胞特性的维持中起重要作用[22-23],本课题组前期研究亦发现CAF分泌的趋化因子CCL2、CCL5、CCL7、CXCL16可激活HCC细胞中的Hh和TGF-β信号通路[8],结合本研究结果,提示CAF可能通过旁分泌作用促进肝癌干细胞自我更新。
综上所述,CAF在肝癌干细胞自我更新能力的维持和促进中起重要作用,这一发现为以CAF与CSC之间的相互作用为靶点的HCC生物靶向治疗提供了有力的实验依据。
1 Magee JA, Piskounova E, Morrison SJ. Cancer stem cells: impact, heterogeneity, and uncertainty[J]. Cancer Cell, 2012, 21 (3): 283-296.
2 Ma S, Chan KW, Hu L, et al. Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J]. Gastroenterology, 2007, 132 (7): 2542-2556.
3 Feng D, Wang N, Hu J, et al. Surface markers of hepatocellular cancer stem cells and their clinical potential[J]. Neoplasma, 2014, 61 (5): 505-513.
4 Kalluri R, Zeisberg M. Fibroblasts in cancer[J]. Nat Rev Cancer, 2006, 6 (5): 392-401.
5 Hasegawa T, Yashiro M, Nishii T, et al. Cancer-associated fibroblasts might sustain the stemness of scirrhous gastric cancer cells via transforming growth factor-β signaling[J]. Int J Cancer, 2014, 134 (8): 1785-1795.
6 Lotti F, Jarrar AM, Pai RK, et al. Chemotherapy activates cancer-associated fibroblasts to maintain colorectal cancer-initiating cells by IL-17A[J]. J Exp Med, 2013, 210 (13): 2851-2872.
7 Liao CP, Adisetiyo H, Liang M, et al. Cancer-associated fibroblasts enhance the gland-forming capability of prostate cancer stem cells[J]. Cancer Res, 2010, 70 (18): 7294-7303.
8 Liu J, Chen S, Wang W, et al. Cancer-associated fibroblasts promote hepatocellular carcinoma metastasis through chemokine-activated hedgehog and TGF-β pathways[J]. Cancer Lett, 2016, 379 (1): 49-59.
9 Kon J, Ooe H, Oshima H, et al. Expression of CD44 in rat hepatic progenitor cells[J]. J Hepatol, 2006, 45 (1): 90-98.
10 Wan S, Zhao E, Kryczek I, et al. Tumor-associated macrophages produce interleukin 6 and signal via STAT3 to promote expansion of human hepatocellular carcinoma stem cells[J]. Gastroenterology, 2014, 147 (6): 1393-1404.
11 Xie Z, Choong PF, Poon LF, et al. Inhibition of CD44 expression in hepatocellular carcinoma cells enhances apoptosis, chemosensitivity, and reduces tumorigenesis and invasion[J]. Cancer Chemother Pharmacol, 2008, 62 (6): 949-957.
12 Mazzocca A, Dituri F, Lupo L, et al. Tumor-secreted lysophostatidic acid accelerates hepatocellular carcinoma progression by promoting differentiation of peritumoral fibroblasts in myofibroblasts[J]. Hepatology, 2011, 54 (3): 920-930.
13 Munz M, Baeuerle PA, Gires O. The emerging role of EpCAM in cancer and stem cell signaling[J]. Cancer Res, 2009, 69 (14): 5627-5629.
14 Yamashita T, Ji J, Budhu A, et al. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features[J]. Gastroenterology, 2009, 136 (3): 1012-1024.
15 Meacham CE, Morrison SJ. Tumour heterogeneity and cancer cell plasticity[J]. Nature, 2013, 501 (7467): 328-337.
16 Chen J, Jin R, Zhao J, et al. Potential molecular, cellular and microenvironmental mechanism of sorafenib resistance in hepatocellular carcinoma[J]. Cancer Lett, 2015, 367 (1): 1-11.
17 Chiba T, Iwama A, Yokosuka O. Cancer stem cells in hepatocellular carcinoma: Therapeutic implications based on stem cell biology[J]. Hepatol Res, 2016, 46 (1): 50-57.
18 Chen WJ, Ho CC, Chang YL, et al. Cancer-associated fibroblasts regulate the plasticity of lung cancer stemness via paracrine signaling[J]. Nat Commun, 2014, 5: 3472.
19 Collura A, Marisa L, Trojan D, et al. Extensive characterization of sphere models established from colorectal cancer cell lines[J]. Cell Mol Life Sci, 2013, 70 (4): 729-742.
20 Fessart D, Begueret H, Delom F. Three-dimensional culture model to distinguish normal from malignant human bronchial epithelial cells[J]. Eur Respir J, 2013, 42 (5): 1345-1356.
21 Watanabe Y, Yoshimura K, Yoshikawa K, et al. A stem cell medium containing neural stimulating factor induces a pancreatic cancer stem-like cell-enriched population[J]. Int J Oncol, 2014, 45 (5): 1857-1866.
22 Cochrane CR, Szczepny A, Watkins DN, et al. Hedgehog Signaling in the Maintenance of Cancer Stem Cells[J]. Cancers (Basel), 2015, 7 (3): 1554-1585.
23 Naka K. TGF-β signaling in cancer stem cells[Article in Japanese][J]. Nihon Rinsho, 2015, 73 (5): 784-789.
(2016-06-06收稿;2016-06-27修回)
Effect of Cancer-associated Fibroblasts on Cancer Stem Cells in Hepatocellular Carcinoma
FENGRenxin,CHENSheng,LIUJiao,NINGBeifang,XIEWeifen.
DepartmentofGastroenterology,ChangzhengHospital,theSecondMilitaryMedicalUniversity,Shanghai(200003)
XIE Weifen, Email: weifenxie@medmail.com.cn
Carcinoma, Hepatocellular; Cancer-Associated Fibroblasts; Neoplastic Stem Cells; Self-Renewal;Spheroids, Cellular
10.3969/j.issn.1008-7125.2016.09.002
国家自然科学基金(81572412)
#本文共同第一作者,冯仁鑫,Email: fengrenxin1989@163.com;陈升,Email: chenshengemc@163.com
&本文通信作者,Email: weifenxie@medmail.com.cn
Background: Cancer-associated fibroblasts (CAF) are a class of specific mesenchymal cells in tumor microenvironment. It has been demonstrated that CAF might regulate the stemness and tumorigenicity of cancer stem cells (CSC) in some malignancies, however, the regulatory effect of CAF on CSC in hepatocellular carcinoma (HCC) is not clear yet. Aims: To explore the effect of CAF on CSC in HCC. Methods: CD44-positive CSC and α-SMA-positive CAF were labeled by immunohistochemistry and immunofluorescence, respectively, for localization of CSC and CAF in human HCC tissue. CAF and peritumoral fibroblasts (PTF) were isolated and purified from HCC surgical specimens, and the respective conditioned medium (CM) and stemness CM were collected. Human HCC cell line HuH-7 was cultured with CAF- or PTF-CM, and the expression of hepatic CSC-related genes in HuH-7 cells was evaluated by real-time PCR. HuH-7 cells positive for EpCAM, a cell surface hepatic CSC marker, were obtained by fluorescence-activated cell sorting, and cultured with CAF- or PTF-stemness CM for spheroid formation. Results: CAF was adjacent to CSC in HCC tissue. When compared with PTF-CM and controlled CM, CAF-CM up-regulated the expression of hepatic CSC surface marker genes and self-renewal-related genes in HuH-7 cells (Pall <0.05). The spheroid formation rates of unsorted HuH-7 cells and EpCAM-positive HuH-7 cells in CAF-stemness CM were significantly higher than those in PTF-stemness CM and controlled stemness CM (19.15%, 32.13%vs. 10.89%, 19.57% and 12.57%, 19.77%,Pall <0.001). Conclusions: CAF play important roles in the maintenance and enhancement of self-renewal capability of hepatic CSC.
