努力提高幽门螺杆菌根除率(二)
2016-11-14刘文忠
刘文忠
上海交通大学医学院附属仁济医院消化内科(200001)
·特约文稿·
努力提高幽门螺杆菌根除率(二)
刘文忠
上海交通大学医学院附属仁济医院消化内科(200001)
幽门螺杆菌; 根除率; 多药耐药相关蛋白质类; 耐药率; 药物敏感试验; 非铋剂四联疗法;
序贯疗法; 伴同疗法; 混合疗法; 铋剂; 铋剂四联疗法; 列线图; 质子泵抑制剂;
CYP2C19基因多态性; 个体化治疗; 补救治疗
第二部分 如何提高幽门螺杆菌耐药菌株根除率
幽门螺杆菌(Hp)对抗菌药物耐药率上升是Hp根除率下降的主要原因。如果Hp对应用的抗菌药物敏感,则目前仍有很多方案的根除率>90%,2周疗程根除率甚至>95%[1],因此需要提高的是Hp耐药菌株感染的根除率。
一、基于药敏试验结果治疗
1. 随着耐药率的上升,药敏试验受到重视:早年,当标准三联方案[质子泵抑制剂(PPI)+克拉霉素+阿莫西林] 7 d疗程Hp根除率>90%时,无学者提出Hp根除治疗需行药敏试验。随着克拉霉素耐药率的上升,标准三联疗法的根除率逐渐下降,推荐的疗程从7 d延长至10 d甚至14 d,但延长疗程的作用有限。为此,《幽门螺杆菌感染处理—Maastricht-4共识报告》提出:如克拉霉素耐药率>15%,则不应使用标准三联方案或使用前应行药敏试验[2]。由此可见,根除Hp是选择经验治疗还是基于药敏试验的治疗主要取决于经验治疗的根除率。经验治疗根除率下降,药敏试验势必受到重视。美国《Helicobacter》杂志主编Graham 教授认为,既然Hp胃炎是一种感染(传染)性疾病,当细菌耐药率上升时,基于药敏试验进行治疗符合感染性疾病处理惯例;目前是否需行药敏试验的争议主要源于实施根除Hp治疗的是消化科医师,而不是感染科医师[1]。
2. 药敏试验难以普遍实施的原因
(1)目前的经验治疗仍可克服耐药:在根除Hp治疗的6种抗菌药物中,阿莫西林、四环素、呋喃唑酮的耐药率仍很低 (<5%),应用前一般不需行药敏试验。甲硝唑的耐药率虽已很高 (>60%),但增加剂量可克服耐药,也有不行药敏试验的理由。真正需行药敏试验的只有克拉霉素和左氧氟沙星,这2种抗菌药物的耐药率达20%~40%,耐药显著降低根除率。克服克拉霉素和左氧氟沙星耐药的策略有2种:①经验治疗方案不选择这2种抗菌药物;②含铋剂的四联方案可在较大程度上克服这2种抗菌药物耐药[3-4]。
(2)药敏试验本身的局限性:药敏试验的可获得性、准确性等问题也是影响其推广的原因。目前第三方检测机构介入,可在很大程度上解决药敏试验的实施问题。但干扰检测结果准确性的因素较多,如约10%~15%的患者是混合菌株感染,即同时有敏感和耐药菌株感染[5];检测本身也存在一定误差。
(3)药敏试验的时机:药敏试验究竟是在初次治疗时实施,还是多次治疗失败后再考虑,目前仍有争议。《幽门螺杆菌感染处理—Maastricht-4共识报告》推荐在2次治疗失败后行药敏试验[2]。但meta分析结果显示,基于药敏试验的二线或三线方案效果并不优于经验治疗[6-7]。基于药敏试验的一线(初次)治疗则优于经验治疗。
(4)国际共识和权威专家的观点和推荐:《多伦多成人根除幽门螺杆菌感染共识》具体列出了根除Hp的一、二、三、四线方案,但未提及药敏试验[8];Graham教授则强调初次治疗时行药敏试验,并提出了一组基于药敏试验的方案[9](图1)。《幽门螺杆菌感染处理—Maastricht-4共识报告》推荐三线方案应基于药敏试验,而Maastricht-5共识报告(尚未发表)推荐的三线方案为基于药敏试验或经验治疗,反而弱化了药敏试验。这3种不同的观点短时间内难以调和,在根除Hp治疗中可根据实际情况和个人经验取舍。
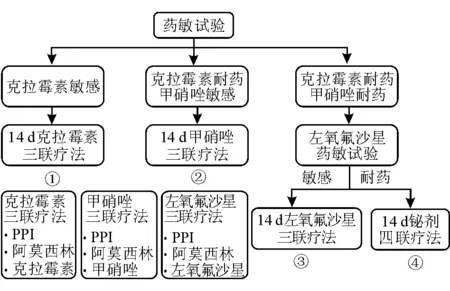
图1 一组建议的基于药敏试验的根除Hp方案
二、重视铋剂四联作为经验治疗方案
本讲座在第一部分中已详细阐述了铋剂四联方案的优点。我国相关研究拓展了经典铋剂四联方案;较大程度上解决了克拉霉素、左氧氟沙星耐药问题;维持了经验治疗相对较高的根除率;这些方案的疗效得到国际同行验证,受到国际共识推荐。因此,如无铋剂禁忌,经验治疗应首选铋剂四联方案。
三、选择高效PPI
多数抗菌药物在酸性环境中难以发挥作用。Hp定植于胃黏膜上皮细胞表面,因此根除Hp抗菌药物的作用受到胃酸的影响。胃酸对抗菌药物活性的影响程度依次为阿莫西林、克拉霉素和左氧氟沙星,对甲硝唑、四环素和呋喃唑酮的影响相对较小。24 h胃内pH>5.0的时间如能维持16 h以上,根除Hp可获得较好疗效。标准剂量PPI(奥美拉唑20 mg、兰索拉唑30 mg、泮托拉唑40 mg、雷贝拉唑10 mg 或20 mg、埃索美拉唑20 mg)bid 服用,约60%~80%的患者可达到这一要求。服用PPI后影响胃内pH值的主要因素包括宿主因素、代谢因素以及用药剂量和方法。
1. 宿主因素
(1)参与炎症反应的白细胞介素-1β(inter-leukin-1β, IL-1β)基因多态性:Hp感染后不同个体的胃酸水平不一,这主要受宿主IL-1β基因多态性影响。IL-1β -511位点有C/C、C/T和T/T三种基因型,Hp感染后T/T型携带者胃黏膜产生的IL-1β水平最高,后者有强烈抑制胃酸的作用,故胃内pH值最高,C/C型携带者pH值最低,C/T型携带者介于两者之间[10]。使用相同的根除治疗方案,T/T型携带者的疗效最好[11]。
(2)参与PPI代谢的细胞色素P450酶 (CYP) 2C19(CYP2C19)基因多态性:CYP2C19基因多态性有三种类型,分别为纯合子快代谢型(homozygous extensive metabolizer, Hom EM)、慢代谢型(poor metabolizer, PM)和杂合子中速代谢型(heterozygous extensive metabolizer, Het EM)。快代谢型者PPI代谢快,服用PPI后药物相应血药浓度低,抑制胃酸分泌作用弱,胃内pH值低;慢代谢型者则相反;中速代谢型者介于两者之间。亚洲人群中约30%~40%的个体属于快代谢型,而白人中快代谢型者约占70%。使用相同的根除治疗方案,快代谢型者的疗效可能会低于慢代谢型或中速代谢型者[12]。
(3)吸烟:吸烟者胃酸分泌水平往往较高,从而影响PPI的抑酸效果[1]。
2. PPI代谢因素:虽然所有PPI的代谢过程均有CYP2C19参与,但依赖程度有所不同。埃索美拉唑和雷贝拉唑属于第二代PPI,与第一代PPI相比较少依赖CYP2C19途径代谢。埃索美拉唑是左旋奥美拉唑(奥美拉唑由左旋和右旋奥美拉唑组成),与右旋奥美拉唑相比较少依赖CYP2C19途径代谢;雷贝拉唑存在非酶代谢途径,亦较少依赖CYP2C19途径代谢[12]。在根除Hp治疗中,选择第二代PPI可获得更好的疗效[13]。
3. PPI剂量、给药时间和次数:虽然一般推荐的埃索美拉唑标准剂量为20 mg bid,但在不少临床试验中用量达到40 mg bid,疗效也有不同程度的提高[14]。雷贝拉唑的情况与之相同。一般推荐餐前30 min服用PPI。有研究[15]显示,雷贝拉唑每日40 mg,一次性给予和分2次或4次给予,抑制胃酸的效果有所不同。10 mg qid给药可消除CYP2C19基因多态性的影响,40 mg每日1次和20 mg bid则不能。
四、尽可能延长疗程至14 d
多数经验治疗研究结果显示,相同根除治疗方案,10 d疗程的根除率往往低于14 d疗程,或10 d疗程的根除率<85%。为此《多伦多成人根除幽门螺杆菌感染共识》推荐的经验治疗方案疗程均为14 d[8]。Maastricht-5共识报告则强调,根除疗程应延长至14 d,除非当地已证实10 d疗程有效。尽管Graham教授提出的基于药敏试验结果的治疗方案疗程均为14 d(根除率>95%)[9],是否可在根除率>90%的情况下将疗程缩短至10 d,值得进一步研究。
五、PPI+阿莫西林二联疗法的再评估
早年研究显示,在阿莫西林剂量不变的情况下,Hp根除率随PPI抑酸强度的增加而上升。迄今为止,阿莫西林的耐药率仍然很低,多数研究中为0~2%,耐药率几乎可忽略不计。随着Hp对其他抗菌药物耐药率的增加,这一方案受到不同程度的重视。由于欧美国家人群中PPI快代谢型个体占比较高,这一方案疗效不够高而未被推荐[2]。日本则将PPI+阿莫西林二联疗法作为三线方案推荐[16]。有学者提出,如能维持胃内pH>6.0,阿莫西林qid给药,则这一方案的根除率可>90%[1]。但常规剂量PPI难以维持胃内pH>6.0,需超常规剂量用药。我国台湾地区开展了一项较大样本的研究[17],雷贝拉唑20 mg qid+阿莫西林750 mg qid,疗程14 d,按意向治疗分析(ITT分析)根除率初次治疗为95.3%,补救治疗为89.3%。
六、其他策略
1. 益生菌的应用:抗Hp治疗联合益生菌有可能减轻抗菌药物的胃肠道不良反应,但是否可提高根除率,目前仍有争议。部分益生菌可通过产生某些抗Hp物质、抑制Hp定植、增强胃黏膜屏障功能及其免疫调节作用发挥抗Hp作用[18]。但《多伦多成人根除幽门螺杆菌感染共识》中明确提出,对Hp感染者,不推荐在根除治疗中出于减轻不良反应或出于提高根除率的目的而常规加用益生菌[8]。纳入安慰剂对照研究的meta分析结果显示,补充益生菌不能增加标准根除治疗方案的Hp根除率[19]。Maastricht-5共识报告则提出,某些益生菌可能对Hp的根除产生有益影响。
2. 新型抑制酸分泌药物的应用:沃诺拉赞(vonoprazan)是一种钾竞争性酸阻滞剂,可选择性与钾竞争结合至胃H+-K+-ATP酶,此结合可逆,平均清除半衰期为7.7 h。沃诺拉赞抑制胃酸分泌的作用强于目前应用的所有PPI,每日使用40 mg,24 h胃内pH>5.0的时间可维持在80%以上[20]。Ⅲ期临床试验结果显示,以沃诺拉赞取代标准三联方案中的PPI,在初次治疗中疗效显著高于标准三联方案(92.6%对75.9%),在补救治疗中也可获得很高的根除率[21]。
(未完待续)
1 Graham DY, Dore MP.Helicobacterpyloritherapy: a paradigm shift[J]. Expert Rev Anti Infect Ther, 2016, 14 (6): 577-585.
2 Malfertheiner P, Megraud F, O’Morain CA, et al; European Helicobacter Study Group. Management ofHelicobacterpyloriinfection -- the Maastricht Ⅳ/Florence Consensus Report[J]. Gut, 2012, 61 (5): 646-664.
3 Sun Q, Liang X, Zheng Q, et al. High efficacy of 14-day triple therapy-based, bismuth-containing quadruple therapy for initialHelicobacterpylorieradication[J]. Helicobacter, 2010, 15 (3): 233-238.
4 Liao J, Zheng Q, Liang X, et al. Effect of fluoroquinolone resistance on 14-day levofloxacin triple and triple plus bismuth quadruple therapy[J]. Helicobacter, 2013, 18 (5): 373-377.
5 Selgrad M, Tammer I, Langner C, et al. Different antibiotic susceptibility between antrum and corpus of the stomach, a possible reason for treatment failure ofHelicobacterpyloriinfection[J]. World J Gastroenterol, 2014, 20 (43): 16245-16251.
6 López-Góngora S, Puig I, Calvet X, et al. Systematic review and meta-analysis: susceptibility-guided versus empirical antibiotic treatment forHelicobacterpyloriinfection[J]. J Antimicrob Chemother, 2015, 70 (9): 2447-2455.
7 Chen H, Dang Y, Zhou X, et al. Tailored Therapy Versus Empiric Chosen Treatment forHelicobacterpyloriEradication: A Meta-Analysis[J]. Medicine (Baltimore), 2016, 95 (7): e2750.
8 Fallone CA, Chiba N, van Zanten SV, et al. The Toronto Consensus for the Treatment ofHelicobacterpyloriInfection in Adults[J]. Gastroenterology, 2016, 151 (1): 51-69.
9 Graham DY, Laine L. The TorontoHelicobacterpyloriConsensus in Context[J]. Gastroenterology, 2016, 151 (1): 9-12.
10 Furuta T, El-Omar EM, Xiao F, et al. Interleukin 1beta polymorphisms increase risk of hypochlorhydria and atrophic gastritis and reduce risk of duodenal ulcer recurrence in Japan[J]. Gastroenterology, 2002, 123 (1): 92-105.
11 Furuta T, Shirai N, Xiao F, et al. Polymorphism of interleukin-1beta affects the eradication rates ofHelicobacterpyloriby triple therapy[J]. Clin Gastroenterol Hepatol, 2004, 2 (1): 22-30.
12 Kuo CH, Lu CY, Shih HY, et al. CYP2C19 polymorphism influencesHelicobacterpylorieradication[J]. World J Gastroenterol, 2014, 20 (43): 16029-16036.
13 McNicholl AG, Linares PM, Nyssen OP, et al. Meta-analysis: esomeprazole or rabeprazolevs. first-generation pump inhibitors in the treatment ofHelicobacterpyloriinfection[J]. Aliment Pharmacol Ther, 2012, 36 (5): 414-425.
14 Anagnostopoulos GK, Tsiakos S, Margantinis G, et al. Esomeprazole versus omeprazole for the eradication ofHelicobacterpyloriinfection: results of a randomized controlled study[J]. J Clin Gastroenterol, 2004, 38 (6): 503-506.
15 Sugimoto M, Shirai N, Nishino M, et al. Rabeprazole 10 mg q.d.s. decreases 24-h intragastric acidity significantly more than rabeprazole 20 mg b.d. or 40 mg o.m., overcoming CYP2C19 genotype[J]. Aliment Pharmacol Ther, 2012, 36 (7): 627-634.
16 Asaka M, Kato M, Takahashi S, et al; Japanese Society forHelicobacterResearch. Guidelines for the management ofHelicobacterpyloriinfection in Japan: 2009 revised edition[J]. Helicobacter, 2010, 15 (1): 1-20.
17 Yang JC, Lin CJ, Wang HL, et al. High-dose dual therapy is superior to standard first-line or rescue therapy forHelicobacterpyloriinfection[J]. Clin Gastroenterol Hepatol, 2015, 13 (5): 895-905.
18 Homan M, Orel R. Are probiotics useful inHelicobacterpylorieradication? [J]. World J Gastroenterol, 2015, 21 (37): 10644-10653.
19 Lu C, Sang J, He H, et al. Probiotic supplementation does not improve eradication rate ofHelicobacterpyloriinfection compared to placebo based on standard therapy: a meta-analysis[J]. Sci Rep, 2016, 6: 23522.
20 Jenkins H, Sakurai Y, Nishimura A, et al. Randomised clinical trial: safety, tolerability, pharmacokinetics and pharmacodynamics of repeated doses of TAK-438 (vonoprazan), a novel potassium-competitive acid blocker, in healthy male subjects[J]. Aliment Pharmacol Ther, 2015, 41 (7): 636-648.
21 Murakami K, Sakurai Y, Shiino M, et al. Vonoprazan, a novel potassium-competitive acid blocker, as a component of first-line and second-line triple therapy forHelicobacterpylorieradication: a phase Ⅲ, randomised, double-blind study[J]. Gut, 2016, 65 (9): 1439-1446.
(2016-09-12收稿)
Strive to Improve the Eradication Rate ofHelicobacterpylori: Part Ⅱ
LIUWenzhong.
DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200001)
Helicobacterpylori; Eradication Rate; Multidrug Resistance-Associated Proteins; Resistance Rate;Drug Susceptibility Testing; Non-Bismuth Quadruple Therapy; Sequential Therapy; Concomitant Therapy;Hybrid Therapy; Bismuth; Bismuth Quadruple Therapy; Nomogram; Proton Pump Inhibitor;CYP2C19 Genotypic Polymorphism; Tailored Therapy; Rescue Therapy
10.3969/j.issn.1008-7125.2016.09.001
