混酸掺杂聚吡咯/凹凸棒石复合材料对甲基橙的吸附性能*
2016-11-14王时雨康桂英
陈 泳,王时雨,康桂英
(兰州理工大学 石油化工学院,兰州 730050)
混酸掺杂聚吡咯/凹凸棒石复合材料对甲基橙的吸附性能*
陈 泳,王时雨,康桂英
(兰州理工大学 石油化工学院,兰州 730050)
采用原位聚合法合成了盐酸(HCl)与对甲苯磺酸(TSA)共掺杂的聚吡咯/凹凸棒石(PPy/ATP)复合材料。采用扫描电子显微镜(SEM)、傅里叶变换红外光谱(FT-IR)对复合材料的结构进行表征,发现聚吡咯微球包覆在凹凸棒石的外面,形成了粗糙的表面,其红外谱图与聚吡咯的基本一致,只是强度略有变化。考察了吸附时间、吸附剂用量、pH值和溶液初始浓度对复合材料吸附甲基橙的影响,结果表明,在45 ℃,溶液初始浓度为35 mg/L,pH值=7,反应时间为4 h,0.02 g的复合材料对甲基橙的吸附效果最好;吸附过程符合准二级动力学方程和Langmuir吸附等温式,最大吸附量为143.07 mg/g。
聚吡咯;凹凸棒;甲基橙;吸附
0 引 言
近年来,工业技术迅猛发展,纺织印染行业每年排放大量废水,我们赖以生存的水资源受到不同程度的污染。染料废水具有难降解、有机污染物含量高、色泽深、碱性大、水质成分复杂、毒性大等特点,成为难降解的工业废水之一[1]。其中甲基橙(MO)这种较难降解的有色化合物,在酸性和碱性条件下的偶氮和醌式结构是染料化合物的主体结构,选择其作为染料模型化合物,具有一定的代表性[2]。目前,国内外处理印染废水的主要方法有混凝沉降法[3]、电化学法[4]、光催化法[5]、臭氧氧化法[6]、固体吸附法[7]等。其中,光催化降解法是近年来被看好和研究较多的处理技术[8-10],但这一技术设备复杂,成本较高。固体吸附法投资少,处理周期短,吸附过程可以保留染料的结构,备受人们的关注。
聚吡咯(PPy)是一种典型的具有共轭π键结构的导电高分子材料。目前,国内外对聚吡咯和掺杂态聚吡咯的合成、结构和性能的研究较多,主要集中在电化学性能的研究[11],而吸附方面的应用关注较少。导电聚吡咯在聚合掺杂过程中携带一定电荷,为了达到电中性需要相应的补偿离子,因而对溶液中的一些带电离子有一定的吸附作用,这为导电聚吡咯在吸附领域的应用提供了条件[12]。
凹凸棒石(ATP)是一种链层状结构的含水镁铝硅酸盐矿物。其内部有许多大小不一的开放性孔道,使其具有很大的比表面积(内表面积可高达300~400 m2/g);凹凸棒石独特的晶体结构,使其具有较强的吸附能力和离子交换能力,因此,用于处理工业废水。同时,凹凸棒石化学性质稳定、原材料丰富、成本低廉、具有较弱的棒晶间相互作用,是制备高性能聚合物复合材料的理想增强体[13-14]。
本文采用原位聚合法制备了盐酸(HCl)和对甲苯磺酸(TSA)共掺杂的聚吡咯/凹凸棒石复合材料(PPy/ATP),研究其对溶液中甲基橙的去除效果,并考察了吸附热力学和动力学特性。
1 实 验
1.1 仪器和试剂
JSM-6701F扫描电镜(日本电子光学公司);NEXQS670傅里叶变换红外光谱仪(美国Nicolet公司);7230G分光光度计(上海精密科学仪器有限公司);PHS-3D型pH计(上海精密科学仪器有限公司)。
吡咯(C4H5N):化学纯,上海中秦化学试剂有限公司,重新蒸馏后使用;JC-J503 ATP(99%纯土,江苏玖川纳米科技有限公司);对甲苯磺酸(AR,天津市凯信化学工业有限公司);氢氧化钠(AR,天津市化学试剂六厂三分厂);盐酸(AR,白银市化学试剂厂);过硫酸铵(AR,天津市化学试剂三厂);甲基橙(AR天津市化学试剂一厂)。
1.2 复合材料的制备
先将80 mL摩尔比为1∶1的TSA和HCl混合酸溶液,倒入三口瓶中,然后将1.0 g ATP和1 mL新蒸的吡咯加入搅拌均匀,将3.0 g过硫酸铵溶于20 mL去离子水,室温下用恒压漏斗将过硫酸铵溶液缓慢滴加到三口烧瓶中进行原位聚合,不断搅拌,反应4 h后,抽滤并用无水乙醇和大量蒸馏水洗涤数次,得到滤饼。将滤饼在 60 ℃烘干,经粉碎后即得到黑色纳米复合材料。(标记为掺杂HCl+TSA的PPy/ATP)
在上述制备过程中不使用混酸溶液,其它步骤完全一致即可得到纯的PPy/ATP复合材料。单酸掺杂的材料在制备中只是先加入HCl或TSA,其它仍采用混酸掺杂的步骤。(所得产物分别标记为掺杂HCl的PPy/ATP,掺杂TSA的PPy/ATP)
1.3 吸附实验
于250 mL烧杯中加入一定量复合材料吸附100 mL配置好的甲基橙溶液,磁力搅拌吸附一定时间后过滤取滤液,用分光光度法测定甲基橙含量。根据吸附公式计算
(1)
(2)
式中,qt为t时刻甲基橙的量,mg/g;C0为甲基橙溶液初始浓度,mg/L;Ct为t时刻甲基橙溶液的浓度,mg/L;V为溶液的体积,L;m为吸附剂的质量,g。
当吸附达平衡时,Ct等于平衡浓度Ce,qt等于平衡吸附容量qe。
2 结果与讨论
2.1 不同材料的吸附效果
在初始浓度为20 mg/L、吸附剂用量为0.02 g、吸附时间为4 h和吸附温度为288 K的条件下,考察不同吸附材料:ATP、PPy/ATP、掺杂HCl的PPy/ATP、掺杂TSA的PPy/ATP、HCl和TSA混掺杂的PPy/ATP对甲基橙的吸附效果。如表1所示,ATP对甲基橙的吸附容量很低,只有12.64 mg/g,与PPy复合后吸附容量明显增加,掺杂酸后又进一步提高,当将HCl和TSA混合掺入时,吸附容量达到95.23 mg/g,相当于纯ATP对甲基橙吸附容量的8倍。

表1 不同材料对甲基橙吸附效果
这可能是因为甲基橙(对二甲基氨基偶氮苯磺酸钠)在溶液中是以阴离子形式存在的,天然的ATP矿物表面晶体边缘带正电荷,阴离子基团可以通过静电引力吸附在ATP的边面上,但天然的ATP表面电荷少,因此对甲基橙的吸附容量很低。吡咯由于聚合中亚氨基带有正电荷,故而能够与凹凸棒复合后进一步提高了对阴离子甲基橙的吸附效果。当复合材料在酸性条件下制备时,溶液中大量带正电荷的H+转移到聚吡咯分子链上,使聚合物上的碳原子质子化,并伴随溶液中对阴离子的掺杂,使复合材料的活性位点进一步增加,因而吸附容量随之提高。
2.2 材料的结构与表征
2.2.1 SEM分析
图1分别是纯ATP和PPy/ATP纳米复合材料的扫描电镜图。从图1(a)可以看到ATP分散性良好,表面呈光滑整齐的棒状结构。从图1(b)可以明显看到ATP表面完全被颗粒状的PPy包覆着,表面比较粗糙。

图1 纯ATP和PPy/ATP复合材料的SEM图
2.2.2 红外光谱分析
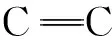
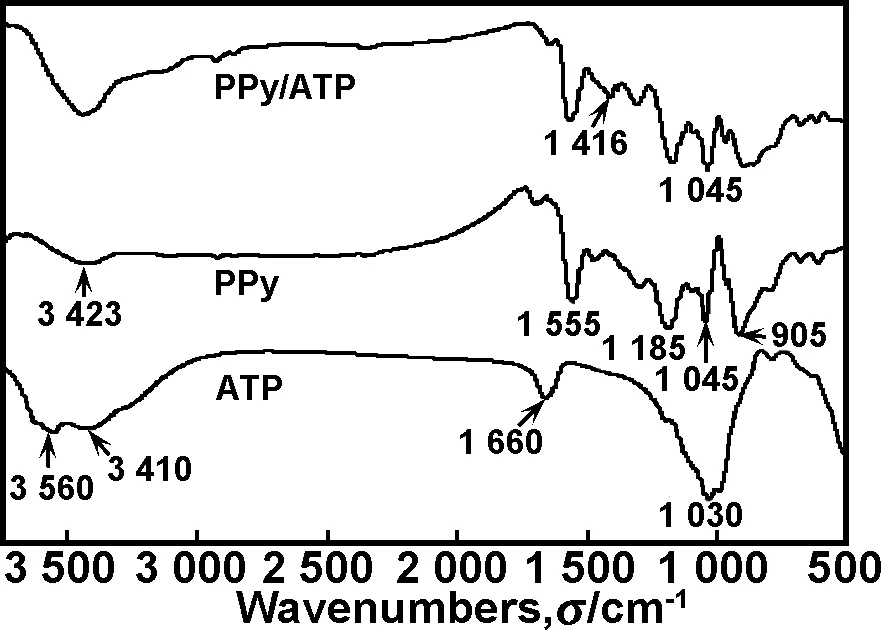
图2 ATP,PPy和PPy/ATP的红外谱图
2.3 影响复合材料吸附性能的因素
2.3.1 吸附时间对甲基橙吸附效果的影响
在不调节pH值、吸附剂用量为0.02 g、甲基橙溶液浓度为20 mg/L和吸附温度为288 K的条件下,考察吸附时间对甲基橙吸附性能的影响。如图3所示,开始,随着吸附时间的不断延长,溶液中的甲基橙分子与吸附剂PPy/ATP有效接触时间增加,故吸附容量不断增大,在240 min时可达到最大95.23 mg/g,随着时间继续延长,PPy/ATP表面的活性位点逐渐饱和,吸附容量不再随着时间的延长而增大,逐渐趋于平衡。最后确定240 min(4 h)为甲基橙的有效吸附时间。
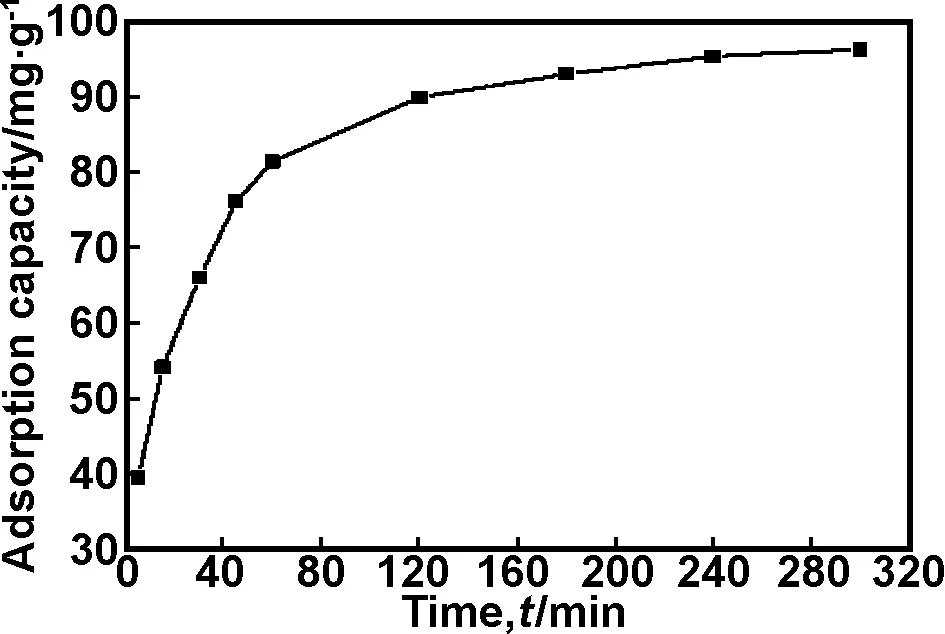
图3 吸附时间对甲基橙吸附效果的影响
2.3.2 吸附剂投入量对甲基橙吸附效果的影响
在不调节pH值、甲基橙溶液浓度为20 mg/L、吸附时间为4 h和吸附温度为288 K的条件下,考察吸附剂投入量对甲基橙吸附性能的影响。如图4所示,当吸附剂用量小于0.024 g时,随着吸附剂用量的增加,甲基橙的吸附率也随之提高,当吸附剂用量大于0.024 g时,甲基橙的吸附率变化很小,达到最大99.53%,几乎为100%。而吸附容量随着吸附剂用量的增加逐渐下降,0.032 g吸附剂的吸附容量只有62.21 mg/g。当吸附剂用量为0.02 g时,甲基橙的吸附率为95.23%,吸附容量也高达95.23 mg/g。
2.3.3 溶液pH值对甲基橙吸附效果的影响
在吸附剂用量为0.02 g、吸附时间为4 h、甲基橙溶液浓度为20 mg/L和吸附温度为288 K的条件下,考察溶液pH值对甲基橙吸附性能的影响。利用浓度为0.5 mol/L盐酸溶液和浓度为0.5 mol/L氢氧化钠溶液调节甲基橙溶液的pH值。从图5可以看出,溶液的酸碱环境对复合材料吸附甲基橙的影响很大,甲基橙在pH值为2~8之间吸附效果良好,最佳吸附的pH值为7,在酸性条件下,复合材料中聚吡咯上的氨基发生质子化后含有大量荷正电基团,可与甲基橙骨架中N原子形成氢键,并与甲基橙中的—SO3-存在静电吸引作用,有利于甲基橙的吸附[15-16];在pH值为9~12之间时,溶液中存在大量的阴离子—OH与甲基橙中的磺酸根存在竞争吸附,不利于溶液中甲基橙的吸附,故碱性越强,吸附效果越差。
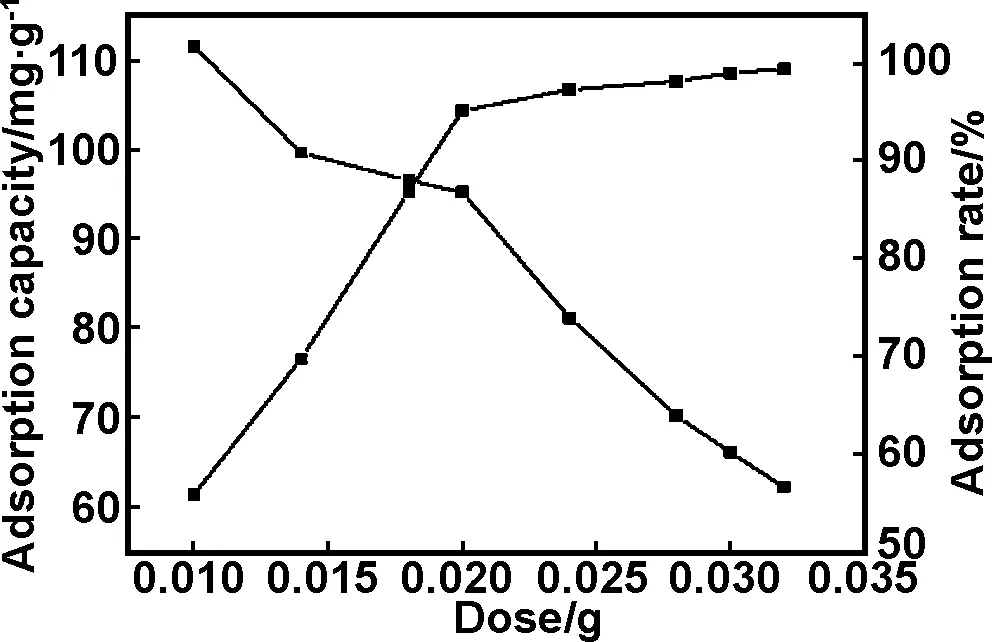
图4 吸附剂用量对甲基橙吸附效果的影响

图5 pH对甲基橙吸附效果的影响
2.3.4 溶液初始浓度对甲基橙吸附效果的影响
在不调节pH值、吸附剂用量为0.02 g、吸附时间为4 h、吸附温度为288 K的条件下,考察甲基橙溶液的初始浓度对吸附效果的影响。如图6所示, 随着甲基橙浓度的增加,吸附容量也逐渐增大,当甲基橙溶液的初始浓度为35 mg/L时,吸附容量达到110.98 mg/g,之后随着甲基橙浓度增加吸附容量却迅速降低。
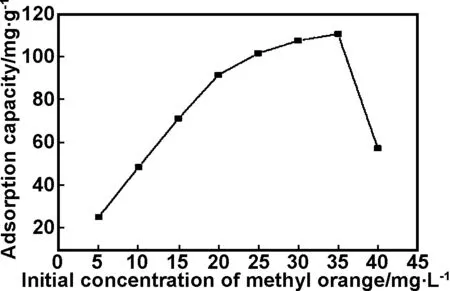
图6 溶液初始浓度对甲基橙吸附性能的影响
这是因为当吸附剂PPy/ATP用量恒定时,由于PPy/ATP内外浓度差的驱使,随着溶液中甲基橙浓度的增大,甲基橙分子扩散更加剧烈,使得更多的甲基橙分子能和PPy/ATP接触,从而导致吸附容量的不断增加[17]。当甲基橙浓度增加到一定程度后,纳米复合材料PPy/ATP吸附逐渐达到饱和,吸附能力下降,吸附容量随之降低。
2.4 等温吸附模型
分别取一系列100 mL不同初始浓度的甲基橙溶液(10~35 mg/L),不调节pH值,加入0.02 g复合材料分别在288,298,308和318 K下搅拌吸附4 h后过滤,测定出吸附后甲基橙平衡浓度和吸附量之间的关系,如图7所示。
采用 Langmuir 等温方程(3)和 Freundlich 等温方程(4)对图7实验数据进行回归处理。
(3)
(4)
式中,qe为平衡时的吸附容量,mg/g;Ce为吸附平衡时溶液质量浓度,mg/L;qm为最大吸附容量,mg/g;b为吸附速率常数;K和n是特征常数。
将等温吸附实验数据分别按Langmuir和Freundlich等温方程进行拟合,结果如表2所示,Langmuir方程R2均大于0.99,说明纳米复合材料对甲基橙的吸附更符合Langmuir 等温吸附,其吸附属于单分子层吸附。单层饱和吸附量qmax随着温度的升高,逐渐增大,理论吸附量由114.42 mg/g变为144.93 mg/g,表明吸附过程可能是吸热的,升温有利于吸附。
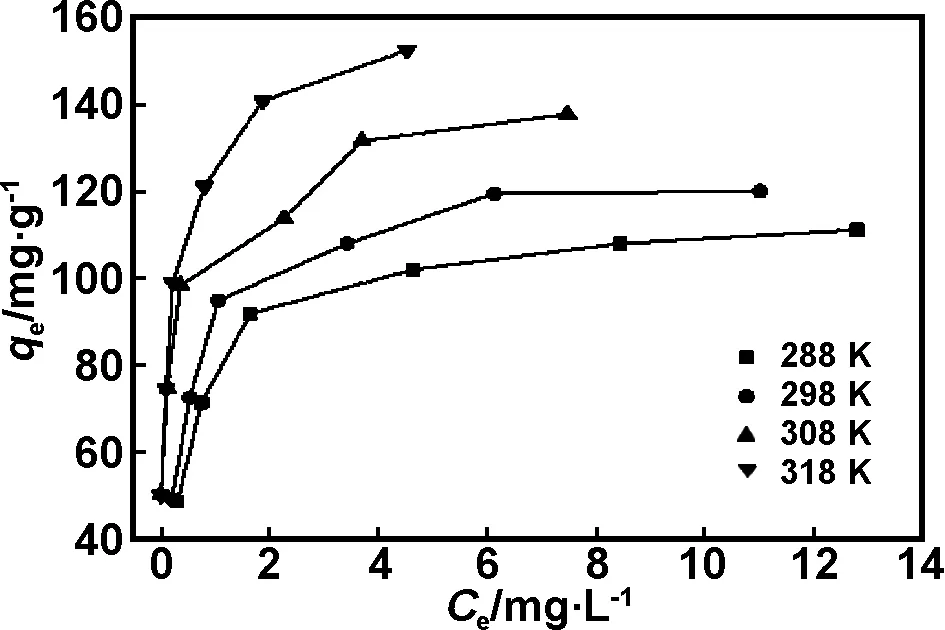
图7 甲基橙在PPy/ATP上的吸附等温曲线
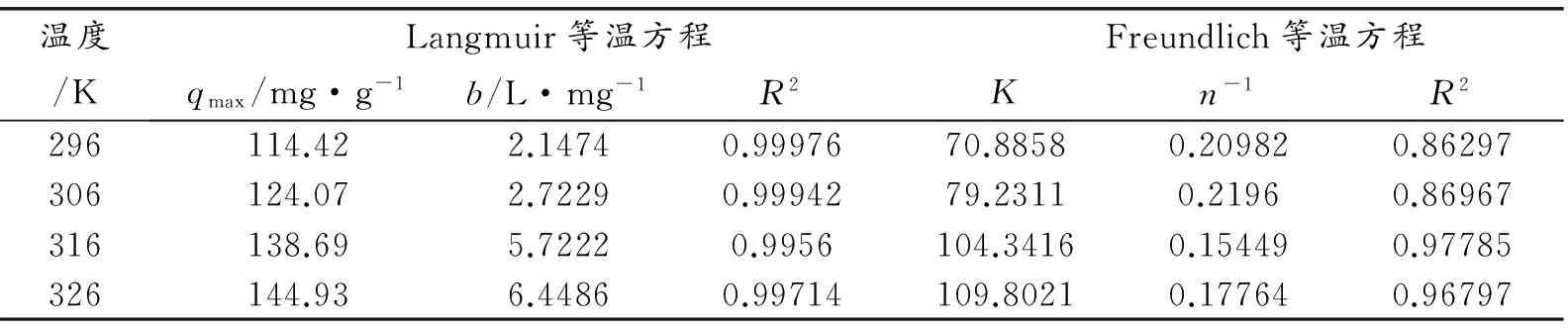
表2 吸附等温式模型参数和相关系数
2.5 吸附动力学
取100 mL浓度分别为10,15和20 mg/L的甲基橙溶液,不调节pH值,加入0.02 g复合材料在288 K下,搅拌时间为(5~300) min,考察了纳米复合材料对甲基橙的吸附动力学曲线,如图8所示。
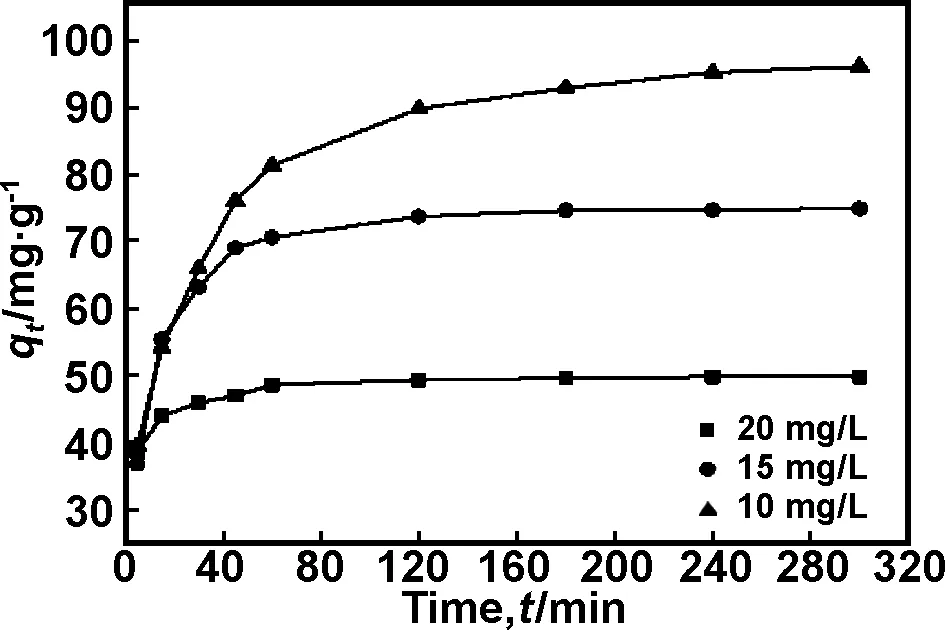
图8 甲基橙在PPy/ATP上的吸附力学曲线
分别采用准一级动力学方程(5)、修正准一级动力学方程(6)、准二级动力学方程(7)和速率扩散方程(8)对数据进行拟合,计算出相应的速率常数。
ln(qe-qt)=lnqe-k1t
(5)
(6)
(7)
(8)
式中,qt为t时的吸附容量,mg/g;qe为吸附平衡时的吸附容量,mg/g;k1为一级反应速率常数,min-1;K1为为修正一级反应速率常数,min-1;k2为二级反应速率常数,g/mg·min-1;kp为速率常数,mg/(g·s)。
表3为不同动力学方程对吸附过程拟合结果,由表3可知,准二级动力学方程R2>0.999。说明复合材料对甲基橙的吸附更符合准二级动力学模型,准二级模型是基于假定吸附速率受化学吸附机理的控制,因此,甲基橙的吸附反应过程属于化学吸附反应过程。

表3 吸附动力学模型参数和相关系数
3 结 论
本文以盐酸和对甲苯磺酸作为掺杂剂,用原位聚合法合成掺杂态的PPy/ATP纳米复合材料,并分析了纳米复合材料的微观形貌和红外光谱特性。然后对甲基橙进行吸附实验探究,结果表明,纳米复合材料对甲基橙的吸附基本符合Langmuir等温吸附方程和二级动力学方程式,随着温度升高吸附量增加,单分子层最大吸附量为143.07 mg/g。
[1] Sakkayawong N, Thiravetyan P, Nakbanpote W. Adsorption mechanism of synthetic reactive dye wastwater by chitosan[J]. Journal of Colloid and Interface Science, 2005, 286(1): 36-42.
[2] Wang Xin,Zhang Chunli,Ren Guangjun,et al. Study on the adsorption of methyl orange from aqueous solution by carbon nanotubes[J]. Contemporary Chemical Industry, 2008, 37(4): 375-381.
王 昕,张春丽,任广军,等. 碳纳米管吸附染料甲基橙的性能研究[J]. 当代化工,2008, 37(4): 375-381.
[3] Aksu Z. Biosorption of reaetive dyes by dried aetivated sludge, equilibrium and kinetie modeling[J]. Bioehemieal Engineering Journal, 2001, 7(l): 79-84.
[4] Zhang Yufeng,Teng Jie,Zhang Xueying,et al. Progress of the researches on dyeing wastewater treatment techniques[J]. Industrial Water Treatment, 2003, 23(4): 23-27.
张宇峰,滕 洁,张雪英,等. 印染废水处理技术的研究进展[J]. 工业水处理,2003, 23(4): 23-27.
[5] Pala A, Tokat E. Color removel from cotton textile industry wasterwater in an activated sludge system with various additives[J]. Water Research, 2002, 36(11): 2920-2925.
[6] Uygur A, Kök E. Decoloisation treatments of azo dyes waste waters including dichlorotriazinyl reactive groups by using advanced oxidation method[J]. Society of Dyers and Colourists, 1999, 115(11): 350-354.
[7] Zhao Z Q,Chen X,Yang Q,et al. Selective adsorption toward toxic metal ions results in selective response: electrochemical studies on a polupyrrole/reduced graphene oxide nanocomposite[J]. Chem Commun, 2012,(48): 2180-2182.
[8] Liu Yue’e,Pang Guilin,Zhen Weijun,et al. Study on TiO2/bentonite catalyst to treat industrial wastewater[J]. Journel of Matal Mine, 2009, 11: 157-161.
刘月娥,庞桂林,甑卫军,等. TiO2/膨润土催化降解工业废水研究[J]. 金属矿山,2009, 11:157-161.
[9] Silvalingam G, Nagaveni K, Hegade M S, et al. Photocatalytic degradation of various dyes by co-mbustion synthesized nano anatase TiO2[J]. Applied Catalysis B:Environmental, 2003, 45(1): 23- 28.
[10] Fan Shanhu,Sun Zhenfan,Wu Quanzhou,et al. Adsorption and photocatalytic kinetics of azo dyes[J]. Acta Physico-Chimica Sinica, 2003, 19(1): 25-29.
范山湖,孙振范,邬泉周,等. 偶氮染料吸附和光催化氧化动力学[J]. 物理化学学报,2003, 19(1): 25-29.
[11] Ding Wenyan,Li Dan,Wang Xin,et al. Study of the deposition of polypyrrole on self-assembled polyelectrolyte layers[J]. Journal of Functional Materials, 2002, 33(4): 437-439.
丁文艳,李 丹,汪 信,等. 聚电解质组装膜对聚吡咯原位沉积的影响[J]. 功能材料,2002, 33(4): 437-439.
[12] Li J J, Feng J T, Yan W. Synthesis of polypyrrole-modified TiO2composite adsorbent and its ads adsorption performance on acid Red G[J]. Journal of Applied Polymer Science, 2013, 128(5): 3231-3239.
[13] Li Y F. Conducting polymers[J]. Progress In Chemistry, 2002, 14(3): 207-211.
[14] Liu P, Wang T M. Adsorption properties of hyperbranched aliphatic polyester grafted attapulgite towards heavy metal ions [J]. J Hazard Mater, 2007, 149(1): 75-79.
[15] Steen S, Lasse B, Kamal V, et al. Simultaneous anion and cation mobility in polypyrrole[J]. Solid State Ionics, 2003, 1599(1/2): 143-147.
[16] Li Y F, He G F. Effect of preparation conditions on the two dopingstructures of polypyrrole[J]. Synthetic Metals, 1998, 94(1): 127-129.
[17] Yang Bingchao,Liu Qian,Huo Jie,et al. Adsorption of methyl orange from aqueous solutions onto protonated cross-linked chitosan[J]. Journal of Functional Materials, 2013, 44(3): 376-379.
杨炳超,刘 倩,霍 杰,等. 质子化交联壳聚糖对甲基橙的吸附研究[J]. 功能材料,2013,44(3): 376-379.
Removal of methyl orange using polypyrrple/attapulgite composites doped with mixed acids
CHEN Yong, WANG Shiyu, KANG Guiying
(College of Petrochemical Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
Doped with hydrochloric acid and p-toluenesulfonic acid PPy/ATP composites were prepar-ed by situ polymerization method.The structure of the composites was studied and characterized by Scanning electron microscopy (SEM) and Fourier transform infrared (FT-IR). The results indicated that the surface of ATP was covered with PPy microsphere to form a rough surface and the spectrum of PPy/ATP composites is consistent with PPy except for the intensity of some peaks. The effect of adsorption time, adsorbent dosage, pH and initial concentration was investigated. The optimum conditions were found to be: an initial concentration of 35 mg/L, contact time of 4 h, pH and temperature of 7 and 45 ℃ respectively. The experimental data fited well with the pseudo-second-order kinetic model and Langmuir equation, and the maximum adsorption capacity reached up to 143.07 mg/g.
polypyrrple; attapulgite; adsorption; methyl orange
1001-9731(2016)10-10198-05
甘肃省青年科技基金计划资助项目(1208RJYA086)
2015-08-18
2015-10-27 通讯作者:陈 泳,E-mail: chenylut@126.com
陈 泳 (1977-),女,兰州人,副教授,主要从事有机无机复合材料研究。
TB332
A
10.3969/j.issn.1001-9731.2016.10.037
