焦化废水处理过程中盐分变化及其影响因素
2016-11-12李湘溪吴超飞吴海珍胡成生韦朝海
李湘溪,吴超飞,2,吴海珍,胡成生,韦朝海,2
(1华南理工大学环境与能源学院,广东 广州 510006;2工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006;3华南理工大学生物科学与工程学院,广东 广州 510006;4广州市市政工程维修处,广东广州 510100)
焦化废水处理过程中盐分变化及其影响因素
李湘溪1,吴超飞1,2,吴海珍3,胡成生4,韦朝海1,2
(1华南理工大学环境与能源学院,广东 广州 510006;2工业聚集区污染控制与生态修复教育部重点实验室,广东 广州 510006;3华南理工大学生物科学与工程学院,广东 广州 510006;4广州市市政工程维修处,广东广州 510100)
基于优化工艺单元参数实现原位盐分削减的构思,以广东韶关钢铁厂一期和二期焦化废水处理工程为例,用电导率表征废水中盐分的含量,通过水质和运行参数、投加药剂的种类和浓度讨论工程工艺各单元的电导率变化规律,分析影响盐分变化的因素,再分别从生物降解实验、药剂用量实验、混凝条件实验深入分析生化过程及物化过程水样、泥样中的主要阴离子浓度变化及其对盐分归趋的主要作用途径。研究发现:焦化废水的生化处理工艺与物化处理优化的工艺均能实现盐分浓度的部分削减,过程中,盐分的主要来源是有机物的矿化以及生化过程磷盐和碱的投加所致,此外还有物化过程混凝剂阴离子的引入,盐分的削减包括生化工艺废水中表现为盐分的N、S元素及强电解质C6H5O-转化为非电解质N2、H2S、CH4、CO2和H2O以及物化工艺以Fe2+与废水中CN-、S2-、SCN-、OH-、CO32-结合为弱电解质或难溶性盐的混凝沉淀、络合沉淀共同作用的结果,两方面比较,来源量小于削减量,导致废水电导率下降;生化过程之前的有机物特别是难降解有机物的预分离,物化过程的投药量、投药顺序和pH控制的优化均有利于盐分在废水处理工艺中的原位削减。上述结果表明了基于某一性质的焦化废水其工艺原理选择、反应原理与条件优化控制成为了影响水处理过程中盐分变化的重要因素,原位削减盐分对于废水零排放具有重要工程学指导意义。
焦化;盐分削减;电导率;混凝;生物降解;优化
我国每年大约产生4.7×108m3的焦化废水,由此带来了严峻的环境问题[1]。作为煤化工废水的典型代表,焦化废水总体表现为高浓度/盐分、高污染(组分多)、有毒/难降解、富氮缺磷等的水质特征[2-3]。焦化废水是由超过千种有机污染物和无机污染物组成,通常含有苯、苯酚、含氮杂环化合物和多环芳香烃[4-6]等有机污染物和以F-、Cl-、S2-、SO4-、CN-、SCN-以及氨氮为主的无机阴离子化合物[7]。中国政府已经出台了严禁新建焦化厂排放废水的规章[8],即焦化废水处理工艺必须实现“零排放”的目标,脱盐工艺将必不可少。根据已有的报道,焦化废水生化处理出水的电导率一般在2000~4000mS/cm范围内[9-10],约为海水电导率的1/10,属于高浓度含盐废水,是深度处理的水质基础。由于缺乏对焦化废水处理工艺过程盐分形成机制的分析,难以判断高盐分含量的生物出水是原水中固有的盐分、有机物降解产生的盐分、还是添加药剂引进的盐分,也无法知道水处理过程中因混凝及污泥吸附所可能削减的盐分,即盐分的形成与归趋原理不明朗。
目前广泛应用的脱盐技术包括蒸馏、反渗透、离子交换、电渗析等,追求高的脱盐效率时,普遍存在投资成本大、运行费用高的缺点[11-13]。废水处理工艺中往往为了pH调节和COD、SS等指标的达标,加入了大量的无机混凝药剂,新增加了盐分。程斌等[14]通过混凝-Fenton法预处理含盐废水,在最佳混凝和氧化条件下,硫化物和COD去除率分别高达99%和90%以上;LI等[15]将焦化废水生物出水用混凝剂聚合氯化铝(PAC)和助凝剂聚丙烯酰胺(PAM)预处理后,再用膜蒸馏法脱盐,其脱盐效果明显优于直接膜蒸馏脱盐方法。在一定浓度范围内(盐浓度在0.1221~2.9300mol/L),溶液含盐量与电导率呈正相关,溶解的盐类越多,溶液电导率就越大,故可根据溶液电导率的大小,间接地测量水溶液的含盐量[16-18]。若能在废水处理工艺中通过工艺选择或调整工艺参数进行预脱盐,如吸附法移除废水中的有机物[19]、混凝法沉淀高价金属离子、吹脱或蒸馏法降低氨氮的浓度等,将大大降低后续脱盐设备的投资与运行费用。
本文以稳定达标运行若干年的韶钢焦化废水处理两个工程(以下简称一期、二期)作为考察对象,对工程中的各个工艺单元实地采样,分析其盐分相关的物理化学指标,从工程规模讨论盐分变化的原因及影响因素,分析工艺单元原位削减盐分的可行性。在获得宏观数据变化信息基础上,通过药剂实验、混凝实验、降解实验分别讨论物化单元和生化单元工艺参数优化条件下的盐分归趋。基于对盐分的离子价态、种类、浓度以及来源的了解,根据脱盐过程中混凝反应的效果、离子转化的途径及形态分析和弱电解质的电离平衡等方面的原理,找到科学和经济的盐分过程控制技术与方法。
1 材料与方法
1.1工艺介绍
由于焦化厂两个工程所产生焦化废水性质存在一定差异,根据其废水具体性质,设计不同工艺有针对性地解决焦化废水难处理的问题。废水的生物流化床工艺流程如图1所示。韶钢一期工程采用A/O/O工艺,韶钢二期采用A/O/H/O工艺。两个工程主要的水质指标COD、氨氮、挥发酚和氰化物在外排水中的含量均达到设计标准,工程现场监测期间,一期工程COD、氨氮、挥发酚、氰化物的总去除效率分别为97.7%、96.4%、99.9%、99.5%,二期工程COD、氨氮、挥发酚、氰化物的总去除效率分别为98.5%、97.3%、100%、99.6%[20];一期、二期工程的总氮去除率分别达到55%±8%和78%±6%。
1.2采样方法
实验所需水样来自韶关钢铁焦化一期、二期废水处理工程的各个工艺单元出水,焦化废水处理工艺可以分为物化过程和生化过程。一期工程的物化工艺单元包括调节池、前混凝池、后混凝池,二期工程的物化工艺单元包括气浮池、调节池、后混凝池。一期工程的生化工艺单元包括A、O1、O2池,二期工程的生化工艺单元包括A、O1、H、O2池。一期、二期工程采样点的选取为工艺流程(图1)所有单元的出水以及一期的O1、O2池污泥和二期的O1、H、O2池污泥。采样时间分别为2015年4月、2015年8月及2015年11月,每月连续3天,平均气温是32℃,每天早上9点和下午15点分二次采样,等比例混合水样、泥样后,自然冷却,水样的检测分析温度为27.5℃,测定了溶液中电导率、pH、COD,以分析结果的平均值作为检测报告数据。
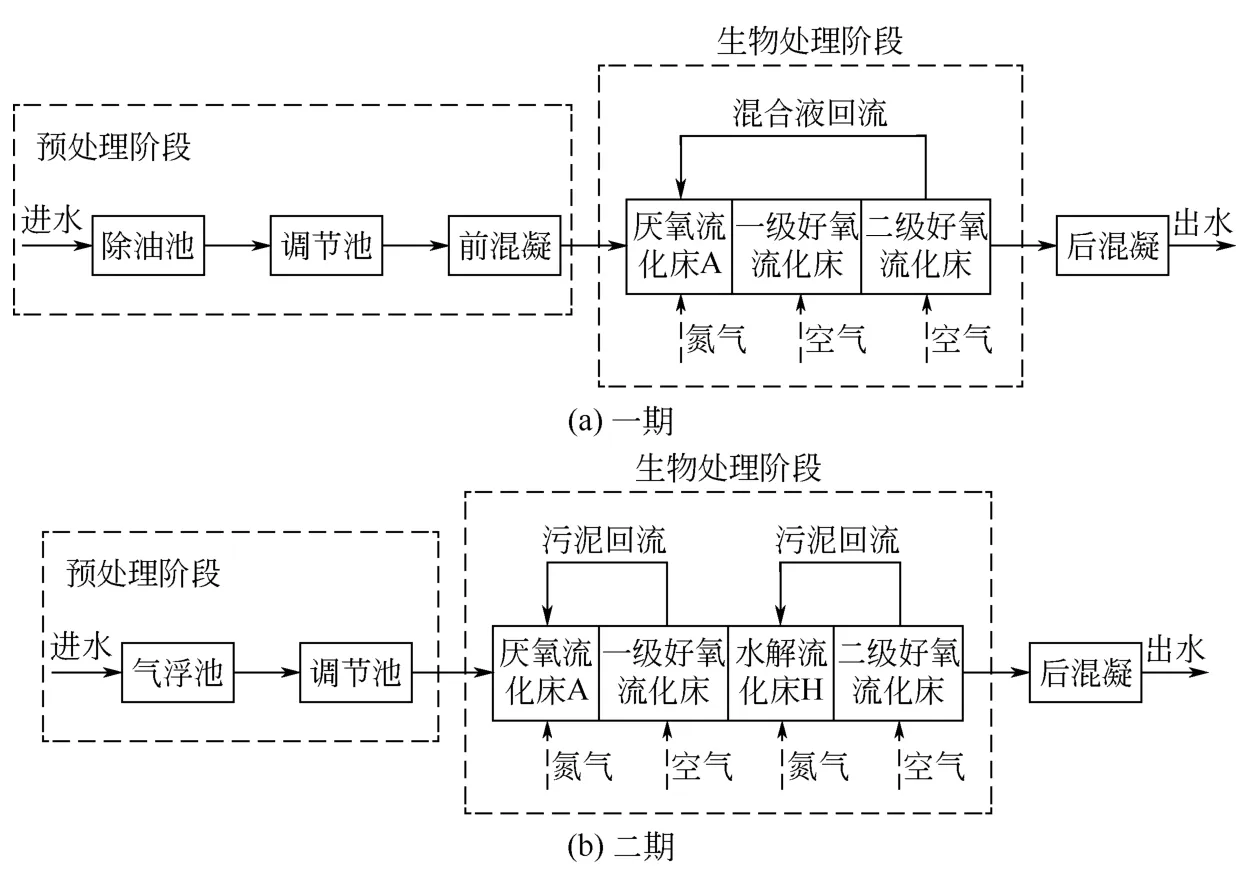
图1 焦化废水处理一期、二期工程的工艺流程
1.3实验方法
1.3.1主要阴离子浓度的分析
水样经简单沉降粗滤,澄清样品置冰箱保存并用电导率仪和离子色谱仪检测。泥水混合样的预处理方法如下:先将1.2节中的泥样通过真空抽滤机过滤,收集残留在滤纸上的污泥。将收集的污泥分别放在贴有标签的培养皿中,放入烘箱控制105℃保持12h,然后取出,呈颗粒状。再将污泥用研磨棒磨碎,用60mm的网格格栅筛选细粒粉末,放入培养皿中。分别从每个工艺单元的污泥粉末中准确称量0.5g样品,溶于50mL超纯水中,并在油浴锅100℃温度下加热搅拌40min,然后冷却至常温,测其电导率。再将各个工艺单元泥水混合液通过真空抽滤机,取其上清液10mL,用离子色谱仪分析其离子浓度。测试前水样经超滤、用C18小柱去除有机物然后再进样,SO42-和Cl-的分析水样稀释100倍进样,NO3-的分析水样稀释20倍进样。此数据用来分析废水处理过程中主要阴离子的归趋,为盐分进一步削减提供依据。
1.3.2微生物降解COD对溶液电导率的影响
取500mL二期A池出水水样作为二期O1进水水样,加至好氧反应器中。从盛有二期O1池污泥的反应器中连续取污泥样,连续监测了10h内污泥的沉降比值,然后取10h污泥沉降比的平均值32.4作为污泥的SV值,计算出投加的污泥体积,投加至好氧反应器中,再加入0.013g NaH2PO4,测量完全混合后的电导率、pH、COD,作为起始值。然后通入空气曝气,每隔2h测其电导率及其COD值,连续监测COD和电导率至微生物对有机物的完全降解。通过分析COD降解过程中电导率的变化,进一步解释物化过程和生化过程中COD对盐分的贡献。
1.3.3脱盐的混凝实验
混凝反应对脱盐有效果,设计了脱盐的混凝实验,分析参数的影响。从二期O2池出水水样中准确量取水样450mL(水样均采用上一工艺单元的出水水样)盛入烧杯中,测定混凝前初始水样的电导率、浊度、COD值。边搅拌边加入混凝剂,按一定顺序加入100g/L的聚合硫酸铁(PFS)溶液、5g/L的PAM、3mol/L的Ca(OH)2溶液,快速搅拌2min,转速200r/min,然后慢速搅拌30min,转速50r/min,停止搅拌后静置1h。最后用电导率仪、浊度计、COD快速测定仪、笔式pH计分别测定溶液的电导率、浊度、COD和pH。同时设计一组空白对照实验,取450mL蒸馏水,按相同的投药量和投加顺序,采用相同的混凝步骤,测定溶液电导率值,分析单独投药带来的盐分。将优化混凝参数后的电导率等指标对比1.2节中的相关参数,评价盐分削减效果。
1.3.4分析方法
以笔式pH计(OHAUS,ST10)测定水样的pH,以哈希DRB200测定水样中的COD,以哈希2100Q浊度仪测定混凝反应完全后水样中的浊度,以便携式电导率仪(雷磁,DDB-303A)测定水样中的电导率,用离子色谱仪(ICP-MS,Elan6000)测定各工艺单元水相和生物阶段泥相中主要无机阴离子浓度,对于SO42-、Cl-、NO3-的离子色谱法测定,单个离子的标准曲线R2均高于0.999。以上仪器、设备在使用前均进行了校准。离子色谱法仪器测试条件为:以0.175mmol/L优级纯NaOH溶液为淋洗液,流速为1.00mL/min,柱温为35℃。实验数据采用Excel2013、Origin9.0等软件进行绘图制表。1.3.5 数据评价
根据2012年开始实行的《炼焦化学工业污染物排放标准》(GB16171—2012)规定了悬浮物、出水pH、COD等指标,针对混凝脱盐效果,在考察脱盐效率的同时,应考虑混凝参数的改变带来的外排水理化指标的变化。常用的脱盐方法效率在95%以上[21],参考此数据分析“预脱盐”的效果。本文以电导率的去除率间接地代表盐分的削减效果,盐分的去除率计算公式如式(1)所示。

2 结果与讨论
2.1工艺过程中盐分的变化
溶液中的盐分受无机离子浓度、离子价态等因素的影响。pH的改变,可能会使溶液中离子的形态、价态发生变化,废水中COD降解会引起溶液中无机化学组分的改变,温度的变化也会影响溶液电导率值的大小。为了全面、准确地反映溶液中盐分的含量,结合一期、二期工程的运行参数,探讨理化指标对盐分的影响,按1.2节中的采样点系统检测了相关理化指标,将结果列于表1中。
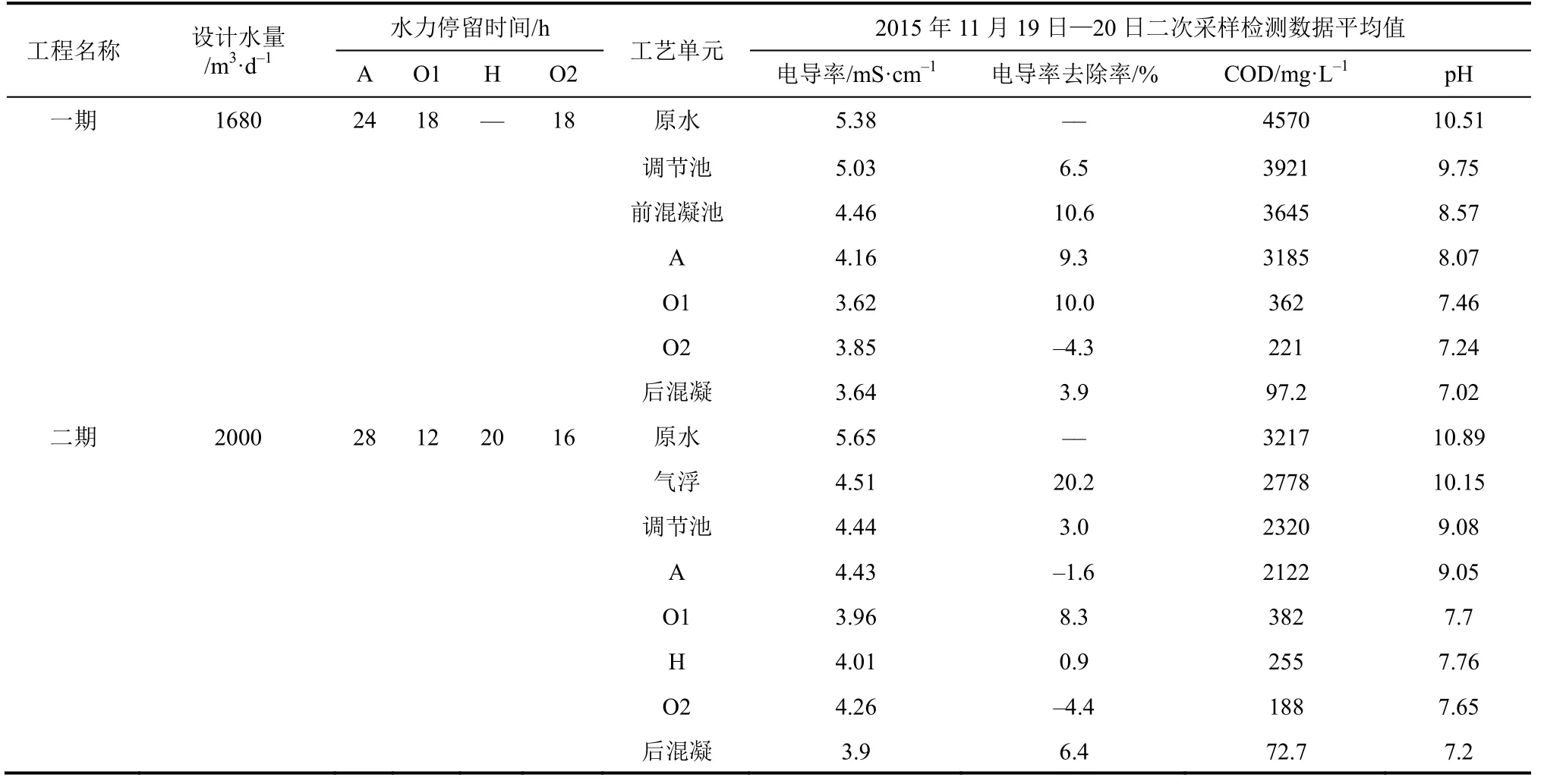
表1 焦化废水的理化指标和运行参数
(1)工艺过程中pH值的变化 从表1中可以看出,一期、二期中预处理工艺单元和A池废水基本呈碱性环境,生化过程的其他单元和后混凝单元基本偏中性环境。焦化废水处理过程中,由于投药和加碱调节,使焦化废水的调控在各个工艺单元相适应的pH环境下,同时也会影响一部分无机离子的组成形态[22]。所以,很有必要从pH的角度去探讨其对废水盐分的影响。在一期、二期的原水中,废水呈碱性环境,CO32-、S2-、CN-均能大量共存,由于生化过程酸碱调节,其浓度会有所降低。铵离子在前处理过程中,其主要以氨分子弱电解质形式存在,在生化过程中,会和其他离子结合产生强电解质。一期、二期前混凝和气浮池投加FeSO4,在碱性环境下,铁元素在废水主要以Fe(OH)2形式存在。而在生化过程中,一部分Fe2+会被氧化为Fe3+。废水中Fe(SCN)2、Fe2[Fe(CN)6]等金属络合物在碱性条件下,具有较强的吸附作用。由此可见,pH调控了废水溶液中的酸碱平衡、络合平衡与沉淀平衡,影响废水中电导率表达的盐分含量。
(2)工艺过程中COD的变化 以二期工程为例,生物降解是其COD降解的主要途径。如表1所示,焦化废水进水COD值为3217.7mg/L,出水72.7mg/L。一期COD去除率较大的工艺单元有调节池、A池、O1池,二期COD降解较大的工艺单元有气浮池、调节池、O1池。一期、二期的调节池均有O2池混合液回流稀释作用,所以稀释了调节池的COD、电导率等物化指标。生化过程中O1池是废水处理过程降解有机污染物的关键步骤,一期、二期O1池对COD的去除率分别为88.6%和82.0%,将废水中大部分含碳物质最终分解为水、CO2等物质。且好氧降解产生的酸也需要消耗碱,均会对溶液中无机盐组分产生较大影响。COD降解对溶液中盐分的贡献,根据有机物的矿化与添加碱等药剂平衡决定,需要进一步实验论证。
(3)工艺过程中电导率的变化 电导率的大小受温度影响[23],按1.2节中的采样点及当时的温度,测得电导率值列于表1中。焦化废水处理工艺物化过程主要目的是调节溶液pH,实现混凝反应。研究发现,前物化过程(一期前混凝、二期气浮池)的预处理工艺单元和深度处理的后混凝工艺单元均有电导率值较大下降的现象。前物化过程投加的药剂为FeSO4和PAM,后混凝工艺单元投加的药剂有Ca(OH)2、PFS和PAM。一期、二期预处理工艺单元理化指标、投加的药剂基本相似,以二期气浮池为例分析物化过程在预处理阶段电导率降低的原因。气浮池中投加了FeSO4后,在碱性环境下水溶后主要以Fe2+、SO42-形式存在。Fe2+与OH-生成Fe(OH)2沉淀,Fe(OH)2不稳定,很容易被空气中的氧氧化成Fe(OH)3。废水中存在少量Fe3+,所以Fe2+在溶液中与S2-生成Fe2S3和FeS沉淀,与CO32-生成FeCO3。废水中的CN-能与Fe2+生成白色沉淀Fe(CN)2,待硫化亚铁沉淀完成后,氰化物还可以与Fe2+发生络合反应生成Fe2[Fe(CN)6]的络合物。焦化废水中富含SCN-[24],与Fe2+生成络合物Fe(SCN)2。Fe2+生成的络合物和沉淀去除的阴离子的摩尔浓度要大于引入废水中的SO42-,且部分SO42-还会与Ca2+以CaSO4沉淀形式被去除。同时,二期气浮池COD去除约600mg/L,后续的2.2.1节(4)中将讨论COD的去除能够削减废水中盐分的原因。气浮工艺主要以沉淀形式、络合反应、COD去除来削减废水中盐分,其主要反应方程式如式(2)~式(7)。

生物出水后混凝物化过程的深度处理工艺单元投药种类与气浮工艺类似,引入的Fe3+会以沉淀、生成络合物等形式带走一部分盐分。增加用于调节混凝反应pH的Ca(OH)2溶液,其溶于水后会与H+、SO42-生成H2O和CaSO4沉淀,调节pH的过程并不会引入新的盐分。SO42-在水中在pH降低的条件下,会和H+生成HSO4-,二价离子转化为一价离子的过程中,离子总量降低,同时离子电荷也有所降低,使溶液中的表观盐分降低。在一期、二期工程后混凝池中,其pH均呈下降趋势,因为Fe3+水解过程生成了H+和Fe(OH)3沉淀。废水中投药后的SO42-总浓度c2(SO42-)等于后混凝进水水样的原始SO42-离子浓度c0(SO42-)和投加PFS引入的SO42-离子浓度c1(SO42-)之和,根据电离平衡常数公式,c2(SO42-)、c2(H+)(投药后废水中H+浓度)增加,Ka(HSO4-)=1.2×10-2(25℃)不变,则c2(HSO4-)会升高。从盐分角度分析,c0(SO42-) ≫c1(SO42-) 时,引入的SO42-、Fe3+浓度较低,对盐分贡献可忽略,但c0(SO42-)转化为c2(HSO4-)的增加,将会削减溶液中的离子浓度。c0(SO42-)≪c1(SO42-)时,引入的SO42-、Fe3+浓度较高,其对盐分的贡献值较大,后混凝工艺废水中残留的与Fe3+沉淀、络合的离子浓度较低,同时弱电解质HSO4-在水中不完全电离,即使SO42-全部转化为HSO4-,投药后废水中的c2(HSO4-)、c2(Fe3+)带来的盐分也大于c2(SO42-),不能达到盐分削减的目的。因此,为了探讨后混凝工艺盐分变化规律,需要检测后混凝进水c0(SO42-)和出水c2(SO42-),相关反应方程式如式(8)~式(10)。

焦化废水生化过程的主要目的是降解废水中的COD成分,从表1中可知,除了两个工程的O1到O2池电导率略有升高外,其余工艺单元的电导率均有明显下降,理解为好氧反应有机物矿化的彻底性所致。为了保证微生物降解效率,需投加NaOH使微生物在适宜、稳定的pH范围内生长,投加NaH2PO4促进微生物繁殖,由此引入了无机离子H2PO4-和Na+,它们是生化过程中盐分的贡献者。结合一期、二期生化过程中COD变化规律,可以发现,COD去除率高的工艺单元,其盐分均有削减,考虑到生化过程影响盐分还有盐分的泥相转移等因素,不能判断COD降解过程对废水中的盐分具有多少削减作用。因此,需要设计实验进一步阐述投药等因素如何影响COD降解与废水中盐分之间的关系。
2.2盐分变化影响因素
2.2.1生化过程
结合生化过程中水相、污泥相中主要阴离子的浓度变化的数据,可以成为探讨废水水相盐分向泥相转化的规律以及泥相对盐分吸附作用的依据。以二期生化工程为例,根据工程参数,在一定水样体积条件下,折算出各个工艺单元投药种类及投药量,讨论投加碱和磷盐对工艺单元盐分的贡献值。
(1)水相中的主要阴离子浓度 焦化废水中的阴离子有F-、Cl-、S2-、SO4-、CO32-、NO2-、NO3-、PO43-、CN-、SCN-,外排水以Cl-、SO42-、NO3-[7,25]为主,根据1.3.1节中的方法,测得的各个工艺单元主要阴离子浓度数据如图2所示。由图2可知,一期和二期工程都含有高浓度的SO42-和Cl-,是水相中阴离子盐分的主要贡献。NO3-在一期的O1和O2池,以及在二期中的O2池其浓度均有上升,与丁逸宁[20]现场监测一期、二期生化过程中氨氮的浓度数据相吻合,即氨氮在一期O1、O2池和二期O2池均有较大降幅。可以判断废水中氨氮在O1池和O2池中均发生了硝化反应,将废水中残留的氨氮和NO2-氧化为NO3-。进一步将O2池的混合液回流至缺氧池进行反硝化反应而将硝氮去除,达到总氮去除的目标。SO42-、Cl-在O1、O2池废水中浓度略有降低的原因可能是少量被泥相所吸附,需要通过泥相中的浓度分析加以证明。
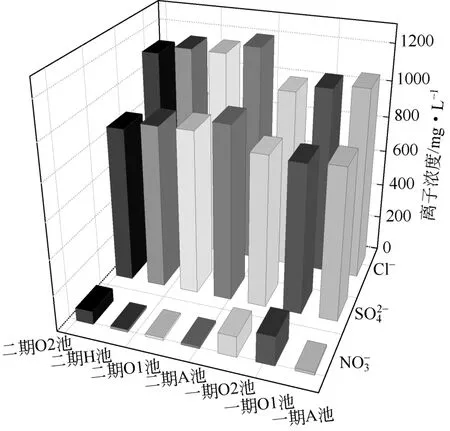
图2 生化过程中主要阴离子浓度
(2)盐分的污泥相转移 根据1.3.1节中的方法,测定污泥中主要离子浓度以及其水溶液的电 导率,可以观察生化过程中污泥吸附了多少阴离子,结果如图3所示。以工程现场污泥的浓度在3.5~5 g/L范围内作为参考,取污泥质量浓度4g/L,根据污泥中离子的质量浓度,换算为工程污泥中含有的离子浓度。数据表明,泥相中NO3-浓度较低,而SO42-和Cl-浓度相对较高。其中,一期、二期O1池吸附的SO42-和Cl-浓度均大于O2池,因为O1池污泥的活性要大于O2池,可能使O1池污泥比O2池污泥吸附更多的无机阴离子,但污泥相中吸附的离子总量均低于该工艺单元水中离子浓度的5%,对盐分的削减总量影响不明显。

图3 生物处理阶段污泥电导率和主要阴离子的质量浓度
(3)磷盐和碱的投加 二期生物处理阶段主要的投药工艺单元有A、O1、O2池,其中A、O1池均投加了药剂NaH2PO4,用于补充废水中微生物所需的营养元素,一个班次(分为早班、中班、晚班,每个班8h)投加25kg纯度为96%的精制NaH2PO4。NaOH投加到O1、O2池中,用于调节pH,针对O1、O2池总共每班投加8包25kg的96%精制NaOH工业品。每班的处理水量平均约为469m3,现将投药量折算成实验室水样体积下的单位剂量(1L工艺单元进水水样),并用蒸馏水投加相同的药量作为空白实验,排除生物降解COD对电导率的影响,单独考虑投药量给处理废水带来的贡献,结果如表2所示。由表2中可知,由于投加无机药剂,使生物处理工艺单元的电导率均有所上升,其中电导率变化较大的是二期O1池和O2池,电导率分别上升了15.2%、12.7%。因为O1、O2池在实验室条件下pH呈中性,而实际废水中O1、O2池出水因不断降解有机物过程带来的H+呈酸性,与加入的NaOH生成了H2O,其电导率略低于上述实验数据,这一现象与表1相对应,说明药剂的投加使废水的盐分增大。

表2 二期O1污泥反应器内投药量对电导率的影响
(4)氧化还原过程 生化过程中有机物的降解,主要包括两个工程中A池的厌氧降解以及O1、O2池的好氧降解。A池中的厌氧过程,将废水中的有机物转化为甲烷和CO2,SO42-被还原为硫化氢,NO3-、NO2-和氨氮发生厌氧氨氮化[26],生成N2和N2O。O1、O2池中,主要发生好氧降解过程,将有机物最终分解为CO2和H2O。苯酚类及其衍生物是焦化废水中含量最高的有机污染物,占总有机物质量60%以上[27]。丁逸宁[20]研究发现,一期、二期O1池挥发酚的去除率为98%以上,因此,可以认为焦化废水中苯酚主要在生化过程中去除。而苯酚与废水中大量的Na+[7]在弱碱性条件下生成有机盐苯酚钠,表现出高电导率,很容易理解,苯酚的降解即强电解质苯酚钠、弱电解质苯酚被氧化为不表现为盐分的CO2和H2O而导致废水电导率大幅度下降。废水中的SCN-及CN-在好氧单元最终降解为SO42-、NO3-、CO32-,其中N、S元素的转化率高达94%[28]以上。在生化过程中,部分 SO42-、NO3-、NO2-和氨氮等无机盐分别转化为H2S和 N2气体,降低了废水中的盐分。SCN-的氧化过程引入了SO42-、NO3-、CO32-三种无机盐阴离子,使离子浓度及电荷增加,废水的电导率增高,但随着反硝化过程的发生,电导率随之下降。因此,生物降解体系电导率的变化由反应途径及其程度决定。
根据1.3.2节的实验方法,可以进一步考察微生物降解焦化废水中COD过程的盐分变化规律,结果如图4所示。二期O2池进水水样、污泥和磷盐完全混合后测定的电导率为4.45mS/cm,pH为9.03,混合液的COD为1811.2mg/L,由于未加碱调节pH,微生物在弱碱性条件下降解COD速度较慢,废水在18h时的COD、电导率分别稳定在290mg/L、3.17mS/cm左右,COD降解了1521.2mg/L,电导率降低约1.28mS/cm。暴露出焦化废水的COD降解过程中实现了盐分的部分削减。结合2.2节中(2)、(3),二期O2池盐分的贡献主要来自碱和磷盐的投加,溶液中电导率增加了0.86mS/cm,与COD下降同步的盐分削减理解为主要是以有机盐分形式存在的强电解质C6H5O-被好氧氧化为非电解质CO2所致,其电导率降低了大约1.28mS/cm。综合上述两个方面的作用,电导率降低了0.42mS/cm,而实测废水中电导率降低了0.47mS/cm。考虑到污泥吸附的少量盐分及实验室条件下O1池COD降解不完全等因素,以盐分的污泥相转移、碱和磷盐投加、氧化还原过程中盐分的变化规律,认为盐分的总量基本守恒。同理,工程的A单元和O1单元因COD降解过程削减的盐分大于投药引入的盐分,反应完全后电导率有所降低。由于难降解有机物含量相对较少,且处理单元水力停留时间长,工程的O2单元降解的COD均不足300mg/L,其削减的盐分小于投加药剂增加的盐分,使废水中电导率略有升高。

图4 微生物降解COD对溶液电导率的影响
2.2.2物化过程
焦化废水物化过程中盐分变化的影响因素主要由盐分在水相中的离子浓度以及混凝脱盐两部分组成。由2.1节中(3)可知,c0(SO42-)≫c1(SO42-)时,通过投加调酸试剂HCl,可以降低溶液中的离子浓度。生化工艺中COD的降解也会带来盐分的削减,但外排水COD已降至100mg/L以下,不具备进一步削减盐分的条件。综上,为了探讨工艺单元盐分原位减排的可行性,选取二期工程后混凝单元进水水样为目标,从投药量、投药顺序、混凝pH等因素进行最优盐分减排效果分析。
(1)水相中的主要阴离子浓度 一期、二期工程物化工艺单元水样根据1.3.1节中方法,用离子色谱仪测得的各个工艺单元阴离子浓度如图5所示。后混凝单元投加的药剂有Ca(OH)2、PFS和PAM,其中PAM是非电解质。由图5可知,一期、二期NO3-浓度和Cl-浓度变化不大,在此单元废水体系中较稳定;一期、二期后混凝出水中SO42-浓度略有上升,结合图2中二期O2池出水SO42-浓度(即二期后混凝池进水SO42-浓度),趋于c0(SO42-)≫c1(SO42-)[详见2.1节中(3)]的情况,在废水pH降低的条件下,废水中部分SO42-转化为HSO4-,削减了废水中以电导率表达的盐分。Ca2+与废水中高浓度的SO42-产生沉淀,引入的OH-中和了PFS的酸性,生成了H2O。
PFS溶于水中能产生[Fe(H2O)6]3+、[Fe(H2O)2]4+、[Fe(H2O)4]2+等多核络离子,对水中金属络合物具有较强的吸附作用,减少了金属络合物发生的弱电离。PFS也能去除残留的酚类物质,主要是由于酚结构中的羟基负离子(—O—)能与PFS中的聚合阳离子[Fe3(OH)4]5+、[Fe4(OH)4]6+、[Fe6(OH)12]6+结合而以沉淀析出,减弱了酚类的弱电离带来的盐分。
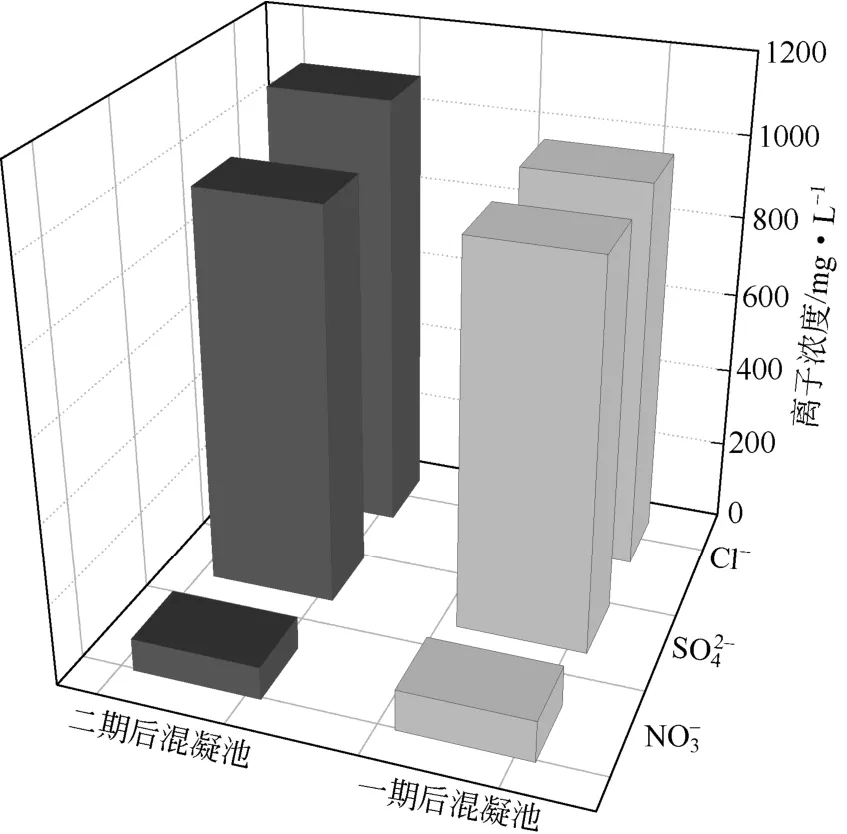
图5 深度处理阶段的主要阴离子浓度
综上,后混凝工艺单元在沉淀了SO42-和酚类,吸附了金属络合物,去除了部分COD以及转化SO42-为HSO4-的过程中,使废水中的盐分减少,电导率降低,回应了表1中的数据变化。
(2)优化投药量对混凝脱盐的影响 为了确定混凝脱盐实验最佳投药量的大概范围,预先进行模拟投药实验,混凝投药的顺序是先加入100g/L的PFS溶液,再加5g的PAM,最后加入3mol/L的Ca(OH)2溶液。PFS的投药量在1~7mL之间,PAM的投药量固定在1.0mL,Ca(OH)2溶液固定在0.5mL,实验方法见1.3.3节,实验结果显示100g/L PFS投药量在200~400mL之间,电导率由原水样4.16mS/cm降至3.64~3.74mS/cm,电导率值出现波谷,PFS投药量在7mL时,电导率反而上升,表明过量的投加药剂会增加盐分。于是采用正交分析法进一步分析PAM、PFS、Ca(OH)2的最佳投加量。由此设计正交实验的因素水平,100g/L PFS、5g/L PAM、3mol/L Ca(OH)2对应的投药量分别为2.5mL、1.0mL、0.4mL(水平1),3mL、1.2mL、0.5mL(水平2) ,3.5mL、1.4mL、0.6mL(水平3),4mL,1.6mL、0.7mL(水平4)。 100g/L PFS投药量2.5mL、3mL、3.5mL、4mL,5g/L PAM投药量1.0mL、1.2mL、1.4mL、1.6mL,3mol/L Ca(OH)2的投药量为0.4mL、0.5mL、0.6mL、0.7mL。根据正交实验设计的原则,需安排16次实验来达到全面分析各个因素对电导率降低的影响作用。以电导率、浊度、COD为指标,考察影响因素对实验结果的显著水平,每列因子中在同一水平上的实验值的算术平均值为均值1、2、3、4,R表示每种因素的极差。正交实验方案及直观分析结果见表3、表4。
从表3中的实验数据可知,只考虑电导率去除率的情况下,正交实验方案12是最佳的混凝脱盐的投药量,且混凝时矾花形成速度较快,大而密实,表现出较好的效果。100g/L PFS投药量为3.5mL,5g/L PAM投药量为1.6mL的条件下,电导率COD分别降低了19.14%和51.7%,出水浊度为10.2NTU。以电导率去除率为考察目标,较好的投药量因素水平选择100g/L的PFS 3.5mL、5g/L的PAM 1.6mL以及3mol/L的Ca(OH)20.5mL。
在所设计的实验水平条件下,由表4中极差R值可判断,影响电导率、浊度、COD因素重要性顺序都是PFS、Ca(OH)2和PAM投加量。因此,在以降低电导率为主的混凝实验中,PFS的投加量必须严格控制,才能达到脱盐、混凝、COD降解的较佳效果。
(3)投药顺序对混凝脱盐的影响 根据1.3.3节中的方法设计了最佳投药顺序的混凝实验,探讨投药顺序对混凝脱盐的影响,测得原始水样电导率为3.36mS/cm,实验结果见表5。由表5可知,混凝脱盐的最佳投药顺序是先用Ca(OH)2调节pH,再加PFS,最后加入PAM,此时溶液电导率为3.29mS/cm。因为加先加入PAM,会使溶液整体黏度增大,不利于后面向溶液投药的混合和反应,所以PAM应该最后投加。如果先加PFS,因为pH降至酸性,产生的絮体会上浮,然后再加Ca(OH)2,由于絮体基本在聚集溶液上层位置,不利于絮凝反应。先加Ca(OH)2,会产生小量的重金属沉淀,且将pH调至碱性,是PFS比较合适混凝的pH范围,然后再加入PFS,会使产生的絮体密实,无上浮挂壁现象,所以,最佳的投药顺序是Ca(OH)2、PFS、PAM。
(4)溶液pH对混凝脱盐的影响 取若干份水样,根据1.3.3节中方法,以混凝脱盐的最佳投药方案及最佳投药顺序进行混凝实验,分别用1mol/L的盐酸和3mol/L的Ca(OH)2调节至酸性和碱性环境,以向蒸馏水中加入调节pH所用的相同浓度盐酸和Ca(OH)2的量作为空白实验,测定其电导率,实验结果如图6所示。
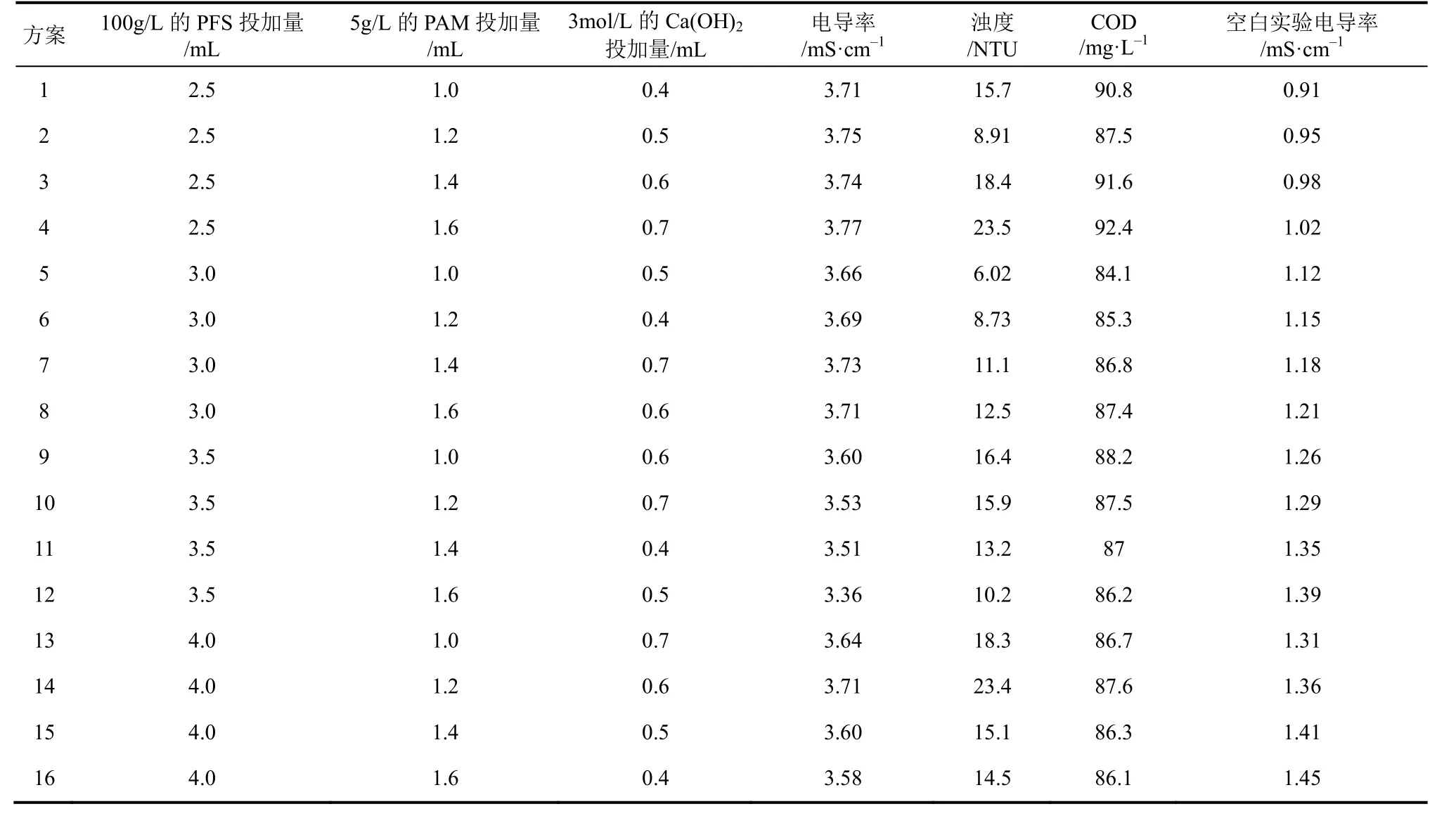
表3 正交实验方案

表4 正交直观分析表

表5 混凝脱盐投药顺序实验

图6 pH对混凝脱盐的影响
从图6中可以看出,溶液的电导率、浊度、COD都随着pH的增大,先减小后增大,表现为溶液中电导率受pH影响波动较大,因此,混凝反应必须控制在适宜的pH范围内。其中,电导率最低值在pH5左右,此时废水中电导率降至2.75mS/cm,出水浊度最小值、COD最大去除率即最佳混凝效果在pH8左右得到。考虑到焦化废水外排水标准,应取pH6作为其最佳脱盐pH,其电导率为2.97mS/cm,相比实际工程外排水的电导率值,进一步下降了0.93mS/cm,盐分去除率优化后增大了约23.8%。当pH较大时,胶体颗粒带负电荷,絮凝剂形成的含OH-的无机高分子絮凝剂带正电,使絮凝剂有较好的去除效果,但水溶液呈碱性环境,HSO4-向SO42-转化,电导率升高。当pH较小时,会影响Fe(OH)3的生成,从而影响了混凝的效果。由2.1节中(3)可知,SO42-向HSO4-转化的浓度增大,废水中离子削减量增多。但pH越小,投加浓盐酸的量也就越多,也贡献了更多的盐分。因此,焦化废水后混凝出水在pH为6时,具有较好的脱盐效果。
3 结 论
生化过程中盐分的主要贡献来自碱和磷盐的投加,盐分削减量主要由COD降解过程决定,有机物在微生物好氧降解过程中,表现为盐分的苯酚类物质被氧化为CO2和H2O,电导率下降,无机盐在兼氧降解过程中,SO42-、NO3-、NO2-和氨氮等分别转化为N2和H2S,降低了废水中的盐分,贡献量小于削减量;前混凝工艺以混凝沉淀、生成络合物形式将投加药剂中的Fe2+与废水中的CN-、S2-、SCN-、OH-、CO32-结合为弱电解质和难溶性盐,引入的SO42-则与Ca2+生成沉淀物,COD去除作用部分降低了有机盐苯酚钠的浓度,而后混凝工艺需要通过严格控制投药量与pH实现脱盐的过程;生化过程中有机组分与营养元素的比例、厌氧/水解/好氧的工艺选择影响盐分的归趋,决定混凝脱盐效果的主要因素是PFS的投加量以及pH,优化混凝条件对原位脱盐效果显著。总体研究表明,追求焦化废水处理工程的原位脱盐主要由废水水质决定的生物反应工艺途径选择、混凝反应药剂种类与条件优化以及原位分离难降解有机物等因素与过程决定。
[1] WEI X X,ZHANG Z Y,FAN Q L,et al. The effect of treatment stages on the coking wastewater hazardous compounds and their toxicity[J]. Journal of Hazardous Materials,2012,239/240(4):135-141.
[2] 韦朝海,贺明和,吴超飞,等. 生物三相流化床A/O2组合工艺在焦化废水处理中的工程应用[J]. 环境科学学报,2007,27(7):1107-1112.
[3] 韦朝海. 煤化工中焦化废水的污染、控制原理与技术应用[J]. 环境化学,2012,31(10):1465-1472.
[4] ZHANG S,ZHENG J,CHEN Z. Combination of ozonation and biological aerated filter(BAF)for bio-treated coking wastewater[J]. Separation & Purification Technology,2014,132(34):610-615.
[5] YANG W,LI X,PAN B,et al. Effective removal of effluent organic matter (EfOM) from bio-treated coking wastewater by a recyclable aminated hyper-cross-linked polymer[J]. Water Research,2013,47(13):4730-4738.
[6] ZHU X P,NI J R,LAI P,et al. Advanced treatment of biologically pretreated coking wastewater by electrochemical oxidation using boron-doped diamond electrodes[J]. Water Research,2009,43:4347-55.
[7] 任源,韦朝海,吴超飞,等. 焦化废水水质组成及其环境学与生物学特性分析[J]. 环境科学学报,2007,27(7):1094-1100.
[8] JIN X,LI E,LU S,et al. Coking wastewater treatment for industrial reuse purpose:combining biological processes with ultrafiltration,nanofiltration and reverse osmosis[J]. Journal of Environmental Sciences,2013,25(8):1565-1574.
[9] 徐永清,周北海,张鸿涛,等. 电吸附工艺用于焦化废水深度处理的中试[J]. 环境科学研究,2014,27(6):663-669.
[10] 赖鹏,赵华,章王超,等. 铁炭微电解深度处理焦化废水的研究[J].环境工程学报,2007,1(3):15-20.
[11] 王建友,王世昌,傅学起. 电去离子水软化技术的实验研究[J]. 工业水处理,2008,27(12):52-55.
[12] NIKONENKO V V,ISTOSHIN A G,URTENOV M K,et al. Analysis of electrodialysis water desalination costs by convective-diffusion model[J]. Desalination,1999,126(1/2/3)207-211.
[13] 李长海,张雅潇. 海水淡化技术及其应用[J]. 电力科技与环保,2011,27(1):48-51.
[14] 程斌,周觅,莫建松. 混凝-Fenton法预处理模拟电脱盐废水[J]. 环境工程,2010,28(6):31-35.
[15] LI J,WU J,SUN H,et al. Advanced treatment of biologically treated coking wastewater by membrane distillation coupled with pre-coagulation[J]. Desalination,2016,380(2):43-51.
[16] 陈丽梅,程敏熙,肖晓芳,等. 盐溶液电导率与浓度和温度的关系测量[J]. 实验室研究与探索,2010,29(5):39-42.
[17] 胡诞康. 溶液电导率测量的新进展[J]. 机电一体化,1995,1(2):42-42.
[18] 张俊海,王襄平. 电导率与含盐量的定量关系[J]. 维纶通讯,2009,29(1):18-20.
[19] HOU C H,HUANG C Y. A comparative study of electrosorption selectivity of ions by activated carbon electrodes in capacitive deionization[J]. Desalination,2013,314(8):124-129.
[20] 丁逸宁. 流化床与沸腾床内微生物群落结构演替分析及污泥异质性证明[D]. 广州:华南理工大学,2015.
[21] 王伟. 脱盐水处理工艺技术的比较与选择[J]. 盐业与化工,2015,44(5):29-34.
[22] 林冲,袁孟阳,韦朝海,等. 焦化废水缓冲体系的存在证明与集水调节池中水质结构调控[J]. 环境化学,2012,31(10):1473-1479.
[23] 陈丽梅,程敏熙,肖晓芳,等. 盐溶液电导率与浓度和温度的关系测量[J]. 实验室研究与探索,2010,29(5):39-42.
[24] 张万辉,韦朝海,吴超飞,等. 焦化废水中有机物的识别、污染特性及其在废水处理过程中的降解[J]. 环境化学,2012,31(10):19-25.
[25] 程亚平. 离子色谱法测定焦化废水中的阴离子[J]. 燃料与化工,2012,43(2):37-39.
[26] 马从安, 张树德. 厌氧氨氧化及其工艺的研究现状[J]. 河北理工大学学报:自然科学版,2008,30(3):134-137.
[27] 陈春,李文英,吴静文,等. 焦化废水中苯酚降解菌筛选及其降解性能[J]. 环境科学,2012,33(5):1652-1656.
[28] 张玉秀,尹莉,李海波,等. 焦化废水处理厂活性污泥对硫氰化物的降解机制[J]. 环境化学,2016,35(1):118-124.
The changes of salt and its influencing factors during coking wastewater treatment
LI Xiangxi1,WU Chaofei1,2,WU Haizhen3,HU Chengsheng4,WEI Chaohai1,2
(1School of Environment and Energy,South China University of Technology,Guangzhou 510006,Guangdong,China;2The Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters,Ministry of Education,Guangzhou 510006,Guangdong,China;3School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,Guangdong,China;4Guangzhou Municipal Engineering Maintenance Department,Guangzhou 510100,Guangdong,China)
Based on the optimized parameters in achieving the in situ salt reduction,the evaluation of coking wastewater treatment process in Shaogang Steel Plant was conducted with special emphasis on the evolution of conductivity. The analysis of water quality,operation parameters,types and quantity of reagents were carried out to examine the variation of conductivity in each unit,and then to elucidate the influencing factors for salinity changes. The influence of biodegradation of coking wastewater,the appliedreagent dosage and the coagulation process on the concentration evolution of main anions were investigated and the fate of salt residual in water as well as sludge during biochemical and physiochemical process were studied. The results showed that the optimized biodegradation and physiochemical degradation of coking wastewater can lead to partial reduction in salinity. The increase of salt concentration is mainly attributed to the addition of phosphorus and alkalinity in the biochemical process,the employment of coagulation in physiochemical process,as well as the mineralization of organics. The reduction of salt was resulted from the transformation of N,S constituent and strong electrolyte C6H5O-into N2,H2S,CH4,CO2,H2O. Also,the complexing precipitation,insoluble salts of coagulation sedimentation coming from the combination of Fe2+with CN-,S2-,SCN-,OH-,CO32-in the physicochemical process contributed to the decrease of salt. The separation of refractory organics in biochemical procedure,the dosage and the order of chemical reagent,the optimization of pH were found to be beneficial for in situ reduction of salt. It was suggested that the choice of process principle,reaction control and optimization of conditions are the significant factors that influence the changes of salt during coking wastewater treatment.
coking;salt reduction;conductivity;coagulation;biodegradation;optimization
X 703.1
A
1000-6613(2016)11-3690-11
10.16085/j.issn.1000-6613.2016.11.046
2016-04-15;修改稿日期:2016-06-21。
广东省应用型科技研发专项基金 (2015B020235005)及国家自然科学基金(21037001)项目。
李湘溪(1989—),男,硕士研究生。联系人:韦朝海,博士,教授,主要研究方向为水污染控制理论及技术。E-mail cechwei@scut.edu.cn。
