微生物发酵产赤霉素的研究进展
2016-11-12彭辉施天穹聂志奎郭东升黄和纪晓俊
彭辉,施天穹,聂志奎,郭东升,黄和,纪晓俊
(1南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816;2江西新瑞丰生化有限公司,江西 新干 331300)
微生物发酵产赤霉素的研究进展
彭辉1,施天穹1,聂志奎2,郭东升1,黄和1,纪晓俊1
(1南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816;2江西新瑞丰生化有限公司,江西 新干 331300)
赤霉素为植物五大激素之一,对植物生长具有多种生理作用,如调控植物的茎干延长、种子发芽、打破种子休眠、诱导开花等。目前赤霉素已经广泛应用于农业、林业、酿造业等,具有很大经济效益和市场前景。赤霉素的工业化生产主要通过藤仓赤霉液体发酵。尽管赤霉素具有多样性的应用及巨大的经济效益,但高生产成本严重制约其广泛的应用。本文首先介绍了赤霉素的生物合成途径以及赤霉素合成基因表达的调控机制,随后重点总结了赤霉素发酵过程的菌种、营养因素、发酵参数、发酵工艺以及下游分离提纯工艺等研究进展。同时指出未来的研究重点在于利用新型的诱变方法与分子生物学方法选育高产菌株以及发酵工艺的革新,以提高赤霉素的产量,降低发酵成本,促进赤霉素的大规模应用。
赤霉素;萜类;发酵;藤仓赤霉
赤霉素(gibberellins,简称GAs),是一种天然的植物生长调节剂,属于生物体内的一类四环二萜类化合物,至今已发现136种,总称赤霉素类(GAs)。常见具有生物活性的主要有GA1、GA3、GA4、GA7等(化学结构如图1所示)[1-3],它与生长素(auxins)、细胞分裂素(cytokinins)、脱落酸(abscisic acid)、乙烯(ethylene)称为植物五大激素[4]。赤霉素对植物生长具有多种生理功能,例如通过调节水解酶活性从而调控种子发芽、茎干延长、诱导开花、打破休眠、性别分化等过程[5-6],因而广泛应用于农业、林业、酿造业等。赤霉素不仅分布于绿色植物,在一些细菌和真菌中也有发现[7]。目前获取赤霉素主要方式有3种:植物中提取,化学合成,微生物发酵。由于前两种方法价格昂贵、效率较低,而微生物发酵法具有周期短、效率高等优点,所以工业大规模生产赤霉素主要通过微生物发酵法。目前用于工业化生产的微生物主要是是丝状真菌藤仓赤霉(Fusarium fujikuroi)、无性状态为串珠镰孢(Fusarium moniliforme),下文所描述的发酵菌种均为藤仓赤霉。但目前价格高依旧是阻碍赤霉素大规模应用的主要障碍[8],因而必须通过菌种改良、发酵工艺优化、下游纯化工艺优化等方法提高赤霉素产量,降低赤霉素的生产成本,以促进赤霉素的大规模应用。
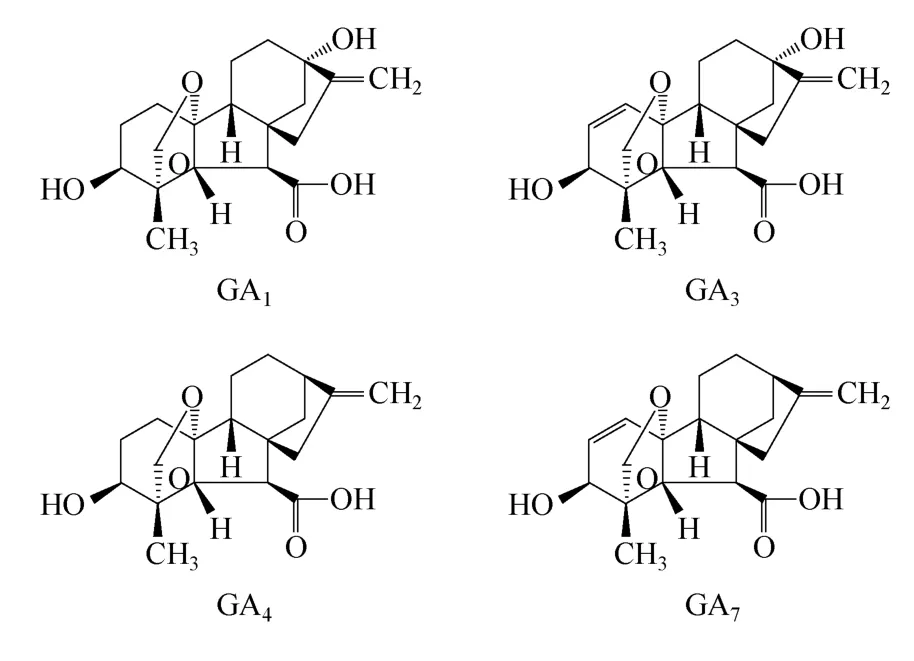
图1 赤霉素GA1、GA3、GA4、GA7的化学结构
1 赤霉素的合成途径和调控机制
赤霉素作为一种典型的微生物次级代谢产物,在发酵中只有当氮源耗尽时才开始合成[9]。尽管合成途径复杂,但研究者通过研究突变菌株、采用放射性标记等方法,已经将赤霉素合成途径阐释清晰[10-11]。同时赤霉素的合成除了受氮源调控,也受Velvet蛋白家族、信号分子等调控[12-13]。
1.1合成途径
作为一种二萜类物质,赤霉素生物合成与其他萜类物质类似,主要分为3个阶段。第一阶段是牻牛儿基牻牛儿基焦磷酸(GGPP)的合成,在真菌中它由乙酰辅酶A通过甲羟戊酸(MVA)途径合成甲羟戊酸,再经过5-磷酸甲羟戊酸、5-焦磷酸甲羟戊酸、异戊烯焦磷酸(IPP)、3,3-二甲烯丙基焦磷酸、牻牛儿基焦磷酸(GPP)、法尼基焦磷酸(FPP)而得到[14];而在植物中IPP合成主要是通过甲基赤藻糖磷酸(MEP)途径,由丙酮酸和3-磷酸甘油醛经过多步催化反应合成IPP,后续合成GGPP则与真菌类似。第二阶段是GA12-醛的合成,是由GGPP经过古巴焦磷酸合成酶(CPS)和内根-贝壳杉烯合成酶(KS)催化,第一次环化合成内根-贝壳杉烯,该反应为赤霉素合成的限速步骤[15];内根-贝壳杉烯的C-19位的甲基经细胞色素P450-4单氧化酶的一系列催化下合成内根-贝壳杉烯酸,内根-贝壳杉烯酸再经过P450-1单氧化酶两步催化合成GA12-醛。在此阶段中,高等植物和真菌的赤霉素合成途径是基本相似的[16]。第三阶段赤霉素的合成,在真菌中GA12-醛首先经过羟基化合成GA14-醛,再经过一系列催化步骤合成GA3;而在高等植物中GA12-醛先经过19C的氧化合成GA12,再经过一系列氧化去饱和合成GA1等[17-19]。具体合成途径如图2所示。
1.2调控机制
类似于其他微生物次级代谢产物,在高浓度氮源条件下赤霉素合成基因表达受到严格的限制。在藤仓赤霉的发酵中只有在氮源限制时赤霉素才被大量合成[20]。研究表明赤霉素是第一个严格依赖GATA型的转录因子AreA的次级代谢产物。转录因子AreA能够直接结合到赤霉素合成基因的启动子上,进而调控赤霉素合成基因的表达[21]。近年MICHIELSE等[22]发现第二个GATA转录因
子——AreB,也是赤霉素合成基因表达所必不可少的。在藤仓赤霉中,谷氨酰胺合成酶(glutamine synthetase)是另一个次级代谢产物的调控因子,也是合成谷氨酰胺的唯一酶。谷氨酰胺是最容易利用的氮源,其较高浓度时强烈抑制所有氮源限制基因的表达。当谷氨酰胺合成酶被移除后,细胞内谷氨酰胺的浓度处于较低水平,赤霉素合成基因则会大量表达。然而有学者发现当编码谷氨酰胺合成酶的基因GLN1被敲除后,相反所有赤霉素合成基因表达水平均下降,导致赤霉素的产量降低[23]。在藤仓赤霉中Velvet蛋白家族的全局调控因子FfVel1、FfVelB也影响赤霉素合成基因的表达。FfVel1能够促进赤霉素的合成。当它被移除后几乎不合成赤霉素[24]。任何次级代谢产物的合成均是应对某种环境因素的刺激。腺苷酸环化酶(adenylyl cyclase)能够刺激合成环磷酸腺苷(cAMP),随后激活蛋白激酶A(Pka)。而Pka能对目的蛋白进行磷酸化修饰,从而改变蛋白活性[25]。MICHIELSE等[13]与GARCÍA-MARTÍNEZ等[26]研究均发现在藤仓赤霉中,当腺苷酸环化酶编码基因被敲除后,细胞内赤霉素的积累水平急剧下降。

图2 赤霉素生物合成途径
2 菌 种
自1959年日本科学家首次将赤霉素从水稻病原菌的培养基中分离出来,逐渐发现赤霉素广泛存在于植物、微藻以及部分真菌和细菌中。虽然植物中含有多种赤霉素,但含量较少,仅仅满足自身需求,不适合工业化生产。目前用于工业化生产的是丝状真菌藤仓赤霉(Fusarium fujikuroi),具有易于培养、产量高等优点。在藤仓赤霉菌菌种的研究方面,外国学者早期主要集中于通过物理诱变或化学诱变,或通过原生质体化及再生作用,得到了大量有关赤霉素合成途经缺失的突变体,以分析赤霉素的合成途径。例如BEARDER等[27]通过紫外诱变获得突变菌株B1-41a,其内根-贝壳杉烯氧化酶基因缺失无法合成赤霉素。CANDAU等[28]通过亚硝基胍诱变获得突变菌株SG123、SG133,其C-13羟化酶的基因缺失导致不能合成GA3而是大量积累GA7。LALE等[29]通过紫外诱变获得菌丝长度较短的突变菌株,有利于提高发酵过程中的溶氧水平,GA3产量提高近两倍。而国内关于赤霉素高产菌株研究主要开始于“九二零菌种选育协作组”所筛选到的高产变种“4303”,该菌成为国内工业化生产上主要菌株。但是该菌为营养繁殖,无法生产孢子且为多核菌丝,给后续诱变带来困难。近年来研究者主要通过制备原生质体进行诱变筛选高产菌株。例如余卿等[30]对赤霉素生产菌株85104的原生质体进行紫外诱变获得高产菌株,产量提高近32%。李武军等[31]通过对藤仓赤霉菌207融合重组诱变获得高产菌株,产量提高近25%。张金儿、王卫[32-34]等采用氯霉素、脂肪酶、制菌霉素、萘比特芬等不同的半理性、理性的筛选方法获取高产菌株。本文作者课题组在菌种选育方面也做了不少工作,已通过常压常温等离子体诱变(ARTP)以及采用酮康唑为筛选压力获得赤霉素产量较高且遗传稳定的优势菌株。近年来国内外主要赤霉素高产菌株研究概况如表1所示。

表1 不同赤霉素高产菌株研究概况
3 发酵过程
发酵过程的优化与优良菌种一样是提高产物产量必不可少的策略。发酵过程优化主要包括对最佳营养因素、发酵条件、发酵工艺的研究与探索。研究者发现藤仓赤霉的发酵过程的参数以及发酵工艺对赤霉素的产量和品质影响巨大。
3.1营养因素
3.1.1氮源
氮源的浓度和种类对发酵产赤霉素至关重要,因为赤霉素只有在氮源限制的情况下才开始合成[45]。所有的研究都指出高浓度的赤霉素含量均是在低浓度的氮源条件下才能积累[46]。常用的无机氮源有硫酸铵、氯化铵,有机氮源有甘氨酸、酒石酸铵、植物粉、玉米浆等[47]。GOHLWAR等[48]发现在乳清培养基中添加含氮化合物时,生物量会急剧增加,但赤霉素的含量却在降低。而VASS等[49]发现在低溶度的铵盐或者硝酸盐的培养基中添加少量的玉米浆、花生粉、大豆粉等能够促进赤霉素的合成。原因可能是这些复合物中含有赤霉素合成的前体物质或者促进剂。CANDAU等[50]发现无论是发酵开始存在或者中途添加硝酸根离子、铵根离子和谷氨酰胺都会抑制赤霉素的合成。SANCHEZ-FERNANDEZ等[51]同样发现包括尿素和氨基酸都是赤霉素合成的抑制剂。LALE等[52]研究发现当用小麦蛋白代替脱脂豆粕作为氮源时,GA3的含量大大降低,而GA4的含量却增加了两倍多。本文作者课题组通过对十余种氮源进行筛选,发现脱脂豆粕为最优氮源。这说明氮源的种类还会影响赤霉素合成途径中酶的活性。
3.1.2碳源
不同的研究者尝试过不同种类的碳源用来生产赤霉素。主要可以分为速效碳源和迟效碳源,两者也经常以不同的比例混合使用。葡萄糖和蔗糖是经常使用的两种碳源,但葡萄糖的初始浓度不能超过20%,否则会引起代谢抑制阻断赤霉素的合成[46]。GONZÁLLEZ等[53]发现蔗糖和淀粉的混合物是发酵产赤霉素的最优碳源。GANCHEVA等[54]发现在发酵中添加油脂,例如葵花籽油、大豆油,有利于提高赤霉素的产量。主要原因可能是由于赤霉素合成中需要乙酰辅酶A的提供,而油脂代谢过程能够提供大量乙酰辅酶A;另外油脂作为碳源也不会引起碳代谢抑制。一些廉价的工业废料如牛奶乳清、甜菜渣、糖蜜也常作为碳源使用。而国内赤霉素的工业化生产大多使用经过淀粉酶液化的淀粉作为碳源,这样不仅可以降低成本,而且还可同时提供速效碳源(如葡萄糖)和迟效碳源(如糊精、淀粉),供细胞生长和赤霉素积累的需要。
3.1.3无机盐与微量物质
除了碳源、氮源,镁、钾、锌等无机盐也是
赤霉素积累的必须营养因素。JEFFERYS[55]发现,添加单种金属离子时,微量锌能有效促进藤仓赤霉产赤霉素;添加多种金属离子时,锌、钼、铜的共同作用能有效促进藤仓赤霉产赤霉素。而其他微量物质作为前体或者促进剂的添加对赤霉素的合成也有一定的促进作用,例如,维生素B1、谷氨酸等。CIHANGIR[56]发现在黑曲霉发酵产赤霉素时添加少量的甲羟戊酸时,赤霉素的产量可以提高近50mg/L。
3.2发酵参数
3.2.1pH
pH是对发酵产赤霉素影响最大的因素之一,它主要影响赤霉素的含量以及赤霉素的种类。对于GA3的生产,pH值主要在3.5~5.8之间,过高(>6.0)则偏向于生产GA4和GA7,过低(<3.5)则偏向于生产GA1[6]。主要原因可能是过高pH促进中间代谢物GA4和GA7等分泌到胞外而不能再转运回胞内继续合成终产物GA3,另外的原因可能pH影响赤霉素合成途径中的酶的活性[57]。MELEIGY等[43]在串珠镰孢发酵产赤霉素时发现在pH为5时,总赤霉素产量为2.25g/L;当pH为3和7时,总赤霉素的产量分别为0.36g/L和0.21g/L。在固体发酵中,pH测定比较复杂。因而固体发酵产赤霉素时,一般很少考虑pH。ESCAMILLA等[41]在固定化发酵中发现初始pH为5时赤霉素产量最高。
3.2.2温度
温度对赤霉素产量的影响与菌株的种类相关。利用藤仓赤霉或者串珠镰孢发酵产赤霉素时,提出过的最适温度分别有25℃、27℃、28℃、29℃、30℃[58-61]。JEFFERYS[55]发现在藤仓赤霉中31~32℃利于菌体生长,而29℃更利于产物赤霉素的合成,高于29℃赤霉素的产量则急剧下降。MELEIGY等[43]发现在串珠镰孢培养中发现,在30℃时赤霉素的产量最高可达1.84g/L。随着温度的升高赤霉素的产量开始下降,直到40℃时赤霉素的合成受到抑制。ESCAMILLA等[41]发现在流化床中培养固定化藤仓赤霉产赤霉素时,在30℃时赤霉素的产量最高。
3.2.3溶氧
赤霉素发酵过程是需氧过程,整个发酵过程都需要充足氧气的供应。除了菌体正常生长所需的氧气,赤霉素的合成也需要大量氧气的参与。因为在赤霉素合成途径中涉及到许多氧化步骤,如细胞色素P450单加氧酶、双加氧酶、脱氢酶所催化的反应都需要氧气的参与,所以在赤霉素生产过程合适的溶氧供给至关重要[62]。当发酵过程中溶氧供应过低时会导致菌丝体内的代谢发生改变,厌氧呼吸产生大量对细胞有毒害作用的乙醇、乙酸等;同时赤霉素的合成受到抑制并产生大量的副产物;造成pH急剧下降,菌丝体自溶,发酵终止,从而产量偏低。在实际生产中,可以通过提高转速、通气量,添加氧载体、表面活性剂以及改变发酵方式等保证氧气的供应。但是发酵过程中并不是溶氧越高越好,当溶氧过高时,不但会造成溶氧过剩提高生产成本,而且也会造成一些副产物的大量合成如脂肪酸等,赤霉素的产量反而降低。BORROW等[63]发现在通气中加入少量的二氧化碳能够大大减少延滞期,GA3的最终产量达0.62g/L,而不添加二氧化碳赤霉素的产量仅仅0.42g/L。MACHADO等[64]在固体发酵期间发现在发酵72h之前提供较低的溶氧[0.24L/(h·kg)],而在其后提供高供氧[0.72L/(h·kg)],GA3的产量可达到最高。庄木坤[65]通过基因工程手段将透明颤菌血红蛋白基因(vgb)整合到藤仓赤霉菌染色体中,得到转化菌株,该工程菌对发酵过程中溶氧的需求降低,从而降低发酵成本,在低溶氧条件下也能获得较高赤霉素的产量。
3.3发酵工艺
赤霉素的发酵工艺有着长足的发展历史。最早由日本学者通过表面培养方式产赤霉素,但产量极低[66]。随着固体发酵技术的成熟以及固体发酵法生产具有设备简单、操作容易等优点,赤霉素的固体发酵在20世纪五六十年代已成功应用。FOCKE等[67]第一次利用玉米废弃物作为固体培养基生产赤霉素。后来研究者发现利用麦麸替换玉米废弃物赤霉素的产量能够提高1.6倍[68]。KUMAR等[69]指出在同等含量的碳水化合物的培养基中,在固体发酵中赤霉素的产量可以达到液体发酵的1.6倍。RODRIGUES等[42]发现利用柠檬果肉作为底物时赤霉素的产量可达5.9g/kg。但固体发酵也存在一些明显的缺点,如固体发酵过程稳定性差,各项参数(pH、溶氧、温度等)不易检测与控制,无法实现大规模工业生产。现在赤霉素工业化生产多采用液体深层发酵。人们对赤霉素液体发酵的研究,除了对营养因素、发酵参数、前体的添加等研究之外,也对不同的液体发酵工艺进行尝试。SHUKLA等[44]采用反复分批发酵方式,赤霉素的产量为1.31g/L,大大缩短了发酵周期,降低了发酵成本。连续发酵也成功应用于赤霉素的生产,不过由于生产成本过高,并没有在大规模工业生产中应用[70]。近年来由于固定化发酵技术的成熟以及该技术的经济性,很多学者都对赤霉素生产菌的固定化发酵进行研究[71-74]。常用的固定化材料有聚氨酯、卡拉胶、海藻酸钙、硅藻土等。ESCAMILLA等[41]在流化床中培养固定化的藤仓赤霉产GA3,通过优化pH、碳氮比、米粉浓度和温度后,产物的浓度是之前悬浮和固体发酵浓度的3倍以上。但固定化大规模生产赤霉素也存在很多问题,例如菌种的退化、无菌环境的维持、发酵过程的控制等。随着固定化材料、生物反应器、发酵过程控制的发展,大规模固定化生产赤霉素将会实现。由于赤霉素发酵中存在产物反馈抑制和赤霉素在水溶液中易于降解失去生物活性的问题导致产量降低,研究者通过采取萃取发酵工艺解决以上问题。例如HOLLMANN等[75]发现通过萃取发酵赤霉素的产量提高了近2倍。但是该工艺存在价格昂贵等问题,难以大规模工业化生产。
4 分离纯化
赤霉素的分离纯化过程中主要关键问题在于保持赤霉素的活性、高得率和高纯度。最早用于赤霉素分离的方法是活性炭吸附法。该法先利用活性炭吸附赤霉素,然后再通过甲醇或者丙酮萃取获取产量。该方法价格昂贵,效率低下,不宜大规模生产使用[76]。20世纪60年代后主要的分离方法为有机溶剂的液液萃取。常用的有机溶剂有乙酸乙酯、乙酸丁酯、丁醇等。该法的纯化效率可达40%以上。但是该方法需要大量的有机溶剂,回收成本昂贵,同时萃取过程中不可避免的会带来一些色素、有机酸等副产物。第三种常用的分离纯化方法为吸附法,主要分为吸附树脂分离法和离子交换分离法。吸附树脂分离法主要通过树脂对赤霉素的选择性吸附富集,再用有机溶剂洗脱下来。常用的树脂是大孔吸附树脂。王瑞芳等[77]通过大孔树脂吸附法提纯赤霉素,最终收率高达95%。由于赤霉素为一种弱酸,常采用强碱性阴离子交换树脂,对赤霉素离子交换提纯。万金保等[78]利用强碱性苯乙烯系阴离子交换树脂提纯赤霉素,总收率达到80%。目前工业化生产逐渐采用膜分离法。因为膜分离法具有分离条件温和、分离效率高、能耗低等优点。但是也存在膜的使用周期短以及价格昂贵的缺点。因此研究新型廉价、耐用的分离膜是进一步促进膜分离法大规模应用的关键问题。
5 展 望
赤霉素作为一种植物激素主要对植物生长具有多种生理功能,已广泛应用于农业、林业、酿造业等行业。目前赤霉素的生产主要通过液体深层发酵方式,产量维持在2g/L左右。但是由于发酵产量一直无法提升,生产成本居高不下,导致赤霉素无法大规模应用。今后的研究应该集中于以下两个方面。
(1)优良的菌种是提高发酵水平最关键的因素之一。菌株的选育应该从两方面研究,一是采取新型的诱变方法(常温常压等离子体诱变、γ射线诱变等)以及高通量的筛选方法,以一种理性诱变方式获取高产菌株;二则通过合成生物学方法在大肠杆菌或者酿酒酵母等模式生物中构建赤霉素合成途径,获得高产赤霉素工程菌。
(2)进一步对藤仓赤霉发酵过程进行优化。首先根据藤仓赤霉内赤霉素合成的调控机制来优化宏观的发酵条件,以微观指导宏观,其次改变传统的发酵方式,如采用新型的生物反应器,达到提高赤霉素产量的目的。
(3)开发高效低耗的赤霉素分离纯化工艺,以较低成本获取高品质的赤霉素产品。
[1] MACMILLAN J,TAKAHASHIT N. Proposed procedure for theallocation of trivial names to the gibberellins[J]. Nature,1968,217:170-171.
[2] HEDDEN P,THOMAS S G. Gibberellin biosynthesis and its regulation[J]. Biochem. J.,2012,444:11-25.
[3] BŐMKE C,TUDZYNSKI B. Diversity,regulation,and evolution of the gibberellin biosynthetic pathway in fungi compared to plants and bacteria[J]. Phytochemistry,2009,70:1876-1893.
[4] RIVIER L,CROZIER A. Principles and practice of plant hormone analysis[M]. London:Academic Press,1987:1-401.
[5] MANDER L N. Twenty years of gibberellin research[J]. Natural Product Reports,2003,20:49-69.
[6] BURCKNER B,BLECHSCHMIDT D. The gibberellin fermentation[J]. Crit. Rev. Biotech.,1991,11:163-192.
[7] MACMILLAN J. Occurrence of gibberellins in vascular plants,fungi,and bacteria[J]. Journal of Plant Growth Regulation,2001,20:387-442.
[8] SHUKLA R,CHAND S,Srivastava A K. Improvement of gibberellic acid production using a model based fed-batch. Cultivation of Gibberella fujikuori[J]. Proc. Biochem.,2005,40:2045-2050.
[9] SHUKLA R,SRIVASTAVA AK,CHAND S. Bioprocess strategies and recovery processes in gibberellic acid fermentation[J]. Biotech.ogy and Bioprocess Engineering,2003,8:269-278.
[10] HEDDEN P,MACMILLAN J,PHINNEY B O. The metabolism of the gibberellins[J]. Ann. Rev. Plant Physiol.,1978,29:149-192.
[11] HEDDEN P,KAMIYA Y. Gibberellin biosynthesis:enzymes,genes and their regulation[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1997,48:431-60.
[12] WIEMANN P,WILLMANN A,BROWN DW,et al. FfVel1 and FfLae1,components of a Velvet-like complex in Fusarium fujikuroi,affect differentiation,secondary metabolism and virulence[J]. Mol. Microbiol.,2010,77:972-994.
[13] MICHIELSE C B,STUDT L,JANEVSKA S,et al. The global regulator FfSge1 is required for expression of secondary metabolite gene clusters but not for pathogenicity in Fusarium fujikuroi[J]. Environmental Microbiology,2015,17(8):2690-2708.
[14] DOMENECH C E,GIORDANO W,AVALOS J. Separate compartments for the production of sterols,carotenoids and gibberellins in Gibberella fujikuroi[J]. Eur. J. Biochem.,1996,239:720-725.
[15] HEDDEN P,KAMIYA Y. Gibberellin biosynthesis:enzymes,genes and their regulation[J]. Annu. Rev. Plant. Physiol. Plant. Mol. Boil.,1997,48:431-460.
[16] TUDZYNSKI B. Gibberellin biosynthesis in fungi:genes,enzymes,evolution,and impact on biotechnology[J]. Appl. Microbiol. Biotech.,2005,66:597-611.
[17] HEDDEN P,SPONSEL V M. A century of gibberellin research[J]. J. Plant Growth Regul.,2015,34:740-760.
[18] 谈心,马欣荣.赤霉素生物合成途径及其相关研究进展[J].应用与环境生物学报,2008,14(4):571-577.
[19] BŐMKE C,TUDZYNSKI B. Diversity,regulation,and evolution of the gibberellin biosynthetic pathway in fungi compared to plants and bacteria[J]. Phytochemistry,2009,70:1876-1893.
[20] BU'LOCK J,DETROY R,HOSTALEK Z. Regulation of secondary biosynthesis in Gibberella fujikuroi[J]. Trans Br. Mycol. Soc.,1974,62:377-389.
[21] MIHLAN M,HOMANN V,TUDZYNSKI B. AREA directly mediates nitrogen regulation of gibberellin biosynthesis in Gibberella fujikuroi,but its activity is not affected by NMR[J]. Mol. Microbiol.,2003,47:975-991.
[22] MICHIELSE C B,PFANNMUELLER A,MACIOS M,et al. The interplay between the GATA transcription factors AreA,the global nitrogen regulator and AreB in Fusarium fujikuroi[J]. Mol. Microbiol.,2014,91(3):472-493.
[23] TEICHERT S,SCHŐNIG B,RICHTER S. Deletion of the Gibberella fujikuroi glutamine synthetase gene has significant impact on transcriptional control of primary and secondary metabolism[J]. Mol. Microbiol.,2004,53:1661-1675.
[24] WIEMANN P,WIEMANN A,BROWN DW,et al. FfVel1 and FfLae1,components of a Velvet-like complex in Fusarium fujikuroi,affect differentiation,secondary metabolism and virulence[J]. Mol. Microbiol.,2010,77:972-994.
[25] STUDT L,HUMPF HU,TUDZYNSKI B. Signaling governed by G proteins and cAMP is crucial for growth,secondary metabolism and sexual development in Fusarium fujikuroi[J]. PloS One,2013,8(2):e58185.
[26] GARCÍA-MARTÍNEZ J,ADĂM AL,AVALOS J. Adenylyl cyclase plays a regulatory role in development,stress resistance and secondary metabolism in Fusarium fujikuroi[J]. PLoS One,2012,7(1):e28849.
[27] BEARDER J R,MACMILLAN J,WELS CM,et al. Position of the metabolic block for gibberellin biosynthesis in mutant B1-41a of Gibberella fujikuroi[J]. Phytochemistry,1974,13:911-917.
[28] CANDAU R,AVALOS J,CERDAA-OLMEDO E. Gibberellins and carotenoids in the wild type and mutants of Gibberella fujikuroi[J]. Appl. Environ. Microbiol.,1991,57:3378-3382.
[29] LALE G,JOGDAND VV,GADRE RV. Morphological mutants of Gibberella fujikuroi for enhanced production of gibberellic acid[J]. J. Appl. Microbiol.,2006,100:65-72.
[30] 余卿,覃红,汪育同,等.赤霉素产生菌85104菌株原生质体的形成再生和紫外光对原生质体诱变条件的研究[J].微生物学杂志,1987,6(2):3-7.
[31] 李武军,郑幼霞.赤霉素生产菌-藤仓赤霉菌融合重组的研究[J].微生物学报,1995,35(4):271-274.
[32] 张金儿,朱江萍,刘义雄,等.从氯霉素抗性突变株筛选赤霉素高产菌株[J].中国抗生素杂志,2005,3(5):301-303.
[33] 王卫,李忠海,黎继烈,等.W脂肪酶为指标筛选赤霉素高产苗株的研究[J].工业微生物,2011,41(1):51-54.
[34] 王卫,李忠海,黎继烈,等.利用特比蔡芬抗性筛选赤霉素高产菌株及相关发酵特性的研究[J].微生物学通报,2014,42(9):1837-1842.
[35] 王继刚,陈守文,喻子牛.豆油对藤仓赤霉苗978菌株产赤霉素GA发酵的影响[J].华中农业大学学报,2005,24(5):470-473.
[36] 李明森,赵祥颖,刘建军,等.菌株SFGi-1产赤霉素固体发酵条件的研[J].山东食品发酵,2012(1):3-8.
[37] 刘文芳,赵祥颖,田延军,等.菌株SFGi-1产赤霉素发酵条件的研究[J].中国酿造,2010,219(6):117-120.
[38] 王卫,李忠海,黎继烈,等.海藻酸钙固定赤霉菌菌丝产素的研究[J].中国生物工程杂志,2012,32(1):36-41.
[39] PASTRANA L M,GONZALEZ M P,MURDO M A. Production of gibberellic acid from mussel processing wastes in submerged batch culture[J]. Bioresource Technology,1993,45:213-221.
[40] CORONA A,SANCHEZ D,AGOSTIN E. Effect of water activity on gibberellic acid production by Gibberella fujikuroi under solidstate fermentation conditions[J]. Process Biochemistry,2005,40:2655-2658.
[41] ESCAMILLA E M,DENDOOVEN L,MAGAŇA I P,et al. Optimization of gibberellic acid production by immobilized Gibberella fujikuroi mycelium in fluidized bioreactors[J]. Journal ofBiotechnology,2000,76:147-155.
[42] RODRIGUES C,VANDENBERGHE LPS,TEODORO J,et al. A new alternative to produce gibberellic acid by solid state fermentation[J]. Brazilian Archives of Biology and Technology,2009,52:181-188.
[43] MELEIGY S A,KHALAF M A. Biosynthesis of gibberellic acid from milk permeate in repeated batch operation by a mutant Fusarium moniliforme cells immobilized on loofa sponge[J]. Bioresource Technology,2009,100:374-379.
[44] SHUKLA R,CHAND S,SRIVASTAVA A K. Production of gibberellic acid by multiple fed-batch cultivation of Gibberella fujikuroi[J]. Chem. Biochem. Eng. Q,2007,21(2):159-162.
[45] BORROW A,BROWN S,JEFFERYS E G,et al. The kinetics of metabolism of Gibberella fujikuroi in stirred culture[J]. Canadian Journal of Microbiology,1964,10:407-444.
[46] SILVA E M E,DENDOOVEN L,REYNELL J A U,et al. Morphological development and gibberellin production by different strains of Gibberella fujikuroi in shake flasks and bioreactor[J]. World J. Microbiol. Biotech.,1999,15:753-755.
[47] KUMAR P K R,LONSANE B K. Microbial production of gibberellins:state of the art[J]. Advances in Applied Microbiology,1989,34:29-139.
[48] GOHLWAR C S,SETHI R P,MARWAHA S S,et al. Gibberellic acid biosynthesis from whey and simulation of cultural parameters[J]. Enz. Microbial. Technol.,1984,6:312-316.
[49] VASS R C,JEFFERYS E G.. Gibberellic acid,secondary products of metabolism[M]. London:Aeademie Press,1979:421-433.
[50] CANDAU R,AVALOS J,CERDA-OLMEDO E. Regulation of gibberellin biosynthesis in Gibberella fujikuroi[J]. Plant Physiol.,1992,100:1184-1188.
[51] SANCHEZ-FEMANDEZ R,AVALOS J,CERDA-OLMEDO E. Inhibition of gibberellin biosynthesis by nitrate in Gibberella fujikuroi[J]. FEBS Lett.,1997,413:35-39.
[52] LALE G,GADRE R. Enhanced production of gibberellin A4(GA4)by a mutant of Gibberella fujikuroi in wheat gluten medium[J]. J. Ind.Microbiol. Biotech.,2010,37:297-306.
[53] GONZÁLLEZ P C,DELGADO G,ANTIGUA M,et al. Some aspects of Gibberella fujikuroi culture concerning gibberellic acid production[M]// Adv. Bioproc. Eng.,Berlin:Springer Netherlands,1994:425-430.
[54] GANCHEVA V,DIMOVA T,KAMENOV K,et al. Biosynthesis of gibberellins:Ⅲ. Optimization of nutrient medium for biosynthesis of gibberellins upon using mathematical methods for planning the experiment[J]. Acta. Microbiol. Bulg.,1984,14:80-84.
[55] JEFFERYS E G. The gibberellin fermentation[J]. Adv. Applied Microbiol.,1970,13:283-316.
[56] CIHANGIR N F. Stimulation of the gibberellic acid synthesis by Aspergillus niger in submerged culture using a precursor[J]. World Journal of Microbiology & Biotechnology,2002,18:727-729.
[57] BEARDER J R. In vivo diterpenoid biosynthesis in Gibberella fujikuroi:the pathway after entkaurene[M]//The biochemistry and physiology of gibberellins. New York:Praeger,1983:251.
[58] KAHLON S S,MALHTRA S. Production of gibberellic acid by fungal mycelium immobilized in sodium alginate[J]. Enz. Microb. Technol.,1986,8:613-616.
[59] BANDELIER S,RENAUD R,DURAND A. Production of gibberellic acid by fed-batch solid state fermentation in as aseptic pilot-scale reactor[J]. Process Biochemistry,1997,32:141-145.
[60] UTHANDI S,KARTHIKEYAN S,SABARINATHAN K G. Gibberellic acid production by Fusarium fujikuroi SG2[J]. Journal of Scientific & Industrial Research,2010,69:211-214.
[61] BERRIOS J,PYLE D L,AROCA G. Gibberellic acid extraction from aqueous solutions and fermentation broths by using emulsion liquid membranes[J]. Journal of Membrane Science,2010,348:91-98.
[62] TUDZYNSKI B. Biosynthesis of gibberellin in Gibberella fujikuroi biomolecular aspects[J]. Appl. Microbiol. Biotech.,1999,52:298-310.
[63] BORROW A,KESSELL R H J,JEERYS E G,et al. The metabolism of Gibberella fujikuroi in stirred culture[J]. Canadian Journal of Microbiology,1961,7:227-234.
[64] MACHADO C M M,OISHI B,PANDEY A,et al. Kinetics of Gibberella fujikuroi growth and gibberellic acid production by solid-state fermentation in a packed-bed column bioreactor[J]. Biotechnology Progress,2004,20:1449-1453.
[65] 庄木坤.赤霉素高产菌株的改造与发酵研究[D].武汉:华中农业大学,2007.
[66] REHM H J. Industrielle microbiologie[M]. New York:Springer. 1980.
[67] FOCKE I,SEMBDNER G,SCHREIBER K. Der Einfluβ komplexer Nährsubstrate auf die Gibberel-linbildung von Fusarium moniliforme Sheld[J]. Biol. Zbl.,1967,86:509.
[68] KUMAR P K P,LONSANE B K. Potential of fed-batch culture in solid state fermentation for production of gibberellic acid[J]. Biotech. Lett.,1987,9:179-182.
[69] KUMAR P K P,LONSANE B K. Gibberellic acid by solid-state fermentation:consistent and improved yields[J]. Biotech. Bioeng.,1987,30:267-271.
[70] HOLME T,ZACHARIAS B. Gibberellic acid fermentation in continuous culture[J]. Biotech. Bioeng.,1965,7:405-415.
[71] HEINRICH M,REHIN L A. Growth of Fusarium monoliforme on n-alkanes:comparison of an immobilization method with conventional process[J]. Eur. J. Appl. Microbiol. Biotech.,1981,11:139-145.
[72] SURINDER S S,MALHOTRA S. Production of gibberellic acid by fungal mycelium immobilized in sodium alginate[J]. Enz. Microbiol. Technol.,1986,8:613-616.
[73] JONES A,PHARIS R P. Production of gibberellins and bikaverin by cells of Gibberella fujikuroi immobilized in carrageeanan[J]. J. Ferment. Technol.,1987,65:717-722.
[74] LU Z X,XIE Z C,KUMAKURA M. Production of gibberellic acid in Giberella fujikoroi adhered onto polymeric fibrous carriers[J]. Proc. Biochem.,1995,30(7):661-665.
[75] HOLLMANN D,SWITALSKI J,GEIPEL S,et al. Extractive fermentation of Gibberellic acid by Gibberella fujikuroi[J]. Journal of Fermentation and Bioengineering,1995,79:594-600.
[76] 严希康.吸附法提取赤霉素的研究[J].微生物学通报,1990(3):175-178.
[77] 王瑞芳,杨佳玲,史作清,等.树脂吸附法纯化赤霉素[J].离子交换与吸附,2007,23(3):252-258.
[78] 万金保,孙日圣,林波,等.离子交换法提取赤霉素工艺研究[J].江西农业大学学报,1993,15(1):9-18.
Fermentative production of gibberellins:a review
PENG Hui1,SHI Tianqiong1,NIE Zhikui2,GUO Dongsheng1,HUANG He1,JI Xiaojun1
(1State Key Laboratory of Materials-Oriented Chemical Engineering,College of Biotechogy and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211816,Jiangsu,China;2Jiangxi New Reyphon Biochemical Co.,Ltd.,Xingan 331300,Jiangxi,China)
Gibberellins(GAs)are one of the five plant hormones which play an important role in plant growth and development. They affect stem elongation,seed germination,elimination of dormancy,flowering and so on. Gibberellins have been widely used in the agriculture,forestry and brewing industries,and have brought great economic benefits. The industrial production of gibberellins is based on submerged fermentation by Fusarium fujikuroi. Although gibberellins have a diversity of applications and huge economic benefits,high production costs severely restrict their widespread application. This review summarizes the metabolic pathway and the regulatory mechanism for gibberellins biosynthesis. Also,the strains,nutritional factors,fermentation conditions,fermentation techniques and separation and purification process are discussed in detail. Meanwhile,it is pointed out that the focus of future research should be placed on screening high-yield strains as well as improving fermentation technology,in order to reduce the production cost and achieve large-scale application of gibberellins.
gibberellins;terpene;fermentation;Fusarium fujikuroi
Q 939.97
A
1000-6613(2016)11-3611-08
10.16085/j.issn.1000-6613.2016.11.034
2016-04-12;修改稿日期:2016-07-15。
国家自然科学基金(21376002,21476111)、江苏省自然科学基金(BK20131405)及江苏高校优势学科建设工程项目。
彭辉(1992—),男,硕士研究生。联系人:纪晓俊,副教授,研究方向为微生物代谢工程。E-mail xiaojunji@njtech.edu.cn。
