溶藻弧菌III型分泌系统vscP基因的克隆与生物信息学分析
2016-11-12庞欢瑛简纪常鲁义善汤菊芬吴灶和
李 静,庞欢瑛,简纪常,鲁义善,汤菊芬,吴灶和
(1.广东海洋大学水产学院,广东 湛江 524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088;3.广东省教育厅水产经济动物病害控制重点实验室,广东 湛江 524088;4.仲恺农业工程学院,广东 广州 510225)
溶藻弧菌III型分泌系统vscP基因的克隆与生物信息学分析
李静1,2,3,庞欢瑛1,2,3,简纪常1,2,3,鲁义善1,2,3,汤菊芬1,2,3,吴灶和2,3,4
(1.广东海洋大学水产学院,广东湛江524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江524088;3.广东省教育厅水产经济动物病害控制重点实验室,广东湛江524088;4.仲恺农业工程学院,广东广州510225)
根据NCBⅠ上登录的溶藻弧菌(Vibrio alginolyticus)全基因组序列,设计一对克隆溶藻弧菌HY9901株ⅠⅠⅠ型分泌系统“分子尺”蛋白 VscP全长基因的特异性引物,PCR扩增获得基因的全长片段。结果显示,vscP(GenBank登录号FR780678)开放阅读框ORF为1 206 bp,共编码401个氨基酸残基。根据推导的氨基酸序列预测其分子质量约为44.4 ku,等电点为5.72。Signal 4.1 Server和TMHMM Server 2.0预测结果表明,VscP无信号肽与跨膜结构域。SoftBerry-Psite预测结果显示,VscP含有3个N端糖基化位点,2个cAMP及cGMP依赖性蛋白激酶磷酸化位点,5个蛋白激酶C磷酸化位点,9个酪蛋白激酶ⅠⅠ磷酸化位点,2个N端豆蔻酰基化位点,1个酰胺化位点和3个微体C末端靶信号位点。运用MEGA6.0构建的VscP系统进化树显示,溶藻弧菌VscP与副溶血弧菌(V.parahaemolyticus)聚为一簇。应用SWⅠSS-MODEL软件构建VscP亚基三维结构模型发现,其与鞭毛FilK蛋白有相似构型。
溶藻弧菌;ⅠⅠⅠ型分泌系统;基因克隆;生物信息学分析;vscP
溶藻弧菌(Vibrio alginolyticus)是一种嗜盐嗜温型的革兰阴性细菌,可引起鱼、虾、贝等养殖动物鳍间组织溃烂、表皮出血、肾脏发白、肝胰脏肿大充血等病变[1]。随着养殖环境的恶化,溶藻弧菌引起的弧菌病时有暴发[2-4],这与其产生的黏附因子、脂多糖、胞外产物、III型分泌系统、外毒素和载铁体等毒力因子密切相关[5-8]。
III型分泌系统(Type 3 secretion system,T3SS)是一种接触依赖性、宿主细胞靶向转运毒力因子的转运机制,近年来已成为病原菌的研究热点之一。溶藻弧菌通过T3SS主动将效应蛋白靶向输送到宿主细胞,诱发宿主细胞快速凋亡或自我吞噬、细胞变圆和渗透性溶胀等病理变化[6-7]。T3SS注射装置是养殖动物致病菌领域中的一项重大发现之一,目前对溶藻弧菌T3SS蛋白已有少量研究,主要集中在其生物学功能和免疫功能上[9-10],而该系统“针状样”注射装置的内腔通路尚未解释清楚。T3SS注射装置形成中空的针,从基座横跨细菌内外膜向胞外延伸并锚定于宿主,该针长度受T3SS严密的调控,而VscP蛋白是控制针长度的“分子尺”[11]。本研究通过克隆溶藻弧菌T3SS“分子尺”VscP蛋白,并对其序列特征、二级结构和三级结构等进行生物信息学分析,以初步了解溶藻弧菌“分子尺”蛋白的表征,为进一步研究“分子尺”蛋白的功能提供理论基础,也为揭示溶藻弧菌T3SS注射装置的转运机制提供依据。
1 材料与方法
1.1材料
1.1.1菌株与质粒溶藻弧菌强毒株 HY9901,分离自广东省湛江海域患病的红笛鲷鱼,并保存于广东省水产经济动物病原生物学及流行病学重点实验室(下称“本实验室”) 。大肠杆菌DH5α由本实验室保存。pMD18-T克隆载体购于大连TaKaRa生物有限公司。
1.1.2主要试剂细菌基因组DNA提取试剂盒、DNA凝胶回收试剂盒购于北京天根生化科技有限公司,ExTaq DNA聚合酶购于大连TaKaRa生物有限公司,引物合成和DNA测序均由上海生物工程有限公司完成。
1.2方法
1.2.1细菌总DNA 的提取溶藻弧菌HY9901按1∶100比例接种于TSB液体培养基,在28℃、200r/min条件下震荡培养12h以上。取适量菌液以转速10 000r/min离心2min收集菌体,参照试剂盒提取细菌基因组DNA,- 20℃保存备用。
1.2.2vscP基因的克隆对 GenBank上登录的溶藻弧菌全基因序列(登录号 GU074526)设计一对引物,上游引物P1:ATGCGCATTACCCCAACA,下游引物P2:TCATAGGTCATTCTCCGCTT。以提取的基因组DNA为模板进行PCR扩增,PCR反应体系为20μL,反应条件为:95℃ 4min;95℃ 30 s,62℃ 45 s,72℃ 1.5min,共35个循环;72℃10min。PCR扩增反应结束后,取4μL PCR产物进行1.0%琼脂糖凝胶电泳检验。余下PCR产物按照DNA凝胶回收试剂盒说明书纯化。
1.2.3目的片段的连接、转化和测序PCR纯化产物与载体pMD-18T在16℃条件下水浴10h,将连接产物转化至大肠杆菌DH5α感受态细胞,菌落PCR鉴定后阳性克隆送上海生物工程有限公司测序。
1.2.4生物信息学分析序列运用不同的在线程序和软件进行生物信息学分析(表1)。

表1 生物信息学分析所需在线程序和软件Table 1 Online program and software of bioinformatics analysis required

续表1(Continued)
2 结 果
2.1vscP基因的全长克隆
PCR扩增获得一条约1 200 bp的特异性条带(图1)。测序显示,vscP基因含有一个1 206 bp的开放阅读框(ORF),共编码401个氨基酸(图2)。将vscP基因提交至GeneBank,登录号为FR780678。
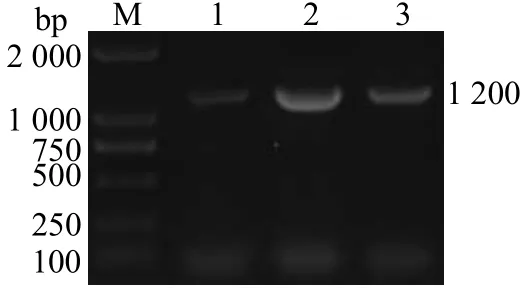
图1 vscP 基因的克隆Fig.1 Cloning of vscP gene

图2 vscP基因核苷酸及其编码的氨基酸序列Fig.2 vscP gene sequences and putative amino acid sequences
2.2vscP的理化性质
用 ExPASy 软件分析溶藻弧菌VscP 蛋白,结果显示其原子总数为 6 232,分子式为C1906H3110N564O648S4。理论分子质量为44.4232 ku,理论 pI 值为 5.72。不稳定系数 52.97,脂肪系数为74.21,总平均亲水性为- 0.941。酸性氨基酸残基(Asp + Glu)总数为60个,碱性氨基酸(Arg + Lys)总数为50个,N端是甲硫氨酸(Met)。在酵母和大肠杆菌中表达的半衰期分别大于 20h 和 10h,在哺乳动物网织红细胞中体外培养表达的半衰期为 30h。
2.3序列分析
Signal 4.1 Server程序预测发现,VscP氨基酸序列的N端信号肽结构无明显的信号肽切割位点,不存在信号肽。TMHMM Server 2.0程序预测,发现VscP蛋白无跨膜结构域。利用SoftBerry-Psite程序预测显示,VscP含有3个N端糖基化位点,2个cAMP及cGMP依赖性蛋白激酶磷酸化位点,5个蛋白激酶C磷酸化位点,9个酪蛋白激酶II磷酸化位点,2个N端豆蔻酰基化位点,1个酰胺化位点和3个微体C末端靶信号位点。蛋白质亚细胞定位预测结果显示VscP位于细胞外。
2.4同源性及进化分析
通过BLAST对溶藻弧菌HY9901强毒株VscP氨基酸序列进行同源性分析,发现溶藻弧菌VscP与弧菌属其他物种同源性较高,其中与副溶血弧菌(V.parahaemolyticus)氨基酸序列的同源性最高,达95%。多序列相似性比较表明,VscP在弧菌中是相对保守的,其高度保守区位于C-末端100多个氨基酸残基(图3)。

图3 vscP基因推导氨基酸序列同源性比较Fig.3 Multiple sequence alignments of vscP amino acid sequence with other vibrios
系统进化树显示,溶藻弧菌HY9901株III型分泌系统“分子尺”蛋白VscP与副溶血弧菌同聚一簇,表明它们在相应系统的亲缘关系较近(图4),在进化关系上极有可能源于同一个祖先。
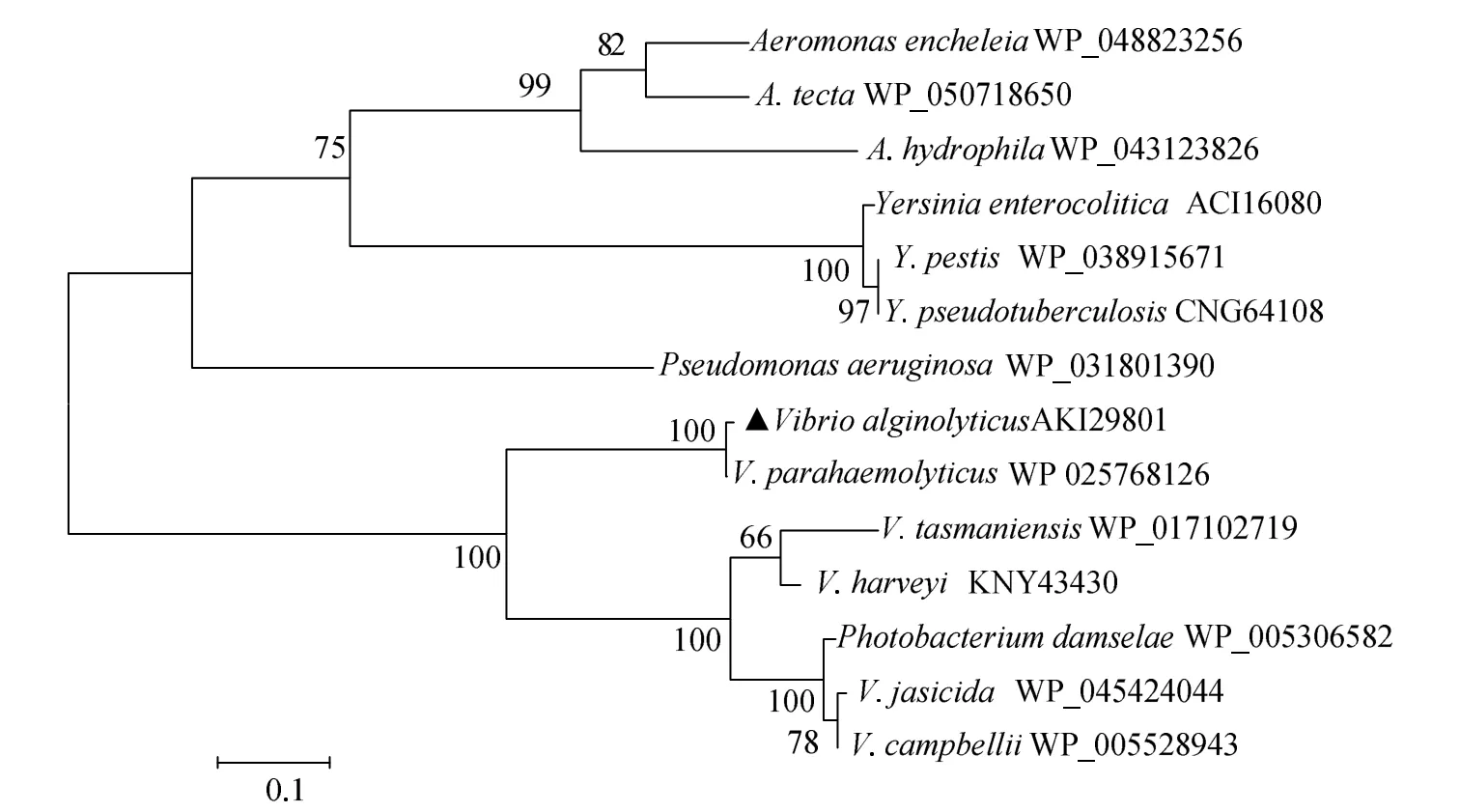
图4 基于NJ法构建的vscP氨基酸系统进化树Fig.4 Phylogenetic trees of vscP constructed by neighbour-joining method
2.5功能结构域和二级结构的预测
利用SMART 程序对VscP功能结构域预测,结果显示VscP具有一个T3S4(第369~389氨基酸)结构域(图5:A)。SOPMA软件对VscP进行二级结构的预测发现,VscP的二级结构组成为 α-螺旋占34.41%,无规则卷曲占43.64%,延伸链占15.46%,β-折叠占6.48%(图5:B)。
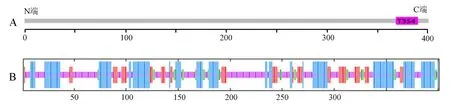
图5 VscP蛋白的结构域预测和二级结构预测Fig.5 Predicting results of the domains and secondary structure of VscP
2.6VscP的亚基结构
将VscP氨基酸序列提交至SWISS-MODEL程序,自动搜索同源蛋白,选择直系同源物FliK单亚基作为模板进行同源建模,且获得VscP单亚基三级结构预测模型,结果显示,VscP的C-端100多个氨基酸残基主要有2个α-螺旋和5个β-折叠(图6:A),与其直系同源物FliK单亚基有相似的构型(图6:B)。
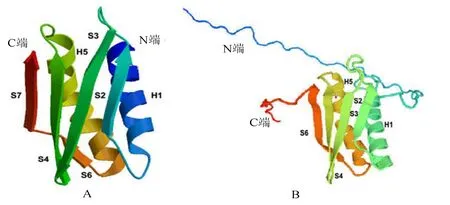
图6 溶藻弧菌VscP(A)和鞭毛FilK(B)亚基三维结构比较Fig.6 Solution structure of VscP from Vibrio alginolyticus Strain HY9901 (A) and flagellum FilK (B)
3 讨 论
溶藻弧菌的 III型分泌系统通过一连续的分子通道(一横跨细菌内外膜的针状样蛋白质结构)将分泌的效应蛋白直接从胞质转运至宿主真核细胞,该系统中的转位蛋白具有相似结构,如跨膜区段和卷曲螺旋区[12-13]。但本研究预测显示,VscP蛋白不存在跨膜区,仅在C-端有两个与鞭毛FliK相似的α-螺旋区。
不同细菌T3SS针状毒力装置均由唯一的分子标尺来调控其针的长度,如大肠杆菌的Orf6[14]、耶尔森氏菌(Yersinia)的 YscP[15]、假单胞菌(Pseudomonas)的PscP[16]、沙门氏菌(Salmonella)的 InvJ[17]和福氏志贺氏菌(Shigella flexneri)的Spa32[18]。蛋白质的N端无序多肽链连接着其C端球状结构称为“锁链”架构。Bergeron等[19]首次提出铜绿假单胞菌(Pseudomonas aeruginosa)“分子尺”PscP蛋白的“锁链”架构模型,本研究的二级结构预测显示,VscP主要以 α-螺旋和无规则卷曲为主,此二级结构亦可作为VscP具有类似PscP蛋白“锁链”架构的佐证。Agrain等[11]指出,耶尔森氏菌“分子尺”蛋白的两个独立分泌信号分别位于蛋白的第1~35和97~137氨基酸残基处。溶藻弧菌VscP二级结构的N端无序多肽链结构简单,预测其N端极可能存在与耶尔森氏菌“分子尺”蛋白功能相同的分泌信号,其位置未知。不同菌属间的“分子尺”蛋白,其分泌信号的位置不同,而两个分泌信号独立执行各自的功能,表明细菌中 III型分泌系统的“分子尺”蛋白是高度保守的。在注射装置组装的早期阶段,耶尔森氏菌YscP的分泌信号被识别后,T3SS分泌YscP来调控针长度[20]。本研究预测显示,VscP位于细胞外,由此推测溶藻弧菌VscP的分泌信号先被识别,最后被分泌至胞外发挥其调控作用,但其分泌与调控机制尚未明。
学者多认为 T3SS针状样注射装置与鞭毛有共同的祖先,也有人认为T3SS由鞭毛进化而来[21-22]。VscP单亚基三级结构预测模型发现,其与鞭毛FliK单亚基有相似的构型,该结果可为解释 T3SS的起源提供重要线索。“分子尺”蛋白具有类似鞭毛FliK蛋白的底物特异性开关(Type 3 Secretion Substrate Specificity Switch,T3S4),该开关位于蛋白的C-端结构域[11]。功能结构域预测显示,位于溶藻弧菌VscP 蛋白C-端的第369~389个氨基酸残基为调控针长度的T3S4,这与上述研究结果一致。研究表明,T3SS注射装置中的“分子尺”蛋白与YscO相互作用可引起T3SS阻塞[23],而YscP蛋白C-末端的T3S4结构域可直接与YscO发生相互作用[24]。多序列相似性比较显示,VscP的C-末端100多个氨基酸残基在弧菌中高度保守,推测VscP蛋白的T3S4结构域是揭示系统针状样装置内腔通路的关键。下一步研究将对 VscP进行分段基因缺失,对缺失株与野生株进行分析,以期揭示潜在的“分子尺”蛋白传感针长度的生成机制。
4 结 论
本研究克隆获得溶藻弧菌HY9901株T3SS的“分子尺”VscP蛋白的全基因序列。该基因 ORF为1 206 bp,编码401个氨基酸,理论分子质量为44.44 ku,理论pⅠ值为5.72。VscP氨基酸序列无信号肽,不存在跨膜区,有多个重要的功能活性位点如N-糖基化等。结构域预测显示具有一个T3S4功能域。同源性分析表明与副溶血弧菌亲缘关系较近。二级结构预测发现,VscP的二级结构组成主要以α-螺旋和无规则卷曲为主。亚基三维结构模型显示VscP与鞭毛FliK单亚基有相似的构型。
[1]SELVIN J,LIPTON A.Vibrio alginolyticus associated with white spot disease of Penaeus monodon[J].Diseases of Aquatic Organisms,2003,57(1):147-150.
[2]赖迎迢,陶家发,孙承文,等.鱼源溶藻弧菌生物学特性和病理组织学观察[J].微生物学报,2014,54(11):1378-1384.
[3]SANTHYIA A V,MULLOORPEEDIKAYIL R G,KOLLANOOR R J,et al.Molecular variations in Vibrio alginolyticus and V.harveyi in shrimp-farming systems upon stress[J].Brazilian Journal of Microbiology,2015,46(4):1001-1008.
[4]SPERLING L,ALTER T,HUEHN S.Prevalence and Antimicrobial Resistance of Vibrio spp.in Retail and Farm Shrimps in Ecuador[J].J Food Prot,2015,78(11):2089-2092.
[5]苑淑宾,朱爱意.溶藻弧菌对水产动物致病性及其防治的研究进展[J].浙江海洋学院学报(自然科学版),2012,31(3):256-264.
[6]ZHAO Z,CHEN C,HU C Q,et al.The type III secretionsystem of Vibrio alginolyticus induces rapid apoptosis,cell rounding and osmotic lysis of fish cells[J].Microbiology,2010,156(9):2864-2872.
[7]ZHAO Z,Zhang L P,REN C H,et al.Autophagy is induced by the type III secretion system of Vibrio alginolyticus in several mammalian cell lines[J].Archives of Microbiology,2011,193(1):53-61.
[8]程海燕,庞欢瑛,鲁义善,等.溶藻弧菌acfA基因克隆与生物信息学分析[J].广东海洋大学学报,2014,34 (1):9-14.
[9]ZHOU Z J,PANG H Y,DING Y,et al.VscO,a putative T3SS chaperone escort of Vibrio alginolyticus,contributes to virulence in fish and is a target for vaccine development[J].Fish & Shellfish Immunology,2013,35(5):1523-1531.
[10]王青柏,胡超群,陈偿,等.溶藻弧菌Ⅲ型分泌系统vscC基因缺失株的构建[J].安徽农业科学,2012,13(3):492-496.
[11]AGRAIN C,CALLEBAUT I,JOURNET L,et al.Characterization of a Type III secretion substrate specificity switch (T3S4) domain in YscP from Yersinia enterocolitica[J].Molecular Microbiology,2005,56(1):54-67.
[12]BÜTTNER D,BONAS U.Port of entry-the type III secretion translocon[J].Trends in Microbiology,2002,10(4):186-192.
[13]COOMBES B K,FINLAY B B.Insertion of the bacterial type III translocon:not your average needle stick[J].Trends Microbiol,2005,13(3):92-95.
[14]MONJARAS FERIA J,GARCIA-GOMEZ E,ESPINOSA N,et al.Role of EscP (Orf16) in injectisome biogenesis and regulation of type III protein secretion in enteropathogenic Escherichia coli [J].Journal of Bacteriology,2012,194(22):6029-6045.
[15]WOOD S E,JIN J,LLOYD S A.YscP and YscU switch the substrate specificity of the Yersinia type III secretion system by regulating export of the inner rod protein YscI[J].Journal of Bacteriology,2008,190(12):4252-4262.
[16]GALLE M,CARPENTIER I,BEYAERT R.Structure and function of the Type III secretion system of Pseudomonas aeruginosa [J].Current Protein and Peptide Science,2012,13(8):831-842.
[17]RÜSSMANN H,KUBORI T,SAUER J,et al.Molecular and functional analysis of the type III secretion signal of the Salmonella enterica InvJ protein[J].Molecular Microbiology,2002,46(3):769-779.
[18]MAGDALENA J,HACHANI A,CHAMEKH M,et al.Spa32 regulates a switch in substrate specificity of the type III secreton of Shigella flexneri from needle components to Ipa proteins[J].Journal of Bacteriology,2002,184(13):3433-3441.
[19]BERGERON J R,FERNANDEZ L,WASNEY G A,et al.The structure of a type 3 secretion system (T3SS)ruler protein suggests a molecular mechanism for needle length sensing [J].The Journal of Biological Chemistry,2016,291(4):1676-1691.
[20]AGRAIN C,SORG I,PAROZ C,et al.Secretion of YscP from Yersinia enterocolitica is essential to control the length of the injectisome needle but not to change the type III secretion substrate specificity [J].Molecular Microbiology,2005,57(5):1415-1427.
[21]BLOCKER A,KOMORIYA K,AIZAWA S-I.Type III secretion systems and bacterial flagella:insights into their function from structural similarities [J].Proceedings of the National Academy of Sciences,2003,100(6):3027-3030.
[22]GALKIN V E,SCHMIED W H,SCHRAIDT O,et al.The structure of the Salmonella typhimurium type III secretion system needle shows divergence from the flagellar system[J].Journal of Molecular Biology,2010,396(5):1392-1397.
[23]RIORDAN K E,SORG J A,BERUBE B J,et al.Impassable YscP substrates and their impact on the Yersinia enterocolitica type III secretion pathway[J].Journal of Bacteriology,2008,190(18):6204-6216.
[24]MUKERJEA R,GHOSH P.Functionally essential interaction between Yersinia YscO and the T3S4 domain of YscP[J].Journal of Bacteriology,2013,195(20):4631-4638.
(责任编辑:刘庆颖)
Molecular Cloning and Bioinformatics Analysis of Yop Secretion Protein P(VscP) from Vibrio alginolyticus Strain HY9901
LI Jing1,2,3,PANG Huan-ying1,2,3,JIAN Ji-chang1,2,3,LU Yi-shan1,2,3,WU Zao-he2,3,4,TANG Ju-fen1,2,3
(1.Fisheries College of Guangdong Ocean University,Zhanjiang 524088,China;2.Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088,China; 3.Key Laboratory of Diseases Controlling for Aquatic Economic Animals of Guangdong Higher Education Institutions,Zhanjiang 524088,China; 4.Zhongkai University of Agriculture and Engineering,Guangzhou 510225,China)
Primers for PCR cloning were designed according to the whole genome sequence of Vibrio alginolyticus published in GenBank.The type 3 secretion system (T3SS) Yop secretion protein P (VscP)gene of V.alginolyticus strain HY9901 was amplified by PCR and cloned into pMD 18-T vector.Sequence analysis reveals that the ORF of VscP gene (GenBank Accession:FR780678) is 1 206 bp and eneodes a putative protein of 401 amino acids.The predicted molecular weight (MW) of VscP was 44.4 ku with an estimated pI of 5.72.Using Signal Server 4.1 and TMHMM Server 2.0 software,and it was predieted that the VscP protein did not contain a signal peptide or a transmembranous region.The VscP protein had three N-glycosylation sites,two cAMP and cGMP dependent protein kinase phosphorylation site,five protein kinase C phosphorylation sites,nine casein kinase II phosphorylation sites,twoN-myristoylation sites,one amidation site and three loci microbody C-terminal targeting signal predieted by SoftBerry-Psite software.This protein shows high genetic relationship with Vibrio parahaemolyticus via a molecular phylogenetic tree constructed by MEGA6.0 software.A model of VscP subunits application of SWISS-MODEL work-space is built and its three-dimensional structure is found to have similar configuration with flagellar hook-length control protein FliK.
Vibrio alginolyticus; type 3 secretion system; gene cloning; bioinformatics analysis; vscP
Q78
A
1673-9159(2016)04-0030-07
10.3969/j.issn.1673-9159.2016.04.006
2016-03-08
国家自然科学基金(31402344);海洋经济创新发展区域示范专项(GD2012-B01004)
李静(1990-),女,硕士研究生,研究方向:海洋环境与生物资源保护。E-mail:janelee812@163.com
吴灶和,男,教授,研究方向为水产动物免疫学及病害防治,E-mail:wuzaohe@163.com;
庞欢瑛,女,博士,副教授,研究方向为水产经济动物病害的研究。E-mail:phying1218@163.com
