强化他汀治疗对脑梗死患者血清HMGB1IL-17A和S-100A12水平的影响
2016-11-12胡仁琳聂德云
李 强,华 梅,李 鸣,胡仁琳,聂德云
强化他汀治疗对脑梗死患者血清HMGB1IL-17A和S-100A12水平的影响
李强,华梅,李鸣,胡仁琳,聂德云
目的观察脑梗死患者血清HMGB1、IL-17A和S-100A12水平的变化,并探讨瑞舒伐他汀钙治疗对脑梗死的脑保护作用机制。方法采用随机、对照、单盲法的前瞻性研究。根据颈动脉彩超检查结果,将卒中单元中符合纳入标准的280例急性脑梗死患者分为稳定斑块组100例和易损斑块组180例,后者按照随机数字法分为低剂量治疗组(A组,瑞舒伐他汀片,5 mg/晚,口服)和高剂量治疗组(B组,瑞舒伐他汀片,20 mg/晚,口服)各90例。检测发病第1天(治疗前)、第3天、第7天、第14天血清HMGB1、IL-17A和S-100A12水平;治疗前、治疗后第3天、治疗后1 w、2 w和3 w神经功能缺损采用NIHSS评分评定。结果发病第1天,易损斑块组(A组和B组)患者血清HMGB1、IL-17A和S-100A12水平高于稳定斑块组,且于第3天均达峰值,继之出现缓慢下降。在发病第7天、第14天B组血清HMGB1、IL-17A和S-100A12含量均明显低于A组(均P<0.01)。治疗后第3天,A组和B组患者NIHSS评分较治疗前明显增加,达峰值(均P<0.01)。治疗后2 w和3 w,B组患者NIHSS评分低于A组(均P<0.01)。易损斑块组患者血清S-100A12水平与NIHSS评分呈正相关(发病第1天,分别r1=0.856,发病第3天,r1=0.870,均P<0.01)。此外,血清HMGB1和IL-17A水平呈显著正相关(发病第1天,r=0.972,发病第3天,r=0.975,均P<0.01)。结论血清S-100A12浓度可作为评估脑梗死后神经功能损伤严重程度的血清学指标,可作为评估颈动脉斑块易损性的血清学指标,HMGB1和IL-17A可能参与了脑梗死后急性期炎性反应过程。采取高强度他汀治疗具有减轻脑梗死后继发炎症反应、保护脑细胞和提高患者神经功能的作用。
脑梗死;瑞舒伐他汀;动脉粥样硬化;钙结合蛋白A12;高迁移率族蛋白-1;白细胞介素-17A
急性脑梗死(acute cerebral infarction,ACI)是临床上最常见的卒中类型,具有高发病率、高病残率和高死亡率的特点,目前已给家庭和社会带来巨大的经济负担[1]。而动脉粥样硬化(atherosclerosis,AS)是以动脉管壁脂质斑块不断累积为主要特征的慢性进展性炎性疾病,被认为是最主要的心脑血管事件发生死亡和致残原因之一[2]。在AS基础上,不稳定斑块的破裂、血小板被激活,继之血栓形成构成了脑梗死(cerebral infarction,CI)的病理生理基础。已有研究表明:许多前炎性介质、某些炎性细胞及其分泌的一些细胞因子均参与了CI后缺血性损伤的病理生理过程[3]。因此,如何采用药物有效减轻神经功能缺损和卒中后炎性反应一直是临床研究的热点和难题。本研究中,采用前瞻性随机对照研究,观察瑞舒伐他汀对急性脑梗死患者血清高迁移率族蛋白-1(high mobility group box-1,HMGB1)和白细胞介素-17A(interleukin-17A,IL-17A)及钙结合蛋白A12(Ca-binding protein A12,S100A12)水平及神经功能恢复的影响,探讨其部分可能作用机制。
1 资料与方法
1.1研究对象选择2013年6月-2015年6月期间武汉市第五医院神经内科卒中单元住院患者,按照2010年中国急性缺血性脑卒中诊治指南的标准,发病24 h经头部CT和(或)MRI(平扫或DWI)检查确诊为前循环脑梗死(大脑中动脉和/或大脑前动脉分布区域),按Pullicino公式计算梗死灶体积(长×宽×CT或MRI扫描阳性层数/2),均为大梗死灶(>10 cm3),入院时行美国国立卫生院神经功能缺损(NIHSS)评分在6~15分,均未行溶栓治疗,参照中国缺血性卒中亚型(CISS分型)确定为大动脉粥样硬化型。共280例患者入组,其中男136例,女144例;年龄46岁~72岁,平均(60.7±11.97)岁。根据颈动脉彩超检查结果,将颈动脉粥样斑块定义为IMT≥1.5 mm,其中稳定斑块组100例和易损斑块组180例,后者按照随机数字法分为A组(低剂量治疗组)和B组(高剂量治疗组)各90例。A组和B组患者一般资料(性别构成比、年龄、血压、血糖、体质量指数、血脂、入院时NIHSS评分、吸烟史、饮酒史、WBC计数、梗死灶体积)均无统计学差异,具有可比性(均P>0.05)。正常对照组:系同期我院体检中心健康体检者80例,各项体检均正常。其中,男42例,女38例,平均(45.73±8.72)岁。
1.2方法
1.2.1治疗方法易损斑块组(A组和B组)患者均使用甘露醇和或甘油果糖脱水降颅内压,酌情加用速尿脱水,调控血压(病情稳定后1 w,若血压水平高于140/90 mmHg,加用非洛地平缓释片即波依定治疗,后者由阿斯利康制药有限公司生产,国药准字H20030414,5 mg/日,必要时可加量至10 mg/日)、抗血小板聚集(拜阿司匹林片,100 mg/晚)等常规治疗,脱水剂使用一般不超过14 d。A组加用瑞舒伐他汀钙片(即可定,由阿斯利康制药有限公司生产,国药准字J20120006),5 mg/晚;B组加用瑞舒伐他汀钙片,20 mg/晚,连续使用3 w。
1.2.2检测指标正常对照组于体检日清晨抽取空腹静脉血3 ml。脑梗死患者发病第1天(治疗前)、第3天、第7天和第14天抽取静脉血5 ml,尽快分离血清,-70 ℃低温保存待测。检测前冻融,采用双抗体夹心ELISA法测定血清HMGB1、IL-17A和S-100A12含量,试剂盒均由武汉华美生物工程有限公司提供,仪器为芬兰热电雷勃HB63-MK3全自动酶标仪。操作严格按说明书进行,结果由酶标分析仪分析所得。此外,A组和B组发病第1天、第7天和第14天均抽血检测血常规、尿规及肝肾功能血脂心肌酶学等。
1.2.3临床神经科评分采用美国国立卫生院卒中量表(NIHSS)。由经过正规培训的神经专科医师负责评分并录入。治疗前(发病第1天)、治疗后第3天(即发病第3天)、第1周、第2周和第3周分别评分一次。
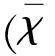
2 结 果
2.1血清HMGB1、IL-17A和S-100A12水平的比较发病第1天(治疗前),易损斑块组(A组和B组)患者血清HMGB1、IL-17A和S-100A12水平高于稳定斑块组和正常对照组,且于第3天均达峰值,继之出现缓慢下降。第7天、第14天B组血清HMGB1、IL-17A和S-100A12含量均明显低于A组(均P<0.01) (见表1~表3)。
2.2治疗前后两组NIHSS评分的比较发病第3天(即治疗后第3天),A组和B组患者NIHSS评分较治疗前明显增加,达峰值(均P<0.01)。治疗后2 w和3 w,B组患者NIHSS评分低于A组(均P<0.01)(见表4)。
2.3相关性分析易损斑块组患者血清S-100A12水平与NIHSS评分呈正相关(发病第1天,分别r1=0.856;发病第3天,r1=0.870,均P<0.01)。此外,血清HMGB1和IL-17A水平呈显著正相关(发病第1天,r=0.972;发病第3天,r=0.975,均P<0.01)。
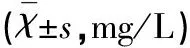
表1 4组血清HMGB1水平比较
与同组治疗前比较*P<0.05;与A组比较△P<0.05;与正常对照组比较#P<0.05;与稳定斑块组比较□P<0.05
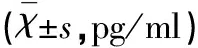
表2 4组血清IL-17A比较
与同组治疗前比较*P<0.05;与A组比较△P<0.05;与正常对照组比较#P<0.05;与稳定斑块组比较□P<0.05

表3 4组血清S-100A12水平比较
与同组治疗前比较*P<0.05;与A组比较△P<0.05;与正常对照组比较#P<0.05;与稳定斑块组比较□P<0.05
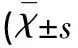
表4 A组和B组NIHSS评分的比较,分)
与同组治疗前比较*P<0.05;与A组比较△P<0.05
3 讨 论
在AS基础上血栓形成后导致ACI的发生,其中神经元凋亡、脑组织缺血缺氧坏死和水肿的病理生理过程复杂,涉及炎性反应、氧自由基生成、新生血管形成等多种机制[4]。AS是缺血性脑卒中的主要危险因素之一,慢性免疫介导的炎症反应是导致AS斑块形成和不稳定的中心环节,而AS斑块的形成与破裂导致急性心肌梗死和卒中的发生[5]。脑缺血后炎症反应是导致缺血后神经元损伤的重要原因,在缺血性卒中发病早期阶段,脑组织水肿、内皮细胞受损和渗入的单核细胞如巨噬细胞、中性粒细胞和淋巴细胞等及其分泌的炎性细胞因子所产生的炎症反应在脑缺血中发挥着重要作用[6]。因此,如何有效干预AS的形成和阻断脑缺血后炎性信号通路和保护神经元则成为缺血脑卒中治疗干预的靶点。
HMGB1是一种DNA结合蛋白,是判断某些细胞凋亡或坏死的一个关键信号,在AS形成中扮演着炎症调节因子的角色[7],能在细胞外活化各种炎症细胞并诱导其分泌细胞因子,在脑梗死急性期,血清HMGB1含量可显著增加,可进一步加剧缺血性卒中后炎性反应。有研究分析显示:缺血性卒中患者血清MMP-9和HMGB-1水平呈现正相关性,且两指标越高,其神经功能结局越差[8]。在本研究中,发病第3天,血清HMGB1水平达高峰,提示HMGB1参与了缺血性脑卒中的炎症反应过程,阻滞HMGB1的生成可作为一种新的治疗AS的方法和药物作用的靶点[9,10]。
IL-17A是近年来新发现IL-17家族的细胞因子成员,主要由Th17细胞产生[11],IL-17A作为一种强大的前炎性因子和炎症反应的微调因子,其与IL-17A受体结合后通过刺激血管内皮细胞、平滑肌细胞及巨噬细胞产生一系列与AS相关的前炎性细胞因子、趋化蛋白和粘附分子等来损伤动脉血管内皮,从而诱导平滑肌细胞迁移,进一步激活具有招募作用的单核-巨噬细胞,参与了AS斑块的形成;同时,IL-17A还能诱导激活的巨噬细胞合成和分泌基质金属蛋白酶(matrix metalloproteinase,MMPs),使局部的基质蛋白降解而导致斑块不稳定和破裂,在功能上阻滞IL-17A的表达可阻止AS病变的进展,诱导斑块的稳定性增加[12]。有研究显示,在颈动脉易损斑块处IL-17A表达水平明显升高,血清IL-17A水平与颈部AS的严重程度及斑块的易损性密切有关[13]。本研究中,发病第1天和第3天,易损斑块组血清IL-17A水平高于稳定斑块组,提示IL-17A水平可作为评估AS易损性的血清学指标。 有研究表明,炎症细胞参与缺血性卒中相关的炎症反应过程与IL-17A的激活密切相关[14],而IL-17A加重脑组织缺血再灌注性损伤是通过增加钙蛋白酶介导的TRPC6蛋白水解物的分泌来实现的,因而抑制IL-17A的过度表达可作为神经保护作用靶点[15]。在本研究中,发病第3天,血清HMGB1和IL-17A水平均达峰值,且两者呈显著正相关,提示血清HMGB1与IL-17A均参与了急性脑梗死的炎性反应过程,其作用机制可能是缺血缺氧后早期星形胶质细胞或神经元细胞向胞外释放HMGB1的增加,通过激活HMGB1-TLR4信号通路来诱导IL-17A的分泌,导致脑的缺血/再灌注损伤[16]。
S100A12主要在中性粒细胞中表达,同时在淋巴细胞、单核细胞中也有少量表达。在AS斑块巨噬细胞和中性粒细胞中均可见S100A12水平升高,而在非AS动脉组织中无或低表达。S100A12与晚期糖基化终产物受体(RAGE)相结合后,激活细胞内信号级联反应,包括丝裂原激活蛋白激酶和核因子-B、放大炎症应答、诱导细胞因子(TNF-α、IL-10)的分泌、黏附分子(细胞间黏附分子-1和血管细胞黏附分子-1)的表达、调节中性粒细胞和单核细胞的迁移、诱导巨噬细胞和内皮细胞中促炎症因子的产生、促进AS的发生和进展。有研究表明,血清S100A12水平与AS斑块不稳定性密切相关,其水平的高低可反映颈部AS斑块的稳定性[17]。本研究中,发病第1天和第3天,易损斑块组血清S100A12水平高于稳定斑块组和正常对照组,提示血清S100A12参与了AS的病程,其水平可作为评估颈动脉斑块易损性的血清学指标。另有研究显示,入院时高水平血清S100A12与急性缺血性脑卒中患者不良神经功能预后密切相关[18]。本研究中发现,发病第3天,血清S100A12水平达峰值,NIHSS评分较治疗前明显增加,血清S100A12水平与NIHSS评分具有正相关性,提示S100A12可作为评估神经功能缺损程度的一个新的血清学指标。
CI急性期治疗方案中,除了抗血小板聚集治疗外,他汀类药物的使用是必不可少的。大量研究表明,采用他汀类药物治疗可显著降低心脑血管事件发生率并减低病死率[19]。在本研究中,在治疗后第7天和第14天,瑞舒伐他汀高剂量治疗组血清HMGB1、IL-17A和S100A12水平明显低于低剂量治疗组,且在治疗后第2周和第3周,高剂量治疗组NIHSS评分明显低于低剂量治疗组,提示瑞舒伐他汀强化调脂治疗可快速有效地降低血清HMGB1、IL-17A和S100A12水平,具有抗炎作用,可更有效地改善缺血性卒中后神经功能障碍。
综上所述,在本研究中,血清S100A12浓度可作为评估脑梗死后神经功能损伤严重程度的血清学指标,可作为评估颈动脉斑块易损性的血清学指标,HMGB1和IL-17A可能参与了脑梗死后急性期炎性反应过程。采取高强度他汀治疗具有减轻脑梗死后继发炎症反应、保护脑细胞和提高患者神经功能的作用。由于脑梗死后继发炎性反应的病理生理机制相当复杂,因此在后期的研究中,我们将进一步推广和扩大样本量研究,并深入探讨瑞舒伐他汀对脑梗死的可能脑保护作用机制。
[1]Wang Y,Zhao X,Liu L,et al.Prevalence and outcomes of symptomatic intracranial large artery stenoses and occlusions in China:the Chinese Intracranial Atherosclerosis(CICAS)Study[J].Stroke,2014,45(3):663-669.
[2]Mozaffarian D,Benjamin EJ,Go AS,et al.Heart disease and stroke statistics-2015 update:a report from the American Heart Association[J].Circulation,2015,131(4):e29-e322.
[3]Amantea D,Micieli G,Tassorelli C,et al.Rational modulation of the innate immune system for neuroprotection in ischemic stroke[J].Front Neurosci,2015,9(147):1-20.
[4]Won S,Lee JH,Wali B,et al.Progesterone attenuates hemorrhagic transformation after delayed tPA treatment in an experimental model of stroke in rats:involvement of the VEGF-MMP pathway[J].J Cereb Blood Flow Metab,2014,34(1):72-80.
[5]Wick G,Jakic B,Buszko M,et al.The role of heat shock proteins in atherosclerosis[J].Nat Rev Cardiol,2014,11(9):516-529.
[6]Shichita T,Ito M,Yoshimura A.Post-ischemic inflammation regulates neural damage and protection[J].Front Cell Neurosci,2014,8(319):1-8.
[7]Tsao CF,Huang WT,Liu TT,et al.Expression of high-mobility group box protein 1 in diabetic foot atherogenesis[J].Genet Mol Res,2015,14(2):4521-4531.
[8]Sapojnikova N,Kartvelishvili T,Asatiani N,et al.Correlation between MMP-9 and extracellular cytokine HMGB1 in prediction of human ischemic stroke outcome[J].Biochim Biophys Acta,2014,1842(9):1379-1384.
[9]Hu N,Kong L,Qian A,et al.HMGB1 silencing potentiates the anti-inflammatory effects of sodium derulate in ox-LDL-stimulated vascular smooth muscle cells[J].Cell Biochem Biophys,2015,72(1):297-304.
[10]Agalave NM,Svensson CI.Extracellular high-mobility group box 1 protein (HMGB1) as a mediator of persistent pain[J].Mol Med,2015,20(1):569-578.
[11]Waisman A,Hauptmann J,Regen T.The role of IL-17 in CNS diseases[J].Acta Neuropathol,2015,129(5):625-637.
[12]Erbel C,Akhavanpoor M,Okuyucu D,et al.IL-17A influences essential functions of the monocyte/macrophage lineage and is involved in advanced murine and human atherosclerosis[J].J Immunol,2014,193(9):4344-4355.
[13]Ma T,Gao Q,Zhu F,et al.Th17 cells and IL-17 are involved in the disruption of vulnerable plaques triggered by short-term combination stimulation in apolipoprotein E-knockout mice[J].Cell Mol Immunol,2013,10(4):338-348.
[14]Pei J,You X,Fu Q.Inflammation in the pathogenesis of ischemic stroke[J].Front Biosci (Landmark Ed),2015,20:772-783.
[15]Zhang J,Mao X,Zhou T,et al.IL-17A contributes to brain ischemia reperfusion injury through calpain-TRPC6 pathway in mice[J].Neuroscience,2014,274:419-428.
[16]Zhang J,Wu Y,Weng Z,et al.Glycyrrhizin protects brain against ischemia-reperfusion injury in mice through HMGB1-TLR4-IL-17A signaling pathway[J].Brain Res,2014,1582:176-186.
[17]Yayar O,Eser B,Buyukbakkal M,et al.Do elevated plasma S100A12 levels predict atherosclerosis in peritoneal dialysis patients[J].Ren Fail,2015,37(5):845-850.
[18] Wakisaka Y,Ago T,Kamouchi M,et al.Plasma S100A12 is associated with functional outcome after ischemic stroke:Research for Biomarkers in Ischemic Stroke[J].J Neurol Sci,2014,340(1/2):75-79.
[19]Bays H,Cohen DE,Chalasani N,et al.An assessment by the statin liver safety task force:2014 update[J].J Clin Lipidol,2014,8(Suppl 3):47-57.
Effect of Rosuvastatin intensive treatment on serum levels of HMGB1,IL-17A and S-100A12 in patients with acute cerebral infarction
LIQiang,HUAMei,LIMing,etal.
(DepartmentofNeurology,TheFifthHospitalofWuhanCity,Wuhan430050,China)
ObjectiveTo observe the changes of high mobility group box-1(HMGB1) and interieukin-17A(IL-17A) and Ca-binding protein A12(S-100A12) in patients with acute cerebral infarction(ACI),and to explore the probablely protective mechanism of Rosuvastatin.MethodsAccording to the results of carotid artery ultrasound,280 patients with ACI were divided into carotid stable plaque group(n=100) and carotid vulnerable plaque group(n=180).180 cases with carotid vulnerable plaque were randomly divided into low-dose group(A group,n=90,rosuvastatin 5 mg/d,oral) and high-dose group (B group,n=90,rosuvastatin 20 mg /d,oral).The therapeutic course for all was 3 weeks.Plasma samples were obtained at the 1st day (before treatment),on days 3,7 and 14 of onset.Levels of serum HMGB1,IL-17A and S-100A12 were measured by enzyme-linked immunosorbent assay.Before treatment,on the 3rd day,in 1 weeks,2 weeks and 3 weeks after treatment,the neurological deficits evaluated by National Institute of Health stroke scale(NIHSS).ResultsCompared with carotid stable plaque group,levels of HMGB1,IL-17A and S-100A12 in A group and B group were significantly increased on the first day of illness (allP<0.01),peaked at 3rd day,decreased gradually thereafter.Plasma HMGB1,IL-17A and S-100A12 levels in B group were significantly lower than that in A group at 7d and 14d ( allP<0.01).On days 3,the NIHSS scores were reached the peak,and obviously higher than that before treatment (allP<0.01).Compared with A group,the NIHSS scores in B group after the 2nd and 3rd week were significantly decreased (allP<0.01).Plasma levels of S-100A12 in A group and B group were positively correlated with NIHSS scores(at the 1st day,r=0.856,on the 3rd day,r=0.870,allP<0.01).In addition,serum HMGB1 levels in patients with ACI were markedly positively relevant to serum IL-17A levels(before treatment,r=0.972,at 3rd day,r=0.975,allP<0.01).ConclusionSerum S-100A12 could be used as the marker for reflecting the degree of neurologic function deficits after cerebral infartion(CI),might be developed as biomarkers for the assessment of carotid plaque vulnerability.Serum HMGB1,IL-17A might contribute to the inflammatory process of ACI.The intensive-lowering therapy of Rosuvastatin could alleviate obviously inflammatory reaction at acute stage of CI patients,which could effectively protect brain cell and improve the neurological function.
Cerebral infarction;Rosuvastatin;Atherosclerosis;Ca-binding protein A12(S-100A12);High mobility group box-1(HMGB1);Interieukin-17A(IL-17A)
1003-2754(2016)02-0109-04
2015-10-12;
2015-11-29
武汉市卫生局科研资助项目(No.WX10C23)
(武汉市第五医院神经科,湖北 武汉 430050)
华梅,E-mail:503018180@qq.com.cn
R743.3
A
