以壳聚糖纳米微球为载体的Crisp1-DNA避孕疫苗的制备及体外表达
2016-11-11罗金杨菁程琰张怡徐望明
罗金,杨菁,程琰,张怡,徐望明
(武汉大学人民医院生殖医学中心,武汉 430060)
·实验研究·
以壳聚糖纳米微球为载体的Crisp1-DNA避孕疫苗的制备及体外表达
罗金,杨菁*,程琰,张怡,徐望明
(武汉大学人民医院生殖医学中心,武汉430060)
目的构建以壳聚糖纳米微球为载体的Crisp1 DNA疫苗,对其物理学、生物学活性进行测定,并评估其在COS-7细胞中的表达情况及细胞毒性。方法采用本实验室前期构建的真核表达质粒pcDNA3.1-Crisp1,以复凝法制备载Crisp1 DNA疫苗的壳聚糖纳米粒(CS/DNA NPs),用透射电镜以及凝胶阻滞分析对其相关物理学、生物学活性进行测定,然后将载Crisp1 DNA疫苗的壳聚糖纳米粒转染至COS-7细胞,检测其细胞毒性,并用间接免疫荧光法鉴定其在细胞内的表达情况。结果透射电镜结果显示纳米粒形态较均一,平均粒径为189.3 nm,Zeta电位约为+0.2 mV。凝胶阻滞分析显示壳聚糖微粒可将DNA疫苗完全阻滞于加样孔中并保护DNA质粒不降解。MTT试验显示壳聚糖组细胞存活率显著高于脂质体组(P<0.01)。间接免疫荧光实验结果显示CS/DNA NPs能在COS-7细胞中有效表达Crisp 1抗原蛋白。结论由壳聚糖纳米微球介导的Crisp1 DNA疫苗,可在真核细胞中有效地表达,且具有较小的细胞毒性,为进一步发展安全有效的DNA避孕疫苗打下了基础。
Crisp-1;避孕;DNA疫苗;壳聚糖;纳米微球
Methods:The eukaryotic expression plasmid pcDNA3.1-Crisp1 was constructed previously and encapsulated in nanoparticles with chitosan by complex coacervation process. Transmission electron microscope (TEM) and Gel retardation assay were used to observe the physical and biological characteristics of the chitosan/pcDNA3.1-Crisp1 nanoparticles. Then,the chitosan/pcDNA3.1-Crisp1 nanoparticles (CS/DNA NPs) were transfected to COS-7 cells,detecting its cytotoxicity and evaluating its expression by indirect immunoflurescence.
Results:TEM showed that chitosan/pcDNA3.1-Crisp1 nanoparticleshad symmetrical shape,with a diameter about 189.3 nm,and zeta potential was+0.2 mV. Gel retardation assay showed that pcDNA3.1-Crisp1 contained in chitosan nanoparticles could be completely retarded and remained intact after DNase I treatment. MTT assay showed that the viability of cells incubated with chitosan-DNA was significantly higher than that of the control Lipofect 2 000 group (P<0.01). Indirect immunouorescence showed that pcDNA3.1-Crisp1 could expressed effectively in COS-7 cells.
Conclusions:Chitosan nanoparticles containing Crisp1-DNA contraceptive vaccine can express effectively in eukaryotic cells and have less cytotoxicity. Chitosan can be used as an effective non-virus DAN vaccine carrier.
(JReprodMed2016,25(10):947-952)
富含半胱氨酸分泌蛋白-1(cysteine-rich secretory protein-1,Crisp1)是由附睾头部的上皮细胞合成分泌的一种雄激素依赖型糖蛋白。由于在生殖过程中的多个环节起着重要作用,如调控精子的获能、参与精卵融合等,Crisp1被认为是一种极具前景的候选避孕疫苗[1-3]。在前期的研究中,本实验室成功的构建了真核表达载体pcDNA3.1-Crisp1[4],并证实该疫苗可在小鼠体内诱导特异性免疫反应,但避孕效果不尽理想[5-6]。其原因可能是:(1)由于裸DNA带负电荷,难以通过脂质的细胞膜;(2)在体内易被核酸酶降解而迅速清除[7];(3)质粒DNA转运到组织细胞尤其是抗原递呈细胞(APc)的效率较低,从而导致抗原表达水平低下[8]。因此,要成功将基因免疫用于开发避孕疫苗,还需要选择一个合适的基因给药载体,以提高 DNA疫苗在体内主动免疫效果。目前,非病毒载体由于具有较好的生物安全性已越来越多地运用于基因治疗研究中。壳聚糖是一种带正电荷的天然聚合物,无细胞毒性,且具有很好的生物相容性和生物降解性[9],近年来作为一种新开发的载体系统得到了广泛而深入的研究。本研究采用复凝法构建了载Crisp1 DNA疫苗的壳聚糖纳米粒,并对其相关物理学、生物学活性进行测定,最后通过与脂质体进行比较评估其在COS-7细胞中的表达情况,望能为后续研究其生物学活性及免疫避孕效应提供基础依据。
材料和方法
一、材料
1. 主要试剂:壳聚糖购自sigma公司;Lipofectamne 2000TM试剂盒和Opti-MEM培养基为Invitrogen公司产品;其余试剂均为国产或进口分析纯。
2. 细菌、细胞和质粒:pcDNA3.1-Crisp1真核表达质粒由本实验室前期构建[4];载体pcDNA3.1 为Novagen 公司产品;COS-7 细胞购自中国科学院上海细胞生物与生物化学所。
二、研究方法
1. 载Crisp-1DNA疫苗壳聚糖纳米粒的制备(复凝法):根据前期文献报道,采用复凝法制备壳聚糖纳米粒[10]。称取纯化的壳聚糖10.0 mg,溶解于l%冰乙酸溶液中,用NaOH调节pH至5.5,稀释溶液使壳聚耱浓度为0.02%(W/V),0.22 μm针式滤器过滤除菌。取适量pcDNA3.1-Crisp1加入25 mmol/L Na2S04溶液中,调节其浓度分别为50 μg/ml、100 μg/ml、200 μg/ml,分别记为CS/DNA 50、CS/DNA 100、CS/DNA 200。将0.02%壳聚糖溶液和3种不同浓度的pcDNA3.1-Crisp1/Na2S04(25 mmol/L)溶液均预热至55℃,分别取等体积的壳聚糖溶液与pcDNA3.1-Crisp1溶液迅速混匀,涡旋30 s,室温静置30 min,所得pcDNA3.1-Crisp1-壳聚糖纳米粒悬液即可用于生物学鉴定和细胞转染。取不同质粒浓度的纳米粒悬液200 μl,高速离心机离心(14 000g×30 min),收集上清液,紫外分光光度法(OD260)检测上清液中质粒DNA的含量,并计算不同质粒浓度下的包埋率。
基因含量(包埋量,μg)=OD260×稀释倍数×体积×50/1 000;
包埋率G(%)=[(Wo-wo)/Wo]×100%(Wo为加入的DNA的总量;wo为上清液中剩余的DNA的量)。
2. 纳米粒形态、粒径分布及zeta电位的测定:取少量纳米粒混悬液滴至铺有碳膜的铜网上,静置2 min,用滤纸吸干混悬液,再滴加2%磷钨酸负染2 min,于透射电子显微镜(TEM)下观察纳米粒形态,并选取有代表性的视野拍照,进行形态测定。另取纳米粒混悬液适量,加双蒸水稀释后用纳米粒度分析仪测定平均粒径、多分散度和zeta电位。
3. 凝胶阻滞分析和DNase I保护试验:分别取裸质粒和壳聚糖纳米质粒复合物,行含0.5 μg/ml溴化乙锭的1%琼脂糖凝胶电泳(100 V,30 min),紫外凝胶成像仪观察并照相,分析壳聚糖纳米粒与质粒的结合力。由于裸质粒DNA在体内易被降解,为验证纳米粒对质粒DAN的保护作用,选用核酸酶(DNase I)作为酶原进行抗核酸试验。取样本和裸质粒DNA 溶液各20 μl (含质粒DNA 1 μg),分别加入0.2 μl DNaseI,37℃反应30 min,0℃冰浴15 mim终止反应,以含0.5 μg/ml溴化乙锭的1%琼脂糖凝胶进行电泳分析(100 V,30 min),同时与未加酶的壳聚糖纳米质粒复合物样品和裸质粒溶液对照。
4. 细胞毒性检测(MTT):COS-7 细胞用含有10%胎牛血清的杜尔伯科极限必需培养基(DMEM),37℃、5% CO2恒温培养。用0.25%胰酶消化单层培养的COS-7细胞,以每孔内1×104个细胞接种于96孔板,培养至细胞贴壁后,将裸DNA、脂质体-质粒DNA、及壳聚糖-质粒DNA分别加入细胞孔中,只加培养液的空白孔调零,非处理细胞为对照。温箱中培养48 h后取出96孔板,加入MTT 20 μl,继续培养4 h。吸弃全部上清液,每孔加入150 μl 二甲基亚砜(DMSO),震荡10 min,选择570 nm波长,以空白孔调零,酶标仪测其吸光度值并计算各组细胞存活率。细胞存活率=[OD570(实验组)/OD570(对照组)] × 100%。
5. 间接免疫荧光细胞化学检测Crisp1蛋白在真核细胞中的表达与定位:转染48 h后,吸弃培养基,PBS洗3次,用4%多聚甲醛-PBS固定液室温固定15 min,吸出固定液,PBS洗3次,0.5 ml 0.2%的Triton-X 100溶液破膜8 min,PBS洗3次,正常山羊血清室温(37℃)下封闭20 min,PBS洗3次,滴加一抗(山羊抗鼠CRISP-1单抗,1∶100稀释) 4℃过夜,PBS洗3次,滴加二抗(FITC标记的兔抗山羊IgG,1∶100稀释),37℃避光孵育90 min,PBS洗3次,缓冲甘油封片,荧光显微镜下观察。
三、统计学分析
结 果
一、不同质粒浓度下壳聚糖对pcDNA3.1-Crisp1的包埋率
采用紫外分光光度仪检测壳聚糖对不同浓度的质粒DNA的包埋率,结果显示,质粒浓度为100 μg/ml时,壳聚糖对质粒DNA的包埋率最高(表1)。
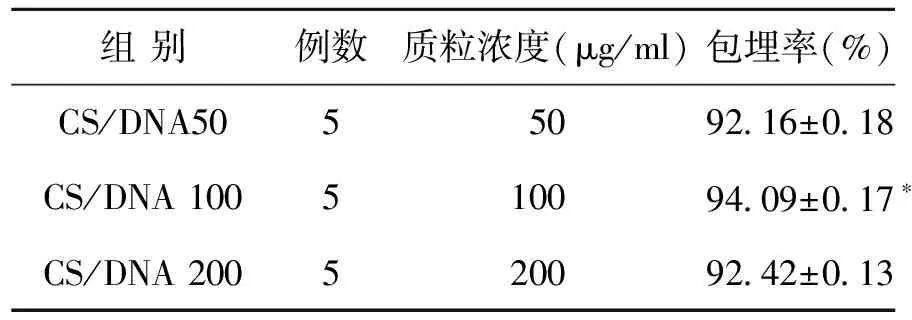
表1 不同质粒浓度下壳聚糖对pcDNA3.1-Crisp1的包埋率
注:分别与低、高浓度组相比,*P<0.05
二、壳聚糖/pcDNA3.1-Crisp1纳米粒的物理学特征
透射电子显微镜观察结果显示,载基因壳聚糖纳米粒形态较为规则,近球形,大小较均一,散在分布,分散性好(图1)。激光粒度分析仪测定结果表明,纳米粒直径约189.3 nm,多分散指数为0.459,粒径分布范围较窄。Zeta电位约为+0.2 mV。
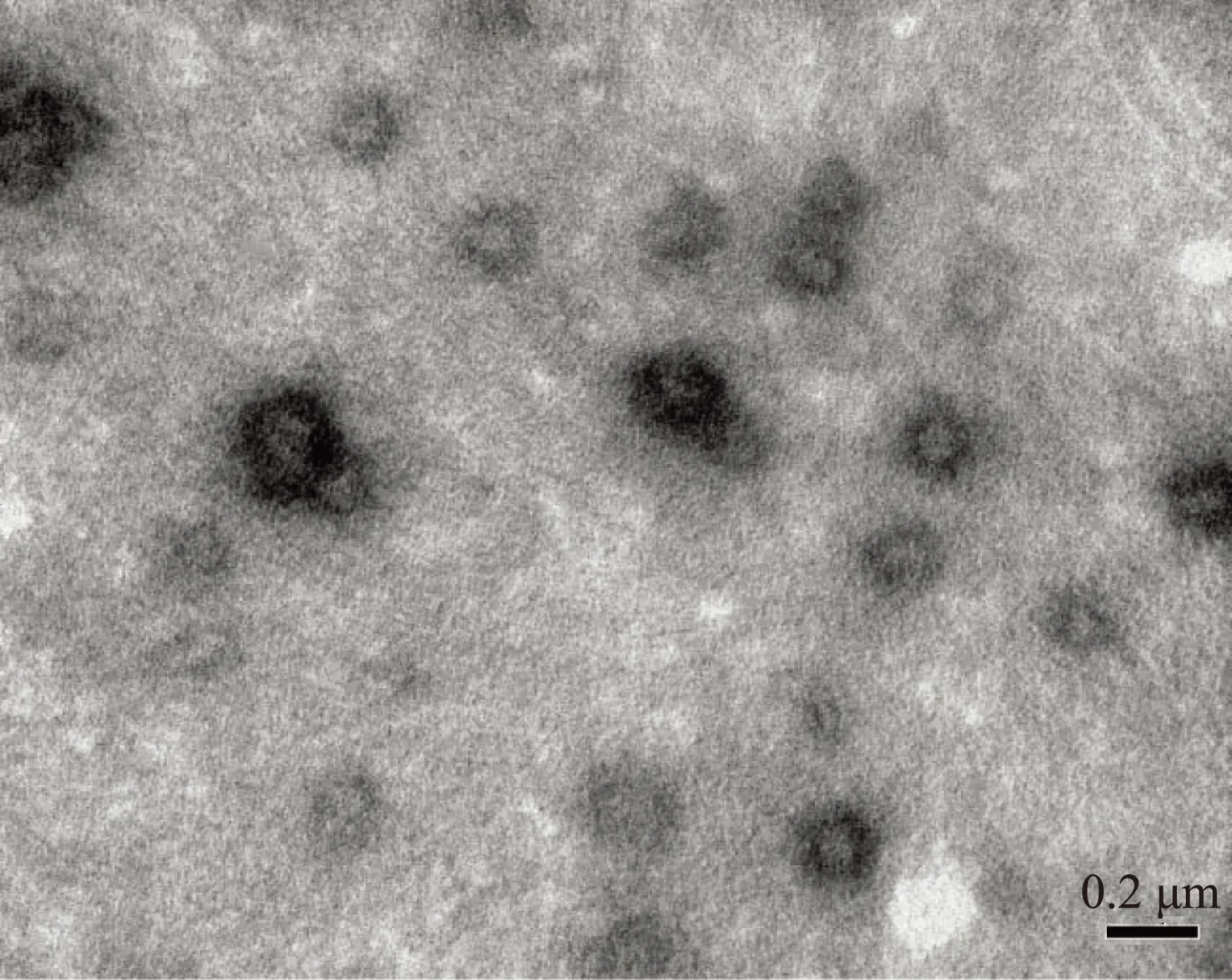
图1 壳聚糖/pcDNA3.1-Crisp-1纳米粒透射电镜成像
三、凝胶阻滞分析和DNase I保护试验
1%琼脂糖凝胶电泳结果显示,壳聚糖与DNA疫苗后结合使质粒DNA阻滞于加样孔中,未观察到质粒跑出,说明壳聚糖能有效地包裹质粒DNA(图2A)。但是,向各组样品加入DNase I后,电泳结果显示裸质粒DNA被DNase I消化;而壳聚糖纳米微粒中的质粒DNA并未受影响,说明壳聚糖能保护质粒DNA不受核酸酶降解(图2B)。

A:壳聚糖纳米粒与质粒DNA结合试验电泳图,1:Marker;2:质粒DNA组;3-5:pcDNA3.1-Crisp-1壳聚糖微粒组。B:壳聚糖纳米粒对质粒DNA保护试验电泳图,1:Marker;2:质粒DNA组;3-5:pcDNA3.1-Crisp-1壳聚糖微粒组图2 壳聚糖纳米粒与质粒DNA凝胶电泳图谱
四、细胞毒性检测(MTT)
MTT试验结果显示裸 DNA、脂质体-质粒DNA、CS/DNA NPs三组的细胞存活率分别为(86.74±3.26)%、(29.13±4.02)%、(80.32±6.23)%。壳聚糖组与裸质粒组细胞存活率差异无统计学意义(P>0.05),但显著高于脂质体-DNA组,差异有统计学意义(P<0.01) (图3)。
五、间接免疫荧光细胞化学检测Crisp-1在真核细胞中的表达
将正常COS-7细胞和经不同方式转染pcDNA3.1-Crisp1的COS-7细胞用4%多聚甲醛-PBS固定液固定后,分别做间接免疫荧光(IIF)检测。如图4所示,经过相同处理后,无论是用脂质体介导转染的COS-7细胞中还是载DNA壳聚糖纳米微球直接转染的COS-7细胞中均可看到明亮的绿色荧光,表明壳聚糖可有效的介导Crisp1 DNA疫苗在真核细胞中表达。
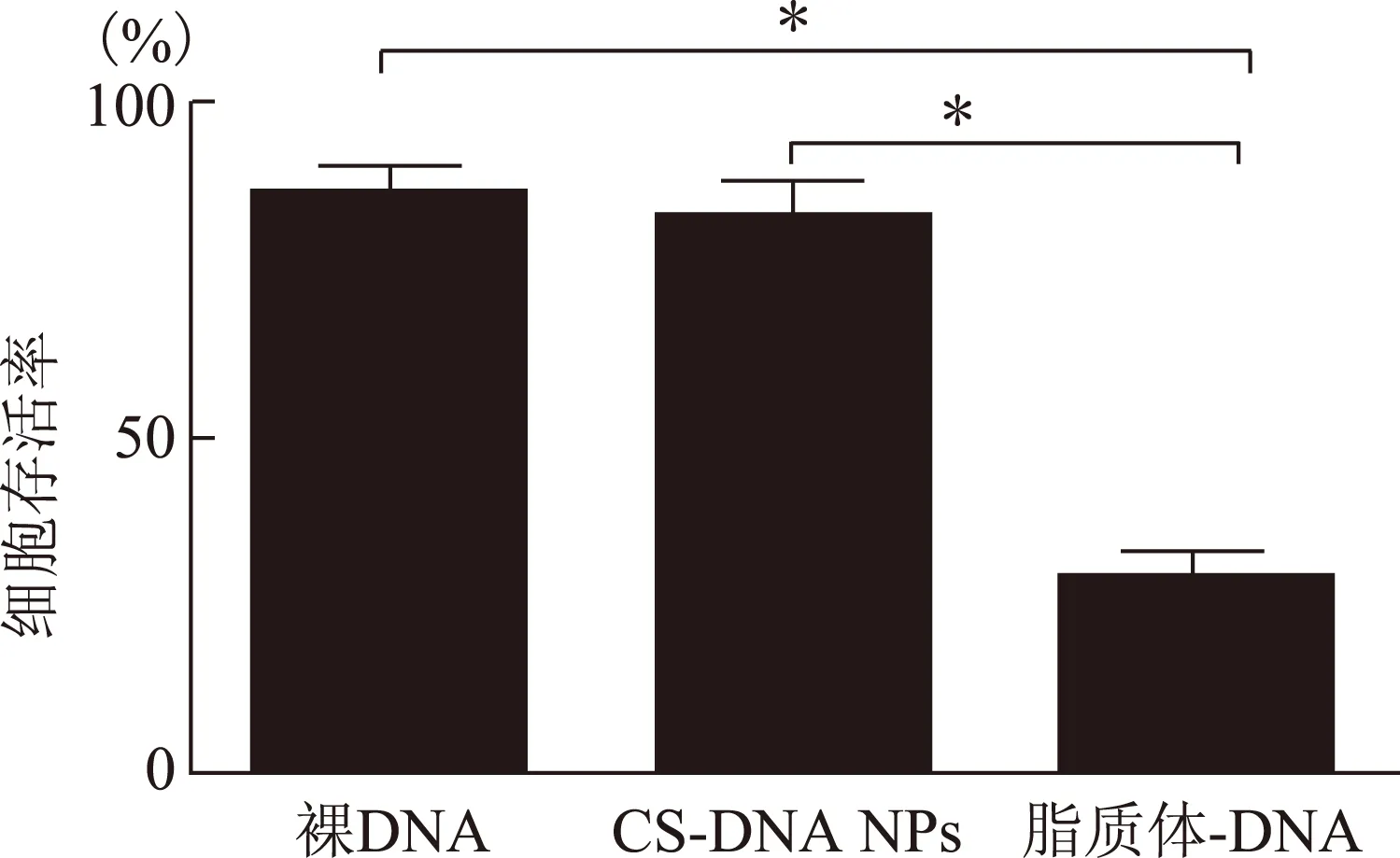
组间两两分别比较,*P<0.01图3 各组细胞毒性检测后细胞存活率

A:以壳聚糖纳米粒介导的pcDNA3.1-Crisp1质粒转染的COS-7细胞;B:经脂质体介导的pcDNA3.1-Crisp1质粒转染的COS-7细胞;C:未经质粒转染的正常COS-7细胞图4 pcDNA3.1-Crisp1质粒经不同方法转染COS-7细胞后Crisp1的荧光表达
讨 论
近年来,随着基因组学和蛋白质组学技术的应用和发展,采用重组DNA技术,以精子相关蛋白为基础研究,在多个动物模型上已证实可产生抗体反应并显示出一定的抗生育效果。Crisp1是一种雄激素依赖性的分泌性糖蛋白,由附睾头部的上皮细胞合成并分泌。有研究表明Crisp1不仅参与了精卵融合[1-2],还参与了精子与透明带的相互作用阶段[8],并可调节精子在附睾中获能[3]。最近,Maldera等[11]研究进一步发现,人类附睾Crisp1主要是通过与透明带3(ZP3)的相互作用介导精子-透明带结合,参与受精过程。在前期的研究中,本课题组成功的构建了以Crisp1为基础的DNA避孕疫苗[4],并对雌雄性小鼠进行主动免疫,结果显示免疫后雌雄性小鼠血清内均可检测到特异性抗Crisp1的IgG抗体,且抗体滴度随着免疫时间延长而逐渐升高,停止免疫后4周抗体滴度开始缓慢下降[5-6],并进一步证实了mCrisp1抗体特异性作用于精卵融合阶段,而对正常小鼠附睾精子的活动率、存活率、自发或诱发顶体反应率及精子粘附卵的能力均无影响[12],但是该疫苗对小鼠的抗生育作用并不十分理想,免疫后仅能使小鼠的生育力降低30%左右,且与重组Crisp1蛋白相比,其免疫原性较低[5-6],因此要提高DNA疫苗的免疫原性,选择一种合适的载体非常重要。
壳聚糖是一种天然的阳离子聚合物,来源广泛,价格低廉,具有较高的生物相容性和生物降解性,并且易与DNA结合形成纳米微粒[13]。有文献报导壳聚糖还具有免疫佐剂的功能,能优化DNA疫苗接种的效果[14-15]。本实验采用经典的复凝法制备壳聚糖/pcDNA3.1-Crisp1纳米微粒,主要是利用壳聚糖与DNA疫苗之间的静电作用和硫酸钠对壳聚糖的盐析作用,使壳聚糖分子和质粒DNA分子复合压缩并包裹缠绕,形成纳米颗粒,然后从体系中析出形成壳聚糖-DNA疫苗纳米粒胶体混悬液。采用这种方法制备的壳聚糖纳米粒,在制备过程中未加入任何有机溶剂,制备条件温和,从而保护了质粒基因的结构和功能。用紫外分光光度法检测壳聚糖-DNA疫苗纳米粒对质粒DNA的包埋率,结果显示在质粒DNA浓度为100 μg/ml时,壳聚糖对质粒DNA的包埋率高达94%,而凝胶阻滞分析实验中,壳聚糖-DNA疫苗纳米粒组质粒DNA全部被阻滞在加样孔中,证明质粒DNA几乎全部被壳聚糖包裹,与包埋率检测结果一致。说明采用该方法制备 CS/DNA纳米粒切实可行。导致裸质粒DNA免疫效应低下的原因之一是其在体内易被核酸酶降解,本实验中,采用DNase I消化实验检测CS-pcDNA3.1-Crisp1纳米复合物的抗核酸酶能力,结果发现当DNase I浓度为25 U/ml,远超过生理剂量时,CS-pcDNA3.1-Crisp1纳米复合物能有效保护DNA不被降解。
纳米粒能否被细胞有效吸收的两个重要影响因素为纳米粒的表面电荷和粒径大小,带正电的纳米粒可以与带负电的细胞膜进行静电作用,而壳聚糖-DNA基因传递系统主要通过内吞或胞饮进入细胞,因此纳米粒径的大小直接影响细胞对纳米粒的吸收[16]。本实验所获得的纳米粒形态规则,大小均一,分散性好,且经纳米粒度分析仪检测显示纳米粒Zeta电位为+0.2 mV,改变了DNA疫苗本身带负电荷的性质,使其更容易通过细胞膜被机体吸收。
壳聚糖能否介导质粒成功转染至真核细胞中并获得表达是实验关键点所在。本实验采用两种不同的方法转染COS-7细胞,结果显示以壳聚糖纳米粒为载体的pcDNA3.1-Crisp-1可在COS-7细胞中有效表达,且与脂质体转染后表达部位一致。由于脂质体可以改变所包裹药物在体内的分布,特异性地靶向肿瘤组织,提高药物疗效,降低药物毒性,因此,近年来,脂质体作为药物传输系统在抗癌药物的制备中应用广泛[17],但其潜在的细胞毒性给脂质体的应用带来了局限性。虽然有报道称阳离子脂质体在细胞内释放核酸后会自我降解,但如果细胞摄入大量的阳离子脂质体,将对细胞产生较大的毒性作用,引起细胞凋亡或坏死[18]。在本实验中,采用MTT试验对两种方法转染后COS-7细胞的存活率进行检测,结果显示:与脂质体Lipofectamine 2000TM转染方法相比,壳聚糖组细胞存活率显著高于脂质体组(P<0.01),说明壳聚糖微粒具有较小的细胞毒性和较高的安全性。
综上所述,本实验成功地构建了以壳聚糖纳米微粒为载体的CRISP1-DNA避孕疫苗,并证实壳聚糖可作为有效地DNA避孕疫苗给药载体,且安全无毒性。
致谢
感谢武汉大学物理学院纳米中心周张凯博士和中国科学院水生所电镜中心袁秀云老师在实验过程中给予的帮助与指导。
[1]Cohen DJ,Ellerman DA,Cuasnicú PS. Mammalian sperm-egg fusion:evidence that epididymal protein DE plays a role in mouse gamete fusion[J]. Biol Reprod,2000,63:462-468.
[2]Roberts KP,Wamstad JA,Ensrud KM,et al. Inhibition of capacitation-associated tyrosine phosphorylation signaling in rat sperm by epididymal protein Crisp-1[J]. Biol Reprod,2003,69:572-581.
[3]Visconti PE,Westbrook VA,Chertihin O,et al. Novel signaling pathways involved in sperm acquisition of fertilizing capacity[J]. J Reprod Immunol,2002,53:133-150.
[4]罗金,杨菁,徐望明,等. 小鼠富含半胱氨酸分泌蛋白-1真核表达载体的构建及其在COS-7细胞中的表达[J]. 生殖与避孕,2010,30:509-513.
[5]罗金,杨菁,程琰,等. 小鼠富含半胱氨酸分泌蛋白-1DNA疫苗免疫避孕效果的评价[J]. 生殖与避孕,2013,33:145-148.
[6]Luo J,Yang J,Cheng Y,et al. Immunogenicity study of plasmid DNA encoding mouse cysteine-rich secretory protein-1 (mCRISP1) as a contraceptive vaccine[J]. Am J Reprod Immunol,2012,68:47-55.
[7]Wolff JA,Malone RW,Williams P,et a1. Direct gene transfer into mouse muscle in vivo[J]. Scienc,1990,247:1465-1468.
[8]Mansouri S,Cuie Y,Winnik F,et al. Characterization of folate-chitosan-DNA nanoparticles for gene therapy[J]. Biomaterials,2006,27:2060-2065.
[9]Guliyeva U,Oner F,Ozsoy S,et al. Chitosan microparticles containing plasmid DNA as potential oral gene delivery system[J]. Eur J Pharm Biopharm,2006,62:17-25.
[10]Busso D,Cohen DJ,Maldera JA,et al. A novel function for CRISP1 in rodent fertilization:involvement in sperm-zona pellucida interaction[J]. Biol Reprod,2007,77:848-854.
[11]Maldera JA,Weigel Muoz M,Chirinos M,et al. Human fertilization:epididymal hCRISP1 mediates sperm-zona pellucida binding through its interaction with ZP3[J]. Mol Hum Reprod,2014,20:341-349.
[12]罗金,刘雪丽,杨菁,等. 小鼠富含半胱氨酸分泌蛋白-1特异性抗体的抗生育作用机制[J]. 武汉大学学报(医学版),2016,37:249-253.
[13]Aiba S. Solution stability and reactivity of partially N-acetylated chitosan derivatives in aqueous media[J]. Int J Biol Macromol,1989,11:249-252.
[14]Xu J,Dai W,Wang Z,et al. Intranasal vaccination with chitosan-DNA nanoparticles expressing pneumococcal surface antigen a protects mice against nasopharyngeal colonization by Streptococcus pneumoniae[J]. Clin Vaccine Immunol,2011,18:75-81.
[15]Sui Z,Chen Q,Fang F,et al. Cross-protection against influenza virus infection by intranasal administration of M1-based vaccine with chitosan as an adjuvant[J]. Vaccine,2010,28:7690-7698.
[16]Erbacher P,Zou S,Bettinger T,et al. Chitosan-based vector/DNA complexes for gene delivery:biophysical characteristics and transfection ability[J]. Pharm Res,1998,15:1332-1339.
[17]盛竹君,徐维平,徐婷娟,等. 脂质体药物传输系统的研究新进展[J]. 中国药业,2015,24:6-8.
[18]林枭,崔韶晖,赵轶男,等. 阳离子脂质体的细胞毒性[J]. 生命的化学,2016,36:50-56.
[编辑:侯丽]
Preparation of chitosan nanoparticles containing Crisp1-DNA contraceptive vaccine and its expression in vitro
LUO Jin,YANG Jing*,CHEN Yan,ZHANG Yi,XU Wang-ming
ReproductiveMedicalCenter,RenminHospitalofWuhanUniversity,Wuhan430060
Objective:To construct chitosan nanoparticles containing Crisp1 DNA contraceptive vaccine,determine its physical and biological characteristics,and evaluate its expression in COS-7 cells.
Cysteine-rich secretory protein-1(Crisp1);Chitosan;DNA vaccine;Immunocontraception;Nanoparticles
10.3969/j.issn.1004-3845.2016.10.018
2016-04-04;
2016-04-23
国家自然科学基金资助项目(81501306)
罗金,女,湖北天门人,博士,生殖医学专业.(*
