莱州湾拟哲水蚤Paracalanus sp.发育期丰度组成和个体大小季节变化
2016-11-11左涛王俊王秀霞
左涛,王俊,王秀霞
(1. 中国水产科学研究院黄海水产研究所,山东 青岛 266071; 2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266000; 3. 农业部海洋渔业可持续发展重点实验室,山东 青岛 266071;4.山东省渔业资源与生态重点实验室,山东 青岛 266071)
莱州湾拟哲水蚤Paracalanus sp.发育期丰度组成和个体大小季节变化
左涛1,2,3,王俊1,2,4,王秀霞1
(1. 中国水产科学研究院黄海水产研究所,山东 青岛 266071; 2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266000; 3. 农业部海洋渔业可持续发展重点实验室,山东 青岛 266071;4.山东省渔业资源与生态重点实验室,山东 青岛 266071)
拟哲水蚤是莱州湾桡足类中周年出现的优势种,是上层鱼类幼鱼早期开口饵料的重要贡献者,掌握其种群动态分布特点,有利于了解湾内生物环境状况、次级生产力生产水平。基于2011年5月至2012年4月采集的浮游生物资料的分析结果显示,莱州湾拟哲水蚤的发育期丰度组成和个体大小均表现了明显的季节变化。调查季节中,4—6月以成体居多,其他季节以桡足幼体CⅢ—CⅤ较多,其中10—11月和3月主要由后期桡足幼体CⅣ和CⅤ期构成。成体中以雌体为主导,雌/雄比介于1.46~9.62,该比值在3—4月最低,10—11月最高。拟哲水蚤各期桡足幼体和成体个体大小以4—5月最大、8月最小,并与水温表现出明显的负相关。拟哲水蚤桡足幼体和成体的总生物量月变化与丰度变化相同,即以8月值最高,3—5月值最低,月均值为2.69 mg/m3(以碳计);日生产力估算值为0.74 mg/(m3·d)(以碳计)。由上述结果,推测莱州湾拟哲水蚤的种群结构周年变化主要可分3个阶段,4—6月是莱州湾拟哲水蚤开始繁殖期,7—8月为种群数量快速增长期,9月之后为种群增长相对停滞期。
拟哲水蚤;发育期丰度;前体长;季节变化;莱州湾
1 引言
莱州湾是渤海的三大海湾之一,是中国北部传统的渔业生物产卵、孵育和索饵场,其东侧紧领渤海口,西侧为中国第二大河黄河的入海口,具有独特的理化和生物特征且受人类活动影响最为突出。拟哲水蚤属Paracalanae种类在全球海洋都有分布。根据近年不同地理区域的拟哲水蚤线粒体DNA鉴定分析结果,西北太平洋中国近海出现的原定名为小拟哲水蚤Paracalanusparvus[1]可能并不同于位于大西洋东北部的小拟哲水蚤的原模式种[2]。鉴此种分类尚存分岐,本文暂使用拟哲水蚤Paracalanussp.。
拟哲水蚤是包括莱州湾在内中国北部近海广布性、常年出现且数量和生物量都占优势的小型桡足类[3—5]。在黄、渤海以及相邻的海湾内,拟哲水蚤喜略高温和高盐,适宜生长水温在13~25℃间,数量以夏、秋季居多,冬、春季较少[5—13]。莱州湾拟哲水蚤数量季节变化是以7—10月较高,高峰值出现在8月[14]。拟哲水蚤是上层经济鱼类幼鱼开口饵料的重要贡献者[15],具备独有的粒级和出现季节双重优势[4]。它的数量高峰季节是莱州湾总渔获量及桡足类食性鱼类(如赤鼻棱鳀、许氏平鲉和青鳞沙丁鱼等)的高渔获量期[16—17],并与莱州湾渔业生物产卵盛期(5—8月)和营浮游动物食性鱼类(如鳀)的仔稚鱼数量高峰期(8月)[18]相重。因此,深入开展莱州湾拟哲水蚤种群结构及其季节变化研究,掌握其种群动态分布特点,对于了解湾内生物环境状况、次级生产力生产水平具有很重要的意义。
目前已有许多海湾区拟哲水蚤的种群动态包括发育期、个体大小以及生殖产卵等研究见于报道,如韩国Jangmok Bay[19]、日本濑户内海[20]、胶州湾[10—11,21]、威海小石岛[22]。研究发现,拟哲水蚤的个体发育快慢和大小具有明显的季节变化,且与环境因素关系密切。本研究是在之前对莱州湾拟哲水蚤周年数量时空分布研究基础上[14],进一步分析拟哲水蚤发育期和个体大小的季节变化等种群结构特点;估算其生物量和生产力;从而更好地定量理解拟哲水蚤在莱州湾的生态环境功能地位,为今后有效评估其在鱼类早期补充过程中饵料供给潜力提供数据基础,这也为中国近海典型海湾小型浮游动物种群研究提供有益补充。
2 数据与方法
2.1数据来源
2011年5—11月、2012年3—4月用渔船“鲁昌渔4193号”(350 kW)在莱州湾(37.25°~38.75°N,119°~120.75°E)进行了9航次的逐月定点综合调查,设18个定点站位。使用浮游生物网(网孔径为160 μm,网口面积为0.2 m2)从底至表垂直拖网采集获得拟哲水蚤。样品采集后固定保存于5%甲醛海水溶液,实验室内镜检分析。在整个调查期间,海水表层水温介于3.5~27℃,盐度介于29~33.5。采样方法和站位及海水温度和盐度的季节空间分布详见文献[14]和[23]。
[24],在实验室Nikon SMZ1500体式显微镜下对拟哲水蚤进行镜检、发育期甄别和计数及测量其头胸部的前体长(prosome length, PL)(精确至0.01 mm)。本研究中拟哲水蚤各发育期包括桡足幼体各期(CⅠ、CⅡ、CⅢ、CⅣ和CⅤ)及雌体(F)和雄体(M),无节幼体期未列入研究。
2.2数据处理
各发育期的数量基于个体计数结果转化为单位滤水量体积个数的值,用丰度(ind/m3)表示。总生物量(mg/m3, 以碳计)基于所有个体的生物量总和所得。个体生物量(μg,以碳计)根据前体长—生物量的经验公式B=PL3.128×10-8.451[25]计算得到;日生产力P[mg/(m3·d),以碳计]估算根据P/B=0.015 e0.163T[20],T为采样站海水温度(℃),T>20℃,P/B值取0.3 d-1。拟哲水蚤各发育期及其前体长组的频数则采利用混合分布法[26]拟合正态曲线,经方差分析(ANOVA)检验后优化和确定拟合曲线与原观测值的差异不显著(P>0.05),方接受拟合后曲线和各拟合分布组的参数。前体长与水温间关系方程分别采用线性回归和Bêlehrdek equation[20]构建。
3 结果
3.1发育期丰度相对组成
所有采样月里,拟哲水蚤都有出现。湾内周年平均丰度为2 156 ind/m3;平均丰度的月变化为,3月最低,仅为113 ind/m3,7月快速增加至约3 000 ind/m3,8月出现周年最高值,达7 305 ind/m3,之后又快速下降,11月整个湾内总丰度降至547 ind/m3。各发育期中,早期幼体CⅠ和CⅡ以秋季9月和10月丰度居多;CⅢ、CⅣ和CⅤ以及雌体和雄体都是8月丰度最多。
各发育期丰度相对组成中,3月以及7—11月主要由CⅢ、CⅣ和CⅤ构成;4—6月以成体所占比例最高;CⅠ和CⅡ期所占比例较低,以10—11月略多,但也不超过10%;成体中,雄体以4和5月所占比例较高(约为20%)、随后逐月降低;雌体所占比例以5月和6月值最高,接近50%, 4月为28%,其他月相应值均小于15%(图1)。两因素(季节和发育期)方差分析结果显示,各发育期的丰度相对组成间的方差差异达到极显著水平(P<0.001),季节间差异未达显著水平(P>0.05)。
成体中雌/雄性比月均值介于1.46~9.62间。各调查月中,3月和4月性比值最低,不超过1.5;10月和11月最高,分别为8.85和9.65,另外5月值也较高,为8.68;6月至9月间,拟哲水蚤的性比均值介于3~5间。
3.2前体长—频数分布
拟哲水蚤桡足体期的个体前体长介于0.25 mm(CⅠ期)至0.93 mm(雌体)。各月的发育期的前体长频数混合分布(图3)中,3月至6月拟哲水蚤的前体长频数分布均有一明显陡峰值,其中3月前体长频数的峰值对应的拟哲水蚤前体长在0.45~0.50 mm间,主要由CⅢ期和CⅣ期桡足幼体构成;4月前体长频数峰值所对应的前体长明显增大,为0.70~0.82 mm,成体中的雄和雌体是该峰值的共同贡献者;5月和6月前体长频数峰值所对应的前体长仍然在0.70~0.82 mm间,但5月由雄体、6月由雌体作为峰值主要贡献者。7月至11月,拟哲水蚤的前体长频数分布呈现较宽而平缓的波峰,这些波峰组对应的前体长组介于0.4~0.6 mm,主要由CⅢ-CⅤ期桡足幼体贡献所致,另外在7月波峰的前体长组介于0.4~0.7 mm,雌体是大于0.6 mm前体长组的贡献者。

图1 2011年5月至2012年4月莱州湾拟哲水蚤各发育期丰度(左图)及其相对组成(右图)月变化Fig.1 Stage-specific abundance and relative abundance distributions of Paracalanus sp. in Laizhou Bay from May 2011 to April 2012图中显示各月调查站的最大值和最小值,柱形上、中、下线代表75%、50% 和25%位值The caps at the end of each box indicate the extreme values (minimum and maximum), the box is defined by the lower and upper quartiles, and the line in the center of the box is the median
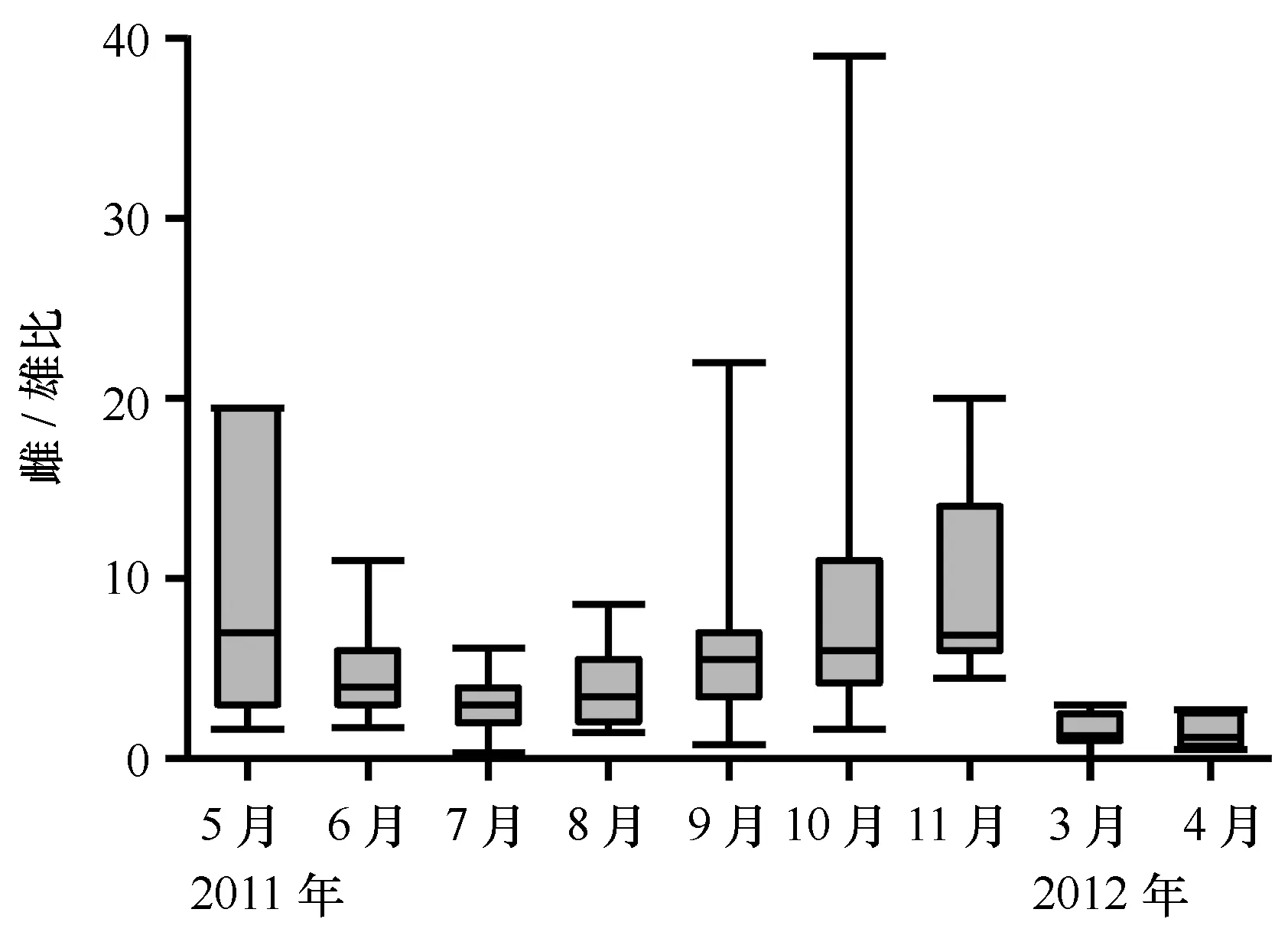
图2 2011年5月至2012年4月莱州湾拟哲水蚤成体雌/雄比Fig.2 Sex ratio of Paracalanus sp. in Laizhou Bay from May 2011 to April 2012图中显示各月调查站的最大值和最小值,柱形上、中、下线代表75%、50% 和25%位值The caps at the end of each box indicate the extreme values (minimum and maximum), the box is defined by the lower and upper quartiles, and the line in the center of the box is the median
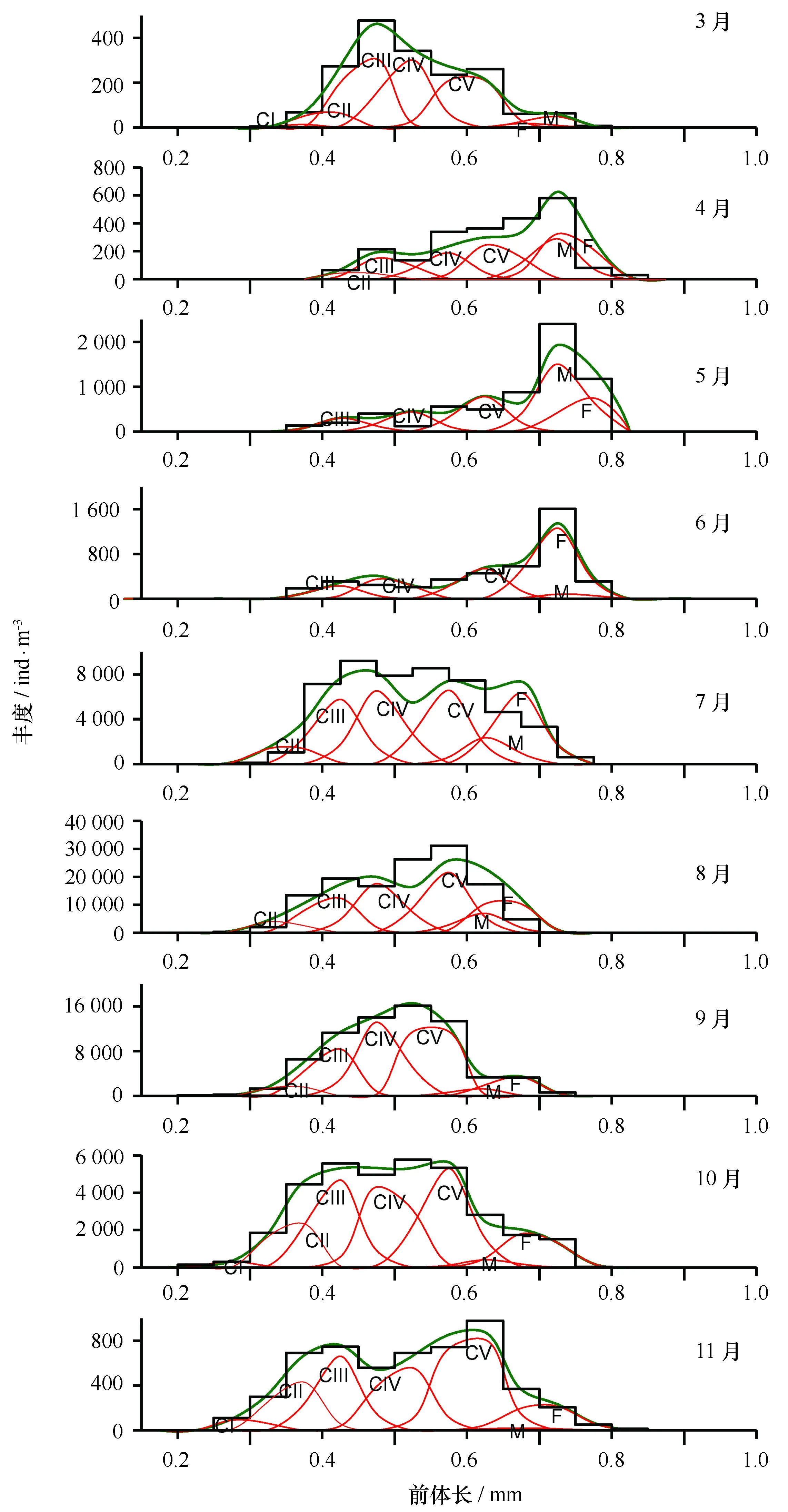
图3 2011年5月至2012年4月莱州湾拟哲水蚤各发育期组成的前体长-频数混合分布Fig.3 Mixed normal distributions based on seasonal stage-specific abundance and prosome length distributions of Paracalanus sp. in Laizhou Bay from May 2011 to April 2012图中绿线代表总的前体长—频数分布,红色代表各发育期的前体长—频数分布Green line represents the mixed distribution of total individuals along the prosome length; red lines represent the normal distributions of stage-specific copepodites a-long the prosome length
综合图3和图4,各调查月中, 3—4月、9—11月各发育期的前体长均值表现为随月增加的趋势。雌体前体长以5月值最大,其他发育期前体长均值均以4月最高,夏季7-8月前体长平均值最小,但9月之后前体长又开始增加。雄体前体长均值在4月几近于雌体,其他月份均小于雌体。总体而言,拟哲水蚤各发育期以冬、春季个体较大,夏、秋季较小。
利用方差分析得到,平均前体长存在显著的月间差异(P<0.05),站位间差异未达显著水平(P>0.05)。雌体和雄体平均前体长表现显著的月间、站位间差异。其他幼体发育期平均前体长存在显著月间差异,站位间差异不明显。各发育期前体长与表层水温都呈显著的负相关(表1)。
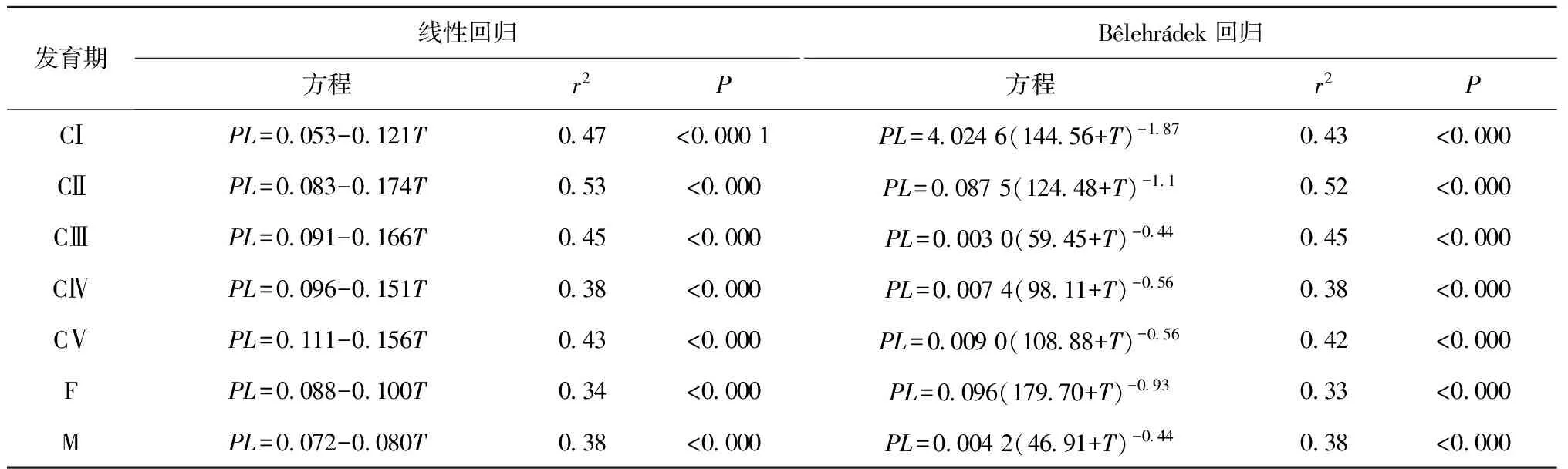
表1 2011年5月至2012年4月莱州湾拟哲水蚤各发育期前体长(PL,μm)与表层水温(T,℃)回归关系

图4 2011年5月至2012年4月莱州湾拟哲水蚤各发育期平均前体长Fig.4 Mean prosome length of stage-specific Paracalanus sp. in Laizhou Bay from May 2011 to April 2012
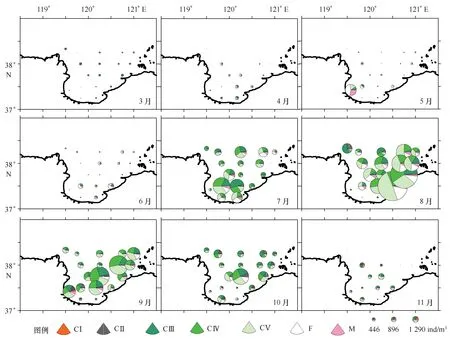
图5 2011年5月至2012年4月莱州湾拟哲水蚤各发育期丰度相对组成的空间分布Fig.5 Spatial distributions of Paracalanus sp. stage-specific abundance compositions in Laizhou Bay from May 2011 to April 2012
3.3发育期丰度组成空间分布
由图5和方差分析,拟哲水蚤各发育期的丰度组成分布更多表现为月间差异,同一月的不同站位间丰度相对组成差异不显著(P>0.05)。
3.4生物量和生产力估算
拟哲水蚤月平均生物量为2.69 mg/m3,其季节变化(图6)是以夏季8月最高(9.92 mg /m3)、3月最低(0.16 mg/m3)。调查月中,各发育期个体的生物量相对贡献比例(图6)亦与其丰度相似(图1)。所有调查月的日生产力均值为0.74 mg/(m3·d)、年生产力估值为222 mg/(m3·a)(12月至2月取3月低值)。
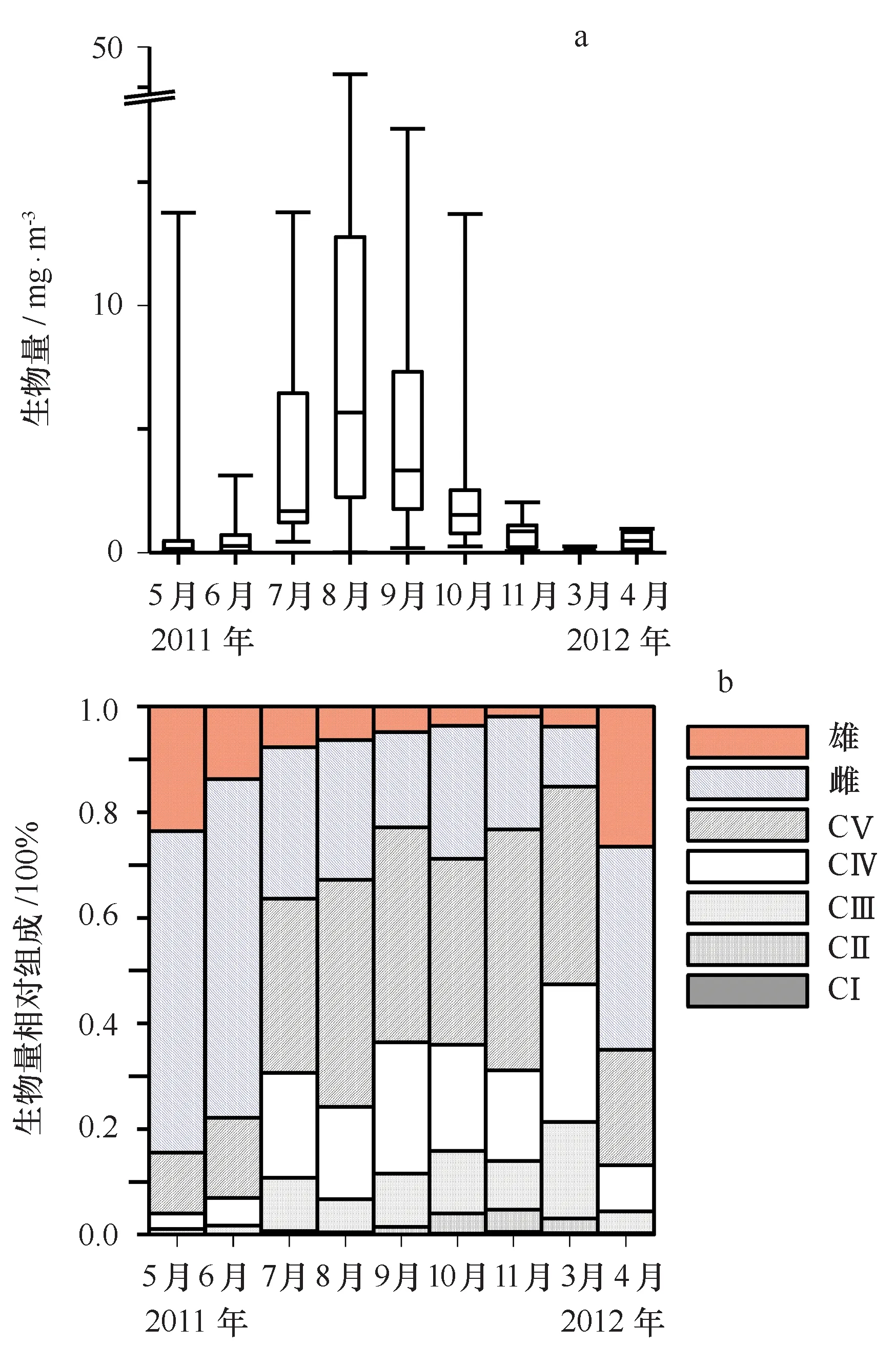
图6 2011年5月至2012年4月莱州湾拟哲水蚤生物量(a)及各发育期相对组成(b)的月变化Fig.6 Monthly variations of Paracalanus sp. biomass (a) and its stage-specific relative compositions (b) in Laizhou Bay during May 2011 to April 2012. In the upper plot, the caps at the end of each box indicate the extreme values (minimum and maximum), the box is defined by the lower and upper quartiles, and the line in the center of the box is the median
4 讨论
本研究显示莱州湾拟哲水蚤种群的周年变化特点是,在湾内全年存在,5月时丰度还很少,6月开始增加,至夏季8月丰度最高,之后急剧降低;8月至翌年的3月之前均以桡足幼体为主,其中夏末和秋季早期桡足幼体明显增多,冬季和早春早期桡足幼体和成体较少,主要由后期桡足幼体CⅣ和CⅤ期构成;成体所占的数量比例以及各发育期桡足幼体的前体长、以5、6月最大,之后急剧降低,9月开始缓慢增加,直至第二年的3月才恢复较高水平。
拟哲水蚤被认为不能产生休眠卵[20,27],主要以后期桡足幼体存在越冬[7,10,28—29]。渤海拟哲水蚤在水温低于5℃时停止生长,因而以后期CⅣ和CⅤ存在越冬,待水温升高时才迅速成熟[4]。莱州湾2010年12月至2011年2月为冰期,因此本研究缺少足够的冬季样品。但本研究采样期3月湾内的平均水温仅为3.5℃[14],属冬末早春期,此时莱州湾拟哲水蚤发育期组成成体所占比例仍远远低于其他桡足幼体(图1)。此外,10月莱州湾拟哲水蚤的频数分布峰值尚由桡足幼体CⅢ—CⅤ期共同构成,11月波峰逐渐向CV期倾斜(图3),且在11月各发育期丰度组成中,CV期桡足幼体所占的相对数量比例亦是最高,成体所占相应比例反而很低(图1)。因此可从一定程度上证实,11月至3月间莱州湾拟哲水蚤种群的主体仍应以桡足幼体后期存在越冬。拟哲水蚤越冬时并不能依靠体内的能量储存。其个体含能量物质油滴以夏季最多,但不能储存越冬,而只是作为其当季生殖生产所需的能量供应[30],这也可能是渤海小拟哲水蚤摄食强度以冬季最大、其次为夏、秋和春季[31]的原因。
拟哲水蚤的世代周期短,14℃时为20 d,在20℃以下自然环境需20~44 d、20℃以上则15~24 d[20,25]。日本濑户内海湾观察到该种类每年有15个世代[20]。渤海拟哲水蚤据推测一年有超过10个世代[4]。本研究采样频次为每月一次,远远低于自然环境中拟哲水蚤世代周期,无法准确推算莱州湾拟哲水蚤的世代数。结果中,在4—6月莱州湾拟哲水蚤成体、特别是雌体是种群组成的主体(图1),其中雌/雄比值在3月和4月最低(图2),且在4月雄体个体大、其前体长均值几与此期雌体相应值相等(图4)。而一般,春季拟哲水蚤度冬群体开始成熟,雄体早于雌体成熟[10,20]。韩国Jangmok Bay雄体占成体总丰度的比例以4月最高、冬季最低[14]。根据上述成体的相对组成,推测4—6月应为莱州湾拟哲水蚤度冬群体发育成熟并进入繁殖盛期。莱州湾拟哲水蚤的繁殖盛期季节相对略晚,胶州湾小拟哲水蚤在3月雌性成体数量已占绝对优势(94%)[28]。这应与莱州湾地理纬度较高、海水季节升温较晚有关。7—10月间莱州湾拟哲水蚤种群进入持续快速增长时期,此期桡足幼体和成体在这段时间均维持较高的丰度,成体所占比例有所降低,其他各发育期的相对组成比例变化没有出现大的波动(图1)。10—11月,整个种群包括成体数量大幅下降,预示着整个种群的增长进入了停滞期,这一时期可延续至翌年的3月。
各月中,莱州湾拟哲水蚤成体明显都以雌体为主导。自然环境拟哲水蚤成体中多以雌体居多[20,32],这与雄体寿命较短[20]以及雌体能交配一次后保持受精状态、多批次产卵生殖策略有关。实际上,拟哲水蚤在桡足幼体后期,雌体和雄体数量比例接近,只是至成体时,才以雌体居多[20]。本研究中,莱州湾拟哲水蚤雄体占成体丰度比例介于0.02~0.21间、月均值为0.06,低于自然海域拟哲水蚤属的相应值(0.1~0.45,平均值为0.2)[33]。具体原因有待深入研究。
莱州湾拟哲水蚤各发育期的个体大小(前体长)以冬、春大,夏、秋季小;除雌体外,高峰值均出现在4月,雌体最大前体长出现在5月。拟哲水蚤各发育期的个体大小(前体长)的季节变化总体趋势与其丰度相反,即拟哲水蚤的周年最大前体长出现季节往往为其丰度低值期,而且丰度最高的月份往往为其个体前体长低值所在,这在胶州湾、日本濑户内海湾等水域都有类似报道,如,胶州湾小拟哲水蚤的平均前体长高值为春季5月,其丰度高峰为6月[11];威海小石岛小拟哲水蚤的前体长自3月开始增加,最大值出现在6月,其丰度高峰期为9月[22];韩国Jangmok Bay的小拟哲水蚤的雌体从8月至5月前体长呈增加趋势,然后开始降低至夏季[19]。上述现象被认为是与水温的季节变化有关。桡足类的成体前体长是不断发育蜕皮过程形成,发育期间隔时间的长短与水温有关[34]。小拟哲水蚤后期桡足幼体过冬时,受低温特别是采样前一个月水温的影响,世代生长慢、周期长,因而成体的个体大[28—29]。从表1中也可看到,莱州湾拟哲水蚤的前体长与水温表现了明显的负相关。另外,也有认为叶绿素、盐度对拟哲水蚤的种群体长有一定的影响[11]。本研究未采集叶绿素样,故未做相关分析,另采用多元分析暂未发现盐度对莱州湾拟哲水蚤前体长有统计意义上的相关作用,其结果未在此研究中列出。
本研究中莱州湾拟哲水蚤的种群丰度峰值为8月7 000 ind/m3,低于1988年8月胶州湾为13 000 ind/m3[28]、1986年高峰期6—7月日本濑户内海为95 000 ind/m3[20]以及1959年渤海7月最大值21 940 ind/m3[6],高于2009年9月威海小石岛4 105 ind/m3[22]、2010且8月的韩国Jangmok Bay的3 000 ind/m3[19]。这可能与各水域的水温年变化有关。莱州湾拟哲水蚤数量分布与温度表现明显的正相关,特别是采样前1—2月的水温[15]。种群的产卵率的区域间差异,在一定范围内,水温高,能促进拟哲水蚤连续的生长和保持较高的产卵率。胶州湾和日本濑户内海的纬度较莱州湾及威海低,季节性升温快,周年世代数可能更多,利于种群数量的增加[10,19,21,27]。除水温外,各海区的盐度和饵料生物多少等其他环境因素也是影响拟哲水蚤数量的重要因素。如在叶绿素小于3 μg/L的有限饵料环境下,拟哲水蚤的产卵率会受到影响[27],还有曾发现莱州湾海水盐度也会影响拟哲水蚤数量分布[14]。此外,上述报道中研究者使用的采样方法不尽相同,网具孔径从60~200 μm,网具采集效率差异也可能引起数量的较大差别。
本研究估算的拟哲水蚤月均数量和生物量高于整个渤海平均值761 ind/m3和23.54 mg/m3(湿质量,按80%含水量和40%含C量换算相当于1.88 mg/m3)[4],月生物量与韩国Jangmok Bay小拟哲水蚤估值2.1 mg/m3[19]相近,其8月生物量最高值9.92 mg/m3高于胶州湾相应周年峰值6月的6.2 mg/m3、但远低于日本濑户内海7月的103 mg/m3。由于受网具采集有限,拟哲水蚤的无节幼体未在本研究之列。据估算,日本濑户内海无节幼体对整个种群的生物量贡献率约为5.2%[20]。因此认为,莱州湾拟哲水蚤的实际生物量和生产力还应略高于结果中的估值。
5 结语
拟哲水蚤是莱州湾内数量较多、分布广泛,偏暖水性的小型桡足类。它在莱州湾的总体丰度和生物量分布水平高于整个渤海均值。与莱州湾小型水母[23]相似,湾内拟哲水蚤的数量时空分布以及种群结构等方面表现较为明显的季节性时间格局上的变动。4—6月为其生殖开始季节,7—10月为其种群快速生长时期,之后为种群增长停滞及减少期。莱州湾拟哲水蚤种群丰度和生物量、前体长的季节变化均为单峰型,其中丰度和生物量以夏、秋季最高,冬、春季最低,前体长的季节变化与之相反。环境因子中水温对于拟哲水蚤数量变动、发育期组成和个体大小分布都表现了明显的作用。现有的研究虽然基本明晰了莱州湾拟哲水蚤数量以及种群结构的月变化特点,但是该种群的关键参数,如产卵率、无节幼体的数量动态、周年世代数等尚未解决,需进一步开展研究工作才能更为清晰阐释莱州湾拟哲水蚤的种群动态。
致谢:本文海上样品采集和处理、分析得到陈峻峰、吴强、孙坚强、陈瑞盛以及农业部黄渤海渔业资源环境重点野外科学观测试验站工作人员的帮助,数据处理得到王新良的帮助,并致谢忱。
参考文献:
[1]陈清潮, 章淑珍. 黄海和东海的浮游桡足类 Ⅰ. 哲水蚤目[J]. 海洋科学集刊, 1965(7): 20-131.
Chen Qingchao, Zhang Shuzhen. The planktonic copepods of the Yellow Sea and the East China Sea Ⅰ. Calanoida[J]. Studia Marina Sinica, 1965(7): 20-131.
[2]Cornils A, Held C. Evidence of cryptic and pseudocryptic speciation in theParacalanusparvusspecies complex (Crustacea, Copepoda, Calanoida)[J]. Frontiers in Zoology, 2014, 11(1): 19.
[3]毕洪生, 孙松, 高尚武, 等. 渤海浮游动物群落生态特点 Ⅰ. 种类组成与群落结构[J]. 生态学报, 2000, 20(5): 715-721.
Bi Hongsheng, Sun Song, Gao Shangwu, et al. The ecological characteristics of the zooplankton community in the Bohai Sea Ⅰ. species composition and community structure[J]. Acta Ecologica Sinica, 2000, 20(5): 715-721.
[4]王荣, 张鸿雁, 王克, 等. 小型桡足类在海洋生态系统中的功能作用[J]. 海洋与湖沼, 2002, 33(5): 453-460.
Wang Rong, Zhang Hongyan, Wang Ke, et al. Function performed by small copepods in marine ecosystem[J]. Oceanologia et Limnologia Sinica, 2002, 33(5): 453-460.
[5]张芳, 孙松, 杨波, 等. 黄海小拟哲水蚤(Paracalanusparvus)丰度的季节变化[J]. 海洋与湖沼, 2006, 37(4): 322-329.
Zhang Fang, Sun Song, Yang Bo, et al. Seasonal changes in abundance of small copepodParacalanusparvusin the Yellow Sea[J]. Oceanologia et Limnologia Sinica, 2006, 37(4): 322-329.
[6]毕洪生, 孙松, 高尚武, 等. 渤海浮游动物群落生态特点Ⅱ. 桡足类数量及变动[J]. 生态学报, 2001, 21(2): 177-185.
Bi Hongsheng, Sun Song, Gao Shangwu, et al. The ecological characteristics of zooplankton community in the Bohai Sea Ⅱ. The distribution of copepoda abundance and seasonal dynamics[J]. Acta Ecologica Sinica, 2001, 21(2): 177-185.
[7]Wang Rong, Zhang Hongyan, Wang Ke, et al. Distribution and population dynamics ofParacalanusparvus,Paracalanuscrassirostris, andAcartiabifilosa(copepoda, calanoida) in the Bohai Sea[J]. Chinese Journal of Oceanology and Limnology, 2002, 20(4): 348-357.
[8]张武昌, 王克, 高尚武, 等. 渤海春季和秋季的浮游动物[J]. 海洋与湖沼, 2002, 33(6):630-639.
Zhang Wuchang, Wang Ke, Gao Shangwu, et al. Zooplankton in the Bohai Sea in spring and autumn[J]. Oceanologia et Limnologia Sinica, 2002, 33(6): 630-639.
[9]高露姣, 杨元利, 李丁成, 等. 黄海南部及东海中小型浮游桡足类生态学研究Ⅳ. 拟哲水蚤属[J]. 水产学报, 2003, 27(S): 23-30.
Gao Lujiao, Yang Yuanli, Li Dingcheng, et al. Study on ecology of meso-small pelagic copepods in the Southern Yellow Sea and the East China Sea Ⅳ.ParacalanusGenus[J]. Journal of Fisheries of China, 2003, 27(S): 23-30.
[10]Sun Xiaohong, Sun Song, Li Chaolun, et al. Seasonal and spatial variation in abundance and egg production ofParacalanusparvus(Copepoda: Calanoida) in/out Jiaozhou Bay, China[J]. Estuarine, Coastal and Shelf Science, 2008, 79(4): 637-643.
[11]Sun Xiaohong, Sun Song, Li Chaolun, et al. Seasonal change in body length of important small copepods and relationship with environmental factors in Jiaozhou Bay, China[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(3): 404-409.
[12]孙松, 周克, 杨波, 等. 胶州湾浮游动物生态学研究 Ⅰ. 种类组成[J]. 海洋与湖沼, 2008, 39(1): 1-7.
Sun Song, Zhou Ke, Yang Bo, et al. Ecology of zooplankton in the Jiaozhou Bay Ⅰ. Species composition[J]. Oceanologia et Limnologia Sinica, 2008, 39(1): 1-7.
[13]盖建军, 袁广旺, 李琴. 海州湾渔场小拟哲水蚤的生态学研究[J]. 淮海工学院学报(自然科学版), 2013, 22(3): 89-92.
Gai Jianjun, Yuan Guangwang, Li Qin. Ecological study ofParacalanusparvusin Haizhou Bay fishery[J]. Journal of Huaihai Institute of Technology (Natural Science Edition), 2013, 22(3): 89-92.
[14]王秀霞, 左涛, 吴强, 等. 莱州湾小拟哲水蚤(Paracalanusparvus)丰度分布周年变动[J]. 渔业科学进展, 2015, 36(1): 1-9.
Wang Xiuxia, Zuo Tao, Wu Qiang, et al. Annual dynamic distributions ofParacalanusparvus(Copepoda Calanoida) in Laizhou Bay, China[J]. Progress in Fishery Sciences, 2015, 36(1): 1-9.
[15]孟田湘. 山东半岛南部鳀鱼产卵场鳀鱼仔、稚鱼摄食的研究[J]. 海洋水产研究, 2011, 22(2): 21-25.
Meng Tianxiang. Studies on the feeding of anchovy (Engraulisjaponnicus) post larva in the spawning ground in the Southern waters of Shandong peninsula[J]. Marine Fisheries Research, 2011, 22(2): 21-25.
[16]孙鹏飞, 单秀娟, 吴强, 等. 莱州湾及黄河口水域鱼类群落结构的季节变化[J]. 生态学报, 2014, 34(2): 367-376.
Sun Pengfei, Shan Xiujuan, Wu Qiang, et al. Seasonal variations in fish community structure in the Laizhou Bay and the Yellow River Estuary[J]. Acta Ecologica Sinica, 2014, 34(2): 367-376.
[17]张波, 吴强, 金显仕. 莱州湾鱼类群落的营养结构及其变化[J]. 渔业科学进展, 2013, 34(2): 1-9.
Zhang Bo, Wu Qiang, Jin Xianshi. Feeding ecology of fish assemblages and its variations in the Laizhou Bay[J]. Progress in Fishery Sciences, 2013, 34(2): 1-9.
[18]万瑞景, 姜言伟. 渤海硬骨鱼类鱼卵和仔稚鱼分布及其动态变化[J]. 中国水产科学, 1998, 5(1): 43-50.
Wan Ruijing, Jiang Yanwei. The distribution and variation of eggs and larvae of osteichthyes in the Bohai Sea[J]. Journal of Fishery Sciences of China, 1998, 5(1): 43-50.
[19]Jang M C, Shin K, Hyun B, et al. Temperature-regulated egg production rate, and seasonal and interannual variations inParacalanusparvus[J]. Journal of Plankton Research, 2013, 35(5): 1035-1045.
[20]Liang D, Uye S. Population dynamics and production of the planktonic copepods in a eutrophic inlet of the Inland Sea of Japan. Ⅲ.Paracalanussp.[J]. Marine Biology, 1996, 127(2): 219-227.
[21]Sun Xiaohong, Sun Song, Li Chaolun, et al. Seasonal and spatial variability in egg production, abundance and production of small copepods in and near Jiaozhou Bay, China[J]. Journal of Plankton Research, 2011, 33(5): 741-750.
[22]Sun Xiaohong, Liang Zhenlin, Zou Jixin, et al. Seasonal variation in community structure and body length of dominant copepods around artificial reefs in Xiaoshi Island, China[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(2): 282-289.
[23]左涛, 吴强, 王俊, 等. 莱州湾水母种类多样性及群集结构的季节变化[J]. 生态学报, 2016, 36(18), doi: 10.5846/stxb201505030902.
Zuo Tao, Wu Qiang, Wang Jun, et al. Annual survey of the species diversity and assemblage dynamics of medusae in Laizhou Bay, Bohai Sea[J]. Acta Ecologica Sinica, 2016, 36(18), doi: 10.5846/stxb201505030902.
[24]高尚武, 林雅蓉. 胶州湾桡足类的生物学研究 Ⅰ. 小拟哲水蚤桡足幼体的变态[J]. 海洋科学, 1986, 10(1): 51-59.
Gao Shangwu, Lin Yarong. A study on the biology of copepodid from Jiao Zhou Bay Ⅰ. the copepodid stages ofParacalanusparvus(Claus)[J]. Marine Sciences, 1986, 10(1): 51-59.
[25]Uye S I. Temperature-dependent development and growth of the planktonic copepodParacalanussp. in the laboratory[J]. Bulletin Plankton Society of Japan, 1991(S): 627-636.
[26]Macdonald P D M, Pitcher T J. Age-groups from size-frequency data: a versatile and efficient method of analyzing distribution mixtures[J]. Journal of the Fisheries Research Board of Canada, 1979, 36(8): 987-1001.
[27]Uye S I, Shibuno N. Reproductive biology of the planktonic copepodParacalanussp. in the Inland Sea of Japan[J]. Journal of Plankton Research, 1992, 14(3): 343-358.
[28]仲学锋, 肖贻昌. 胶州湾三种哲水蚤种群动态的研究[J]. 海洋科学, 1992(1): 44-48.
Zhong Xuefeng, Xiao Yichang. Seasonal cycles of abundance of three copepod species population in Jiaozhou Bay[J]. Marine Sciences, 1992(1): 44-48.
[29]Hirst A G, Sheader M, Williams J A. Annual pattern of calanoid copepod abundance, prosome length and minor role in pelagic carbon flux in the Solent, UK[J]. Marine Ecology Progress Series, 1999, 177: 133-146.
[30]Arima D, Yamaguchi A, Abe Y, et al. Seasonal changes in body size and oil sac volume of three planktonic copepods,Paracalanusparvus(Claus, 1863),PseudocalanusnewmaniFrost, 1989 andOithonasimilisClaus, 1866, in a temperate embayment: what controls their seasonality?[J]. Crustaceana, 2014, 87(3): 364-375.
[31]杨纪明. 渤海小拟哲水蚤摄食的初步研究[J]. 现代渔业信息, 1998, 13(5): 5-9.
Yang Jiming. Primary study on feeding ofParacalanusparvusin Bohai Sea[J]. Modern Fisheries Information, 1998, 13(5): 5-9.
[32]Kouwenberg J H M. Sex ratio of Calanoid copepods in relation to population composition in the northwestern Mediterranean[J]. Crustaceana, 1993, 64(3): 281-299.
[33]Kiørboe T. Sex, sex-ratios, and the dynamics of pelagic copepod populations[J]. Oecologia, 2006, 148(1): 40-50.
[34]Deevey G B. Relative effects of temperature and food on seasonal variations in length of marine copepods in some eastern American and western European waters[J]. Bulletin of the Bingham Oceanography Collection, 1960, 17(2): 54-85.
Seasonal stage-specific abundance compositions and body size distributions of Paracalanus sp. (Copepoda: Calanoida) in Laizhou Bay, Bohai Sea
Zuo Tao1,2,3, Wang Jun1,2,4, Wang Xiuxia1
(1.Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China; 2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China; 3. Key Laboratory for Developmental Utilization of Marine Fisheries, Ministry of Agriculture, Qingdao 266071, China;4.Key Laboratory for Fishery Resources and Eco-Environment, Qingdao 266071, China)
Paracalanussp., which has been identified asParacalanusparvusby previous reports in the northern part of China seas, is a very common small copepod in Laizhou Bay, Bohai Sea. The species is characterized ecologically by a high level of secondary productivity and a suitable food resource for early larvae of fishes in the bay. To explore the population dynamic in Laizhou Bay, copepodites and adult data ofParacalanussp. were collected and analyzed from 147 samples over the annual surveys from May 2011 to April 2012 (excluding December 2011 and January and February 2012, because of the presence of sea ice). The results showedParacalanussp. occurred continuously in the plankton throughout the year, with an enormous peak in August. Its stage-specific population structure and body size fluctuated greatly during the study period. During the surveyed seasons, copepodites stages CⅢ, CⅣ and CⅤ contributed most percentages in total population abundance except that from April to June when the adults became dominant. Of the copepodite stages, CⅣ and CⅤ accounted for the largest proportion of the total population abundance from October to March. In the adult, pronounced dominance of females over males was found throughout the year. The female to male ratios ranged from 1.46 to 9.62, with the lowest value in March and April and highest in October and November. The body size ofParacalanussp. changed seasonally, being the largest in April or May, and the smallest in August. Mean body size of each developmental stage was inversely related to temperature at the time of sampling by regression statistic. The biomass ofParacalanussp. showed marked seasonal variations largely in parallel with numerical abundance. Its monthly mean value was 2.69 mg/m3. The species production rate was estimated with 0.74 mg/(m3·d) based on the reported experienced equation. From above results, the annual population dynamic ofParacalanussp. could be divided into three main phases, starting breeding phase from April to June, rapid population growth phase from July to August, and relative population growth stagnation phase just after September.
Paracalanussp.; stages-specific abundance; prosome length; seasonal variation; Laizhou Bay
10.3969/j.issn.0253-4193.2016.10.010
2016-03-24;
2016-04-25。
国家基金委-山东省联合基金项目(U1406403);国家重点基础研究发展规划项目(2011CB403604);公益性行业(农业)科研专项(201303050-01);山东省自然科学基金(2009ZRB02317)。
左涛(1976—),女,江西省抚州市人,副研究员,主要从事海洋浮游动物生态学研究。E-mail:zuotao@ysfri.ac.cn
Q178.53
A
0253-4193(2016)10-0094-11
左涛,王俊,王秀霞. 莱州湾拟哲水蚤Paracalanussp.发育期丰度组成和个体大小季节变化[J].海洋学报,2016,38(10):94—104,
Zuo Tao, Wang Jun, Wang Xiuxia. Seasonal stage-specific abundance compositions and body size distributions ofParacalanussp. (Copepoda: Calanoida) in Laizhou Bay, Bohai Sea[J]. Haiyang Xuebao,2016,38(10):94—104, doi:10.3969/j.issn.0253-4193.2016.10.010
