南沙海域虫戎群落特征与季风、管水母关系分析
2016-11-11王亮根杜飞雁李亚芳宁加佳谷阳光
王亮根,杜飞雁*,李亚芳,宁加佳,谷阳光
(1.中国水产科学研究院 南海水产研究所 广东省渔业生态环境重点实验室,广东 广州 510300;2. 中国水产科学研究院 南海水产研究所 农业部南海渔业资源环境科学观测实验站,广东 广州 510300;3. 中国水产科学研究院 南海水产研究所 农业部南海渔业资源开发利用重点实验室,广东 广州 510300)
南沙海域虫戎群落特征与季风、管水母关系分析
王亮根1,2,3,杜飞雁1,2,3*,李亚芳1,2,3,宁加佳1,2,3,谷阳光1,2,3
(1.中国水产科学研究院 南海水产研究所 广东省渔业生态环境重点实验室,广东 广州 510300;2. 中国水产科学研究院 南海水产研究所 农业部南海渔业资源环境科学观测实验站,广东 广州 510300;3. 中国水产科学研究院 南海水产研究所 农业部南海渔业资源开发利用重点实验室,广东 广州 510300)
根据2013年3—4月、6—7月、9月和11—12月4个航次的调查资料,分析南沙海域浮游虫戎亚目的种类组成、优势种、栖息密度和群落结构特征,并探讨季风转换对其影响及其与管水母的关系。研究海域内共鉴定浮游虫戎亚目12科26属63种。生态类群结构属于热带大洋性。优势种较少,共出现7种,其中,孟加拉蛮虫戎(Lestrigonusbengalensis)为唯一的年度优势种,优势地位显著。物种组成存在季节性变化,分为春季、夏季与秋-冬季3个群落。虫戎年均栖息密度为18.30×10-2ind/m3,高数量区主要分布于近岸水域,数量季节变化不明显,但平面分布季节差异明显。虫戎年均丰富度、多样性、均匀度指数和多样性阈值各是1.23、1.28、0.33、0.48。虫戎物种组成随季风转换左右近岸低盐水影响程度而变化;群落结构、生物多样性和栖息密度平面分布随季风转换所驱动的表层环流结构改变而变化。虫戎群落分布与管水母间的相关性证实研究海域两类群物种间的寄宿关系。这种关系促使孟加拉蛮虫戎在沿岸低盐水影响下更易形成高优势度,而表现出类似近岸海域优势种优势地位显著的特点。
南沙海域;浮游端足类;虫戎;群落结构;沿岸水;海流;管水母
1 引言
浮游端足类虫戎亚目是海洋浮游甲壳动物主要类群之一,其丰富程度仅次于桡足类和磷虾类,数量通常占大型浮游动物的5%~7%,是鱼类、海鸟和须鲸的直接饵料[1—2],我国舟山渔场鲐鱼产量与浮游端足类的数量密切相关[3—4]。可见,浮游端足类是海洋食物网联接中上层浮游生物与游泳生物的关键类群,了解其分布特征是深入研究海洋食物网的重要基础。
浮游生物分布受风、水团与垂直混合等外在因素驱动[5—6],故海洋环流、水团以及海流的改变会引起浮游端足类分布变动[7]。东海、台湾海峡、南海中北部的研究均表明浮游端足类的分布受到沿岸低盐水、黑潮水等水团影响[4,8—11]。在东太平洋近海,浮游端足类分布随加利福尼亚寒流变化而变化[12]。南沙海域地处中国最南端,为中南半岛、加里曼丹岛与巴拉望岛环抱,与泰国湾、苏禄海、爪哇海、安达曼海相通,其近乎封闭的地理特征是驱动南海环流的主要因素。南沙海域受季风影响,海洋环流结构呈明显的季节差异[13]。南沙海域虫戎的分布与季风转换引起环流改变与水团变化间的关系尚不明确。此外,虫戎能寄生于多种胶质浮游动物体内,借助胶质浮游动物的保护漂流在贫瘠的海洋之中并完成世代交替[14—15],它们之间存在明显的同分布特征[16—18],国内相关研究尚未见报道。
为此,本文在阐明南沙海域浮游端足类虫戎亚目种类组成、数量分布和群落结构及其季节性变化特征的基础之上,探讨其与季风、沿岸水团和环流等因素的关系以及其与管水母共栖息关系,为深入研究南沙海域浮游动物对季风转换响应机制与浮游动物间共栖息关系提供科学基础。
2 材料与方法
2.1样品采集与分析
材料来源于2013年3—4月(春季)、6—7月(夏季)、9月(秋季)与11—12月(冬季)的南沙群岛海域(4°30′~11°30′N,111°30′~112°30′E)的4次渔业生态资源的综合调查,采样站位如图1所示。使用大型浮游生物网(大型网)(网长280 cm,网口内径80 cm,网口面积0.5 m2,网孔直径0.505 mm)采集0~200 m水层的浮游生物。浮游生物样品的处理、保存、计数等均按《海洋调查规范》[19]进行。温度盐度数据采集使用CTD(Sea-Bird MWS12)。
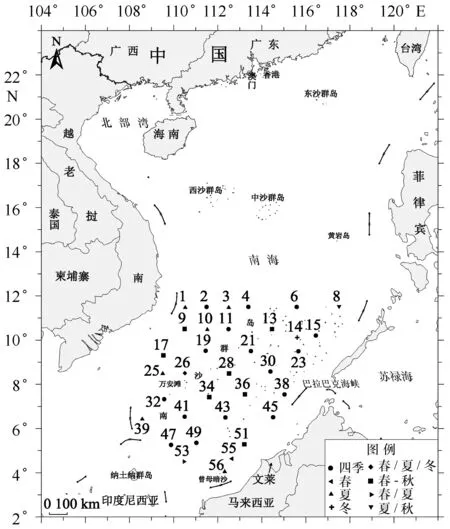
图1 调查站位设置示意图Fig.1 Sketch map of sampling stations
2.2数据分析
种类更替率(R)[20],其计算式为:
(1)
式中,a与b分别为相邻2个季节的种数,c为相邻2个季节共同的种数。
优势度(Degree of Dominance)[3],其计算式为:
(2)
式中,ni为第i种的个体数;N为浮游动物总个体数;fi为某种生物的出现频率。
丰富度指数Margalef指数(D)[21]计算式:
(3)
式中,N表示浮游生物总个体数,S表示浮游生物种类数。
多样性指数Shannon-Wiener指数(H′)[22]计算式是:
(4)
式中,Ni表示某站第i种的栖息密度,N表示某站浮游生物总栖息密度。
均匀度指数(J)[23]计算式是:
(5)
多样性阈值(Dv)[24]计算式是:
(6)
式中,Dv>3.5,多样性非常丰富;2.6≤Dv≤3.5,多样性丰富;1.6≤Dv<2.6,多样性较好;0.6≤Dv<1.6,多样性一般;Dv<0.6,多样性差[24]。
浮游动物群落结构的多变量分析采用非参数多变量群落结构分析方法。应用SIMPER法分析各物种对群落的贡献率[25],并选用累计贡献率达90%的主要种类与种类出现频次超过10%的站位,栖息密度通过lg(x+1)转换后,构建Bray-Curtis Similarity矩阵,应用平均聚类法与db-RDA研究群落结构。数据分析与作图使用R3.25 和Surfer 11.0。
3 结果
3.1种类组成
2013年四季共鉴定出虫戎亚目12科26属63种,各季分别为37、29、37与25种。平均季节更替率为66.5%,其中,春-夏更替率是59.6%,夏-秋更替率是77.8%,秋-冬更替率是62.2%,表明物种组成存在明显的季节变化。四季虫戎种类组成的聚类分析结果表明,除秋-冬季群落的不相似性较低外,其余各季之间的不相似性较高,也反映出南沙海域浮游端足类虫戎亚目物种组成的季节变化明显(图2)。

图2 虫戎亚目生物组成季节聚类结果Fig.2 The seasonal cluster result of hyperiid compositions
3.2生态类群
南沙海域为典型热带寡营养环境,依据虫戎亚目生态习性与地理分布[8—12,16—18,24,26—32],可分为大洋暖水类群和广盐暖水类群。
大洋暖水类群对盐度要求较高,主要出现在深水区域,种数众多,但个体数量一般较少。代表种有刺拟慎虫戎 (Phronimopsisspinifera)、定居慎虫戎 (Phronimasedentaria)、沃氏小泉虫戎 (Hyperiettavosseleri)、近法拟狼虫戎 ( Lycaeopsis themistoides)和钳形四门虫戎 ( Tetrathyrus forcipatus)等。
广盐暖水类群 最适盐度较大洋暖水类群低,适盐范围较广,主要分布于海域近岸区外侧,数量丰富,种类相对较少,如孟加拉蛮虫戎 ( Lestrigonus bengalensis)、大眼蛮虫戎 (L. macrophalmus)、中间真海精虫戎 ( Eupronoe intermedia)、墙双门虫戎 (Amphithyrus muratus)、斑点真海精虫戎 (E. maculata)和西巴似泉虫戎 (Hyperioides sibaginis)等。
3.3主要物种和优势种
Simper分析显示,有孟加拉蛮虫戎、中间真海精虫戎等10种虫戎亚目生物对年度生物群落累计贡献率达到90%,春、夏、秋和冬季分别为10、8、5和7种(表1)。主要贡献种以广盐暖水种为主,其中,广盐暖水种孟加拉蛮虫戎贡献率最高,仅在夏季贡献率低于10%,是春和秋季的第一贡献种、冬季的第二贡献种。大洋暖水种定居慎虫戎仅在夏季成为第一贡献种。冬季第一贡献种为广盐暖水种中间真海精虫戎。
南沙海域全年浮游端足类虫戎的优势种共有7种,占主要物种数的41.2%;春、夏、秋和冬季分别为1、2、5和3种(表1)。年度优势种仅有孟加拉蛮虫戎1种,除在夏季不是优势种外,是其余各季的第一优势种,具有非常显著的优势地位。与其他三季不同,夏季第一优势种为斑点真海精虫戎,其优势不明显。
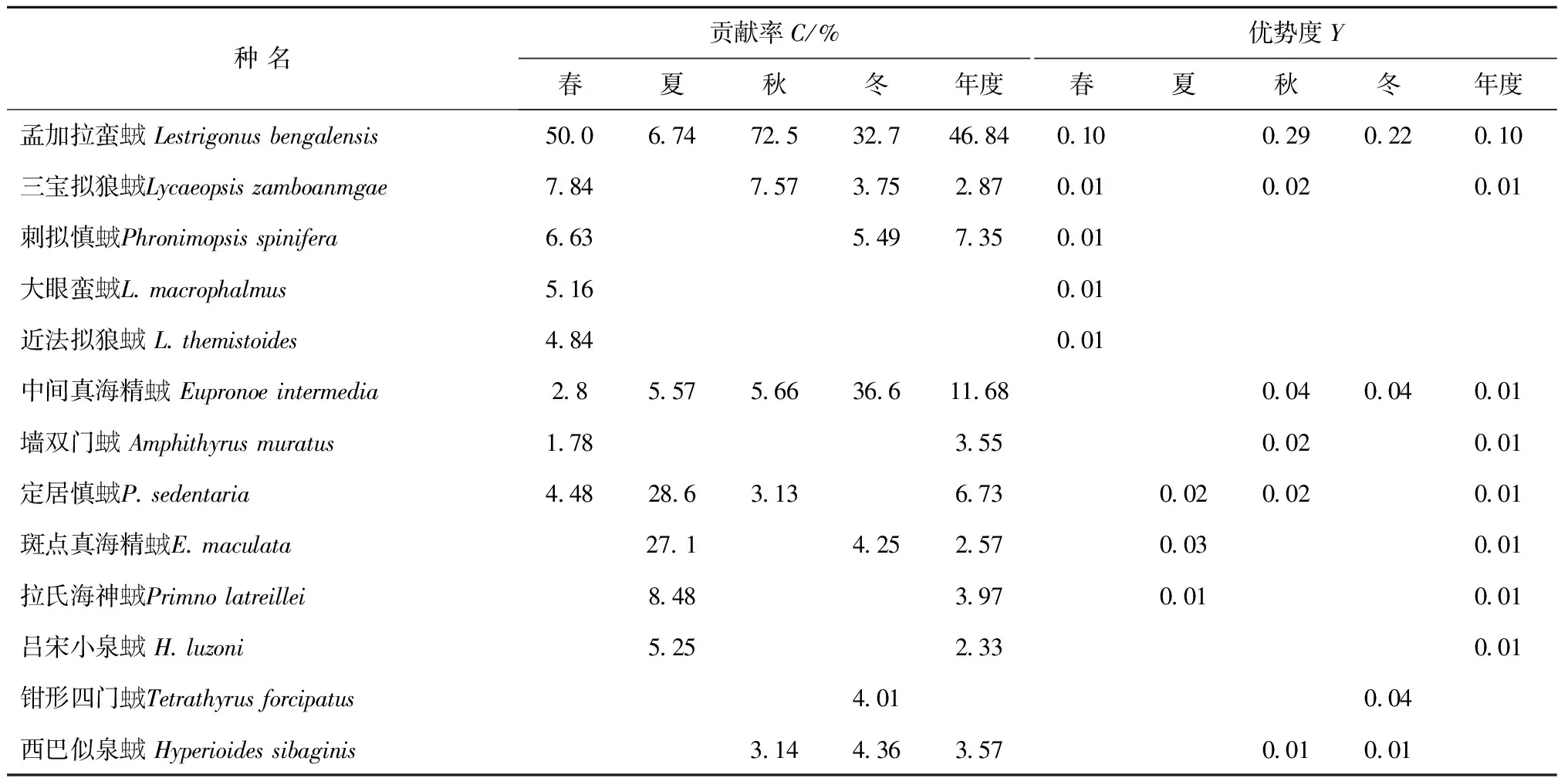
表1 主要种类的贡献率与优势度
3.4生物多样性
南沙海域虫戎亚目种类丰富度一般,四季丰富度指数均值是1.23;除夏季明显偏低外,其他三季丰富度相似(RSD=0.02)。四季多样性多样性指数均值是1.28,季节变化趋势与丰富度指数相似(r=0.342,p<0.05)。四季均匀度指数均值是0.33,四季差异不大(RSD=0.11)。四季多样性阈值均值是0.48,春、秋季稍好于夏、冬季。各季节多样性水平均是多样性差到一般,季节性差异小;平面分布总体呈现北好于南,各季各有不同。春季,海区西北至中部好于东南;夏季,中部优于四周;秋季反转为四周优于中部;冬季,西部与东北好于中南大部(图3)。

表2 丰富度指数、多样性指数、均匀度指数和多样性阈值季节变化
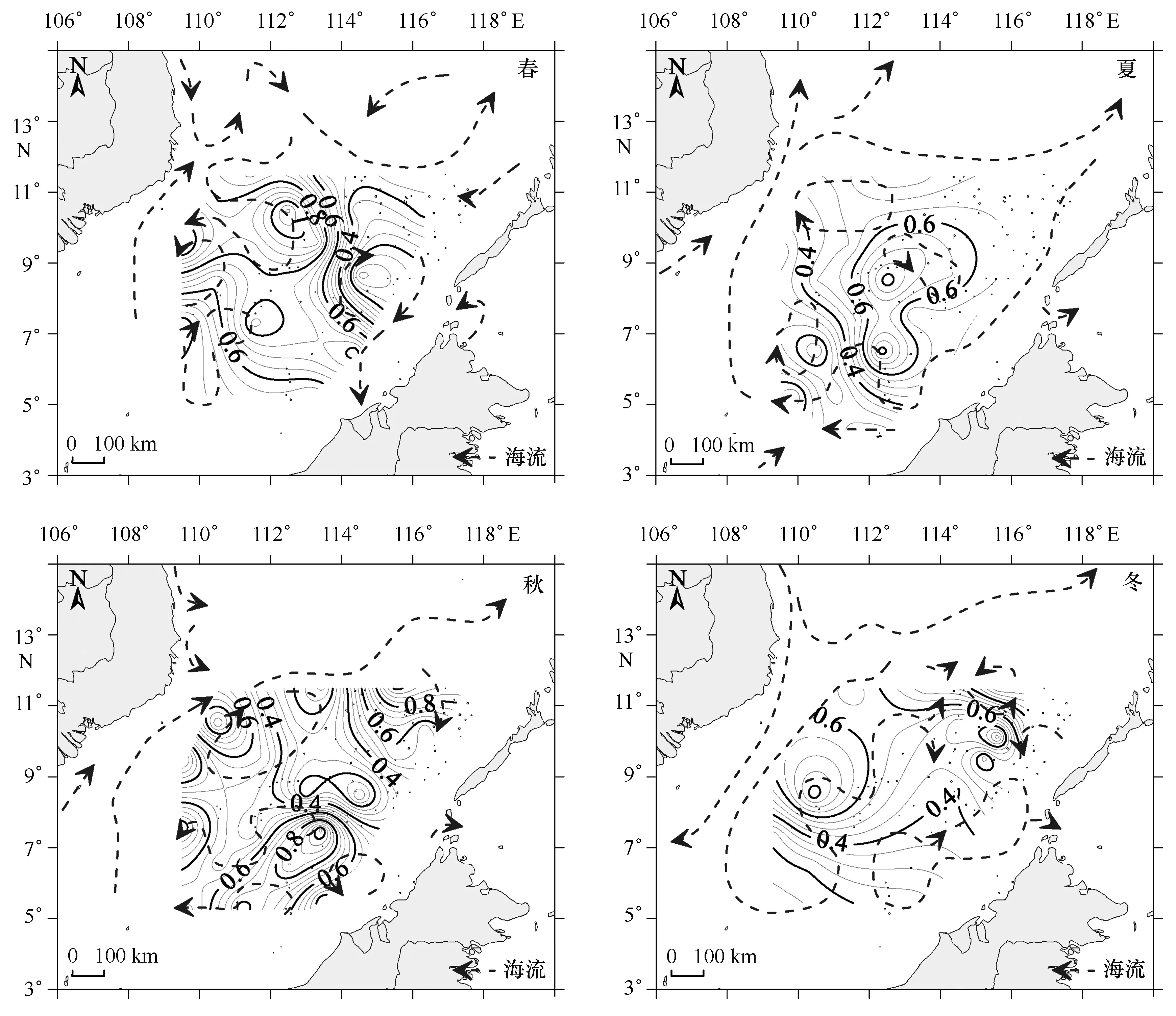
图3 多样性阈值季节分布与表层环流的关系Fig.3 Seasonal distribution of hyperiid diversity threshold associated with surface currents
3.5群落结构
南沙海域虫戎亚目四季生物群落结构的db-RDA分析显示,虫戎亚目群落分为春季、夏季、秋-冬季3个群落,与季节更替率和季节聚类结果相一致。季节变化对生物群落结构解释度是10.0%(图 4a)。春季群落主要代表种是近法拟狼虫戎、大眼蛮虫戎和西巴似泉虫戎等;夏季群落主要代表种是斑点真海精虫戎、拉氏海神虫戎和定居慎虫戎等;秋-冬季群落主要代表种是孟加拉蛮虫戎、中间真海精虫戎和墙双门虫戎等,这9种主要代表种可解释生物群落季节差异的36.5%(图 4b)。
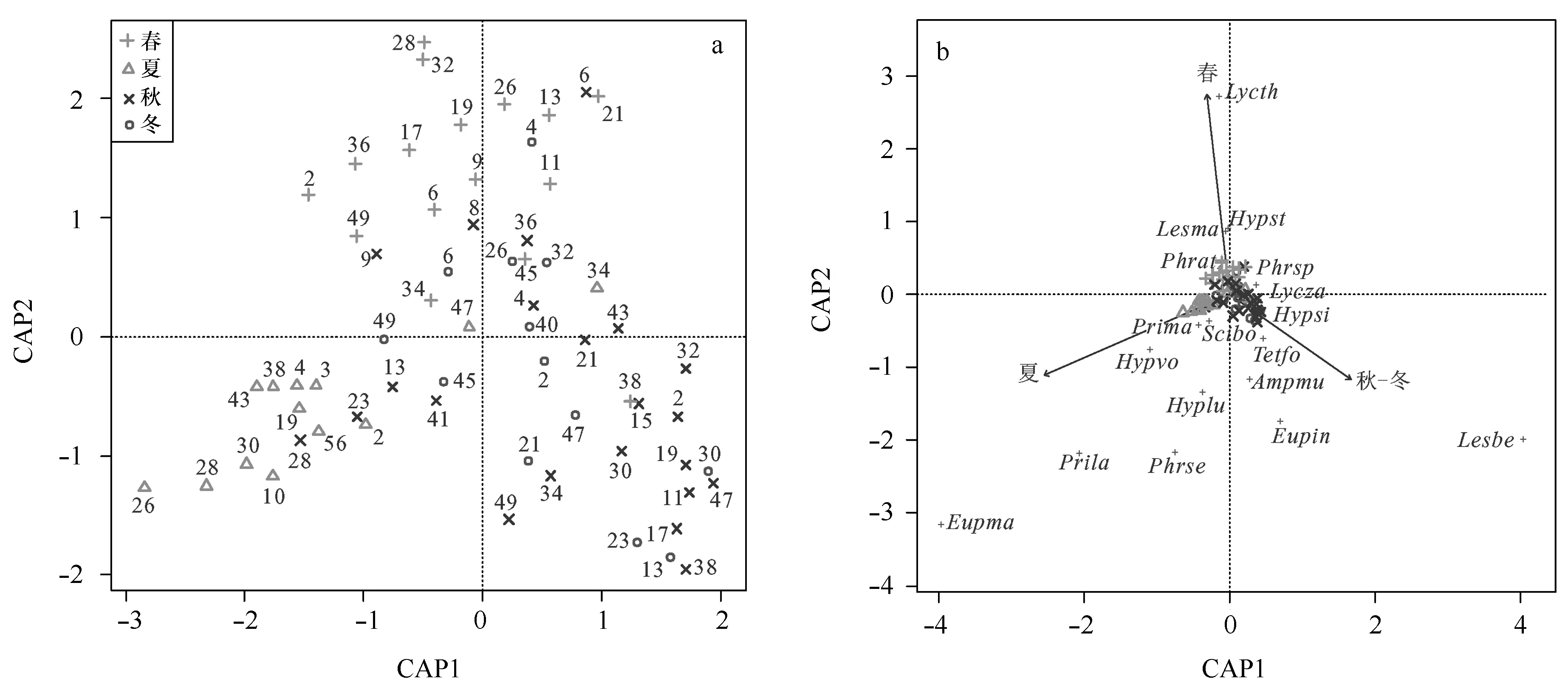
图4 生物群落db-RDA分析Fig.4 Analysis of hyperiid community by db-RDAAmpmu:墙双门虫戎;Eupin: 中间真海精虫戎;Eupma:斑点真海精虫戎;Hyplu:吕宋小泉虫戎;Hypsi:西巴似泉虫戎;Hypvo:沃氏小泉虫戎;Lesbe:孟加拉蛮虫戎;Lesma:大眼蛮虫戎;Lycth:近法拟狼虫戎; Lycza:三宝拟狼虫戎;Phrse:定居慎虫戎;Phrsp:刺拟慎虫戎;Prima:大足海神虫戎;Prila:拉氏海神虫戎;Scibo:北方锥虫戎;Tetfo:钳形四门虫戎Ampmu: Amphithyrus muratus;Eupin: Eupronoe intermedia; Eupma: E. maculate; Hyplu: H. luzoni; Hypsi: Hyperioides sibaginis;Hypvo: Hyperietta vosseleri;Lesbe: Lestrigonus bengalensis;Lesma: L. macrophalmus;Lycth: L. themistoides;Lycza: Lycaeopsis zamboanmgae;Phrse: P. sedentaria;Phrsp: Phronimopsis spinifera;Prima: P. macropa;Prila: Primno latreillei;Scibo: Scina bo- realis;Tetfo: Tetrathyrus forcipatus
生物群落聚类分析显示,四季虫戎亚目大致分为7个群落(图5)。其中,群落Ⅵ与Ⅷ都只有一站点,群落Ⅵ仅出现在春季,优势种是大洋种斯氏小泉虫戎 (Hyperiettastephenseni),表层温度偏低,盐度较高;群落Ⅶ仅出现在冬季,优势种是大洋种钳形四门虫戎,表层温度最低,盐度最高(表3)。群落Ⅱ优势种均是广盐种,表层盐度最低;与之具有共同优势种孟拉加蛮虫戎的群落Ⅰ表层盐度仅高其0.06‰,温度仅高于群落Ⅶ。群落Ⅲ-Ⅴ表层盐度相似,仅群落Ⅳ优势种中出现广盐种。群落平面分布具有明显季节变化(图5),其变化趋势与db-RDA法划分的季节群落相一致。

表3 群落优势种(优势度)与分布海域表层平均温度、盐度Tab.3 The means of surface temperature and salinity and dominant species with dominant degree in the waters hyperiid groups (I-VII) lived
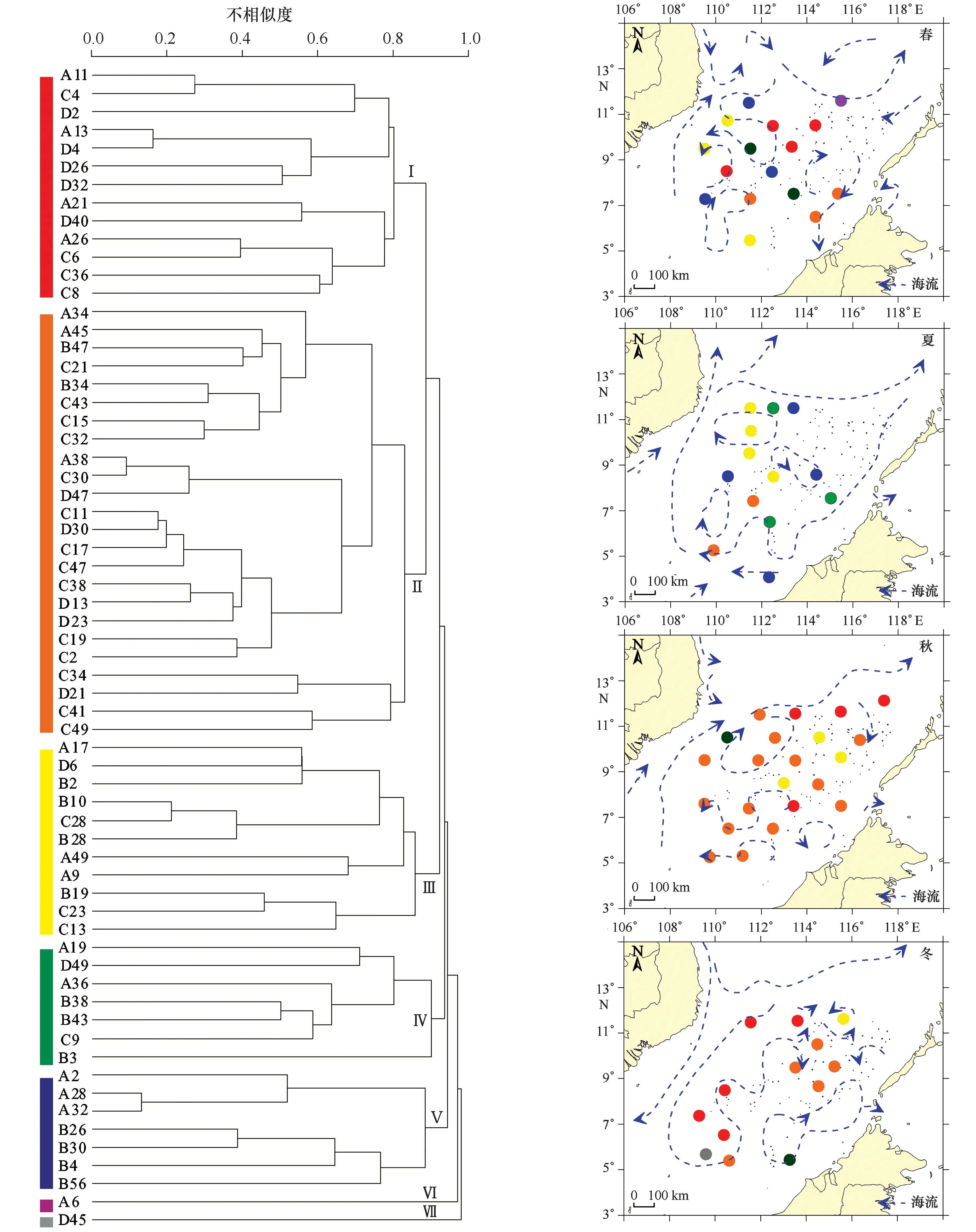
图5生物群落聚类分析及季节分布Fig.5 The cluster result of hyperiid community and seasonal distribution of groups左图:A. 春季,B. 夏季,C. 秋季,D. 冬季;右图:红色. 群落Ⅰ,橙色. 群落Ⅱ,黄色. 群落Ⅲ,绿色. 群落Ⅳ,蓝色. 群落Ⅴ,紫色. 群落Ⅵ,灰色. 群落ⅦLeft: A. spring,B. summer,C. autumn,D. winter;right: red. Group Ⅰ, orange. Group Ⅱ, yellow. Group Ⅲ, green. Group Ⅳ, blue. Group Ⅴ, purple. Group Ⅵ, gray. Group Ⅶ
3.6数量分布与组成
南沙海域虫戎亚目栖息密度年均值是18.30×10-2ind/m3, 整体呈现近岸高于外海,栖息密度分布与孟加拉蛮虫戎(r=0.576,p<0.01)显著相关。各季中,春季栖息密度均值是18.48×10-2ind/m3,分布呈现中部高南、北低的趋势,与孟加拉蛮虫戎的数量(r=0.469,p<0.01)显著相关;其中,以西北角最高。夏季栖息密度均值是21.20×10-2ind/m3,分布呈西南高于东北,以南部陆架边缘区最高,与第一优势种斑点真海精虫戎明显相关(r=0.710,p<0.05)。秋季栖息密度均值是18.78×10-2ind/m3,与春季相近,空间分布差异较小,高栖息密度区在南部陆架边缘偏东区域,与孟加拉蛮虫戎的数量(r=0.586,p<0.01)显著相关。冬季栖息密度均值是14.75×10-2ind/m3,全年最低,主要分布在南部陆架边缘区和东北海域的岛礁区,以南部陆架边缘数量最高,仍与孟加拉蛮虫戎(r=0.886,p<0.01)显著相关(图6)。可见,虫戎亚目栖息密度数量的季节变化较小,但平面差异较大;孟加拉蛮虫戎对除夏季外的3个季节虫戎亚目栖息密度分布具有显著影响,与其显著的优势地位一致。
3.7群落特征与表层温盐的关系分析
南沙海域虫戎亚目群落特征相关参数与0~25 m水层的温度、盐度相关性分析显示,虫戎亚目栖息密度、种类丰富度、多样性指数与表层温度负相关;栖息密度、均匀度指数和年度优势种孟加拉蛮虫戎栖息密度与表层盐度正相关(表4)。各季中,春季,多样性指数和阈值与表层温度明显负相关(r<-0.470,p<0.05);夏季,栖息密度与表层温度正相关(r=0.387,p<0.05),第一优势种斑点真海精虫戎与表层盐度显著负相关(r=-0.905,p<0.05);冬季,虫戎亚目和孟加拉蛮虫戎栖息密度与表层盐度显著负相关(r<-0.659,p<0.01)。可见,南沙海域虫戎亚目群落特征随表层温盐变化而波动。
3.8虫戎亚目群落与管水母的关系分析
通过对南沙海域虫戎亚目群落的特征指数以及主要种类与管水母数量的相关性分析显示,虫戎亚目栖息密度、多样性阈值和年度优势种孟加拉蛮虫戎与管水母具一定相关性(表4)。就两类群优势种间关系而言,孟加拉蛮虫戎与管水母优势种小拟多面水母(Abylopsiseschscholtzi)、扭歪爪室水母(Chelophyescontorta)以及双生水母(Diphyesspp.)均明显相关;夏季第一贡献种定居慎虫戎与爪室水母(C.appendiculata)、细浅室水母 (Eudoxoidesmitra)显著相关;秋、冬季优势种中间真海精虫戎和扭歪爪室水母明显相关;秋季优势种墙双门虫戎与尖角水母(Eudoxoidesmitra)显著相关(表 5);西巴似泉虫戎和与异双生海母(D.dispar) 相关;钳形四门虫戎和多面水母属(Abylopsisspp.)相关。可见,南沙海域虫戎亚目群落分布与管水母具有联系,且受两类群种类组成影响。
表4虫戎亚目群落特征参数与管水母、表层温度盐度的相关性分析
Tab.4The Pearson correction between the characteristic parameters of hyperiid community and siphonohores, surface temperature and salinity

注:**表示0.01水平显著相关,*表示0.05水平显著相关。

表5 虫戎与管水母相关性分析
注:**表示0.01水平显著相关,*表示0.05水平显著相关。

图6 栖息密度季节分布与表层环流的关系Fig.6 Seasonal distribution of hyperiid abundance associated with the surface currents
4 讨论
4.1种类组成分析
南沙海域虫戎亚目由大洋暖水类群和广盐暖水类群组成,以大洋暖水种的种数居多,与桡足类等其他类群[24,33—35]一样,具有明显热带大洋性特征。其种类组成与同属印度-西太平洋热带区系的东海外海、台湾海峡和南海中北部以及南北太平洋环流区、澳大利亚东部海域和加利弗尼亚近海虫戎种类组成相似[4—5,8—12,26—32,39],反映了太平洋地区亚热带-热带近海与大洋虫戎种类分布的相似性。
4.2群落演替与季风转换的关系
南沙海域虫戎亚目群落分为7大群落,群落平面分布和组合随季节变化而呈现出3大季节性群落,为春季、夏季和秋-冬季3个群落,与南沙海域东北-西南季风转换期、西南季风期和西南-东北季风转换期相对应。同属季风转换期的春季与秋-冬群落间相似程度高于夏季,与海区在季风转换期环流变化改变沿岸水的影响有关[37—46]。
春季,越南沿岸流未完全退出,西部南海急流开始北上,在北南沙反气旋与越南中部上升流影响下不同水团汇合[39—43],不同群落夹杂分布。受低温水影响的群落Ⅰ分布较广,优势种是广盐种西巴似泉虫戎和孟加拉蛮虫戎与大洋种三宝拟狼虫戎;特有群落Ⅵ的高盐特点及其优势种为大洋种。春季群落第一贡献种、优势种都广盐种孟拉加蛮虫戎,代表种近法拟狼虫戎是大洋种。这都指示海区受北下沿岸水与海区高盐水团影响。
夏季,群落Ⅲ-Ⅴ比重明显高于其他季节,仅群落Ⅴ的优势种斑点真海精虫戎是广盐种;夏季群落的代表种以大洋种为主,第一贡献种为大洋种,第一优势种为广盐种,且斑点真海精虫戎与表层盐度明显负相关。此时,海区整体受南沙反气旋环流影响,大部为外海高盐水控制,近岸水影响局限在近岸区域[38,41,46]。群落分布反映了这一水文特征。
秋-冬季群落代表种全是广盐种,且两季第一贡献种和第一优势种皆为大洋种,且在冬季, 孟拉加蛮虫戎与表层盐度呈显著负相关,这些都显示出沿岸水的影响,因环流作用不同而出现不同特点。秋季,北上的南海急流与越南沿岸流在南沙反气旋环流作用下汇合后部分由北部进入南沙海区[44],群落Ⅱ分布最广,优势种皆为广盐种,盐度最低,受沿岸水影响最大。冬季,越南沿岸流可达巽他陆架,海区大部为表层混合水团控制[38,41,46],分布于环流区的群落Ⅰ与岛礁区的群落Ⅱ比重相当;特有群落Ⅶ所在环境显著低温高盐且优势种是大洋种钳形四门虫戎显示环流区海水上升运动明显,也进一步暗示群落Ⅰ代表沿岸水与底层海水共同影响。
可见,浮游端足类群落季节性演替反映了季风转变引起南海环流结构变换影响到沿岸水海区作用强度,优势种与主要贡献种具有指示作用。与东太平洋海区研究结果相似,广盐种占有优势[12,47]。
4.3生物多样性与季风转换的关系
南沙海域虫戎亚目多样性水平季节性差异小,与浮游动物、桡足类相似[24,34];呈季风转换期优于季风盛行期。同属季风转换期的春、秋、冬三季种类丰富度和多样性指数都相似,多样性阈值平面分布整体呈现北高南低。各季多样性高阈值区出现在海流做气旋式环流(弯曲)和反气旋式环流(弯曲)之间的海域或气旋式环流(弯曲)附近,即海水涌升影响区,表层温度可反映该海水涌升对表层的影响程度[50],丰富度和多样性指数与表层温度间的负相关与之吻合,与加利弗尼亚近海研究相似[47]。春季,多样性指数和阈值与表层温度明显负相关,可能因春季沿岸水影响区域与海水涌升区相近[39,43],低温影响叠加;而其他三季节无类似水文条件,故均未显示出多样性与表层温度的关系。因南沙海域流场随季风转换而呈现季节性变化[41,45,49],(反)气旋式环流出现区域存在季节性变动,进而引起生物多样性水平平面分布的季节差异。
4.4数量分布与季风驱动的关系
南沙海域与南海中部同属于寡营养海域,虫戎亚目栖息密度数量均明显低于近岸海区,且季节性变化不明显。受海区流场变化的影响,南沙海域虫戎栖息密度的平面分布季节性变化明显。如图8所示,与南沙海域桡足类、墨西哥湾和加利弗尼亚近海虫戎的栖息密度分布特征[25—28,29,36,47]类似,虫戎亚目高栖息密度分布区海流均是作气旋式弯曲或气旋式环流,多位于海域边缘的近岸区域。气旋式海流区海水向上涌升给贫瘠的表层带来营养盐丰富的低温高盐水,促进浮游植物大量繁殖[48,51],利于浮游动物生长[52—53],虫戎栖息密度与表层温度负相关以及与盐度正相关与之印证。同时,近岸区域受沿岸水输入营养物影响,浮游动物栖息密度较外海高[54];如,沿岸流影响最大的冬季,虫戎栖息密度就与表层盐度呈明显负相关。当沿岸混合水团和上升水团相遇,营养盐丰富,并形成相对低盐低温适应广盐种大量繁殖的环境[52],夏、冬两季第一优势种就与表层盐度明显负相关。因此,高栖息密度常出现于海流作气旋式弯曲或气旋式环流的近岸区域。而南沙海域流场随季风转换而呈现季节性变化[37—46],沿岸水团输入则主要来至巽他陆架和越南沿岸[38—43,46],夏季栖息密度与表层温度正相关也暗示夏季沿岸水主要来自巽他陆架。所以,南沙海域虫戎亚目栖息密度平面分布季节变化随季风转换所驱动的环流改变而改变,高栖息密度区始终位于低盐水团影响的近岸海水涌升区域。
4.5虫戎与管水母的关系
虫戎与胶质浮游动物存在共生关系,其数量分布与宿主动物具有联系[14—18,55—58]。与墨西哥湾的情况相似[58],南沙海域虫戎与管水母虽有相关性但相关性不强,可能与虫戎可寄生于多种胶质浮游动物有关[14,16—18]。
但当寄宿双方数量足够丰富时,同一样品中虫戎与管水母物种间数量分布的明显相关可表明它们间存在寄宿关系[14,16]。如表4分析结果所示,南沙海域孟加拉蛮虫戎与小拟多面水母、扭歪爪室水母和双生水母属之间具有寄宿关系; 孟加拉蛮虫戎寄生于双生水母属,已在多个海区得到证实[16—18,33,55—57];而南海管水母优势种小拟多面水母和扭歪爪室水母,均为双生水母亚科大洋性广布种[59],也为孟加拉蛮虫戎寄生提供良好条件,它们间寄宿关系可确信。中间真海精虫戎、定居慎虫戎、具刺端虫戎和钳形四门虫戎分属真海精虫戎科、慎虫戎科和宽腿虫戎科,偏好与寄生于管水母[33,58,60],相关分析也表明它们与扭歪爪室水母、尖角水母、爪室水母、细浅室水母和多面水母属的共栖息关系可信。西巴似泉虫戎和孟加拉蛮虫戎同属于泉虫戎科,与异双生海母的寄宿关系可能性较大,但需要进一步证实。
此外,寄生生活有利于虫戎(尤其是孟加拉蛮虫戎等小型虫戎)聚集和降低被捕食风险[12,15],所以孟加拉蛮虫戎在条件适宜情况下更容易形成高优势度。由此南沙海域虫戎因沿岸水影响表现出与近岸海域类似的优势种特征而与同海区桡足类优势种优势地位不明显相异的现象。因此,南沙海域浮游端足类优势种优势地位明显的特征是由近岸水的影响和虫戎自身寄生习性共同决定的。
致谢:样品鉴定得到了中国科学院南海海洋研究所陈清潮研究员、厦门大学黄加祺教授和许振祖教授、国家海洋局第三海洋研究所陈瑞祥研究员和林茂研究员的帮助和支持,“南锋”全体人员和课题组邱永松研究员、黄洪辉研究员和陈作志副研究员等在样品采集过程中提供帮助,特致谢忱。
[1]Grosse D J, Pauley G B, Moran D. Species profiles: life histories and environmental requirements of coastal fishes and invertebrates (Pacific Northwest): amphipods[R]. US Fish and Wildlife Service Biology Report 82(11. 69), US Army Corps of Engineers, TR EL-82-4. Seattle: Washington University, 1986.
[2]Falk-Petersen I B, Frivoll V, Gulliksen B, et al. Age/size relations and food of two snailfishes,LiparisgibbusandCareproctusreinhardii(Teleostei, Liparididae) from Spitsbergen coastal waters[J]. Polar Biology, 1988, 8(5): 353-358.
[3]徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15, 19.
Xu Zhaoli, Chen Yaqu. Aggregated intensity of dominant species of zooplankton in Autumn in the East China Sea and Yellow Sea[J]. Chinese Journal of Ecology, 1989, 8(4): 13-15, 19.
[4]蒋玫, 袁骐, 陈亚瞿, 等. 东海浮游端足类数量的时空分布特征[J]. 海洋学报, 2004, 26(5): 132-138.
Jiang Mei, Yuan Qi, Chen Yaqu, et al. Study on spatial and temporal distribution of planktonic Amphipoda in the East China Sea[J]. Haiyang Xuebao, 2004, 26(5): 132-138.
[5]Woodward G. Integrative Ecology: from Molecules to Ecosystems[M]. London: Academic Press, 2010.
[6]Ressler P H, Jochens A E. Hydrographic and acoustic evidence for enhanced plankton stocks in a small cyclone in the Northeastern Gulf of Mexico[J]. Continental Shelf Research, 2003, 23(1): 41-61.
[7]Young J W. The distribution of hyperiid amphipods (Crustacea: Peracarida) in relation to warm-core eddy J in the Tasman Sea[J]. Journal of Plankton Research, 1989, 11(4): 711-728.
[8]Xu Zhaoli, Jiang Mei. Distribution pattern of pelagic amphipods and its affecting facors in the East China Sea[J]. Acta Oceanologica Sinica, 2006, 25(5): 112-119.
[9]林景宏, 陈瑞祥. 台湾海峡西部海域浮游端足类的分布[J]. 台湾海峡, 1988, 7(4): 14-20.
Lin Jinghong, Chen Ruixiang. Distribution of planktonic Amphipoda in western Taiwan Strait[J]. Journal of Oceanography in Taiwan Strait, 1988, 7(4): 14-20.
[10]林景宏, 陈瑞祥. 南海中部浮游端足类的分布[J]. 海洋学报, 1994, 16(4): 113-119.
Lin Jinghong, Chen Ruixiang. Distribution of planktonic Amphipoda in central South China Sea[J]. Haiyang Xuebao, 1994, 16(4): 113-119.
[11]Lin Jinghong, Chen Riuxiang. Distributional characteristics of planktonic Amphipoda (Hyperiidea) in the South Huanghai Sea and East China Sea[J]. Acta Oceanologica Sinica, 1995, 14(4): 553-561.
[12]Lavaniegos B E, Hereu C M. Seasonal variation in hyperiid amphipod abundance and diversity and influence of mesoscale structures off Baja California[J]. Marine Ecology Progress Series, 2009, 394: 137-152.
[13]李立. 南海上层环流观测研究进展[J]. 台湾海峡, 2002, 21(1): 114-125.
Li Li. Advance in observational studies of upper layer circulations of the South China Sea[J]. Journal of Oceanography in Taiwan Strait, 2002, 21(1): 114-125.
[14]Laval P. Hyperiid amphipods as crustacean parasitoids associated with gelatinous zooplankton[J]. Oceanography and Marine Biology: An Annual Review, 1980, 18: 11-56.
[15]Purcell J E. Pelagic cnidarians and ctenophores as predators: selective predation, feeding rates, and effects on prey populations[J]. Annales de l’Institut Océanographique, 1997, 73(2): 125-137.
[16]Gasca R, Haddock S H D. Associations between gelatinous zooplankton and hyperiid amphipods (Crustacea: Peracarida) in the Gulf of California[J]. Hydrobiologia, 2004, 530-531(1/3): 529-535.
[17]Gasca R, Surez-Morales E, Haddock S H D. Symbiotic associations between crustaceans and gelatinous zooplankton in deep and surface waters off California[J]. Marine Biology, 2007, 151(1): 233-242.
[18]Gasca R, Hoover R, Haddock S H D. New symbiotic associations of hyperiid amphipods (Peracarida) with gelatinous zooplankton in deep waters off California[J]. Journal of the Marine Biological Association of the United Kingdom, 2015, 95(3): 503-511.
[19]中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 12763.6-2007, 海洋调查规范 第6部分: 海洋生物调查[S]. 北京: 中国标准出版社, 2008.
General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China, Standardization Administration of the People’s Republic of China. GB/T 12763.6-2007, Specifications for oceanographic survey—Part 6: marine biological survey[S]. Beijing: China Standard Press, 2008.
[20]连光山, 林玉辉, 蔡秉及. 大亚湾浮游动物群落的特征[G]//国家海洋局海洋第三研究所. 大亚湾海洋生态文集(Ⅱ). 北京: 海洋出版社, 1990: 274-281.
Lian Guangshan, Lin Yuhui, Cai Bingji. Characteristics of zooplankton community in Daya bay[G]//Third Institute of Oceanography, State Oceanic Administration. Collections of Papers on Marine Ecology in the Daya Bay (Ⅱ). Beijing: China Ocean Press, 1990: 274-281.
[21]Margalef R. Diversidad de Especies en las comunidades naturales[J]. Publicaciones del Instituto De Biología Aplicada, 1951, 9: 5-27.
[22]Shannon C E, Weaver W. The mathematical theory of communication[M]. Urbana, IL: University of Illinois Press, 1949.
[23]Pielou E C. An introduction to mathematical ecology[M]. New York: Wiley Interscience, 1969.
[24]陈清潮, 黄良民, 尹健强, 等. 南沙群岛海区浮游动物多样性研究[G]//中国科学院南沙综合科学考察队. 南沙群岛及其邻近海区海洋生物多样性研究I. 北京: 海洋出版社, 1994: 42-50.
Chen Qingchao, Huang Liangmin, Yin Jianqiang, et al. Studies on the zooplanktonic biodiversities in the waters around Nansha Islands[G]//Nansha Integrated Scientific Investigation Team of Chinese Academy of Sciences. Studies on Marine Biodiversity of the Nansha Islands and Neighbouring Waters. Beijing: China Ocean Press, 1994: 42-50.
[25]Clarke K R. Non-parametric multivariate analyses of changes in community structure[J]. Australian Journal of Ecology, 1993, 18(1): 117-143.
[26]Bowman T E, Gruner H E. The families and genera of Hyperiidea (Crustacea: Amphipoda) (Smithsonian Contributions to Zoology, No.146)[R]. Washington D C: Smithsonian Institution Press, 1974.
[27]Shulenberger E. Hyperiid amphipods from the zooplankton community of the North Pacific central gyre[J]. Marine Biology, 1977, 42(4): 375-385.
[28]Brinton E, Fleminger A, Siegel-Causey D. The temperate and tropical planktonic biotas of the Gulf of California[J]. CalCOFI Reports, 1986, 27: 228-266.
[29]Vinogradov G M. Hyperiid amphipods in the eastern part of the South Pacific gyre[J]. Marine Biology, 1991, 109(2): 259-265.
[30]Zeidler W. Hyperiid amphipods (Crustacea: Amphipoda: Hyperiidae) collected recently from eastern Australian waters[J]. Records of the Australian Museum, 1992, 44(1): 85-133.
[31]Shih C T, Chen Q C. Zooplankton of China Seas (2)-The Hyperiidea (Crustacea: Amphipoda)[M]. Beijing: China Ocean Press, 2002.
[32]Lavaniegos B E. Pelagic amphipod assemblage associated with subarctic water off the west coast of the Baja California Peninsula[J]. Journal of Marine Systems, 2014, 132: 1-12.
[33]尹健强, 陈清潮, 张谷贤, 等. 南沙群岛海区上层浮游动物种类组成与数量的时空变化[J]. 科学通报, 2006, 51(S2): 129-138.
Yin Jianqiang, Chen Qinghcao, Zhang Guxian, et al. Spatial and temporal variations of zooplankton composition and quantity distribution in the upper waters around Nansha Islands[J]. Chinese Science Bulletin, 2006, 51(S2): 129-138.
[34]王亮根, 杜飞雁, 李亚芳, 等. 西南季风暴发前后南沙海域浮游桡足类群落特征比较研究[J]. 南方水产科学, 2015, 11(5): 47-55.
Wang Lianggen, Du Feiyan, Li Yafang, et al. Community characteristics of pelagic copepods in Nansha area before and after onset of Southwest Monsoon[J]. South China Fisheries Science, 2015, 11(5): 47-55.
[35]陈柏云. 中国海洋浮游桡足类区系的初步研究[J]. 海洋通报, 1984, 5(增刊): 914-922.
Chen Baiyun. The distribution of planktonic copepods in the South China Sea[J]. Marine Science Bulletin, 1984, 5(S): 914-922.
[36]林景宏, 陈明达, 陈瑞祥. 中国海洋浮游端足类的物种多样性[J]. 生物多样性, 1996, 4(4): 228-234.
Lin Jinghong, Chen Mingda, Chen Ruixiang. The species diversity of planktonic Amphipoda in China Seas[J]. Chinese Biodiversity, 1996, 4(4): 228-234.
[37]廖秀丽, 黄洪辉, 巩秀玉, 等. 2013年南沙海域混合层深度的季节变化特征[J]. 南方水产科学, 2015, 11(5): 67-75.
Liao Xiuli, Huang Honghui, Gong Xiuyu, et al. Seasonal variability in mixed layer depth in Nansha area in 2013[J]. South China Fisheries Science, 2015, 11(5): 67-75.
[38]李磊, 李凤岐, 苏洁, 等. 1998年夏、冬季南海水团分析[J]. 海洋与湖沼, 2002, 33(4): 393-401.
Li Lei, Li Fengqi, Su Jie, et al. Analysis on water masses in the South China Sea in summer and winter of 1998[J]. Oceanologia et Limnologia Sinica, 2002, 33(4): 393-401.
[39]Chen Changsheng, Lai Zhigang, Beardsley R C, et al. Current separation and upwelling over the southeast shelf of Vietnam in the South China Sea[J]. Journal of Geophysical Research, 2012, 117(C3): C03033.
[40]Vlasova G A, Xuan N B, Long B H. Influence of synoptic processes on the vietnamese current (the South China Sea) dynamics during the winter-summer 1999 transition period[J]. Russian Meteorology and Hydrology, 2013, 38(4): 239-247.
[41]Fang Wendong, Fang Guohong, Shi Ping, et al. Seasonal structures of upper layer circulation in the southern South China Sea from in situ observations[J]. Journal of Geophysical Research, 2002, 107(C11): 23-1-23-12.
[42]Chen Changlin, Wang Guihua. Interannual variability of the eastward current in the western South China Sea associated with the summer Asian monsoon[J]. Journal of Geophysical Research: Oceans, 2014, 119(9): 5745-5754.
[43]薛惠洁, 柴扉, 徐丹亚, 等. 南海沿岸流特征及其季节变化[G]//中国海洋学文集第13集:南海海流数值计算及中尺度特征研究. 北京: 海洋出版社, 2001: 64-74.
Xue Huijie, Chai Fei, Xu Danya, et al. Characteristics and seasonal variation of the coastal currents in the South China Sea[G]//Oceanography in China 13: Studies on circulation models and meso-scale characteristics in the South China Sea. Beijing: China Ocean Press, 2001: 64-74.
[44]刘岩松, 于非, 刁新源, 等. 越南离岸流跨海盆特征初步分析[J]. 海洋科学, 2014, 38(7): 95-102.
Liu Yansong, Yu Fei, Diao Xinyuan, et al. Characteristics analysis of Vietnam offshore flow across the basin[J]. Marine Sciences, 2014, 38(7): 95-102.
[45]鲍李峰, 陆洋, 王勇, 等. 利用多年卫星测高资料研究南海上层环流季节特征[J]. 地球地理学报, 2005, 48(3): 543-550.
Bao Lifeng, Lu Yang, Wang Yong, et al. Seasonal variations of upper ocean circulation over the South China Sea from satellite altimetry data of many years[J]. Chinese Journal of Geophysics, 2005, 48(3): 543-550.
[46]毛庆文, 王卫强, 齐义泉, 等. 夏季季风转换期间南沙群岛海域的温盐分布特征[J]. 热带海洋学报, 2005, 24(1): 28-36.
Mao Qingwen, Wang Weiqiang, Qi Yiquan, et al. Analyses on temperature and salinity distributions in Nansha Islands waters during Spring to Summer monsoon transition[J]. Journal of Tropical Oceanography, 2005, 24(1): 28-36.
[47]Valencia B, Lavaniegos B, Giraldo A, et al. Temporal and spatial variation of hyperiid amphipod assemblages in response to hydrographic processes in the Panama Bight, eastern tropical Pacific[J]. Deep-Sea Research Part Ⅰ: Oceanographic Research Papers, 2013, 73: 46-61.
[48]Lima M C G, Valentin J L. Preliminary results to the holistic knowledge of the Amphipoda Hyperiidea faunal composition off the Brazilian coast[J]. Journal of Plankton Research, 2001, 23(5): 469-480.
[49]Tang D L, Kester D R, Kawamura H, et al. Upwelling in the Taiwan Strait during the summer monsoon detected by satellite and shipboard measurements[J]. Remote Sensing of Environment, 2002, 83(3): 457-471.
[50]Thomas A C, Brickley P, Weatherbee R. Interannual variability in chlorophyll concentrations in the Humboldt and California Current systems[J]. Progress in Oceanography, 2009, 83(1/4): 386-392.
[51]李秀珍,梁卫,温之平,等. 南海盐度对南海夏季风响应的初步分析[J].热带海洋学报,2011,30(1):29-34.
Li Xiuzhen, Liang Ping, Wen Zhiping, et al. Preliminary study on the salinity characteristics of South China Sea and its response to the summer monsoon[J]. Journal of Tropical Oceanography, 2011, 30(1): 29-34.
[52]Barton E D, Largier J L, Torres R, et al. Coastal upwelling and downwelling forcing of circulation in a semi-enclosed bay: Ria de Vigo[J]. Progress in Oceanography, 2015, 134: 173-189
[53]Fontana R E, Elliott M L, Largier J L, et al. Temporal variation in copepod abundance and composition in a strong, persistent coastal upwelling zone[J]. Progress in Oceanography, 2016, 142: 1-16.
[54]Lischka S, Knickmeier K, Hagen W. Mesozooplankton assemblages in the shallow Arctic Laptev Sea in summer 1993 and autumn 1995[J]. Polar Biology, 2001, 24(3): 186-199.
[55]Madin L P, Harbison G R. The associations of Amphipoda Hyperiidea with gelatinous zooplankton-Ⅰ. Associations with Salpidae[J]. Deep-Sea Research, 1977, 24(5): 449-463.
[56]Harbison G R, Biggs D C, Madin L P. The associations of Amphipoda Hyperiidea with gelatinous zooplankton-Ⅱ. Associations with Cnidaria, Ctenophora and Radiolaria[J]. Deep-Sea Research, 1977, 24: 465-488.
[57]Lavaniegos B E, Ohman M D. Hyperiid amphipods as indicators of climate change in the California Current[C]//Schram F R, von Vaupel Klein J C. Crustaceans and the Biodiversity Crisis Vol. 1: Proceedings of the Fourth International Crustacean Congress, Amsterdam, The Netherlands, July 20-24, 1998. Leiden, Holanda: Brill, 1999: 489-509.
[58]Gasca R, Manzanilla H, Surez-Morales E. Distribution of hyperiid amphipods (Crustacea) of the southern Gulf of Mexico, summer and winter, 1991[J]. Journal of Plankton Research, 2009, 31(12): 1493-1504.
[59]许振祖, 黄加祺, 林茂, 等. 中国刺胞动物门水螅虫总纲 下册[M]. 北京: 海洋出版社, 2014.
Xu Zhenzu, Huang Jiaqi, Lin Mao, et al. The superclass Hydrozoa of the phylum Cnidria in China Vol. Ⅱ[M]. Beijing: China Ocean Press, 2014.
[60]Ohtsuka S, Koike K, Lindsay D, et al. Symbionts of marine medusae and ctenophores[J]. Plankton and Benthos Research, 2009, 4(1): 1-13.
Hyperiid community characteristics associated with monsoon and siphonophores in Nansha Islands waters, South China Sea
Wang Lianggen1,2,3, Du Feiyan1,2,3, Li Yafang1,2,3, Ning Jiajia1,2,3, Gu Yangguang1,2,3
(1. Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 2. Scientific Observing and Experimental Station of South China Sea Fishery Resources and Environments,Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China; 3. Key Laboratory of South China Sea Fishery Resources Development and Utilization, Ministry of Agriculture, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
Hyperiid community characteristics were analyzed using net and concurrent environmental data obtained during seasons of 2013. We evaluated the effect of monsoon changing on hyperrid community and the correlation between hyperiid and siphonophire. We identified 63 species comprised of 26 genera within 12 families for the hyperiid community. This hyperiid community can be divided into three groups: spring group, summer group and autumn-winter group. Hyperiid fauna belongs to the typical tropical ocean region with two ecotypes: the oceanic ecotype with more species and the euryhaline ecotype with higher abundance. Seven seasonal dominant species wereLestrigonusbengalensi,Eupronoeintermedia,E.maculate,Phronimasedentaria,Lycaeopsiszamboanmgae,TetrathyrusforcipatusandAmphithyrusmuratuswhileL.bengalensiwas the annual dominant specieswith noticeable domination. The annual mean of hyperiid abundance was 18.30×10-2ind/m3and annually abundant hyperiid distributed on the continental shelf. The seasonal means of hyperiid abundance were consistent while the seasonal horizontal distributions showed significant differences through seasons. The annual means of hyperiid richness index, diversity index, evenness index and diversity threshold were 1.23, 1.28, 0.33 and 0.48, respectively. Hyperiid composition changed along with the effect of monsoon reversal on the expending and shrinking of coastal hypohaline waters. The horizontal distribution of hyperiid abundance and diversity threshold changed along with the surface currents driven by monsoon reversal. The correlation analysis indicates a symbiosis relationship between hyperiid and siphonophore in Nansha Islands waters. Due to such a symbiosis,L.bengalensidominates upon the effect of coastal hypohaline waters in-flowed, showing the similarity to the dominant species in coastal ocean.
Nansha Islands waters; pelagic amphipod; hyperiid; community structure; coastal waters; current; siphonophire
10.3969/j.issn.0253-4193.2016.10.008
2016-03-25;
2016-05-27。
国家自然科学基金项目(41406188);广东省省级科技计划项目(2014A020217011);国家科技支持计划项目(2013BAD13B06) ;农业部财政重大专项(NFZX2013)。
王亮根(1984—),男,安徽省池州市人,助理研究员,从事浮游甲壳生物方向研究。E-mail:lung1984@163.com
杜飞雁,研究员。E-mail:feiyanegg@163.com
S917;P735;Q958
A
0253-4193(2016)10-0070-13
王亮根,杜飞雁,李亚芳,等. 南沙海域虫戎群落特征与季风、管水母关系分析[J].海洋学报,2016,38(10):70—82,
Wang Lianggen, Du Feiyan, Li Yafang,et al. Hyperiid community characteristics associated with monsoon and siphonophores in Nansha Islands waters, South China Sea[J]. Haiyang Xuebao,2016,38(10):70—82, doi:10.3969/j.issn.0253-4193.2016.10.008
