附着基粗糙度等因素与海藻密度的相关性研究
2016-11-11施超梁振林梅俊学
施超,梁振林,梅俊学*
(1.山东大学(威海) 海洋学院,山东 威海 264209)
附着基粗糙度等因素与海藻密度的相关性研究
施超1,梁振林1,梅俊学1*
(1.山东大学(威海) 海洋学院,山东 威海 264209)
海藻附着基表面粗糙度与孢子附着密度有密切的相关性,已经由许多研究证实。但是海藻苗的密度是否仍然受到附着基粗糙度的影响,还缺乏明确的结论。本文以尼龙和亚克力两种材料作为海藻附着基,悬挂于自然海区中使海藻孢子附着并萌发生长,用以研究附着基表面粗糙度对4种海藻密度的影响。结果显示,多管藻、尾孢藻、点叶藻、硬毛藻这4种海藻,在不具沟槽的光滑面,密度显著低于任何有沟槽的粗糙面;但粗糙度不同的附着基之间比较,对海藻密度的影响并不显著。室内培育的海带苗,在尼龙上的密度与粗糙度成正相关,但是将海带苗移至海上培育后,不再与粗糙度有相关性,可能与其假根状固着器下海后的发育有关。本文还试验了海泥、灭活海泥和低栖硅藻3种沉积物与附着基粗糙度对海藻密度的影响,结果表明,沉积物和附着基粗糙度,以及它们的交互作用对海藻密度的影响,因附着基的材料和海藻种类而有差别。
附着基;粗糙度;海藻密度;沉积物
1 引言
基于显著的生态和经济效益,最近几年人工藻礁技术和应用获得了飞速发展。根据国家知识产权局网站公布的数据,2007—2015年仅国内就已经有超过40种藻礁获得专利授权。但是,多数研究集中在礁体的立体结构和礁体材料方面,关注礁体表面结构的研究很少[1—9]。藻类繁殖体(孢子、合子等)的附着与藻礁表面形状的相关性研究,主要在生物污损(biofouling)方面。研究证明,凹凸的表面更利于海藻孢子的附着。但是孢子萌发后形成的藻体与藻礁的表面的粗糙度是否仍然具有相关性,还有待于证实[10—19]。藻礁投入海水中后,各种颗粒物会在表面附着沉积,它们在改变藻礁表面粗糙度的同时,对于海藻幼苗数量的影响也缺乏详实的报道。为进一步探索藻礁表面与海藻密度的相关性,本文采用尼龙和亚克力两种材料、6种表面粗糙度、3种沉积物,即硅藻、海泥和灭活海泥,在山东威海海域实施4种藻类自然附着试验,这4种藻是多管藻(Polysiphoniaurceolata)、尾孢藻(Urosporapenicilliformis)、点叶藻(Punctarialatifolia)、硬毛藻(Chaetomorphaantennina),比较各种组合条件对海藻附着数量的影响。另外,还试验了海带(Laminariajaponica)在室内和海上条件下幼苗密度的变化以及与附着基粗糙度的关系。这些数据将为人工藻礁的表面微结构设计提供科学依据。
2 材料与方法
2.1材料
为了在藻礁表面精确雕刻出各种刻度,以表示不同的粗糙度,作者试验了各种材料,如岩石、混凝土等,均因质地粗糙和材料坚硬而告失败。最后,只在亚克力和玻璃表面按一定间隔,刻出宽度和深度一致的凹槽。后来因玻璃极易碎裂,也放弃使用。市售的各种尼龙扎带,不同的规格凹槽深度基本一致,凹槽间隔不同,可以作为海藻附着基,以模仿不同粗糙度的藻礁。
附着基材料1:市售尼龙扎带,白色,原料聚酰胺纤维,俗称尼龙(NYLON 66)。扎带分为5种规格,宽度分别为2 mm、 3 mm、4 mm、5 mm、8 mm,长度分别为10 cm、15 cm、20 cm、25 cm、35 cm,粗糙程度以每单位面积扎带表面凹槽或隔数partition (简称par.)表示。其粗糙度分别标示为75 par./cm2、43 par./cm2、28 par./cm2、 18 par./cm2、11 par./cm2,扎带背面光滑无凹槽,将粗糙度定为0 par./cm2。凹槽平均深度(0.4±0.03)mm(图1)。数字越大,视为粗糙度越大。将不同粗糙度的扎带随机固定在镂空塑料篮的四周及底部,作为附着海藻繁殖体(孢子、合子等)的附着基(图2)。
附着基材料2:透明亚克力片,无色,原料聚甲基丙烯酸甲酯(PMMA),宽25.4 mm,长76.2 mm,厚1~1.2 mm。亚克力片上划刻边长为0.5 mm、1.0 mm、1.5 mm、2.0 mm的正方形小格,刻槽深度(0.118±0.012)mm。其粗糙度以每平方厘米中的格数来计量,分别对应的粗糙度为400格/cm2、100格/cm2、44格/cm2、25格/cm2、0格/cm2,数字越大,视为粗糙度越大(图3)。亚克力片两端打孔,将不同粗糙度的亚克力片随机水平固定在镂空塑料篮四周和底部底部,作为附着海藻孢子的附着基(图4)。图5、6为海藻附着后的外观效果。
沉积物:海泥和底栖硅藻取自威海麻子山潮间带(37°32′18.27″N,122°3′17.34″E)。

图1 尼龙附着基侧面观Fig.1 Side view of one nylon substrate

图2 固定尼龙附着基的塑料篮及附着基顶面观Fig.2 Top view of nylon substrate fixed on a basket

图3 亚克力片附着基Fig.3 PMMA substrate

图4 固定亚克力附着基的塑料篮及附着基顶面观Fig.4 Top view of PMMA substrate fixed on a basket

图5 亚克力附着基上海带附着结果Fig.5 Laminaria Japonica sporelings on PMMA substrate

图6 尼龙附着基上海带附着结果Fig.6 Laminaria Japonica sporelings on nylon substrate
2.2方法
2.2.1海区自然附着海藻幼苗数量与附着基粗糙度及沉积物的关系
依附着基上沉积物的不同分4组处理:
(1)活泥:从威海麻子山潮间带挖取表层潮湿的海泥在半小时内运回实验室,气温10℃,将1 kg 海泥放入装有10 L 海水的塑料桶中,水温15℃充气搅动海水,然后将附着基投入塑料桶底部,使海泥沉积到附着基上,3 d后取出。
(2)死泥:将海泥经121℃高温灭菌2 h,以杀灭其中的生物,然后如活泥组的操作,将海泥沉积到附着基上。
(3)硅藻:硅藻原种来自威海麻子山潮间带岩礁,在室内培养6个月。本试验开始时,将人工培养的硅藻从原基质上刷下,放置于装有10 L过滤海水的塑料桶中,通气搅动海水,然后用上述方法使硅藻沉积于附着基表面,水温15℃。
(4)空白:将附着基放入过滤海水中,通气,3 d后取出。
2013年12月1日将处理好的4组附着基1 h内运到威海靖子海区(37°33′21.46″N ,122°7′6.13″E),吊挂于养殖筏架上,使海水中海藻繁殖体自然附着。附着基距离海水表面50 cm,表层水温5℃。海上吊挂培养于2014年4月15日结束时,海水表层水温11℃。
每组处理3个小框,每个小框各种扎带各24根,或亚克力片12片。
2.2.2室内人工培育海带幼苗与附着基粗糙度的关系
2014年8月10日于山东威海寻山集团靑鱼滩海带育苗场,随常规生产采孢子,密度为160倍显微镜视野中15~20个游动孢子时,将上面描述两种空白附着基,即绑有尼龙扎带和亚克力片的小框投入孢子水中采集孢子。随后的培养光照强度30~80 μmol·photons/( m2·s)之间,海水温度在7~9℃,直至10月12日统计幼苗数量。
2.2.3室内人工培育海带幼苗在自然海区密度与附着基粗糙度的关系
2014年10月12日将上述海带苗连同附着基吊挂于威海市刘公岛附近海区中(37°29′15.19″N,122°8′54.56″E),水深40~50 cm,表层水温18℃。
2.2.4结果统计
将附着基从海水中取出,剪下各种规格的扎带放入盛有过滤海水的烧杯中,水温13~15℃。各扎带附着基的取样长度分别为2 mm×5.0 cm,3 mm×3.3 cm,4 mm×2.5 cm,5 mm×2.0 cm,8 mm×1.25 cm,即取相同面积1 cm2。各亚克力附着基取方格大小为1 cm×1 cm,即面积1 cm2。每种规格取9个数,体式镜下观察并确定幼苗的种类,统计大于0.5 mm幼苗数量。体式显微镜为桂光2040571,型号TXL-400。将试验所得数据输入Excel 2007作图, 采用SPSS 20.0进行ANOVA分析。
3 实验结果
3.1空白尼龙附着基粗糙度对4种海藻幼苗附着数量的影响
在海中放置105 d后,至试验结束时,附着基表面出现尾孢藻、硬毛藻、多管藻和点叶藻幼苗,体长0.1~3.0 mm。另外有少量的酸藻,因其数量极少,不计入统计数字内。
结果如图7。单因子ANOVA统计结果显示,各种藻在光滑面上的附着密度均小于各粗糙面,且差异性显著,p<0.05。各粗糙度之间比较,多管藻差异性明显,p=0.000,且粗糙度越大,幼苗数量越多。但是尾孢藻、硬毛藻和点叶藻在不同粗糙度的附着基上的差异不显著,p=0.379>0.05。
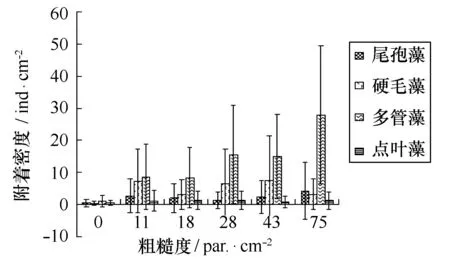
图7 4种海藻附着密度与不同粗糙度关系Fig.7 Density of five species of seaweeds on substrates with different roughness
3.2尼龙附着基上的沉积物以及粗糙度对4种海藻幼苗数量的影响
4种海藻在3种不同沉积物上附着情况见图8~11。双因素ANOVA分析结果显示,对多管藻,粗糙度的效应显著,沉积物的效应和两者交互作用不显著;对尾孢藻,粗糙度效应不显著,沉积物效应显著,两者交互作用不显著;对硬毛藻,粗糙度与沉积物效应不显著,两者交互作用显著;对点叶藻,粗糙度效应不显著,沉积物效应和两者交互作用显著。
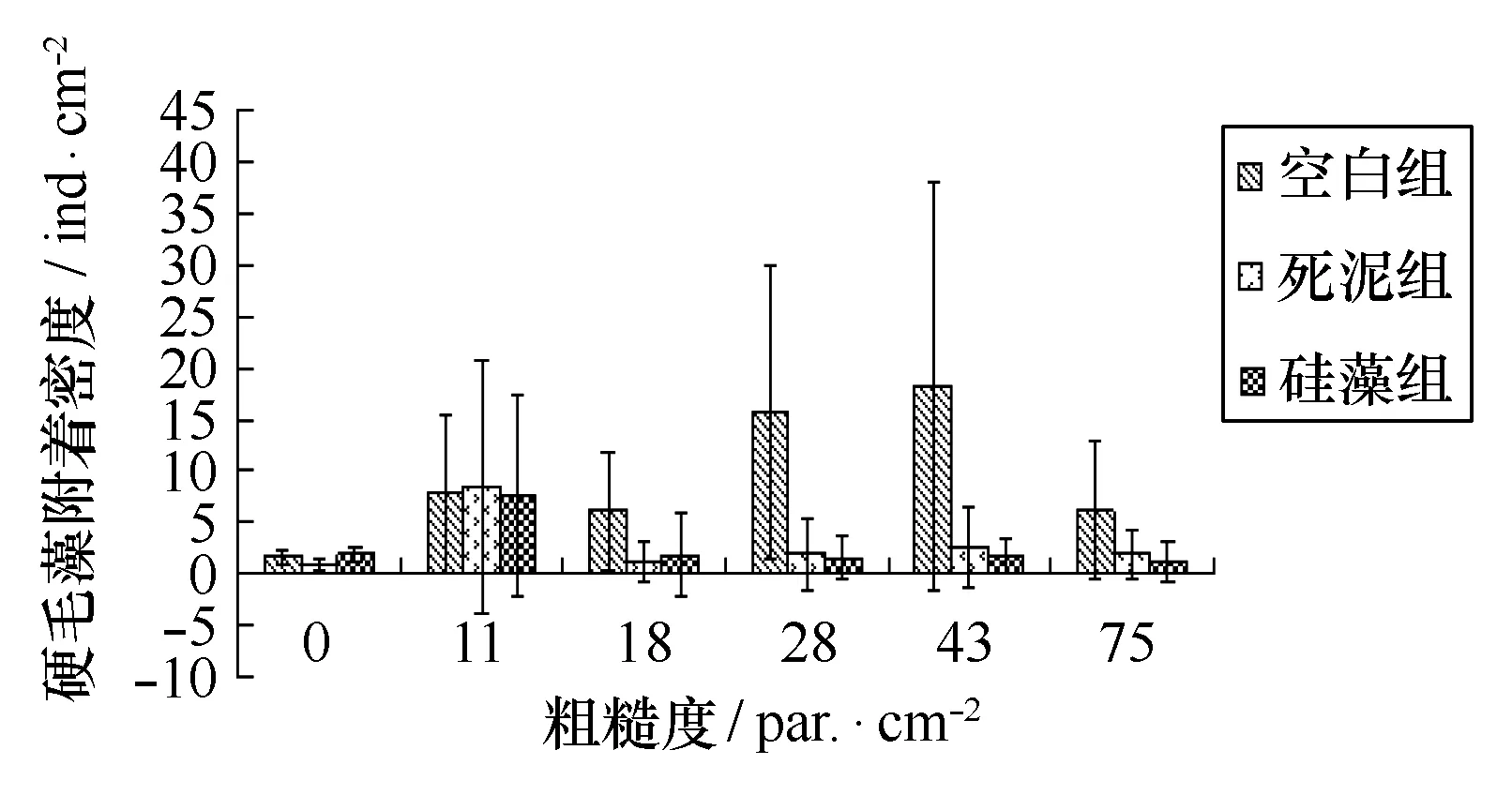
图8 不同粗糙度上硬毛藻幼苗密度与不同沉积物的关系Fig.8 Chaetomorpha antennina density on NYLON substrates of with different roughness and sediment

图9 不同粗糙度上尾孢藻幼苗密度与不同沉积物的关系Fig.9 Urospora penicilliformis density on NYLON substrates with different roughness and sediment

图10 不同粗糙度上多管藻幼苗密度与不同沉积物的关系Fig.10 Polysiphonia urceolata density on NYLON substrates with different roughness and sediment
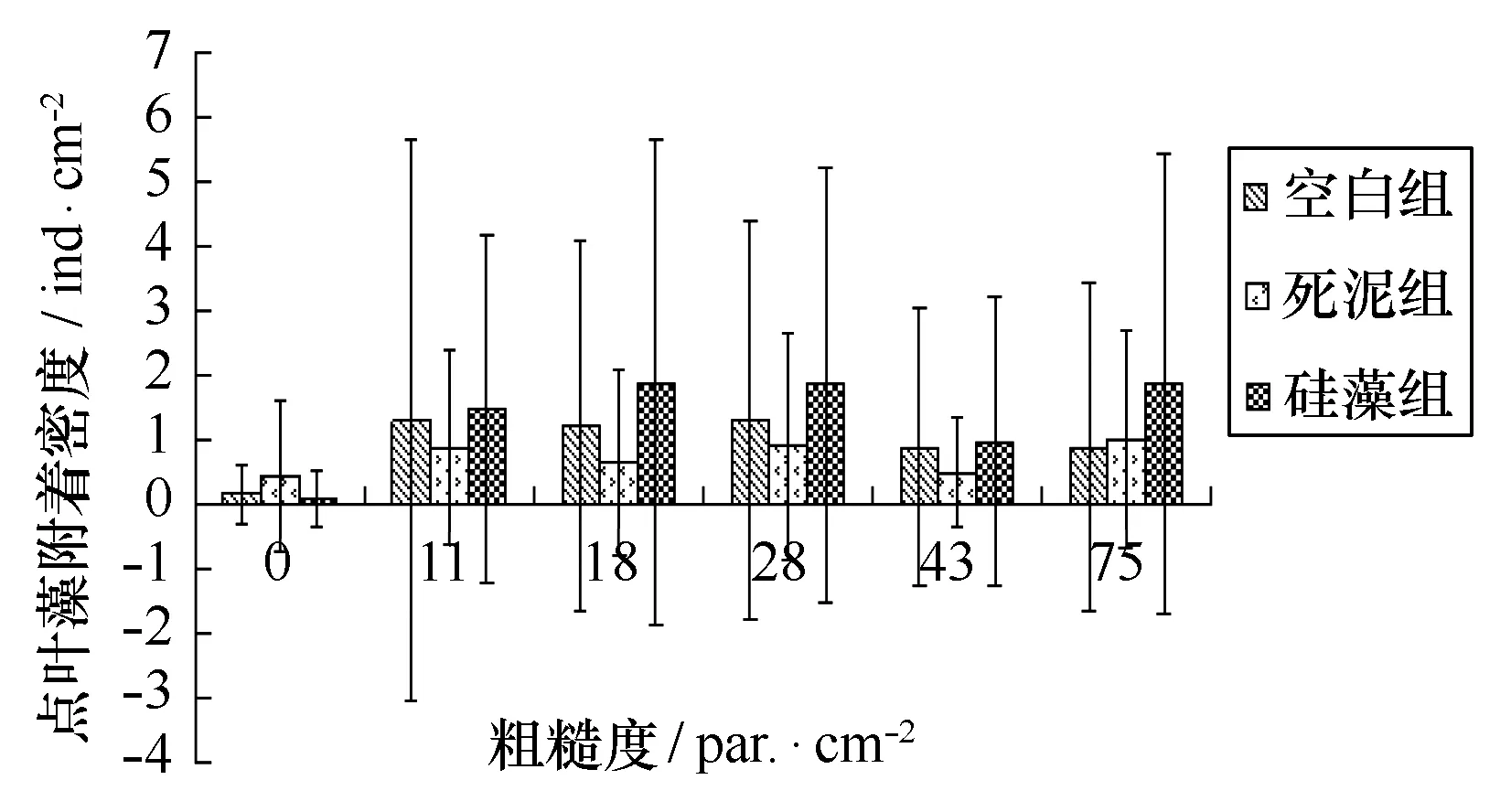
图11 不同粗糙度上点叶藻幼苗密度与不同沉积物的关系Fig.11 Punctaria latifolia density on NYLON substrates with different roughness and sediment
3.3空白亚克力附着基粗糙度对4种海藻幼苗附着数量的影响
统计结果如图12所示,4种海藻的附着密度差异较大。各藻在光滑面上的附着密度均小于个粗糙面,且差异性显著,p=0.000。对尾孢藻和多管藻,各粗糙度的影响差异性明显,p=0.000;但是硬毛藻和点叶藻,各粗糙度的影响不显著,p=0.107>0.05。

图12 4种海藻孢子密度与附着基粗糙程度的关系Fig.12 Density of five species of seaweeds on PMMA substrates with different roughness
3.4亚克力附着基上的沉积物以及粗糙度对4种海藻幼苗附着数量的影响
4种海藻在3种不同沉积物下附着情况见图13~16。双因素ANOVA分析结果显示,对点叶藻,粗糙度效应不显著,沉积物效应显著,两者交互作用不显著;对尾孢藻、硬毛藻和多管藻,粗糙度与沉积物效应不显著,两者交互作用显著。

图13 不同粗糙度上尾孢藻幼苗密度与不同沉积物的关系Fig.13 Urospora penicilliformis density on PMMA substrates with different roughness and sediment

图14 不同粗糙度上硬毛藻幼苗密度与不同沉积物的关系Fig.14 Chaetomorpha antennina density on PMMA substrates with different roughness and sediment
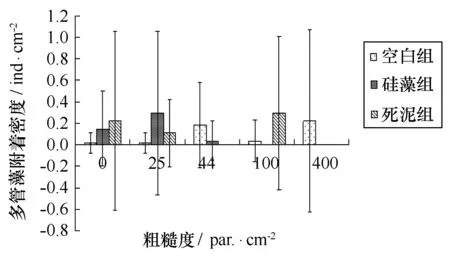
图15 不同粗糙度上多管藻幼苗密度与不同沉积物的关系Fig.15 Polysiphonia urceolata density on PMMA substrates with different roughness and sediment
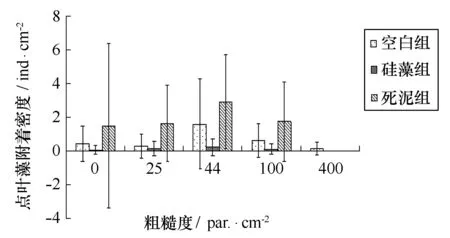
图16 不同粗糙度上点叶藻幼苗密度与不同沉积物的关系Fig.16 Punctaria latifolia density on PMMA substrates with different roughness and sediment
3.5室内人工培育海带幼苗与附着基粗糙度的关系
如图17、18所示,尼龙附着基上的海带苗附着密度与附着基粗糙度呈正相关,粗糙度越大附着密度越大,p=0.000;亚克力附着基上的海带苗附着密度,各粗糙度之间差异不显著,p>0.05。
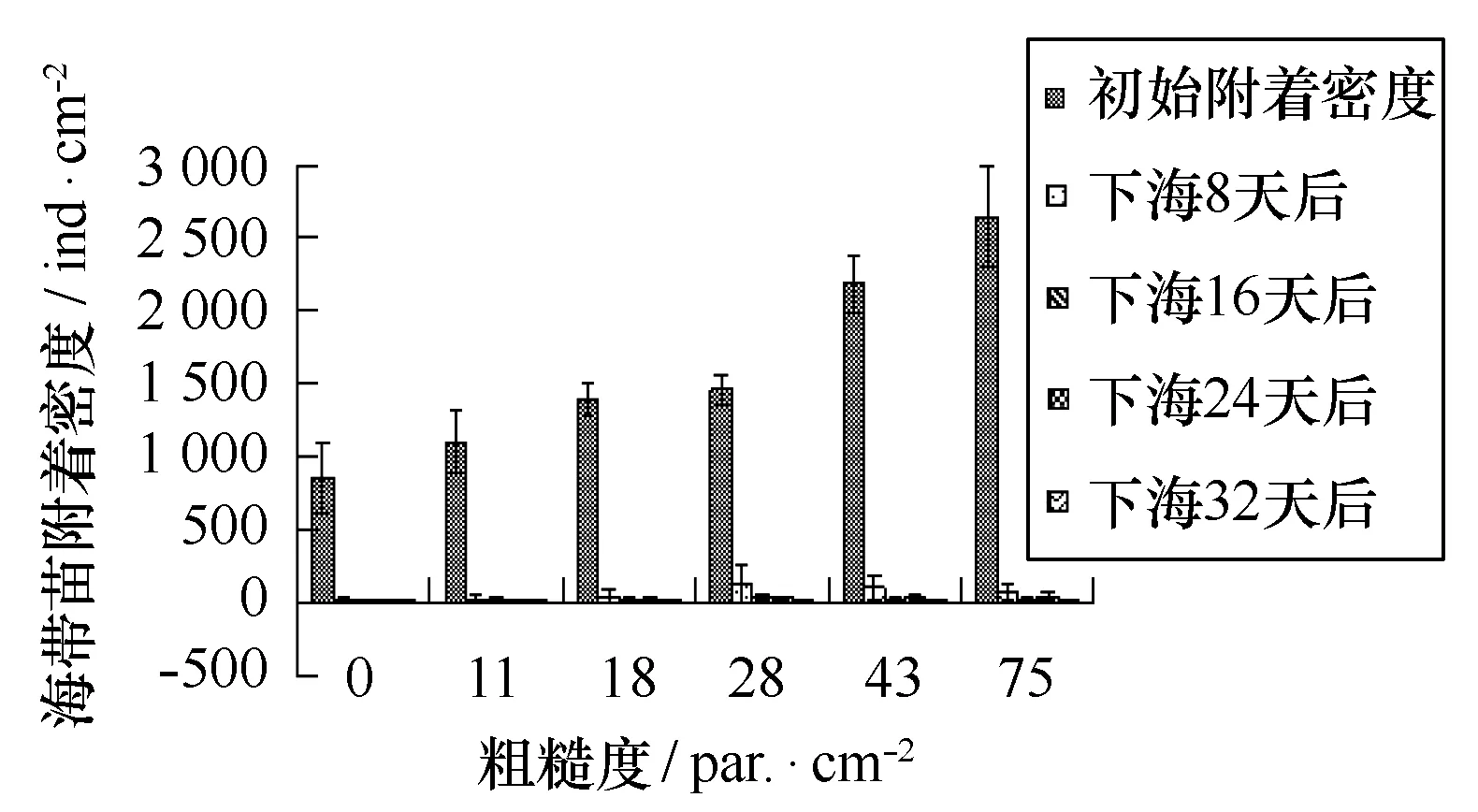
图17 海带苗密度与尼龙附着基粗糙程度的关系Fig.17 Sporeling density of Laminaria Japonica on NYLON substrates with different roughness
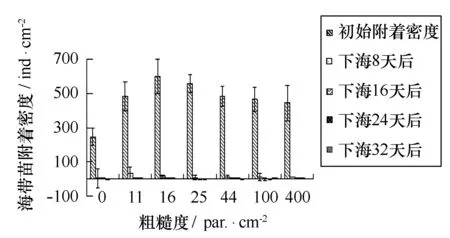
图18 海带苗密度与亚克力附着基粗糙程度的关系Fig.18 Sporeling density of Laminaria Japonica on PMMA substrates with different roughness
3.6室内人工培育海带幼苗在自然海区附着密度与附着基粗糙度的关系
从育苗室内转移到海中吊养后,尼龙附着基海带苗大量减少,到第8天时,超过95%海带苗消失。随着吊养时间的延长,幼苗继续减少,且集中在扎带的顶端。下海8 d后的海带苗密度各粗糙度之间差异显著,p<0.05;下海下海24天之后各组之间差异不显著,p>0.05。下海8 d、16 d、24 d和32 d 4个时间之间,海带苗之间差异不显著,p>0.05。
下海吊养之后亚克力上海带苗密度急剧下降,下海8 d之后,光滑面仍有少量海带苗,但是从下海16 d开始所有附着基上基本无海带苗。
3.7两种材料作为附着基的比较
由于两种材料表面的凹槽深度和形状不同,因此只能比较光滑面的附着情况。试验数据分析证明,室内附着孢子的海带苗在两者间的差异显著,p<0.01,平均值分别为855株/cm2和247株/cm2,尼龙优于亚克力。
4 讨论
4.1孢子的附着密度与附着基粗糙度
海藻的孢子,有些有鞭毛,能主动移动,如绿藻和褐藻;有些不具鞭毛,如红藻[10]。红藻的附着机制为黏附型。绿藻的浒苔属(Enteromorpha)和石莼属(Ulva)是常见的污损海藻,对这些藻类孢子的附着的研究也较多。研究结果显示,附着基上的生物、附着基成分和表面形态影响着游动孢子的附着。例如,浒苔孢子在疏水的表面自由能低,孢子附着力小,而在亲水的表面则相反[11,15]。聚集在一起附着的浒苔孢子,比单个附着的孢子附着力更强[11,16]。绿藻游动孢子附着和附着基粗糙度的关系,Granhag 等认为,在凹槽的底部有更多的孢子附着,是由于凹槽增加了孢子的粘附力,并且为孢子提供了躲避水流冲击的场所,从而减少孢子脱离附着基可能性[17]。对于没有鞭毛的红藻孢子,施超等的研究也已经也证实,附着基表面凹槽内的数量远远大于凹槽外,而且与粗糙度成正相关[19]。
4.2海藻密度与附着基粗糙度
从以上的试验数据看,不同藻类以及同一种海藻在不同基质上的附着密度均有差异。海藻苗密度与附着基粗糙度的关系很复杂,但是仍然能够总结出一些规律。
4.2.1光滑面与粗糙面
无论哪种海藻,与光滑的表面相比,在粗糙的附着基表面确实有更多的海藻幼苗。一是因为表面的沟槽内有更多的孢子附着,二是因为沟槽为海藻的固着器提供更大的附着面,增加固着力。因此,粗糙面比起光滑面,有更多的海藻附着和生长。
4.2.2附着基粗糙度与海藻密度是否正相关
在以上的所有试验中,除了室内培育的海带苗在尼龙上的分布,粗糙度与密度成正相关关系,其他的均不具体这种相关性。原因可能有以下几个。第一,海藻群体内的自疏效应(self-thinning)。植物生态学上,当种群密度达到一定程度时,个体间的竞争导致部分个体死亡。第二,水流冲击效应。虽然在粗糙面上海藻的固着器有较大的附着面积,但当水的冲击力达到一定程度,即使附着面积较大的藻体也会因冲击而掉落。第三,动物的啃食效应。根据观察,啃食动物主要为端足类中华赢蜚CorophiumSinensis,其体长几微米至1 cm,完全能够取食凹槽内的藻体。以上3种效应在凹槽内外均可发生,从而影响了粗糙度本身对海藻附着的效应。
4.3沉积物的效应
在附着基表面添加沉积物后,其作用依海藻种类和附着基材料不同而有差别。在尼龙上,死泥对尾孢藻、点叶藻附着有利;在亚克力上,死泥对点叶藻有利。其余的海藻密度与沉积物之间无相关性。
4.4粗糙度与沉积物的交互作用
这两种因素对海藻密度的交互作用与附着基质的材料有关。在尼龙上,对硬毛藻和点叶藻的作用显著;在亚克力上,对尾孢藻、硬毛藻、多管藻的作用显著。
从以上的分析来看,附着基表面对海藻密度的作用,受许多因素的影响。除了粗糙度外,沉积物和附着基材料本身也起一定作用。而且这3种因素在各种海藻上的效应是不同的。这与海藻本身的生物学特性有关。例如,多管藻孢、尾孢藻、硬毛藻和点叶藻个体大小、对环境因子的要求都有区别。各种海藻的固着器结构也有不同,如试验中的多管藻、尾孢藻和硬毛藻固着器丝状分支,纤细;海带固着器假根状,较前面几种粗壮;而点叶藻固着器圆盘状。另外,海洋中各种食植性动物对海藻的啃食也有选择性。
自然海水中,礁体上一般都有泥沙颗粒、单细胞藻、动物卵等各种沉积物。沉积物的存在在一定程度上改变附着基的粗糙程度,也可能对海藻产生其他物理的、化学的、生物的影响。这些影响可能在孢子附着期产生,也可能影响孢子萌发和海藻苗的生长。这些都需要进一步的研究。
本研究结果还显示,动物啃食和海流冲击,对海藻在藻礁上的存活也是值得关注的,这可能是今后人工藻礁发展的重要研究课题。
[1]李冠成. 人工鱼礁对渔业资源和海洋生态环境的影响及相关技术研究[J]. 海洋学研究, 2007, 25(3): 93-102.
Li Guancheng. Influence of artificial fish reef on fishery resources and oceanic ecological environment and research on correlation technique[J]. Journal of Marine Sciences, 2007, 25(3): 93-102.
[2]江艳娥, 陈丕茂, 林昭进, 等. 不同材料人工鱼礁生物诱集效果的比较[J]. 应用海洋学学报, 2013, 32(3): 418-424.
Jiang Yan’e, Chen Pimao, Lin Zhaojin, et al. Comparison of effectiveness of various artificial reef materials for fish attraction[J]. Journal of Applied Oceanography, 2013, 32(3): 418-424.
[3]陈应华. 大亚湾大辣甲南人工鱼礁区的生态效应分析[D]. 广州: 暨南大学, 2009.
Chen Yinghua. Analysis of ecological effects of southern Dalajia Island artificial reef area in Daya Bay, Guangdong, China[D]. Guangzhou: Jinan University, 2009.
[4]Wilkinson C R. Coral reefs of the world are facing widespread devastation: can we prevent this through sustainable management practices?[C]//Proceedings of the 7th International Coral Reef Symposium. Guam: University of Guam, 1992, 1: 11-21.
[5]Richmond R H. Coral reefs: present problems and future concerns resulting from anthropogenic disturbance[J]. American Zoologist, 1993, 33(6): 524-536.
[6]Perkol-Finkel S, Benayahu Y. The role of differential survival patterns in shaping coral communities on neighboring artificial and natural reefs[J]. Journal of Experimental Marine Biology and Ecology, 2009, 369(1): 1-7.
[7]张磊, 张秀梅, 吴忠鑫, 等. 荣成俚岛人工鱼礁区大型底栖藻类群落及其与环境因子的关系[J]. 中国水产科学, 2012, 19(1): 116-125.
Zhang Lei, Zhang Xiumei, Wu Zhongxin, et al. Effect of environment on benthic macro-algal communities of artificial reefs in Lidao, Rongcheng[J]. Journal of Fishery Sciences of China, 2012, 19(1): 116-125.
[8]刘国山, 佟飞, 蔡星媛, 等. 威海双岛海域人工鱼礁区大型海藻夏季群落结构变化[J]. 中国水产科学, 2014, 21(5): 1010-1019.
Liu Guoshan, Tong Fei, Cai Xingyuan, et al. Variation in the macroalgae community structure during summer in the artificial reef zones of Shuangdao Bay, Weihai, Shandong Province, China[J]. Journal of Fishery Sciences of China, 2014, 21(5): 1010-1019.
[9]潘永玺. 人工鱼礁对生物群落影响的研究[D]. 烟台: 烟台大学, 2010.
Pan Yongxi. Research on the effects of artificial reef to the biological community[D]. Yantai: Yantai University, 2010.
[10]Maggs C A, Callow M E. Algal spores[M]//Encyclopedia of Life Sciences. London: Nature Publishing Group, 2002: 1-6.
[11]Callow M E, Callow J A, Ista L K, et al. Use of self-assembled monolayers of different wettabilities to study surface selection and primary adhesion processes of green algal (Enteromorpha) zoospores[J]. Applied and Environmental Microbiology, 2000, 66(8): 3249-3254.
[12]Johnson L E. Enhanced settlement on microtopographical high points by the intertidal red algaHalosaccionglandiforme[J]. Limnology and Oceanography, 1994, 39(8): 1893-1902.
[13]Pickett-Heaps J, West J, Wilson S, et al. Time-lapse videomicroscopy of cell (spore) movement in red algae[J]. European Journal of Phycology, 2001, 36(1): 9-22.
[14]Hoffmann J P. Wastewater treatment with suspended and nonsuspended algae[J]. Journal of Phycology, 1998, 34(5): 757-763.
[15]Callow M E, Callow J A, Pickett-Heaps J D, et al. Primary adhesion ofEnteromorpha(Chlorophyta, Ulvales) propagules: quantitative settlement studies and video microscopy[J]. Journal of Phycology, 1997, 33: 938-947.
[16]Finlay J A, Callow M E, Schultz M P, et al. Adhesion strength of settled spores of the green algaEnteromorpha[J]. Biofouling: The Journal of Bioadhesion and Biofilm Research, 2002, 18(4): 251-256.
[17]Granhag L M, Finlay J A, Jonsson P R, et al. Roughness-dependent removal of settled spores of the green algaUlva(syn.Enteromorpha) exposed to hydrodynamic forces from a water jet[J]. Biofouling: The Journal of Bioadhesion and Biofilm Research, 2004, 20(2): 117-122.
[18]Callow M E, Callow J A. Substratum location and zoospore behaviour in the fouling algaEnteromorpha[J]. Biofouling: The Journal of Bioadhesion and Biofilm Research, 2000, 15(1/3): 49-56.
[19]施超, 张迪, 梁振林, 等. 附着基粗糙度及表面沉积物对6种海藻孢子附着和幼苗数量的影响[J]. 海洋湖沼通报, 2014(2): 118-124.
Shi Chao, Zhang Di, Liang Zhenlin, et al. The effect of substrate roughness and sediment on algal spore attaching ability and sporeling density[J]. Transactions of Oceanology and Limnology, 2014(2): 118-124.
Effects on algal density of substrate roughness and sediment
Shi Chao1,Liang Zhenlin1,Mei Junxue1
(1. Marine College,Shandong University(Weihai), Weihai 264209, China)
It has been proved that there are more algal spores settled on rough surface than on smooth surface. However, the effect of surface roughness on algal density has not been tested. In this study, two substrate material NYLON and PMMA were suspended in the sea to get algal propagules attaching and developing. Densities of four species of seaweedsPolysiphoniaurceolata,Urosporapenicilliformis,PunctarialatifoliaandChaetomorphaantenninawere counted on 6 different roughness surfaces. The ANOVA show that there is significantly less sporelings on smooth surface (without depression) than on any rough surface (with any of six densities of depression). However, different roughness on substrate surface has no significant impact on seaweed density. In the experiment in a greenhouse with filtered seawater, surface roughness on NYLON substrate significantly impact sporeling density ofLaminariajaponica. However, when the substrate withLaminariajaponicasporelings were transferred and suspended into the sea for 8 days, most sporelings were removed and the roughness had no significant impact on the algal density. The possible effects of zooplankton grazing and hydrodynamic forces in the sea decreasing algal adhesion are discussed. 3 types of sediment, sea mud, sterial-sea-mud and diatom were settled on substrate surface to test the affect on algal density. The results show that the affect of sediment and roughness and the interaction between them on algal density depends on the algal species and substrate materials.
substrate; roughness; algal density; sediment
10.3969/j.issn.0253-4193.2016.10.011
2016-03-07;
2016-07-29。
国家自然科学基金项目(人工鱼礁表面粗糙度与海藻附着效果的关系及其机理研究,31272703)。
施超(1989—),女,浙江省义乌市人,研究方向为生物工程专业海洋繁育工程。 E-mail:starble@126.com
梅俊学,副教授,研究方向为海藻发育生物学和实验生态学。E-mail:meijunxue@sdu.edu.cn
S917.3
A
0253-4193(2016)10-0105-08
施超,梁振林,梅俊学. 附着基粗糙度等因素与海藻密度的相关性研究[J].海洋学报,2016,38(10):105—112,
Shi Chao,Liang Zhenlin,Mei Junxue, et al. Effects on algal density of substrate roughness and sediment[J]. Haiyang Xuebao,2016,38(10):105—112, doi:10.3969/j.issn.0253-4193.2016.10.011
