预测核苷(酸)类似物停药后慢性乙型肝炎复发的生化标记筛查及其临床应用
2016-11-11汪月娥温潇陈沛冬范清琪汪婷贾雯包莹王嘉颖
汪月娥,温潇,陈沛冬,范清琪,汪婷,贾雯,包莹,王嘉颖
上海市静安区中心医院,复旦大学附属华山医院静安分院感染科,上海 200040
·论著·
预测核苷(酸)类似物停药后慢性乙型肝炎复发的生化标记筛查及其临床应用
汪月娥,温潇,陈沛冬,范清琪,汪婷,贾雯,包莹,王嘉颖
上海市静安区中心医院,复旦大学附属华山医院静安分院感染科,上海 200040
为探寻核苷(酸)类似物停药后慢性乙型肝炎复发的相关因素及可能血清标记,收集经核苷(酸)类似物治疗的乙型肝炎病毒e抗原(hepatitis B virus e antigen,HBeAg)阳性或阴性慢性乙型肝炎患者,根据治疗应答对其能否停药进行临床评估,分析达到停药标准患者的临床资料,包括性别,年龄,疗程,HBeAg水平,基线丙氨酸氨基转移酶(alanine aminotransferase,ALT)、HBV DNA,停药时的肝硬度值、HBV表面抗原(HBV surface antigen,HBsAg)水平、白细胞介素21(interleukin 21,IL-21)水平、外周血CD4+IL-21+T细胞频数。结果显示,共47例患者符合停药标准,其中HBeAg阳性26例,HBeAg阴性21例;平均年龄(42.45±14.08)岁。抗病毒疗程平均为(4.60±1.61)年。抗病毒治疗初始ALT值为(174.38±200.84)U/L;基线HBV DNA 为(5.87±1.06)log拷贝/mL;停药时HBsAg精确定量平均为(1 104.82±1 328.11)IU/mL,IL-21平均为(729.82±427.39) pg/mL,CD4+IL-21+T细胞频数平均为(0.79±0.49)%,肝硬度测定F1 27例、F2 16例、F3 4例、F4 0例。共27例患者复发,1年内累积复发率为57.45%。Logistic回归单因素分析提示,慢性乙型肝炎患者停用核苷(酸)类似物后复发与服药总疗程及停药时IL-21水平、CD4+IL-21+T细胞频数、HBsAg水平有关;Logistic回归多因素分析则提示,停药时HBsAg和IL-21水平与复发有关。因此,停药时HBsAg和IL-21水平可作为慢性乙型肝炎患者停用核苷(酸)类似物后复发的预测因素。
慢性乙型肝炎;复发;核苷(酸)类似物;白细胞介素21
慢性乙型肝炎患者不管是乙型肝炎病毒e抗原(hepatitis B virus e antigen,HBeAg)阳性还是阴性,经过长期核苷(酸)类似物治疗,均能很好地抑制病毒复制,延缓肝纤维化,减少肝功能失代偿及肝癌发生。但慢性乙型肝炎抗病毒治疗停药后的复发是目前全球临床医师必须面对的一个问题,因此探讨并寻找慢性乙型肝炎患者停用口服抗病毒药物后复发的预测因子成为研究热点。
1 材料与方法
1.1病例来源
收集2012年10月—2015年1月在上海市静安区中心医院就诊的47例慢性乙型肝炎患者,所有患者均接受核苷(酸)类似物治疗,且达到停药标准。其中男性36例、女性11例;平均年龄(42.45±14.08)岁。HBeAg阳性26例,HBeAg阴性21例。所有慢性乙型肝炎患者的诊断均符合《慢性乙型肝炎防治指南》(2010年版)。HBeAg阳性患者停药标准为:口服核苷(酸)类似物后丙氨酸氨基转移酶(alanine aminotransferase,ALT)复常、HBV DNA阴转,且HBeAg血清转换持续至少1年以上;HBeAg阴性患者的停药标准为:口服核苷(酸)类似物后ALT复常,HBV DNA阴转,巩固治疗至少2年以上。排除合并有肝硬化、肝功能失代偿或肝癌的患者。
1.2检测方法
血生化指标检测采用全自动生化分析仪;血清HBV DNA检测采用荧光定量聚合酶链反应(polymerase chain reaction,PCR);白细胞介素21(interleukin 21,IL-21)检测采用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA),仪器为Thermo公司MK3酶标仪,试剂盒由美国R&D公司提供;HBV表面抗原(HBV surface antigen,HBsAg)检测采用罗氏公司Cobas e601全自动电化学发光分析仪,试剂盒由罗氏诊断产品上海有限公司提供,未稀释样本的线性范围为0.05~130 IU/mL,进行1∶400稀释后样本线性范围为20~52 000 IU/mL;外周血CD4+T细胞表达IL-21的细胞频数采用Beckman公司Navios流式细胞仪检测。
1.3统计学分析
采用Stata 11.2软件进行统计处理。计量资料比较用t检验,计数资料比较用χ2检验,对影响复发的相关因素采用单因素logistic回归分析和多因素logistic回归分析法,P<0.05为差异有统计学意义。
2 结果
2.1复发患者的总体情况
共入组47例符合标准的患者,平均年龄(42.45±14.08)岁。其中男性36例,占76.6%。服用的核苷(酸)类似物分别为:恩替卡韦27例、拉米夫定8例、阿德福韦酯10例、替比夫定1例、拉米夫定联合阿德福韦酯1例。26例初始HBeAg阳性患者停药后,17例出现病毒学反弹,其中2例在停药后3个月内复发、4例在停药后3~6个月复发、11例在停药半年后复发。21例HBeAg阴性患者中,10例复发,其中6个月内复发4例、6~12个月复发6例。所有患者半年内累积复发率为21.28%(10/47),1年内累积复发率为57.45%(27/47)。HBeAg阳性患者1年内累积复发率为65.38%(17/26),HBeAg阴性患者1年内累积复发率为47.62%(10/21)。
2.2停药时的HBsAg定量分析
所有患者HBsAg精确定量平均为(1 104.82±1 328.11)IU/mL。复发患者停药时的HBsAg精确定量为(2 380.5±2 356.4)IU/mL,未复发患者为(189.4±265.3)IU/mL,复发患者与未复发患者之间HBsAg精确定量差异有统计学意义(P<0.001)。
2.3服药疗程与复发的关系
所有患者的服药总时间为2.5~10年(中位数为5.8年)。服药5年以上患者25例,5年以下患者22例。复发患者用药平均时间为(4.10±1.26)年,未复发患者用药平均时间为(5.92±1.83)年,有统计学差异(P=0.000 2)。
2.4IL-21水平与复发的关系
所有患者停药时IL-21平均值为(729.82±427.39) pg/mL。复发患者停药时IL-21为(521.2±278.4)pg/mL,未复发患者停药时IL-21为(1 071.6±361.8)pg/mL,有统计学差异(P=0.000)。
2.5CD4+IL-21+细胞频数与复发的关系
复发患者的CD4+IL-21+T细胞频数为(0.48±0.35)%,未复发患者的细胞频数为(1.03±0.45)%,有统计学差异(P=0.000 1)。图1为一复发病例的流式细胞图,图2为一未复发病例的流式细胞图。

图1某一复发病例的CD4+IL-21+流式细胞频数图
Fig.1Flow cytometry analysis: the frequency of circulating IL-21+T cells with off-treatment virologic relapse in a chronic hepatitis B patient

图2某一未复发病例的CD4+IL-21+流式细胞频数图
Fig.2Flow cytometry analysis: the frequency of circulating IL-21+T cells without off-treatment virologic relapse in a chronic hepatitis B patient
2.6年龄、基线ALT和HBV DNA及停药时的肝硬度测定值与复发的关系
比较复发与未复发患者的年龄、基线ALT和 HBV DNA及停药时的肝硬度测定值。两组年龄比较的t值为1.154 2 (P=0.254 5),基线ALT比较的t值为1.649 4(P=0.106),基线血清HBV DNA定量比较的t值为1.691 3 (P=0.097 7),停药时肝硬度测定值比较的t值为1.203 8(P=0.235),均无统计学差异。
2.7复发预测因子的单因素分析
对停药时的相关因素进行logistic回归单因素分析,包括性别,年龄,服药总疗程,停药时的HBsAg水平、肝硬度测定值、IL-21水平、CD4+IL-21+T 细胞频数,基线ALT、HBV DNA。结果显示,服药总疗程及停药时的IL-21水平、CD4+IL-21+T 细胞频数、HBsAg水平具有预测价值。表1为logistic单因素分析结果。
2.8复发预测因子的多因素分析
对单因素分析获得的有预测价值的因素如服药总疗程及停药时的IL-21水平、HBsAg水平、CD4+IL-21+T细胞频数进行logistic多因素分析。结果显示,仅停药时的IL-21和HBsAg水平具有预测意义。表2为logistic回归多因素分析结果。
表1Logistic回归单因素分析结果
Tab.1Single-factor logistic regression analysis
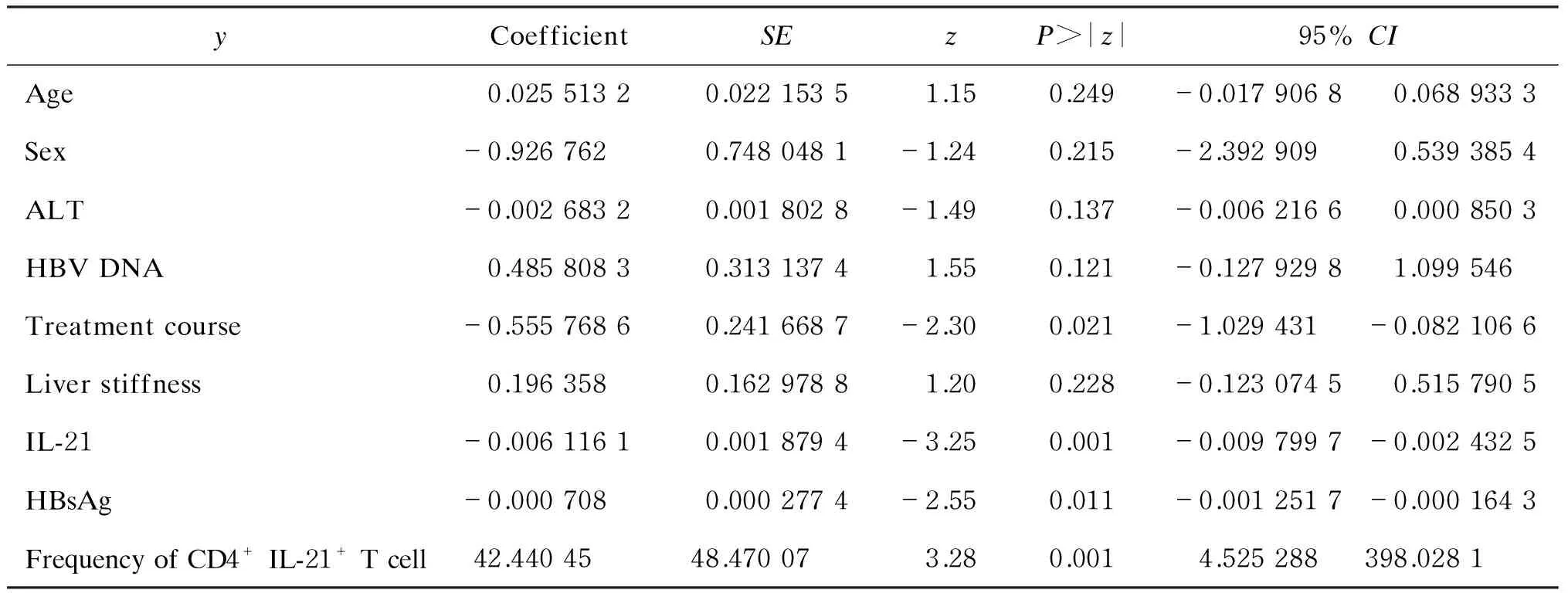
yCoefficientSEzP>|z|95%CIAge0.02551320.02215351.150.249-0.01790680.0689333Sex-0.9267620.7480481-1.240.215-2.3929090.5393854ALT-0.00268320.0018028-1.490.137-0.00621660.0008503HBVDNA0.48580830.31313741.550.121-0.12792981.099546Treatmentcourse-0.55576860.2416687-2.300.021-1.029431-0.0821066Liverstiffness0.1963580.16297881.200.228-0.12307450.5157905IL-21-0.00611610.0018794-3.250.001-0.0097997-0.0024325HBsAg-0.0007080.0002774-2.550.011-0.0012517-0.0001643FrequencyofCD4+IL-21+Tcell42.4404548.470073.280.0014.525288398.0281
表2Logstic回归多因素分析结果
Tab.2Multi-factor logistic regression analysis
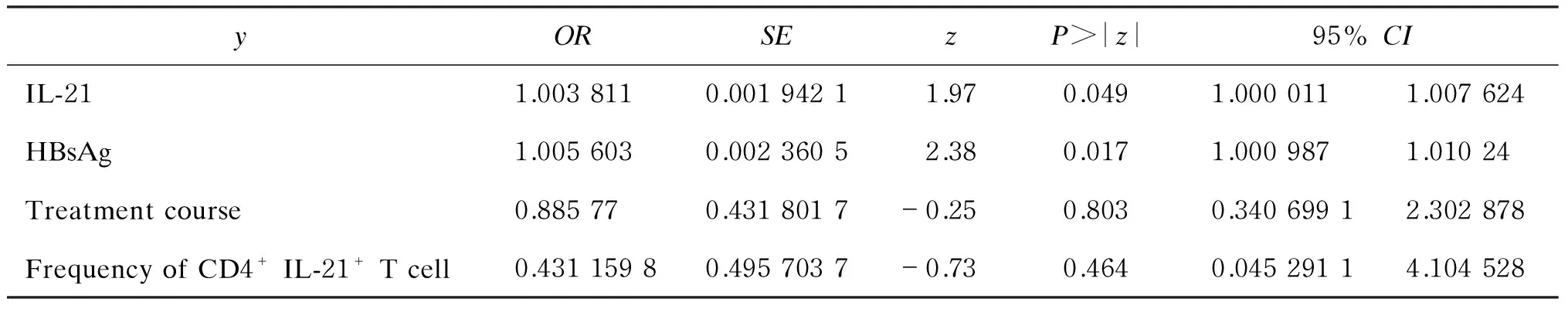
yORSEzP>|z|95%CIIL-211.0038110.00194211.970.0491.0000111.007624HBsAg1.0056030.00236052.380.0171.0009871.01024Treatmentcourse0.885770.4318017-0.250.8030.34069912.302878FrequencyofCD4+IL-21+Tcell0.43115980.4957037-0.730.4640.04529114.104528
3 讨论
全球有超过2亿人感染HBV,其中4 000万为乙型肝炎或乙型肝炎相关性肝硬化、肝功能失代偿及肝癌患者。自1999年首个口服核苷类抗病毒药物——拉米夫定上市以来,先后已有恩替卡韦、阿德福韦酯、替比夫定及替诺福韦等多种核苷(酸)类似物用于抗HBV治疗,极大改善了乙型肝炎患者的病情和生活质量,小部分患者甚至获得治愈,但绝大部分需长期治疗。
慢性乙型肝炎治疗的理想目标为HBsAg阴转或HBsAg血清转换,满意治疗目标为最大限度地改善患者的生活质量,长期抑制病毒复制,延缓肝纤维化及肝硬化病程,防止肝衰竭和肝癌发生。2015年亚太肝脏研究协会年会明确指出,核苷(酸)类似物的停药时机为:HBeAg阳性者,HBeAg血清转换后3年;HBeAg阴性者,HBsAg转阴,抗HBs的形成或HBsAg清除后至少巩固12个月。
慢性乙型肝炎患者即使达到停药标准,选择停药后仍有很高的复发率,是目前临床面临的重大问题,因此如何选择停药节点并最大化地避免停药后的复发是当前的研究热点。本研究旨在了解至少达到满意停药标准的患者停药后的复发率及影响复发的因素。结果显示,HBeAg阳性慢性乙型肝炎患者停药后的1年内累积复发率为65.38%,HBeAg阴性慢性乙型肝炎患者停药后的1年内累积复发率为47.62%。Liu等的研究显示,HBeAg阴性慢性乙型肝炎患者服用拉米夫定停药后的复发率为50.82%,6、12、24、36、48和 60个月的累积复发率分别为26.2%、43.6%、49.7%、52.1%、56.1%和56.1%。韩国的一项研究提示,服用恩替卡韦治疗的慢性乙型肝炎患者获得病毒学应答终止治疗后的复发率为48.4%。中国一项关于慢性乙型肝炎患者停止替比夫定治疗的持久性研究发现,其累积临床复发率24周时为2.6%,48周为7.7%,60周时为16.3%,204周时为23.3%,进一步研究发现HBeAg阳性与阴性患者之间累积复发率无统计学差异。无论是HBeAg阳性还是阴性患者,停药后1年内累积复发率均达50%以上。研究显示,服用不同的核苷(酸)类药物,停药后复发率有差异。本研究由于病例数较少,无法进行药物分类分析,即不能判断复发率是否与服用的药物种类有关,可能会导致结果偏差。
口服核苷(酸)类似物治疗慢性乙型肝炎停药后的高复发率一直是个棘手问题。多项研究发现,停药复发与多种因素有关。有报道称,年龄、治疗基线HBV DNA定量数值、治疗周期、停药时HBsAg定量水平、HBeAg状态等与停药后持续病毒学应答有关[4,7-11]。中国的慢性乙型肝炎患者多为幼时感染,感染时间越长,预后越差。Liu等的研究提示,年龄是影响复发的唯一因素。Lee等亦报道复发与年龄相关,>40岁的患者较易复发,认为复发可能与感染HBV的病程长短有关。Sohn 等则认为,服药疗程是停药后复发的唯一预测因素,停药后复发独立于HBeAg状态、HBeAg血清转换及口服核苷(酸)类药物种类[12]。IL-21参与机体多种免疫细胞的调节及活化[13],广泛用于预测慢性乙型肝炎抗病毒治疗的HBeAg血清转换及停药方面的研究。通过检测外周血单个核细胞中的CD4+IL-21+T细胞频数可判断患者的细胞免疫状态[14],因为慢性HBV感染中可出现CD4+T细胞功能耗竭,表现为IL-21分泌不足。Ma等的研究显示,在HBV感染阶段IL-21表达水平有显著性差异,抗病毒治疗12周血清IL-21和血清HBV DNA水平是独立预测治疗1年后发生HBeAg血清转换的重要指标[15]。本研究将可能影响停药复发的因素如年龄,性别,基线HBV DNA、ALT水平,服药疗程,停药时的HBsAg水平、IL-21水平、CD4+IL-21+T细胞频数等进行分析。结果显示,年龄,性别,基线HBV DNA、ALT水平等与复发无关。单因素分析显示,服药疗程及停药时的HBsAg水平、IL-21水平、CD4+IL-21+T细胞频数与复发有关,但多因素logistic回归分析仅提示停药时的HBsAg和IL-21水平与复发有关,故停药时的HBsAg和IL-21水平可作为慢性乙型肝炎患者停用核苷(酸)类似物后复发的预测因素。
由于病例数少,本研究存在一定的局限性,不能对使用药物及年龄进行分层分析;且随访时间短,缺少用药过程中如4周、8周及12周后HBV DNA及HBsAg水平较基线下降程度等数据;此外,选择用于统计的可能影响因素有一定的片面性,使研究结果与文献报道有一定差异。因此,还需扩大样本量、进行药物分层等研究来更好地探讨这一迫切关注的停药复发问题。
[1]贾继东,李兰娟.慢性乙型肝炎防治指南(2010年版) .肝脏,2011,16(1):2-16.
[2]王贵强,王福生,成军, 任红,庄辉,孙剑,李兰娟,李杰,孟庆华, 赵景民,段钟平,侯金林,贾继东,唐红,盛吉芳,彭劼,鲁凤民,谢青, 魏来.慢性乙型肝炎防治指南(2015更新版) .临床肝胆病杂志,2015,31(12): 1941-1960.
[3]盛秋菊,窦晓光.2015年亚太肝病学会乙型肝炎管理临床实践指南草案解读 .中国实用内科杂志,2015,35(9):744-747.
[4]Liu F,Wang L,Li XY,Liu YD,Wang JB,Zhang ZH,Wang YZ.Poor durability of lamivudine effectiveness despite stringent cessation criteria: A prospective clinical study in hepatitis B e antigen-negative chronic hepatitis B patients .J Gastroenterol Hepatol,2011,26(3): 456-460.
[5]Song MJ,Song do S,Kim HY,Yoo SH,Bae SH,Choi JY,Yoon SK,Paik YH,Lee JS,Lee HW,Kim HJ.Durability of viral response after off-treatment in HBeAg positive chronic hepatitis B .World J Gastroenterol,2012,18(43): 6277-6283.
[6]Chen DB,Chen YM,Liu J,Xie DY,Lu CR,Huang ZL,Zhu RH,Gao ZL.Durability of efficacy after telbivudine off-treatment in chronic hepatitis B patients .J Clin Virol,2014,59(1): 50-54.
[7]Lee HW,Lee HJ,Hwang JS,Sohn JH,Jang JY,Han KJ,Park JY,Kim DY,Ahn SH,Paik YH,Lee CK,Lee KS,Chon CY,Han KH.Lamivudine maintenance beyond one year after HBeAg seroconversion is a major factor for sustained virologic response in HBeAg-positive chronic hepatitis B .Hepatology,2010,51(2): 415-421.
[8]Cai W,Xie Q,An B,Wang H,Zhou X,Zhao G,Guo Q,Gu R,Bao S.On-treatment serum HBsAg level is predictive of sustained off-treatment virologic response to telbivudine in HBeAg-positive chronic hepatitis B patients .J Clin Virol,2010,48(1): 22-26.
[9]陈立,李孝楼,甘巧蓉,张冬青,林榕生,林明华.核苷(酸)类似物治疗慢性乙型肝炎停药复发患者的临床特点及其影响因素 .中华肝脏病杂志,2013,21(11):825-828.
[10]Patwardhan VR,Sengupta N,Bonder A,Lau D,Afdhal NH.Treatment cessation in noncirrhotic,e-antigen negative chronic hepatitis B is safe and effective following prolonged anti-viral suppression with nucleosides/nucleotides .Aliment Pharmacol Ther,2014,40(7): 804-810.
[11]Chen CH,Lu SN,Hung CH,Wang JH,Hu TH,Changchien CS,Lee CM.The role of hepatitis B surface antigen quantification in predicting HBsAg loss and HBV relapse after discontinuation of lamivudine treatment .J Hepatol,2014,61(3): 515-522.
[12]Sohn HR,Min BY,Song JC,Seong MH,Lee SS,Jang ES,Shin CM,Park YS,Hwang JH,Jeong SH,Kim N,Lee DH,Kim JW.Off-treatment virologic relapse and outcomes of re-treatment in chronic hepatitis B patients who achieved complete viral suppression with oral nucleos(t)ide analogs .BMC Infect Dis,2014,14: 439.doi: 10.1186/1471-2334-14-439.
[13]Pan Q,Yu Y,Tang Z,Xi M,Jiang H,Xun Y,Liu X,Liu H,Hu J,Zang G.Increased levels of IL-21 responses are associated with the severity of liver injury in patients with chronic active hepatitis B .J Viral Hepat,2014,21(9): e78-e88.
[14]马世武,黄璇,侯金林.白细胞介素-21在慢性乙型肝炎病毒感染中的作用 .中国病毒病杂志,2012,2(3):169-172.
[15]Ma SW,Huang X,Li YY,Tang LB,Sun XF,Jiang XT,Zhang YX,Sun J,Liu ZH,Abbott WG,Dong YH,Naoumov NV,Hou JL.High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B .J Hepatol,2012,56(4): 775-781.
.WANG Yuee,E-mail: wye1017@126.com
Assessment of probable biomarkers predicting relapse of chronic hepatitis B after withdrawal of nucleos(t)ide analogs
WANG Yuee,WEN Xiao,CHEN Peidong,FAN Qingqi,WANG Ting,JIA Wen,BAO Ying,WANG Jiaying
Department of Infectious Diseases,Jing′an District Centre Hospital of Shanghai,Jing′an Branch of Huashan Hospital,Fudan University,Shanghai 200040,China
To evaluate the probable predicting factors and biomarkers associated with the relapse of chronic hepatitis B after withdrawal of nucleos(t)ide analogs,a clinical assessment of patients with chronic hepatitis B,either hepatitis B virus e antigen (HBeAg)-positive or -negative,who had received the treatment of nucleos(t)ide analogs and met the requirement for withdrawal was made.Then the clinical data were collected including sex,age,treatment course,HBeAg level,baseline alanine aminotransferase (ALT) and HBV DNA levels,liver stillness,HBV surface antigen (HBsAg) level,interleukin 21 (IL-21) level and frequency of peripheral blood CD4+IL-21+T cells at the time of withdrawal.Forty seven patients met the requirement for withdrawal.Among them,26 patients were HBeAg-positive and 21 patients were HBeAg-negative.The mean age was (42.45±14.08) years.The mean treatment course was (4.60±1.61) years.The mean baseline ALT level was (174.38±200.84) U/L.The mean baseline HBV DNA level was (5.87±1.06) log copies/mL.The mean HBsAg level was (1 104.82±1 328.11) IU/mL.The mean IL-21 level was (729.82±427.39) pg/mL.The mean frequency of peripheral blood CD4+IL-21+T cells was (0.79±0.49)%.The liver stillness measurement at the time of withdrawal was F1 in 27 patients,F2 in 16 patients,and F3 in 4 patients.Twenty seven (57.45%) patients relapsed in one year.Single-factor logistic regression analysis showed that the relapse of chronic hepatitis B after withdrawal of nucleos(t)ide analogs was associated with treatment course,IL-21 level,frequency of peripheral blood CD4+IL-21+T cells,and HBsAg level.Multi-factor logistic regression analysis showed that HBsAg level and IL-21 level could predict the relapse of chronic hepatitis B after withdrawal of nucleos(t)ide analogs.
Chronic hepatitis B;Relapse;Nucleos(t)ide analog;Interleukin 21
上海市科研计划项目(124119b0900)
汪月娥
2016-03-01)