PD-1/PD-L1抑制剂在晚期非小细胞肺癌中的临床进展与治疗策略
2016-11-11唐宛豫张国伟王慧娟马智勇
唐宛豫 张国伟 王慧娟 马智勇
(河南省肿瘤医院,郑州450000)
PD-1/PD-L1抑制剂在晚期非小细胞肺癌中的临床进展与治疗策略
唐宛豫张国伟王慧娟马智勇
(河南省肿瘤医院,郑州450000)
肺癌是世界范围内发病率与致死率最高的肿瘤[1],而非小细胞肺癌占肺癌的85%。绝大多数患者就诊时已经属于晚期,经过化疗、放疗等传统治疗后,5年生存率不超过15%。由于GVAX瘤苗、黑素瘤相关抗原-3(MAGE-A3)疫苗、BLP疫苗、MUC-1疫苗等肿瘤疫苗在肺癌的临床研究中失败,既往认为免疫治疗对肿瘤无效,肿瘤细胞可以通过“免疫逃逸”机制而避免免疫系统的攻击。近年来肿瘤免疫治疗研究发现了一些与肿瘤免疫逃逸相关的监测点,针对这些监测点设计的免疫监测点抑制剂,如CTLA-4和PD-1/PD-L1抑制剂在临床中观察到了抗肿瘤的效果,也为治疗NSCLC提供了一种新的方法。
晚期肺癌的主要治疗手段包括:化疗、放疗以及近年来兴起的靶向治疗。通过这些治疗,晚期肺癌患者的5年生存率有很大提高,尤其是EGFR和EML4-ALK驱动基因阳性的患者,中位生存时间提高了2~3倍。然而临床上肺鳞癌的患者大多数不能检测到驱动基因,肺腺癌患者也仅有40%能检测到驱动基因,因此对于这些患者,必须开辟新的治疗方法。而免疫检测点抑制剂,给这些患者带来了生存的希望。针对负性调节因子的免疫检测点抑制剂可以克服由肿瘤上调负性调节蛋白所导致的肿瘤免疫逃逸,从而增强机体的免疫系统对肿瘤细胞的杀伤作用。目前PD-1/PD-L1抑制剂已经完成了Ⅲ期临床研究,且Nivolumab及Pembrolizumab已经被FDA批准用于NSCLC的治疗。下面本文就PD-1/PD-L1抑制剂在临床上取得的成就进行综述。
1 免疫检测点抑制剂在NSCLC中的进展
肿瘤生长初期,先天免疫系统和适应性免疫系统会对肿瘤细胞识别并清除,如清除不完全,免疫系统便会与肿瘤细胞进入一种平衡状态。若肿瘤细胞的免疫原性减弱,将会导致肿瘤细胞生长增殖的微环境得以建造。对比NSCLC患者与健康志愿者的循环血,发现虽然CD8+T淋巴细胞明显增多[2],但是由于T细胞表面的免疫抑制分子的表达水平升高[3]、调节性T细细胞增多[4]、主要组织相容性分子表达减少以及促使免疫细胞抗原递呈能力降低的细胞因子分泌增多[5]等因素,导致机体对肿瘤细胞的杀伤力降低。
最初的研究希望通过机体注射肿瘤相关抗原,以提高T淋巴细胞对肿瘤细胞的杀伤作用。然而,MAGE-A3[6,7]、MUC-1[8,9]等疫苗的失败逐渐使人们了解到NSCLC中增殖的T细胞处于抑制状态。而CTLA-4、PD-1/PD-L1、LAG-3、TIM-3等T细胞表面的免疫抑制分子的表达水平升高正是导致T细胞无能的主要原因[10]。
1999年Dong等[11]首次发现B7家族中的B7-H1分子(之后被命名为PD-L1),阻滞这个分子可以导致IL-10等分子的分泌,因此他们考虑B7-H1可能是一个细胞介导的免疫反应的负性调节共刺激分子。PD-1/PD-L1通路于2000年被Freeman发现[12],PD-1与B7-1/B7-2结构相似,与PD-L1结合可以抑制T细胞内NF-κB的转录,从而使T细胞无能。随后研究发现PD-1缺陷的小鼠易患淋巴细胞增殖性疾病、自身免疫性扩张型心肌病等疾病[13],这些研究证实了在机体内PD-1/PD-L1通路可以负性调节自身免疫系统,导致机体活化的T淋巴细胞减少,细胞因子分泌减少。2005年Hirano等[14]在肿瘤模型小鼠中发现,对CD137单克隆抗体耐药的小鼠肿瘤细胞表面高表达PD-L1,而阻滞PD-1/PD-L1通路的特异性抗体可以反转这种耐药并增强治疗效果。之后人们试图将抗PD-1单抗用于临床。
2010年,MDX-1106[15]的Ⅰ期临床试验首次证实了抗PD-(L)1抗体在人体内的抗肿瘤作用,在治疗的39例患者中(其中6例NSCLC),1例黑色素瘤患者获得了持续的完全缓解,1例黑色素瘤和1例肾细胞癌患者获得了部分缓解。其中1名NSCLC患者根据RECIST1.1标准,疗效评价为病情稳定。第一次证实了抗PD-1/PD-L1抗体在人机体内的抗肿瘤作用。之后多个公司研制的PD-1/PD-L1抑制剂逐步进入临床研究,其中由施贵宝公司研发的抗PD-1抑制剂Nivolumab已在NSCLC的Ⅲ期临床试验显示出良好的疗效。CheckMate 017与057研究结果显示[16,17],Nivolumab对比多西他赛二线治疗获得大约3个月的额外生存获益,因此2015年经FDA批准用于晚期非小细胞肺癌含铂方案化疗后的二线治疗[18]。至此,肿瘤免疫治疗成为继手术、放疗、化疗、靶向治疗之后,已被证明具有显著临床疗效及优势的第五种抗肿瘤治疗方法。此后,这些药物进行了大量的临床试验(见表1),证实了肿瘤免疫治疗的显著疗效。
2 免疫治疗疗效的预测因素
随着免疫检测点抑制剂类药物临床研究的深入,人们发现抗PD-1抑制剂仅在部分患者中获得良好的疗效。寻找可靠的生物标记以区别出可获益的人群是免疫治疗能否更好应用于临床的关键。
2.1PD-L1是否有可能成为预测因子研究显示PD-L1大约在45%~50%的肺癌患者中(各种组织类型的肺癌)表达。且目前已有大量临床研究已经证实了PD-1及PD-L1的表达与患者的淋巴结转移状态[23]、分期[24]、机体淋巴细胞水平[25]及患者的预后[26]有直接的关系。因此在临床试验中,PD-L1第一个被考虑是可能的预测因子,且已有部分临床试验探究了PD-L1阳性与PD-1通路抑制剂的疗效之间的关系。
(1)支持PD-L1是预测因子的临床试验:Ⅲ期临床试验CheckMate 057[16,17]的结果显示, PD-L1表达≥10%的腺癌患者中,接受Nivolumab治疗(n=86)与接受多西他赛治疗(n=79)的患者中位OS分别为19.4与8.0个月,风险比为0.4。而在PD-L1表达低于10%的患者中,患者OS分别为9.9和10.3个月(无统计学差异)。
同样在Pembrolizumab[19]的临床研究中,我们发现PD-L1的表达对疗效有一定的预测作用。101名NSCLC患者中,超过50%的肿瘤细胞表达PD-L1的患者的ORR为47%,而少于50%的肿瘤细胞表达PD-L1的患者ORR仅为19%。
MPDL3280的临床试验并未区分病理类型,均为ⅢB-Ⅳ期的NSCLC患者。该研究用免疫组化的方法检测肿瘤浸润免疫细胞和肿瘤细胞的PD-L1的表达,然后对肿瘤细胞和免疫细胞进行评分(其中高表达评分为3分)。最后将患者分为TC3或者IC3组,TC2/3或者IC2/3组,TC1/2/3或者IC1/2/3组,TC0且IC0组,结果显示高表达PD-L1蛋白的亚组(TC3或者IC3组)达到了最长的PFS为9.7个月,而在不表达PD-L1的亚组中(TC0且IC0组),患者PFS仅为2.8个月,对比多西他赛组的3.4个月,无明显的生存获益[20]。
表1免疫检测点抑制剂在晚期NSCLC的临床试验结果
Tab.1Clinical trials of immune checkpoint inhibitors in advanced NSCLC
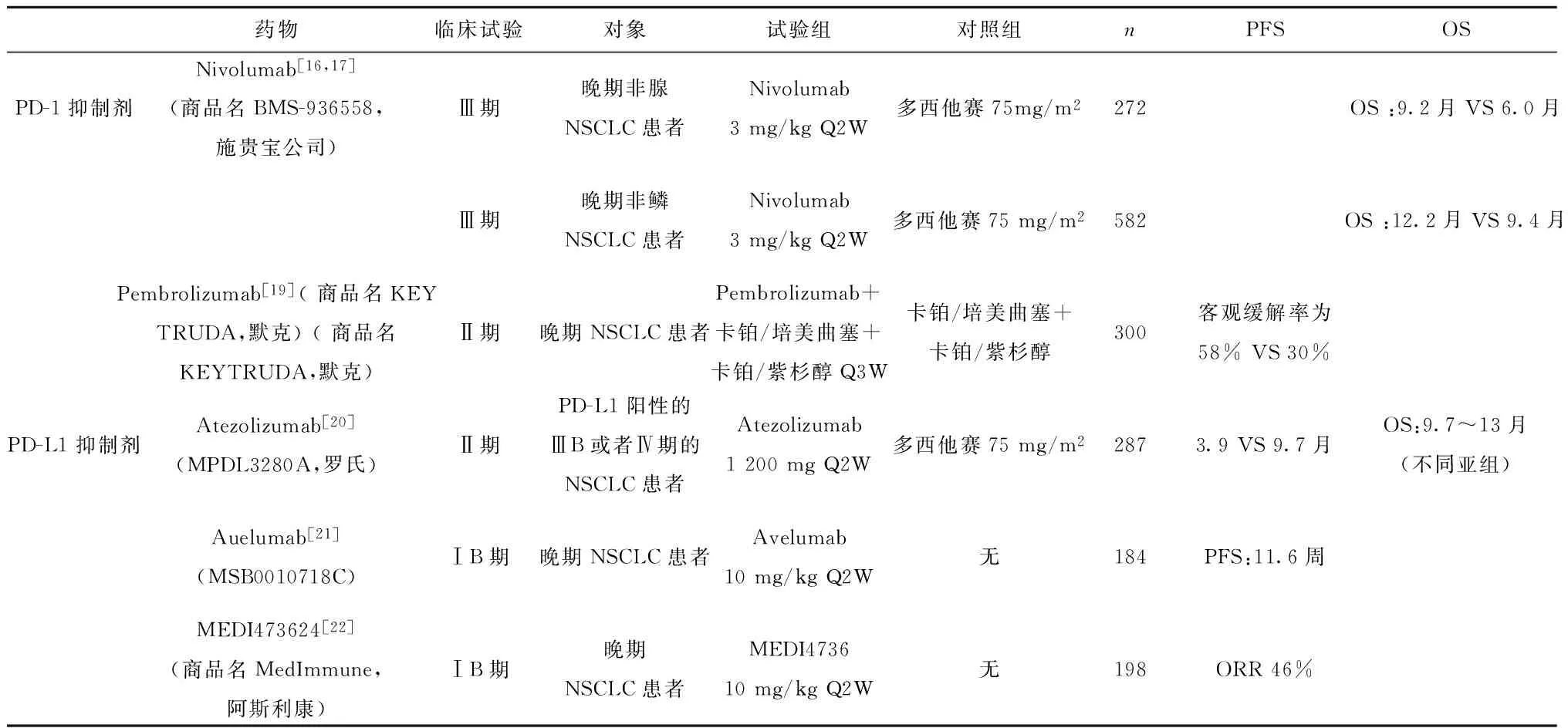
药物临床试验对象试验组对照组nPFSOSPD-1抑制剂Nivolumab[16,17](商品名BMS-936558,施贵宝公司)Ⅲ期晚期非腺NSCLC患者Nivolumab3mg/kgQ2W多西他赛75mg/m2272OS:9.2月VS6.0月Ⅲ期晚期非鳞NSCLC患者Nivolumab3mg/kgQ2W多西他赛75mg/m2582OS:12.2月VS9.4月Pembrolizumab[19](商品名KEYTRUDA,默克)(商品名KEYTRUDA,默克)Ⅱ期晚期NSCLC患者Pembrolizumab+卡铂/培美曲塞+卡铂/紫杉醇Q3W卡铂/培美曲塞+卡铂/紫杉醇300客观缓解率为58%VS30%PD-L1抑制剂Atezolizumab[20](MPDL3280A,罗氏)Ⅱ期PD-L1阳性的ⅢB或者Ⅳ期的NSCLC患者Atezolizumab1200mgQ2W多西他赛75mg/m22873.9VS9.7月OS:9.7~13月(不同亚组)Auelumab[21](MSB0010718C)ⅠB期晚期NSCLC患者Avelumab10mg/kgQ2W无184PFS:11.6周MEDI473624[22](商品名MedImmune,阿斯利康)ⅠB期晚期NSCLC患者MEDI473610mg/kgQ2W无198ORR46%
(2)但是在CheckMate 017[16,17]中,鳞癌患者的PD-L1表达状况对于疗效终点既不是预后性的也不是预测性的指标。且研究证明机体PD-L1表达水平并不是一直不变的,随着治疗线数的增加、疾病的进展,PD-L1的表达水平也会有所变化[26]。PD-L1的表达也存在异质性,例如一名接受Nivolumab治疗获得完全缓解,其原发灶组织标本的PD-L1表达为阳性,但是淋巴结转移灶和皮肤转移灶的PD-L1表达均为阴性[27]。
综合目前的临床试验结果,考虑到PD-L1对疗效的预测并非完全准确,有可能与组织类型及所检测的组织标本有关,尚需进一步的研究。现在有许多研究试图找出更为精确的预测因子。
2.2吸烟患者接受免疫检测点抑制剂的疗效较无吸烟史的患者好经统计在Nivolumab、Pembroli-zumab和MPDL3280a的临床试验中,吸烟与不吸烟患者的ORR有差异(分别为27%vs 0%、27%vs 9%与26%vs 10%),同时Calles[28]发现吸烟患者的PD-L1表达高于不吸烟患者。Calles认为是烟草中的尼古丁诱导体细胞高频率突变,导致吸烟患者免疫原性高于无吸烟史患者[29],因此对免疫检测点抑制剂的敏感性增加[30]。一直以来,吸烟史意味着肺癌患者接受化疗及靶向治疗的预后较差[31],而PD-(L)1抑制剂对吸烟患者的疗效良好,这可能会在肺癌患者选择治疗方案时提供帮助。
2.3错配修复基因MMR的预测作用是否适用于NSCLC2015年ASCO报道了错配修复基因MMR缺失可以预测Pembrolizumab在直肠癌中的疗效。在伴MMR缺失的结直肠癌的患者中有效率可达62%,且疾病控制率高达92%,而MMR正常的患者分别为0%和16%。MMR系统广泛存在于生物体中,是细胞复制后的一种修复机制,可以矫正DNA重组和复制过程中产生的碱基错配而保持基因组的稳定性。一旦该基因发生突变,就会导致细胞错配修复功能缺陷,结果产生遗传不稳定,表现为复制错误或微卫星不稳定,进而导致体细胞突变频率升高,因而容易发生肿瘤。由于突变频率增高会导致肿瘤的免疫原性增强,所以MMR缺失的患者对免疫治疗有较高的敏感性。虽然MMR缺失首先在结直肠癌中发现,但是之前相关研究曾报道错配修复基因在肺癌组织的缺失表达率可高达74%,因此研究NSCLC患者MMR缺失与免疫治疗的疗效关系是极其有必要的。
2.4其他可能的预测方法目前其他的预测因素大都尚未进行临床试验,处于研究阶段。目前可能的预测方法有CT、LA-4及PD-1/PD-L1基因、癌症基因组(Cancer gene panels,CGPs)及在结直肠癌中发现的错配修复基因MMR。
(1)Ma等[32]人分析了中国528名NSCLC患者和600名健康患者,发现CTLA-4和PD-1基因分布的多态性在NSCLC患者与健康对照组的分布相似,除了PD-L1 8923 A/C等位基因,其中AC基因型与C等位基因在NSCLC患者中的频率明显高于健康志愿者(P分别为0.006与0.004)。Cheng等[33]也分析了288名NSCLC患者和300名健康对照组,同样发现了PD-L1 8923A/C基因在NSCLC患者中的频率明显高于健康患者。比起检测组织中的CTLA-4和PD-L1表达水平,CTLA-4和PD-1基因在NSCLC中表达稳定,也使其有希望成为免疫检测点疗效的预测因子。
(2)Campesato等[34]试图用CGPs来预测患者对PD-1和CTLA-4抑制剂的疗效。他们在研究中发现有高CGPs突变负荷的NSCLC患者对PD-1抑制剂有更持久的临床获益(P=0.01)。该预测因子的机制也与突变负荷高导致的免疫原性增强有关。
目前患者PD-L1的表达水平及吸烟史可能对PD-(L)1抑制剂的疗效有一定的预测作用,然而对于优势人群选择的精确度是远远不够的,错配修复基因MMR对PD-L1抑制剂的预测作用是否能在NSCLC中重现尚需大样本数据来证实。其他可能的预测因子尚无明确的研究结果来证实在肺癌中的预测作用。然而对于精准医学的实现来说,生物标记的探索是目前PD-(L)1抑制剂最有可能的出路之一,因此对生物学标记的探索仍需进一步努力。
3 小结
由于肿瘤的发生和发展是多种因素导致的,因此任何一种治疗手段都不可能适合所有的肺癌患者,然而随着治疗手段的多样化,精准医疗、个体化治疗必将成为趋势,免疫治疗也必将面对该挑战。因此对联合用药副作用的管理、对预测因子的寻找仍然是摆在我们面前的重要课题。
[1]Edwards BK,Noone AM,Mariotto AB,etal.Annual Report to the Nation on the status of cancer,19a75-2010,featuring prevalence of comorbidity and impact on survival among persons with lung,colorectal,breast,or prostate cancer[J].Cancer,2014,120(9):1290-1314.
[2]胥萍,陈慧 陈永井,等.肺癌患者外周血中单个核细胞表面程序性死亡蛋白1及其受体的表达和生物学意义[J].中华肿瘤杂志,2013,35(12):910-913.
[3]Yuan J,Page DB,Ku GY,etal.Correlation of clinical and immunological data in a metastatic melanoma patient with heterogeneous tumor responses to ipilimumab therapy[J].Cancer Immun,2010,10(1):1-7.
[4]Woo EY,Yeh H,Chu CS,etal.Cutting edge:Regulatory T cells from lung cancer patients directly inhibit autologous T cell proliferation[J].J Immunol,2002,168(9):4272-4276.
[5]Grosso JF,Jure-Kunkel MN.CTLA-4 blockade in tumor models:an overview of preclinical and translational research[J].Cancer Immunity Archive,2013,13(5):1-14.
[6]Ramlogan-Steel CA,Steel JC,Morris JC.Lung cancer vaccines:current status and future prospects[J].Transl Lung Cancer Res,2014,3(1):46-52.
[7]Sienel W,Varwerk C,Linder A,etal.Melanoma associated antigen (MAGE)-A3 expression in Stages I and II non-small cell lung cancer:results of a multi-center study[J].Eur J Cardiothorac Surg,2004,25(1):131-134.
[8]Palmer M,Parker J,Modi S,etal.Phase I study of the BLP25 (MUC1 Peptide) liposomal vaccine for active specific immunotherapy in stage IIIB/IV non-small-cell lung cancer[J].Clin Lung Cancer,2001,3(1):49-57.
[9]Sangha R,Butts C.L-BLP25:a peptide vaccine strategy in non small cell lung cancer [J].Clin Lung Cancer,2007,13(15):4652-4654.
[10]Li X,Hu W,Zheng X,etal.Emerging immune checkpoints for cancer therapy[J].Acta Oncol,2015,54(10):1706-1713.
[11]Dong H,Zhu G,Tamada K,etal.B7-H1,a third member of the B7 family,co-stimulates T-cell proliferation and interleukin-10 secretion[J].Nat Med,1999,5(12):1365-1369.
[12]Dong H,Zhu G,Tamada K,etal.Engagement of the Pd-1 immunoinhibitory receptor by a Novel B7 family member leads to negative regulation of lymphocyte activation[J].J Exp Med,2000,192(7):1027-1034.
[13]Nishimura H,Okazaki T,Tanaka Y,etal.Autoimmune dilated cardiomyopathy in PD-1 receptor-deficient mice[J].Science,2001,291(5502):319-322.
[14]Hirano F,Kaneko K,Tamura H,etal.Blockade of B7-H1 and PD-1 by monoclonal antibodies potentiates cancer therapeutic immunity[J].Cancer Res,2005,65(3):1089-1096.
[15]Brahmer JR,Drake CG,Wollner I,etal.Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors:safety,clinical activity,pharmacodynamics,and immunologic correlates [J].JCO,2010,28(19):3167-3175.
[16]Spige DR,Reckamp KL,Rizvi NA,etal.A phase III study (CheckMate 017) of nivolumab (NIVO;anti-programmed death-1 [PD-1]) vs docetaxel (DOC) in previously treated advanced or metastatic squamous (SQ) cell non-small cell lung cancer (NSCLC)[R].ASCO,2015 .
[17]Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J].N Engl J Med,2015,373(2):123-135.
[18]Times O.FDA expands approved use of opdivo (Nivolumab) for lung cancer[J].Oncology Times,2015,37(7):3.
[19]Brahmer JR,Kim ES,Zhang J,etal.KEYNOTE-024:Phase III trial of pembrolizumab (MK-3475) vs platinum-based chemotherapy as first-line therapy for patients with metastatic non-small cell lung cancer (NSCLC) that expresses programmed cell death ligand 1 (PD-L1)[R].ASCO,2015.
[20]Rittmeyer A,Spira A,Park K.Efficacy,safety and predictive biomarker results from a randomized phase II study comparing MPDL3280A vs docetaxel in 2L/3L NSCLC[R].ASCO,2015 .
[21]Heery CR,Coyne GH,Marte JL,etal.Pharmacokinetic profile and receptor occupancy of avelumab (MSB0010718C),an anti-PD-L1 monoclonal antibody,in a phase I,open-label,dose escalation trial in patients with advanced solid tumors[R].ASCO,2015.
[22]Antonia S,Rizvi N,Brahmer J,etal.Safety and clinical activity of MEDI4736,an anti-programmed cell death-ligand 1 (PD-L1) antibody,in patients with NSCLC[R].ASCO,2015.
[23]Schmidt LH,Kummel A,Gorlich D,etal.PD-1 and PD-L1 Expression in NSCLC Indicate a Favorable Prognosis in Defined Subgroups[J].PLoS One,2015,10(8):e0136023.
[24]韦腾飞,张军,吴豫,等.CD4+T细胞表面共抑制分子的表达水平与非小细胞肺癌疾病进展的关系[J].中华肿瘤杂志,2014,36(6):424-429.
[25]Zhang Y,Huang S,Gong D,etal.Programmed death-1 upregulation is correlated with dysfunction of tumor-infiltrating CD8+T lymphocytes in human non-small cell lung cancer[J].Cell Mol Immunol,2010,7(5):389-395.
[26]Zhang J,Gao J,Li Y,etal.Circulating PD-L1 in NSCLC patients and the correlation between the level of PD-L1 expression and the clinical characteristics[J].Thorac Cancer,2015,6(4):534-538.
[27]Han JJ,Kim DW,Koh J,etal.Change in PD-L1 expression after acquiring resistance to gefitinib in EGFR-mutant non-small-cell lung cancer[J].Clin Lung Cancer,2016,17(4):263-270.
[28]Calles A,Liao X,Sholl LM,etal.Expression of PD-1 and its ligands,PD-L1 and PD-L2,in smokers and never smokers with KRAS-mutant lung cancer[J].J Thorac Oncol,2015,10(12):1726-1735.
[29]Chen DS,Irving BA,Hodi FS ,etal.Molecular pathways:next-generation immunotherapy-inhibiting programmed death-ligand 1 and programmed death-1[J].Clin Cancer,2012,18(4):6580-6587.
[30]Soria J,Gettinger S,Gordon M,etal.Clinical activity,safety and biomarkers of PD-L1 blockade in non-small cell lung cancer (NSCLC):additional analyses from a clinical study of the engineered antibody MPDL3280A (anti-PDL1)[J].Eur J Cancer,2014,25(4):465.
[31]Lee JY,Na II,Jang SH,etal.Differences in clinical presentation of non- small cell lung cancer in never- smokers versus smokers[J].J Thorac Dis,2013,5(6):758- 763.
[32]Ma Y,Liu X,Zhu J,etal.Polymorphisms of co-inhibitory molecules (CTLA-4/PD-1/PD-L1) and the risk of non-small cell lung cancer in a Chinese population[J].Int J Clin Exp Med,2015,8(9):16585-16591.
[33]Cheng S,Zheng J,Zhu J,etal.PD-L1 gene polymorphism and high level of plasma soluble PD-L1 protein may be associated with non-small cell lung cancer[J].Int J Biol Markers,2015,30(4):364-368.
[34]Campesato LF,Barroso-Sousa R,Jimenez L,etal.Comprehensive cancer-gene panels can be used to estimate mutational load and predict clinical benefit to PD-1 blockade in clinical practice[J].Oncotarget,2015,27(6):33.
[收稿2016-02-19修回2016-03-28]
(编辑倪鹏)
10.3969/j.issn.1000-484X.2016.10.033
唐宛豫(1992年-),女,硕士,医师,主要从事晚期肺癌综合治疗方面的研究,E-mail:tangwanyu3940@sina.com。
及指导教师:马智勇(1952年-),男,主任医师,硕士生导师,主要从事晚期肺癌的综合治疗方面研究,E-mail:mazhiyong@csco.org.cn。
R392
A
1000-484X(2016)10-1558-04