人脐带血干细胞移植对2型糖尿病家兔血清学的影响①
2016-11-11丁海霞王富军杜亚萍齐会卿
丁海霞 王富军 刘 贝 史 宁 杜亚萍 齐会卿 丁 娟
(河北医科大学第四医院内分泌科,石家庄050000)
人脐带血干细胞移植对2型糖尿病家兔血清学的影响①
丁海霞王富军刘贝史宁杜亚萍齐会卿丁娟
(河北医科大学第四医院内分泌科,石家庄050000)
目的:观察人脐带血干细胞(Human umbilical cord blood stem cells,HUCBSC)移植后2型糖尿病家兔血糖、胰岛素及二肽基肽酶Ⅳ ( Dipeptidyl peptidase-Ⅳ,DPP-Ⅳ/CD26 )的变化。方法:18只家兔随机分成正常对照组(6只,C组)和糖尿病造模组(12只),造模组制备2型糖尿病模型,其中6只经兔耳缘静脉输注给予免疫学表型为CD45+、CD34-的HUCBSC移植(A组),6只同法输注等量的PBS液作为对照(B组)。以上三组家兔均喂养观察4周,每天监测家兔血糖,每周测血胰岛素及DPP-Ⅳ/CD26的水平。结果:HUCBSC阳性标志物CD45表达率达100%,阴性标志物CD34表达率为3.5%。与非移植组相比,HUCBSC移植组家兔血糖和DPP-Ⅳ/CD26逐渐下降,胰岛素水平逐渐上升,差异均有统计学意义(P<0.01)。结论:HUCBSC呈圆形或椭圆形贴壁生长,免疫学表型为CD45+、CD34-。HUCBSC移植可以明显降低家兔血糖、增加胰岛素分泌量、降低血DPP-Ⅳ/CD26的水平,从而为临床糖尿病及其并发症的治疗提供新的理论依据。
人脐带血干细胞;2型糖尿病;家兔;血清学
近年来,糖尿病的发病率逐年增加,而糖尿病所致的高血糖主要是由于患者的胰岛素分泌绝对或相对不足所致,长期存在的高血糖可导致心、脑、眼、肾等各种组织的慢性损害和功能障碍[1]。糖尿病最根本的治疗方法是胰腺或胰岛移植促进胰岛素分泌,但终因来源匮乏、价格昂贵且需终生服用免疫抑制剂而无法广泛应用于临床,因此需要寻找更好的治疗方法。而人脐带血干细胞因其可分化为胰岛β细胞分泌胰岛素使得其在糖尿病治疗中的效果备受关注[2],与骨髓干细胞和外周血干细胞相比,脐带血干细胞具有来源广泛、免疫源性低、增殖能力强等特点[3,4],本研究中对其CD45+、CD34-的免疫学表型进行鉴别,可用来区别血液中的造血干细胞、间充质干细胞和内皮祖细胞,目前已有25 000多例临床移植成功的案例[5,6]。因此用脐带血干细胞移植治疗糖尿病及其并发症成为研究的热点。
此外,研究发现,二肽基肽酶Ⅳ(Dipeptidyl pep-tidase-Ⅳ,DPP-Ⅳ/CD26)参与了2型糖尿病及其并发症的发生发展[7,8]。与非糖尿病组相比,2型糖尿病患者血清中可溶性DPP-Ⅳ浓度显著增加。因此,本实验通过经家兔耳缘静脉移植脐带血干细胞,观察其对糖尿病家兔血糖、胰岛素和DPP-Ⅳ/CD26水平的影响,以期为脐带血干细胞应用于治疗糖尿病及其并发症提供更多的理论依据。
1 材料与方法
1.1材料健康家兔18只(河北医科大学动物实验中心提供),体重(2.7±0.5)kg。淋巴细胞分离液由天津颢阳公司(密度为1.077 g/ml)提供,低糖DMEM培养液、 0.25%胰蛋白酶-EDTA消化液于北京索莱宝科技有限公司购买,CD34单抗-PE、CD45单抗-PE购买于德国美天旎公司,超净工作台购于美国Biological公司,倒置相差显微镜购于日本三洋公司,恒温培养箱由中国常州华普达仪器制造厂提供,200目一次性尼龙膜美国Sigma公司,流式细胞仪、高速离心机购于德国Heraeus公司,血糖测定试剂盒由保定长城临床试剂公司提供,血糖监测采用罗氏血糖仪,胰岛素ELISA试剂盒由Mercodia公司提供,DPP-Ⅳ/CD26 ELISA试剂盒购买于北京百奥莱博科技有限公司。
1.2方法
1.2.1HUCBSC混悬液的制备脐带血由石家庄市妇产医院提供,来源于足月分娩的健康产妇,乙肝、艾滋、梅毒等检测均呈阴性,产妇及其家属均签署知情同意书,实验方案经医院医学伦理委员会批准。取新鲜脐带血8例,每例取50~80 ml(6 h内用毕),用PBS液等倍稀释后置于50 ml离心管中,按1∶1比例加入至人淋巴细胞分离液上,4℃,2 000 r/min,离心20 min后,脐带血分5层,中间白膜层即为单个核细胞。用移液器小心吸取富含单个核细胞的悬液以2∶1比例放入备好的两个离心管内,4℃,1 000 r/min离心15 min,PBS洗涤3次。细胞数量较多的离心管用低糖DMEM培养液悬浮,计数细胞浓度为5×105ml,HUCBSC混悬液制备成功,细胞数量较少的离心管内的细胞冻存后用于细胞表型的鉴定。
1.2.2HUCBSC表型的鉴定成功复苏细胞后以1×106ml-1接种于60 mm×15 mm培养皿中,放于37℃、5%CO2培养箱内培养,以低糖DMEM培养液培养,每天换液,培养7 d后细胞贴壁良好,细胞铺满80%~90%皿底,倒掉培养基,PBS冲洗3遍后,对贴壁干细胞拍照观察其形态学表现,加入0.25%胰酶-EDTA消化液消化贴壁干细胞,镜下观察待细胞间隙增大停止消化。用无菌吸管反复吹打贴壁细胞至脱落,将细胞悬液吸入离心管中,1 000 r/min离心3 min,加入2 ml PBS液稀释,吹打均匀后移入EP管中,在每个EP管中加入10 μl CD34单抗-PE和10 μl CD45单抗-PE,常温下避光染色30min。PBS液冲洗后加入1 ml PBS液,每个EP管中的细胞悬液用200目一次性尼龙膜分别过滤,流式细胞仪上机检测细胞表面标志物CD34和CD45的表达。
1.2.3兔2型糖尿病模型的制备12只家兔基础饲料适应性喂养1 周,给予100 g高脂饲料喂养,高脂饲料配方:2%胆固醇、1%脱氧胆酸钠、5%猪油、92%普通饲料。第5周所有动物禁食16 h(不禁水),经耳缘静脉一次快速注射STZ 60 mg/kg,于STZ 造模后第1 周、第2 周分别空腹采血1 次。采血后及时分离血清,测定FBG,以空腹血糖≥11.0 mmol/L为2型糖尿病造模成功。
1.2.4脐带血干细胞移植术12只2型糖尿病家兔造模成功后,随机分成两组,其中一组经耳缘静脉输注脐带血干细胞悬液2 ml,浓度为5×105个/ml(A组),其余6只家兔经耳缘静脉输注等量的PBS液作为对照(B组)。正常对照组(C组)家兔和上述两组家兔均喂养观察4周,每天监测家兔血糖,每周通过ELISA法检测家兔血胰岛素及DPP-Ⅳ/CD26水平,采血及血糖监测时间均为夜间空腹10 h后次日晨8点。

2 结果
2.1HUCBSC表型的鉴定倒置显微镜下观察到的HUCBSC呈贴壁生长,细胞形态为圆形或椭圆形(见图1A)。经流式细胞仪检测贴壁生长的HUCBSC阴性标志物CD34表达率为3.5%(见图1B),阳性标志物CD45表达率达100%(见图1C)。
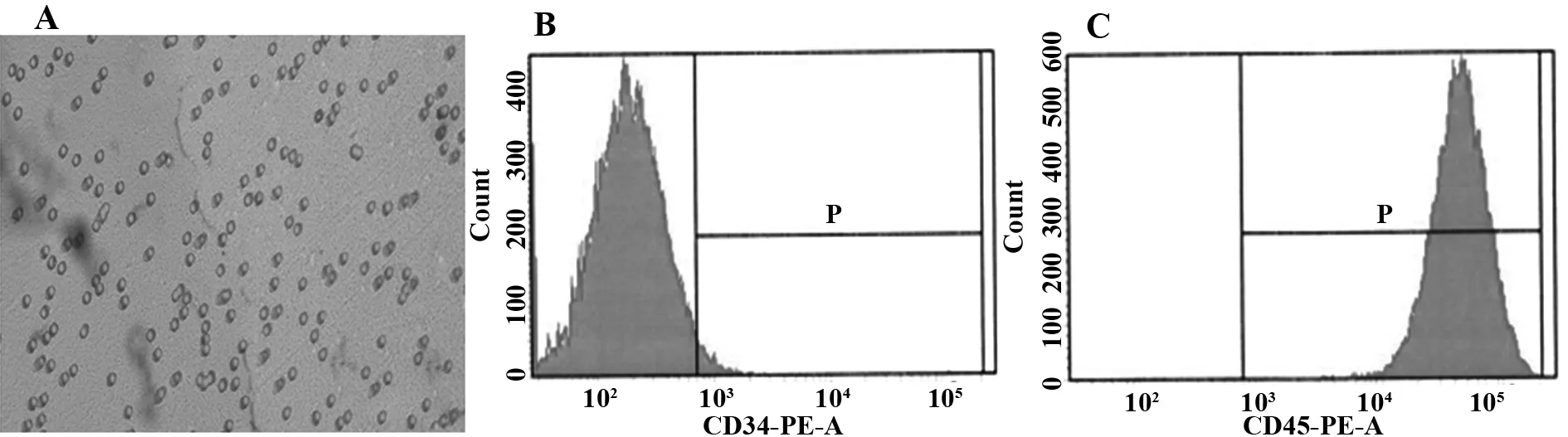
图1 HUCBSC的免疫学表型特征Fig.1 Immunophenotype character of HUCBSCNote: A.HUCBSCwere round or oval,with adherent growth (×200).B.Expression of CD34 in HUCBSC was negative and negative expression rate was 96.5%;C.Expression of CD45 in HUCBSC was positive and positive expression rate was 100%.
表1移植前后各组家兔血糖水平的变化
Tab.1Changes of blood glucose levels in rabbits before and after transplantation
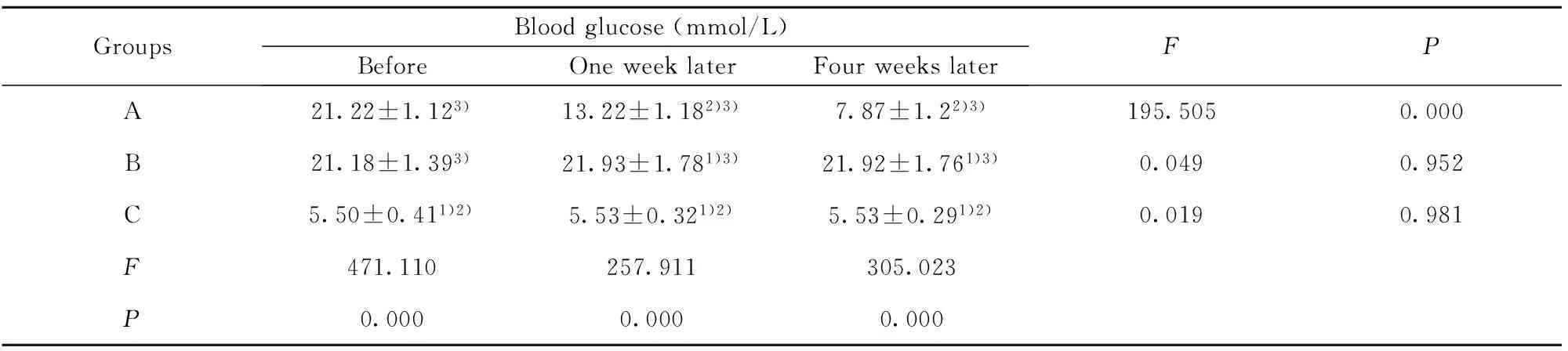
GroupsBloodglucose(mmol/L)BeforeOneweeklaterFourweekslaterFPA21.22±1.123)13.22±1.182)3)7.87±1.22)3)195.5050.000B21.18±1.393)21.93±1.781)3)21.92±1.761)3)0.0490.952C5.50±0.411)2)5.53±0.321)2)5.53±0.291)2)0.0190.981F471.110257.911305.023P0.0000.0000.000
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
表2移植前后各组家兔胰岛素水平的变化
Tab.2Changes of insulin levels in rabbits before and after transplantation
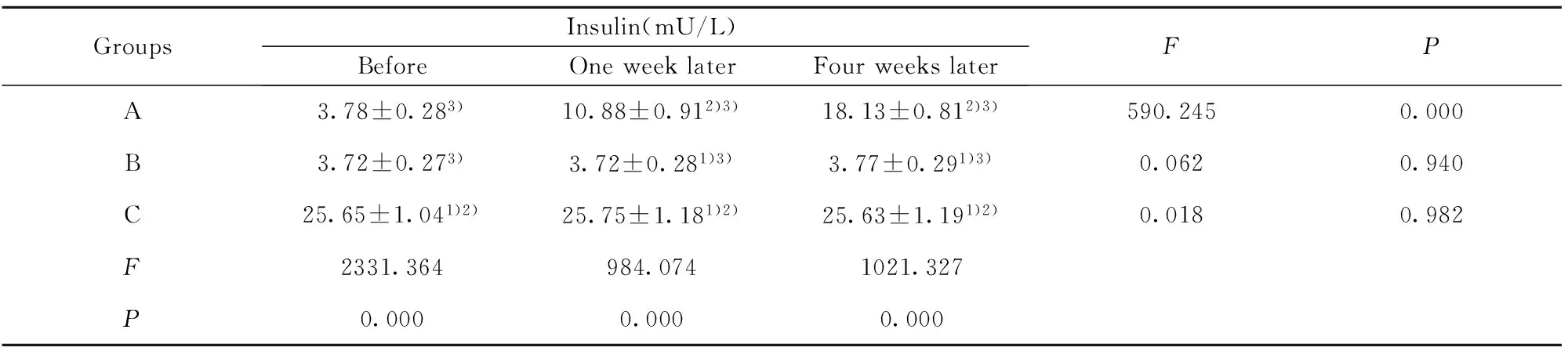
GroupsInsulin(mU/L)BeforeOneweeklaterFourweekslaterFPA3.78±0.283)10.88±0.912)3)18.13±0.812)3)590.2450.000B3.72±0.273)3.72±0.281)3)3.77±0.291)3)0.0620.940C25.65±1.041)2)25.75±1.181)2)25.63±1.191)2)0.0180.982F2331.364984.0741021.327P0.0000.0000.000
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;Compared with group C,3)P<0.01.
表3移植前后各组家兔血DPP-Ⅳ/CD26水平的变化
Tab.3Changes of blood DPP-Ⅳ/CD26 levels in rabbits before and after transplantation
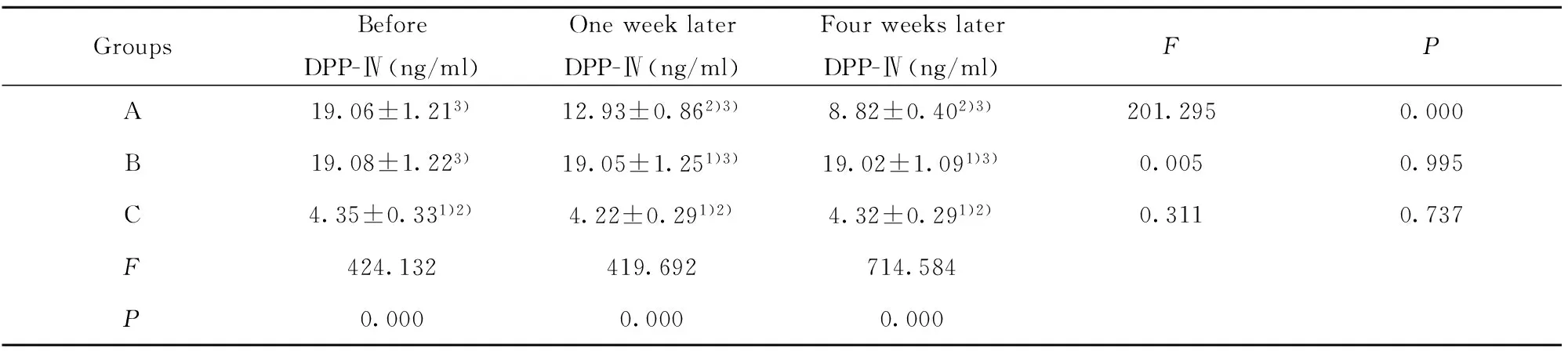
GroupsBeforeDPP-Ⅳ(ng/ml)OneweeklaterDPP-Ⅳ(ng/ml)FourweekslaterDPP-Ⅳ(ng/ml)FPA19.06±1.213)12.93±0.862)3)8.82±0.402)3)201.2950.000B19.08±1.223)19.05±1.251)3)19.02±1.091)3)0.0050.995C4.35±0.331)2)4.22±0.291)2)4.32±0.291)2)0.3110.737F424.132419.692714.584P0.0000.0000.000
Note:Compared with group A,1)P<0.01;compared with group B,2)P<0.01;compared with group C,3)P<0.01.
2.2HUCBSC移植后对家兔血糖、胰岛素及DPP-Ⅳ/CD26水平的影响18只家兔均进入结果分析,中途无脱落,与正常对照组(C组)相比,2型糖尿病造模组造模后血糖、DPP-Ⅳ/CD26明显升高,血胰岛素水平较正常明显减低,差异有统计学意义。脐带血干细胞移植组(A组)在移植后血糖及DPP-Ⅳ/CD26的水平逐渐下降,胰岛素水平逐渐上升,与非移植组(B组)比较,差异均有统计学意义(P<0.01)。见表1~3。
3 讨论
糖尿病以其高发生率、高致残率和高死亡率严重影响着患者的生活质量,甚至危及生命[9],目前主要应用口服药物及胰岛素注射降糖,但都不能从根本上解决胰岛素分泌不足的问题,因此有学者利用脐带血干细胞移植来治疗糖尿病,取得了不错的疗效[10,11],新生儿脐带血中含有丰富的造血干细胞,研究发现,小鼠胰岛中有10%~20%的胰岛素阳性细胞可检测出造血干细胞标志物,说明造血干细胞与胰岛β细胞再生存在密切的关系[12]。在我们的研究中发现脐带血干细胞移植组家兔血糖逐渐下降,胰岛素分泌量逐渐增加,与上述的研究结果一致。脐带血干细胞移植治疗2型糖尿病的机制可能使脐带血干细胞到达胰腺微环境,受到定向的诱导从而分化为胰岛β细胞,促进胰岛细胞的再生,恢复胰岛素分泌功能有关[13]。本研究应用的脐带血干细胞是一种存在于人脐带血的多能干细胞,形态学表现为圆形或椭圆形,其CD45+、CD34-的免疫学表型,可用来区别血液中的造血干细胞、间充质干细胞和内皮祖细胞[14]。
糖尿病并发症的发病机制复杂,研究显示免疫和炎症在其病理过程中发挥重要作用。DPP-Ⅳ酶在1966年首次从大鼠肝脏中分离得到,1990年以来这种能够降解肠促激素等多肽的水解酶在糖尿病领域逐渐受到重视,1993年,DPP-Ⅳ酶经进一步确认也是一种T细胞激活分子-CD26,DPP-Ⅳ/CD26是一种膜结合蛋白水解酶,广泛存在于胃肠道、肾脏、淋巴结和结缔组织中,同时在免疫细胞及非免疫细胞上均有表达[15]。动物研究表明,糖尿病患者血清中DPP-Ⅳ的增加可能与糖尿病性心肌病有关。血清中的DPP-Ⅳ每增加100 pmol/(min·ml),左室功能异常发生的风险增加10%[16]。此外DPP-Ⅳ的活性还与内皮细胞的促凝状态有关,DPP-Ⅳ水平升高,可导致血液呈高凝状态,说明其与糖尿病血管并发症有关[7]。长期的高糖毒性可使肾脏局部生长因子表达增加,导致肾脏基底膜增厚,引起肾小球结构和功能异常。研究发现伴有尿微量白蛋白增高的2型糖尿病患者其血清DPP-Ⅳ水平明显高于尿微量白蛋白正常的糖尿病患者,提示DPP-Ⅳ可能参与了糖尿病肾病的发生发展[8]。
我们的研究发现,糖尿病造模组,血清DPP-Ⅳ的水平明显升高,说明DPP-Ⅳ可能参与了糖尿病的发病,脐带血干细胞移植后糖尿病家兔血清DPP-Ⅳ的水平明显降低,由上述研究结果可以推出由DPP-Ⅳ导致的糖尿病相关的肾病、血管病变、心肌病变等并发症发病风险明显降低,但其具体机制目前仍不清楚。相信随着我们对脐带血干细胞和DPP-Ⅳ的关系研究逐渐深入,将为糖尿病及其并发症的治疗提供更多的思路和方法。
[1]Picard F,dos Santos P,Catargi B.Diabetes,obesity and heartcomplications[J].Rev Prat,2013,63(6):759-764.
[2]Butler MG,Menitove JE.Umbilical cord blood banking:anupdate[J].Jassist Reprod Genet,2011,28(8):669-676.
[3]箱凤宇,李佳佳,陈秀丽,等.脐血干细胞向不同体细胞分化的研究进展[J].生物技术通报,2012,(1):30-36.
[4]孙晓辉,王颜刚.干细胞移植定向分化为胰岛β细胞治疗糖尿病[J].中国组织工程研究与临床康复,2009,13(8):165-168.
[5]Pittenger MF,Mackay AM,Jaiswal SC,etal.Multilineage potential of mesenchymal stem cell[J].Science,1999,284(5411):143-147.
[6]Huang ZH,Tian CF.The research status of umbilical cord blood and its clinical application[J].Med Rev,2015,21(8):1375-1376.
[7]Krjnen PA,Hahn NE,Kholova L,etal.Loss of DPP4 activity is related to a prothrombogenic status of endothelial cells:implications for the coronary microvascularture of myocardial infarction patients[J].Basic Res Cardiol,2012,107(1):233-250.
[8]李文斌,崔美玉,徐冬梅,等.二肽基肽酶Ⅳ活性与糖尿病肾病的相关性[J].山东大学学报(医学版),2010,48(3):12-14.
[9]Rasekaba TM,Lim WK,Hutchinson AF.Effect of a chronic disease management service for patients with diabetes on hospitalization and acute care costs[J].Aust Health Rev,2012,36(2):205-212.
[10]张丽欣,孙丽芳,邢利和,等.脐血干细胞移植治疗2型糖尿病的研究进展[J].临床合理用药,2011,4(4C):125-127.
[11]迟作华,陆琰,张洹,等.体外诱导脐血间充质干细胞向胰岛β样细胞分化的初步研究[J].细胞生物学杂志,2008,30(3):383-386.
[12]Wang HL,Long AM,Ma Z,etal.Bone marrow mesenchymal stem cells differentiate into insulin producing cells as co-culturing with pancreatic ductal epithelial cells[J].J Practical Med Techni-ques,2010,17(3):200-202.
[13]徐谷根,杨茵,尹卓娜,等.脐带血干细胞移植治疗2型糖尿病临床分析[J].中国医药科学,2011,1(22):22-25.
[14]Zhao Y,Wang H,Mazzone T.Identification of stem cells from human umbilical cord blood with embryonic and hematopoietic characteristics[J].Exp Cell Res,2006,312(13):2454-2464.
[15]Ibegbu CC,Xu YX,Dimitri F,etal.Differential expression of CD26 on virus-specific CD8+T cells during antive,latent and resolved infection[J].Immunology,2009,126(3) :346-353.
[16]Susana R,Joaquin B,Coma-Canella I,etal.The activity of circulating dipeptidyl peptidase-4 is associated with subclinical left ventricular dysfunction in patients with type 2 diabetes mellitus[J].Cardiovas Diabetol,2013,12:143-159.
[收稿2015-12-14修回2016-02-02]
(编辑许四平)
Effection of human umbilical cord blood stem cell transplantation on serum of rabbits with type 2 diabetes mellitus
DING Hai-Xia,WANG Fu-Jun,LIU Bei,SHI Ning,DU Ya-Ping,QI Hui-Qing,DING Juan.
Department of Endocrinology,the Fourth Affiliated Hospital of Hebei Medical University,Shijiazhuang 050000,China
Objective:To observe the changes of blood glucose,insulin and dipeptidyl peptidase-Ⅳ(DPP-Ⅳ/CD26)on type 2 diabetes mellitus in rabbits after HUCBSC(human umbilical cord blood stem cells)transplantation.Methods: 18 rabbits were randomly divided into normal control group (6 rats,Group C) and diabetic model group (12 rats).After preparation model of type 2 diabetes,and 6 rats of them were treated with HUCBSC (CD45+,CD34-) transplantation by ear vein transfusion (Group A),and 6 rats were treated with PBS(Group B).All three groups of rabbits were fed for 4 weeks,and the blood glucose was monitored every day,and the level of blood insulin and DPP-IV/CD26 were measured every week.Results: The negative expression rate of CD34 in HUCBSC was 96.5%.The positive expression rate of CD45 in HUCBSC was 100%.Compared with non transplantation group,the blood glucose and DPP-IV/CD26 in the umbilical cord blood stem cell transplantation group were gradually decreased,and insulin level was gradually increased,the difference was statistically significant (P<0.01).Conclusion: HUCBSC were round or oval,with adherent growth,HUCBSC transplantation can significantly reduce blood glucose,increase insulin secretion,reduce the level of DPP-IV/CD26,the immunological phenotype of HUCBSC was CD45+,CD34-,thus providing a new theoretical basis for the clinical treatment of diabetes and its complications.
Human umbilical cord blood stem cell;Type 2 diabetes mellitus;Rabbits;Serology.
10.3969/j.issn.1000-484X.2016.10.008
丁海霞(1981年-),女,博士,主治医师,主要从事糖尿病下肢血管病变的研究。
R587.1
A
1000-484X(2016)10-1446-04
①本文为河北省卫生厅课题(No.20150760)。