异土木香内酯通过介导ROS产生及线粒体损伤诱导人宫颈癌Hela细胞凋亡①
2016-11-11于秀艳吴雪峰刘晓峰
于秀艳 李 铤 吴雪峰 刘晓峰
(吉林省肿瘤医院,长春130012)
异土木香内酯通过介导ROS产生及线粒体损伤诱导人宫颈癌Hela细胞凋亡①
于秀艳李铤吴雪峰刘晓峰
(吉林省肿瘤医院,长春130012)
目的:探讨异土木香内酯通过介导ROS产生及线粒体损伤诱导人宫颈癌Hela细胞凋亡机制。方法:不同终浓度异土木香内酯体外诱导Hela细胞24 h及加入抑制剂NAC作为实验组,以正常细胞作为对照组,MTT测定细胞活性;Hoechst 33258染色观察Hela细胞凋亡细胞核变化;流式细胞仪检测细胞凋亡及周期和ROS产生变化和MMP水平;Western blot方法测定细胞色素C蛋白、Bcl-2、Bax和半胱氨酸天冬氨酸蛋白酶(Caspase-3)蛋白表达水平。结果:异土木香内酯以浓度依赖性抑制Hela细胞生长;20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,细胞核出现典型的核固缩及核碎裂凋亡形态,细胞凋亡率增加,可抑制细胞生长于S期,细胞内均可诱导ROS的产生。ROS抑制剂NAC可以明显阻断异土木香内酯对Hela细胞生长的抑制作用,降低细胞凋亡率;20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,Bax蛋白表达水平明显增加而Bcl-2蛋白表达水平明显降低,同时Caspase-3蛋白也被活化,出现cleaved Caspase蛋白,线粒体内细胞色素C蛋白释放增加。结论:异土木香内酯在体外可通过介导ROS产生及线粒体损伤来抑制人宫颈癌Hela细胞生长且诱导其凋亡,且伴随Bax蛋白表达上调、Bcl-2蛋白表达下调及Caspase-3活化相关变化。
异土木香内酯;ROS;线粒体损伤;Hela细胞
宫颈癌是最常见的妇科恶性肿瘤,严重威胁着女性的健康及生活质量,其在我国乃至全球恶性肿瘤发病率屈居第二,全球每年死于宫颈癌的女性高达25万之多,死亡率排第四位[1]。其高发病率和死亡率与女性对宫颈癌的认知水平和预防息息相关[2]。而随着越来越多中草药植物的发现及其天然提取物药理作用的研究,特别是在抗肿瘤方面[3,4],天然提取物的研发已经备受关注。
异土木香内酯(Isoalantolactone)是从系菊科旋覆花属植物土木香(Inula helenium L)中分离出来的倍半萜内酯类化合物,具有抗炎、抗菌、抗肿瘤、驱虫、降血糖和镇痛等多种活性[5]。国内学者发现,无论是异土木香内酯自身[6,7]还是其修饰后的产物[8],都可以抑制肿瘤细胞增殖,具有一定的抗肿瘤活性。我们也报道过其抗肿瘤活性[9]。国内外[6,10]有研究发现异土木香内酯可以显著抑制体外Hela细胞增殖,并推测11,13-去氢内酯基团与其抗肿瘤活性有关系,而异土木香内酯诱导Hela细胞凋亡细胞内ROS变化和线粒体损伤机制未见报道。本研究旨在探讨异土木香内酯诱导Hela细胞凋亡细胞内ROS变化和线粒体损伤机制,以期为临床应用提供理论研究基础。
1 材料与方法
1.1主要试剂RPMI1640细胞培养液购自美国HyClone 公司;胎牛血清和胰蛋白酶购自美国Gibco公司;异土木香内酯(色谱纯度>99%)购自上海同田生物技术有限公司;MTT、DMSO购于北京鼎国生物技术有限公司;Hoechst 33258染料、Annexin V-FITC细胞凋亡检测试剂盒、细胞周期与细胞凋亡检测试剂盒、活性氧检测试剂盒、兔抗cytochrome C多克隆抗体、兔抗Bax多克隆抗体、兔抗Bcl-2多克隆抗体和兔抗多克隆Caspase-3均购自上海碧云天生物技术研究所;罗丹明123荧光染料购于Sigma公司;鼠抗β-actin单克隆抗体购自Santa Cruz公司;羊抗鼠IgG、羊抗兔IgG美国Proteintech公司;其他仪器及化学分析纯由吉林大学第二医院中心实验室提供。
1.2.1Hela细胞培养及活性测定Hela细胞由吉林大学第二医院中心实验室保存,用RPMI1640细胞培养基培养,加入双抗100 U/ml 青霉素和100 μg/ml链霉素,1 g/L 葡萄糖和L-谷氨酸,10% 的胎牛血清,细胞培养于37℃、5% CO2细胞孵箱中。每3~4 d胰蛋白酶消化传代1 次,按1∶6比例传代。
根据1983年Mosmann[11]报道的MTT法检测细胞活性。取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔1×104个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯,培养箱中孵育24 h后,MTT粉末溶解于DMEM细胞培养基中,滴加入培养有细胞的96孔板中(终质量浓度为0.5 mg/ml),37℃孵育1 h,弃掉细胞培养液,加入200 μl DMSO溶解细胞中还原的甲臜蓝颗粒,酶标仪(Thermo scientific)测定波长为570 nm处的吸光度值,参考波长为690 nm,计算细胞活性。IC50数值使用软件GraphPad Prism 5测定。
1.2.2Hoechst 33258核染实验取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔1×104个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯,培养箱中孵育24 h后,用4%多聚甲醛室温固定30 min,PBS洗涤后加入终浓度为50 μg/ml的Hoechst 33258 37℃避光孵育20 min,PBS洗涤后用荧光显微镜(Olympus 1×71)观察。
1.2.3细胞凋亡率测定取对数期生长的Hela细胞,胰酶消化后制成单细胞悬液,按每孔2×105个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯和终浓度为3 mmol/L抑制剂NAC,培养箱中孵育24 h后,收集细胞,PBS洗涤2~3次,最后使用含有5 μl Annexin V的PBS 200 μl重悬细胞,室温避光孵育10 min后,离心,弃上清,加入190 μl Annexin V-FITC结合液轻轻重悬细胞,加入10 μl碘化丙啶染色液,轻轻混匀,冰浴避光放置,随即进行流式细胞仪检测(Beckman Coulter,Epics XL)。
1.2.4细胞凋亡周期的测定取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔2×105个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯,培养箱中孵育24 h后,收集细胞,PBS洗涤。用70%乙醇4 ℃过夜固定。第二天PBS洗涤2遍,加入含有50 μg/ml PI和100 μg/ml RNase A的染色液200 μl,室温孵育30 min,流式细胞仪测定(Beckman Coulter,Epics XL)。
1.2.5活性氧(Reactive oxygen species,ROS)测定取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔2×105个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯和终浓度为3 mmol/L抑制剂NAC,培养箱中孵育24 h后,收集细胞后悬浮于稀释好的终浓度为10 μmo/L的DCFH-DA染液中,37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。PBS洗涤、离心细胞3次,以充分去除未进入细胞内的DCFH-DA,流式细胞仪测定(Beckman Coulter,Epics XL)。
1.2.6线粒体膜电位(Mitochondrial membrane potential,MMP)测定取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔2×105个细胞数接种于6孔板,第2天加入不同终浓度的异土木香内酯和终浓度为3 mmol/L抑制剂NAC,培养箱中孵育24 h后,收集细胞后加入10 μg罗丹明123,避光孵育30 min后PBS洗涤、重悬后上机测定(Beckman Coulter,Epics XL)。
1.2.7凋亡相关蛋白测定
1.2.7.1蛋白样本制备测定取对数生长期的Hela细胞,胰酶消化后制成单细胞悬液,按每孔2×105个细胞数接种于6孔板,第二天加入不同终浓度的异土木香内酯,培养箱中孵育24 h后,收集细胞。应用蛋白裂解液(30 mmol/L Tris-HCl,pH7.4,25℃,2 mmol/L EDTA,0.5 mmol/L EGTA,1 mmol/L DTT,50 mg/ml亮肽素,50 mg/ml胃蛋白酶抑制剂A,0.1 mmol/L苯甲基磺酰氟(PMSF)和50 mg/ml抑肽酶)裂解细胞,同时超声粉碎3~4次,每次3~4 s,形成细胞裂解液。用BCA方法定量计算蛋白质含量。将裂解后的细胞加入样本缓冲液(62.5 mmol/L Tris-HCl,pH7.4,4% SDS,10%丙三醇,10%β-巯基乙醇,0.002%溴酚蓝),沸水中煮6 min,-20 ℃保存。
下面我通过比喻、夸张、对比和反问四种修辞手法,分别阐述在《哈利·波特》小说的翻译过程中,修辞法准确的翻译与我们的习俗与文化相互结合帮助读者真正理解《哈利·波特》的内容,地道准确的融合提高读者对《哈利·波特》的理解力。
1.2.7.2SDS-PAGE电泳和Western blot实验按不同蛋白分子量配胶,每孔加入50 μg的蛋白进行电泳后转移到硝酸纤维素膜(NC膜)上,5%脱脂奶粉4 ℃过夜封闭;第二天TBST洗膜3次,5 min/次,抗体稀释液稀释一抗Bcl-2(1∶1 000)、Bax (1∶300)、Caspase-3(1∶1 000)、β-Actin(1∶5 000),室温摇床孵育3 h;TBST洗膜3次,5 min/次;加入辣根过氧化物酶(HRP)标记的二抗(1∶5 000),室温摇床孵育1.5 h;TBST洗膜3次,5 min/次。进入暗室操作,甩干NC膜上的液体,加入ECL化学发光底物反应5 min,压片后胶片经过显影液,双蒸水,定影液洗片曝光。

2 结果
2.1MTT实验及Hoechst 33258核染异土木香内酯对Hela的细胞毒性采用MTT方法测定。不同浓度的异土木香内酯处理Hela细胞24 h后,以浓度依赖的方式使细胞活性降低,80 μmol/L的土木香内酯可使Hela细胞活性抑制率高达80%以上,IC50抑制率浓度值为40.36 μmol/L(图1);而加入3 mmol/L抑制剂NAC可以显著提高细胞活性。20 μmol/L和40 μmol/L的土木香内酯诱导Hela细胞后,荧光显微镜可以观察到Hela细胞核出现典型的核固缩及细胞凋亡核碎裂形态(图2 箭头所示)。以上说明异土木香内酯诱导Hela细胞凋亡与ROS的产生相关。
2.2异土木香内酯可诱导Hela细胞凋亡且抑制细胞生长于S期细胞凋亡和周期是反映细胞抑制生长的两个主要条件。数据表明,用20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,与对照组(2.31±0.56)(图3A1)相比,细胞凋亡率明显增加,分别为19.56±3.41(图3A2)、48.72±4.25(图3A3),P<0.05,可诱导Hela细胞凋亡,抑制Hela细胞生长;而加入抑制剂NAC预处理后,再0加入异土木香内酯,可以有效地抑制Hela细胞凋亡(4.35±1.24)。数据也表明,异土木香内酯以浓度依赖抑制Hela细胞生长于S期。20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,S期细胞数(P<0.05)从18.43±1.34增加到28.89±1.73和41.53±1.78;而相应的G0/G1期细胞数(P>0.05)从58.18±3.63变化到58.33±1.72和59.36±0.97,G2/M期细胞数(P<0.05)从23.5±1.71递减到15.16±0.78和5.16±0.63(图4)。可以看出异土木香内酯可诱导Hela细胞凋亡依赖于ROS的产生。

图1 MTT方法测定不同浓度异土木香内酯对Hela细胞活性的影响Fig.1 MTT assay were used to test effect of different concentrations of isoalantolactone (IALT) on Hela cell viabilityNote: Compared with control group,*.P<0.05,**.P<0.01.

图2 荧光显微镜和Hoechst 33258染色观察异土木香内酯对Hela细胞诱导凋亡的细胞核变化Fig.2 Fluorescence microscope and Hoechst 33258 staining were used to observe nuclear morphological changes of apoptosis induced by isoalantolactone in Hela cellsNote: A.Control;B.20 μmol/L;C.40 μmol/L.Scale bar=20 μmol/L.
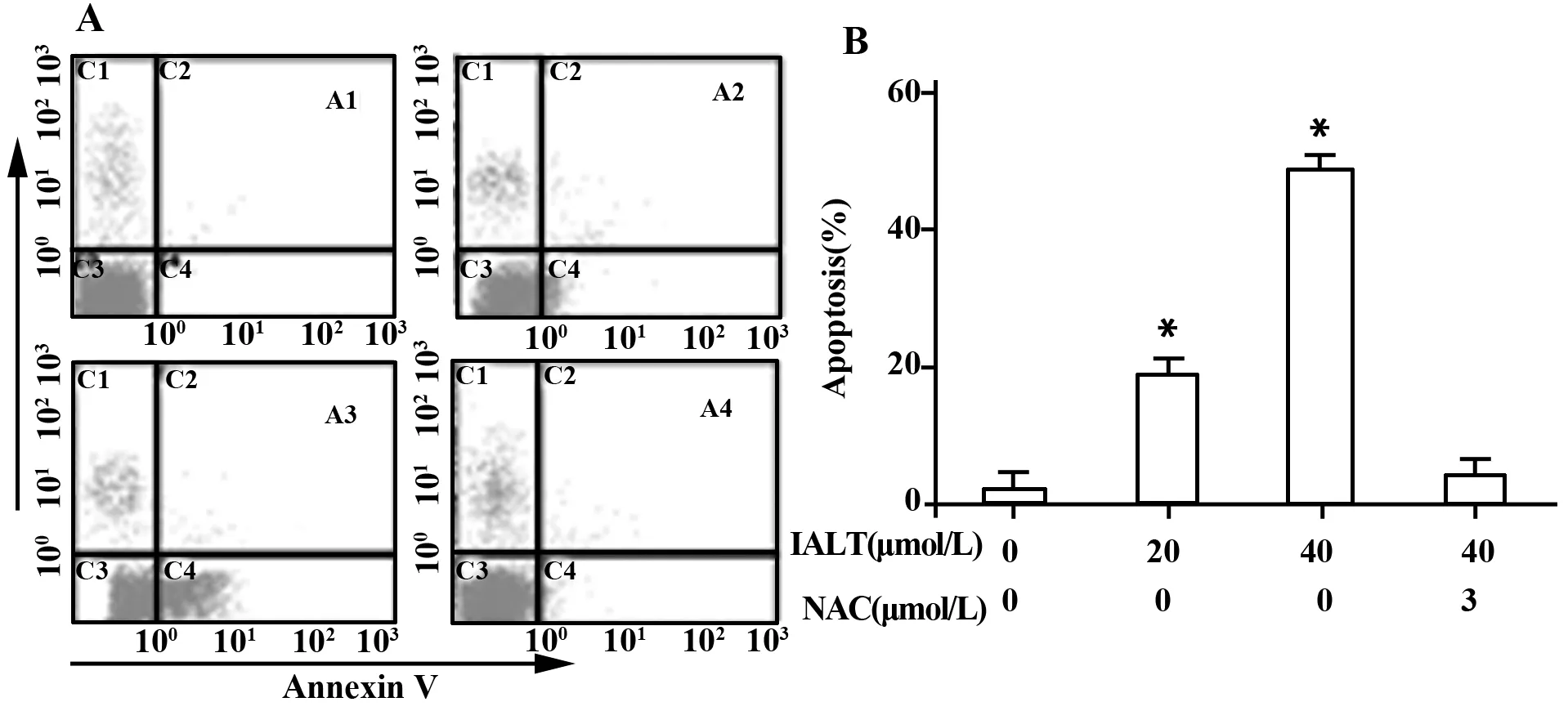
图3 流式细胞仪测定异土木香内酯诱导Hela细胞的凋亡率Fig.3 Flow cytometry analysis of apoptosis induced by isoalantolactone(IALT) in Hela cellsNote: A1.Control;A2.20 μmol/L;A3.40 μmol/L;A4.40 μmol/L isoalantolactone+3 mmol/L NAC;B.Data are showed with ±s(n=3).Compared with control group,*.P<0.05.
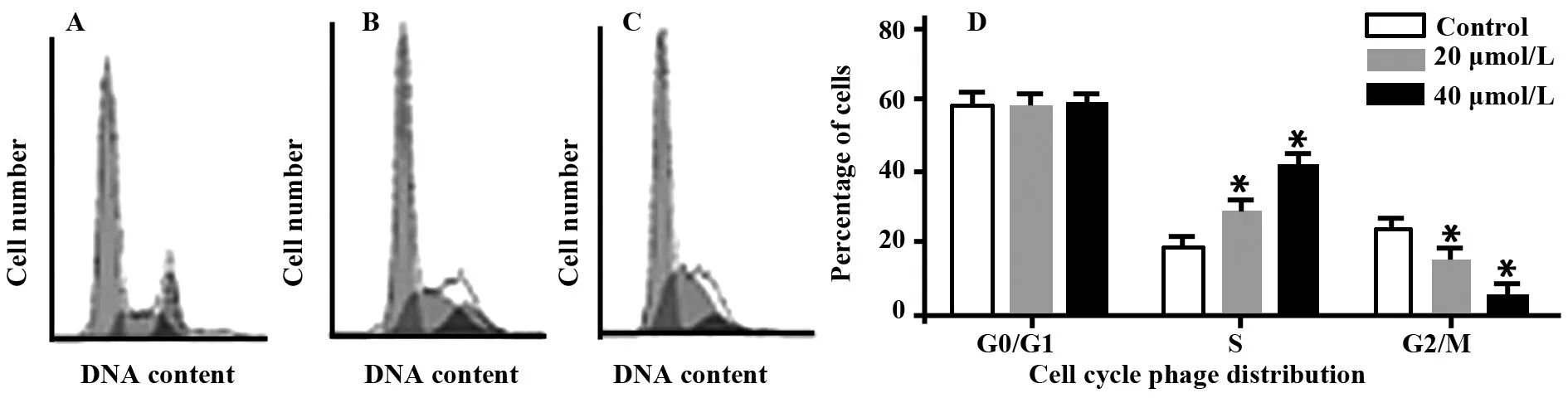
图4 流式细胞仪测定异土木香内酯诱导Hela细胞凋亡各周期分布Fig.4 Flow cytometry analysis of cell cycle phase distribution induced by isoalantolactone(IALT) in Hela cellsNote: A.Control;B.20 μmol/L;C.40 μmol/L;D.).Compared with control group,*.P<0.05.
2.3异土木香内酯可使Hela细胞内ROS生成增加Hela细胞内ROS水平通过DCFH-DA染料来测定。数据表明(图5),20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,Hela细胞内ROS水平与对照组相比有不同程度的增加,从2.02±0.47分别增加到20.63±3.45和25.14±4.70,P<0.05;而加入抑制剂NAC预处理后,再加入异土木香内酯可以明显减少ROS的产生。
2.4异土木香内酯可使Hela细胞内MMP水平降低为了测定异土木香内酯对线粒体细胞膜的损伤,我们使用罗丹明123荧光染色检测MMP水平变化。数据表明(图6),20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,Hela细胞MMP水平与对照组相比有不同程度的降低,从(93.14±0.57)%分别降低到(80.17±3.69)%和(67.32±4.41)%,P<0.05;而加入抑制剂NAC预处理后,再加入异土木香内酯可以明显提升MMP水平。
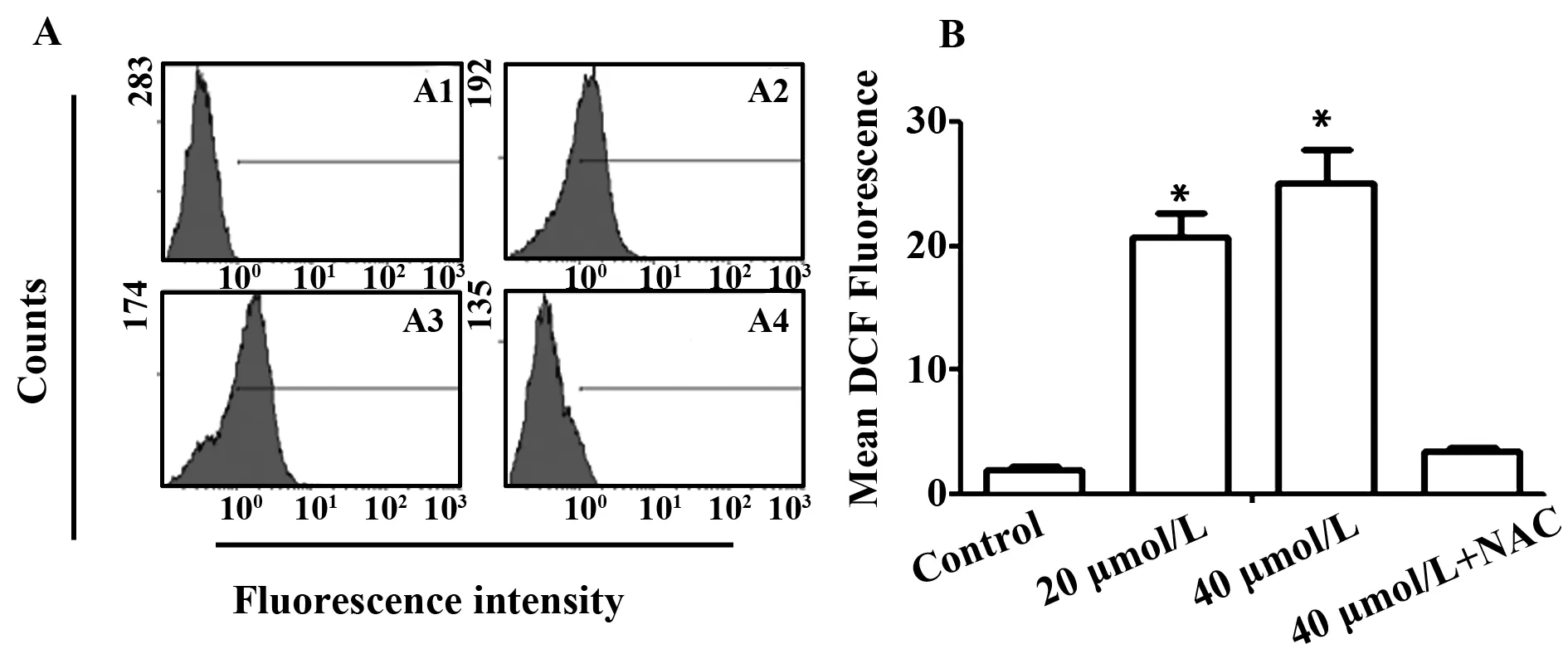
图5 流式细胞仪测定异土木香内酯诱导Hela细胞内ROS的生成Fig.5 Flow cytometry analysis of ROS generation induced by isoalantolactone(IALT) in Hela cellsNote: A1.Control;A2.20 μmol/L;A3.40 μmol/L;A4.40 μmol/L isoalantolactone+3 mmol/L NAC;B.Data are showed with ±s(n=3).Compared with control group,*.P<0.05.
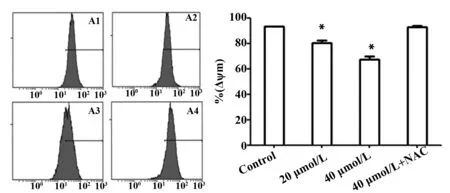
图6 流式细胞仪测定异土木香内酯诱导Hela细胞MMP水平变化Fig.6 Flow cytometry analysis of changes of mitochond-rial membrane potential induced by isoalantolactone(IALT) in Hela cellsNote: A1.Control;A2.20 μmol/L;A3.40 μmol/L;A4.40 μmol/L isoalantolactone+3 mmol/L NAC;B.Data are showed with ±s(n=3).Compared with control group,*.P<0.05.
2.5异土木香内酯诱导Hela细胞凋亡对相关蛋白的影响为了进一步测定异土木香内酯对Hela细胞凋亡的影响,我们从蛋白水平测定凋亡相关蛋白Bax、Bcl-2和Caspase-3的变化。如图6A所示,20 μmol/L和40 μmol/L终浓度异土木香内酯处理Hela细胞24 h后,Bax蛋白表达水平明显增加而Bcl-2蛋白表达水平明显降低,同时Caspase-3蛋白也被活化,细胞色素C释放增加(P<0.05)。
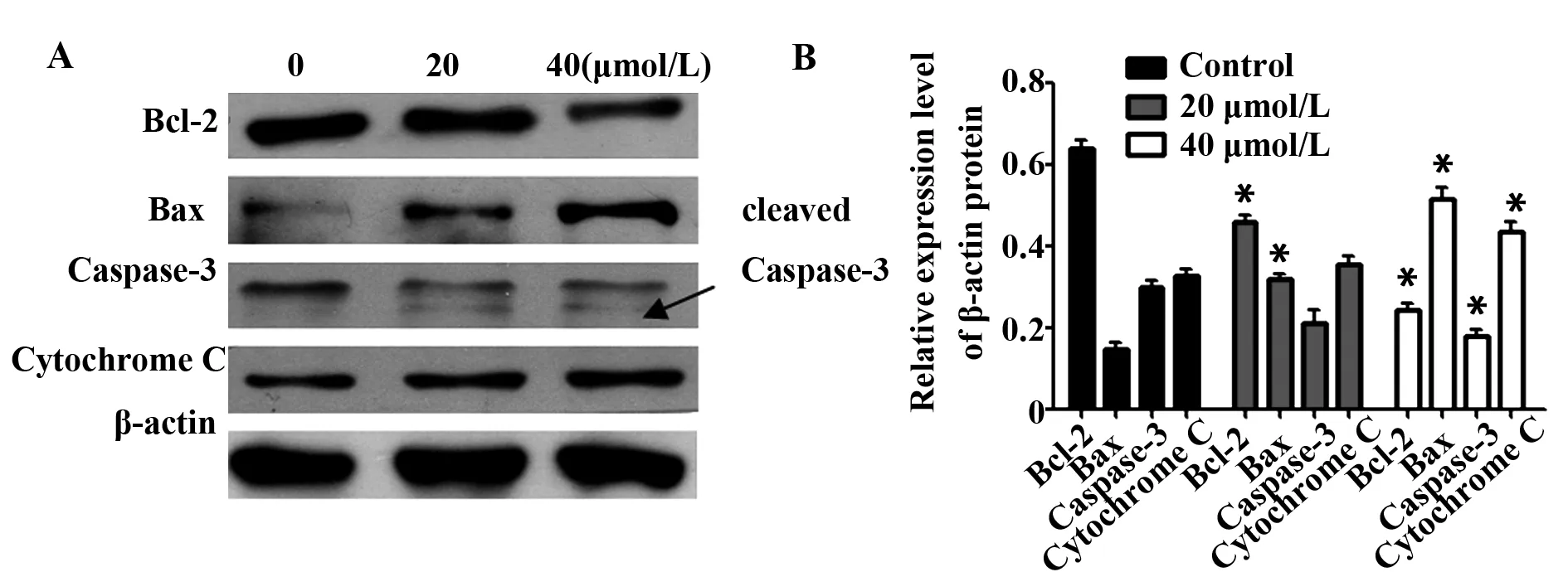
图7 免疫印迹实验测定异土木香内酯诱导Hela细胞凋亡的蛋白表达Fig.7 Protein expressions of apoptosis induced by isoalantolactone(IALT) in Hela cells were detected by Western blotNote: A.The protein expressions of Bcl-2,Bax,Caspase-3,Cytochrome C and β-actin;B.Data are showed with ±s(n=3).Compared with control group,*.P<0.05.
3 讨论
宫颈癌作为全球排名第二位的女性恶性肿瘤[12],其主要的致病因素是高危HPV持续感染导致的上皮内瘤样病变[13]。研究宫颈癌分子靶点的治疗药物仍然是当前一大热点,而天然提取物用于抗肿瘤治疗的研究也越来越广泛[14]。近年来发现的许多天然药物单体化合物如土木香内酯和表没食子儿茶素没食子酸酯等都具有良好的抗肿瘤活性[15,16]。异土木香内酯是从系菊科旋覆花属植物土木香中分离出来的倍半萜内酯类化合物单体,也具有良好的抗肿瘤活性[17],在此,我们主要研究其诱导Hela细胞凋亡的初步机制。凋亡一直是肿瘤治疗研究的热点话题[14]。从我们的实验可知,异土木香内酯抑制Hela细胞增殖呈明显的浓度依赖性。Hoechst 33258核染后,在荧光显微镜下观察到明显的细胞核固缩及核碎裂形态。流式细胞仪检测同样显示,异土木香内酯浓度增加,Hela细胞凋亡率也增加,也具有浓度依赖性;通过测定细胞周期发现,异土木香内酯可以抑制Hela细胞生长于细胞周期S期,说明异土木香内酯是通过抑制Hela细胞内DNA合成而阻滞细胞生长;且异土木香内酯诱导的Hela细胞凋亡伴随着ROS产生。ROS过多可产生氧化应激,可使线粒体膜脂质过氧化、膜蛋白氧化和DNA损伤,对线粒体膜产生损害,导致线粒体通透性增加,从而使线粒体内细胞色素C释放增加,最终导致细胞死亡[15]。我们也发现异土木香内酯可以使Hela细胞线粒体膜电位水平降低,同时也检测到大量细胞色素C从线粒体内释放到细胞质中。Caspase-3作为Caspase家族成员在凋亡中的关键酶,异土木香内酯诱导的Hela细胞凋亡也被激活,出现cleaved Caspase蛋白。ROS作为第二信使进入线粒体,可以激活线粒体内级联反应中蛋白Bcl-2家族[17]。Bcl-2家族包括抗凋亡蛋白如Bcl-2和促凋亡蛋白如Bax等蛋白,在线粒体外膜稳定性和凋亡调节中发挥重要作用,当Bcl-2/Bax蛋白比例失调后,可导致细胞凋亡[18]。本研究也发现,异土木香内酯诱导Hela细胞凋亡后,Bcl-2蛋白表达明显下降,而Bax蛋白表达明显升高。
综上所述,ROS的产生、细胞膜电位的改变和细胞色素C的释放是线粒体损伤凋亡的特征性改变,由此可见异土木香内酯是通过介导ROS产生和线粒体损伤来诱导Hela细胞凋亡的,同时伴随着上调Bax蛋白表达而下调Bcl-2蛋白表达,激活Caspase-3蛋白酶。异土木香内酯对其他肿瘤的作用及更多机制和体内药理作用有待进一步研究,有望开发成为以线粒体凋亡途径为靶点的新型抗肿瘤药。
[1]Vineis P,Wild CP.Global cancer patterns:causes and prevention[J].Lancet,2014,383(9916):549-557.
[2]Bansal AB,akhare AP,Kapoor N,etal.Knowledge, attitude,and practices related to cervical cancer among adult women:A hospital-based cross-sectional study[J].J Nat Sci Biol Med,2015,6(2):324-328.
[3]Scarpa ES,Ninfali P.Phytochemicals as innovative therapeutic tools against cancer stem cells[J].Int J Mol Sci,2015,16(7):15727-15742.
[4]Daniel M,Tollefsbol TO.Epigenetic linkage of aging,cancer and nutrition[J].J Exp Biol,2015,218(Pt 1):59-70.
[5]Cantrell CL,Abate L,Fronczek FR,etal.Antimycobacterial eudesmanolides from Inula helenium and Rudbeckia subtomentosa[J].Planta Med,1999,65(4):351-355.
[6]司亚茹,李珊珊,姜霞,等.3种倍半萜化合物抑制妇科肿瘤细胞增殖活性及其作用机制探讨[J].癌变·畸变·突变,2010,22(1):28-31.
[7]于峰,王思明,董玫,等.三种倍半萜类化合物体外抗肿瘤细胞增殖活性研究[J].天然产物研究与开发,2010,22(3):506-509.
[8]杜会静,史海明,王梦月,等.异土木香内酯及土木香内酯的结构修饰研究[J].天然产物研究与开发,2013,25(2):156-160.
[9]Khan M,Ding C,Rasul A,etal.Isoalantolactone induces reactive oxygen species mediated apoptosis in pancreatic carcinoma PANC-1 cells[J].Int J Biol Sci,2012,8(4):533-547.
[10]Konishi T,Shimada Y,Nagao T,etal.Antiproliferative sesquiterpene lactones from the roots of Inula helenium[J].Biol Pharm Bull,2002,25(10):1370-1372.[11]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Methods,1983,65(1-2):55-63.
[12]Flatley JE,Sargent A,Kitchener HC,etal.Tumour suppressor gene methylation and cervical cell folate concentration are determinants of high-risk human papillomavirus persistence:a nested case control study[J].BMC Cancer,2014,14:803.
[13]Bosch FX,Lorincz A,Muoz N,etal.The causal relation between human papillomavirus and cervical cancer[J].J Clin Pathol,2002,55(4):244-265.
[14]Kumar M, Kaur V,Kumar S,etal.Phytoconstituents as apoptosis inducing agents:strategy to combat cancer[J].Cytotechnology,2016,68(4):531-563.
[15]Khan M,Li T,Ahmad Khan MK,etal.Alantolactone induces apoptosis in HepG2 cells through GSH depletion,inhibition of STAT3 activation,and mitochondrial dysfunction[J].Biomed Res Int,2013,2013:719858.
[16]Cerezo-Guisado MI,Zur R,Lorenzo MJ,etal.Implication of Akt,ERK1/2 and alternative p38MAPK signalling pathways in human colon cancer cell apoptosis induced by green tea EGCG[J].Food Chem Toxicol,2015,84:125-132.
[17]Di W,Khan M,Rasul A,etal.Isoalantolactone inhibits constitutive NF-kappaB activation and induces reactive oxygen species-mediated apoptosis in osteosarcoma U2OS cells through mitochondrial dysfunction[J].Oncol Rep,2014,32(4):1585-1593.
[18]Farsinejad S,Gheisary Z,Ebrahimi Samani S,etal.Mitochondrial targeted peptides for cancer therapy[J].Tumour Biol,2015,36(8):5715-5725.
[收稿2016-05-29]
(编辑张晓舟)
Isoalantolactone induces apoptosis in human cervical cancer Hela cells through ROS generation and Mitochondrial dysfunction
YU Xiu-Yan,LI Ting,WU Xue-Feng,LIU Xiao-Feng.
Cancer Hospital of Jilin Province,Changchun 130012,China
Objective:To investigate the induction of apoptosis by isoalantolactone in human cervical cancer Hela cells is mediated through ROS generation and Mitochondrial dysfunction.Methods: Cells were treated with isoalantolactone in a dose-dependent manner in the presence or absence of NAC for 24 h as the experimental group,and the normal cells were used as control group.Cell viabilities were determined by the MTT assay;the nuclear morphology of Hela cells were observed under fluorescence microscope using the Hoechst 33258 staining;apoptosiscell cycle and reactive oxygen species(ROS) and mitochondrial membrane potential(MMP) were measured by flow cytometry;the protein expression levels of cytochrome C,Bcl-2,Bax and Caspase-3 were detected by Western blot.Results: In the present study,we found that isoalantolactone inhibits growth in a dose-dependent manner in Hela cells.Further studies revealed that Hela cells were treated with 20 and 40 μmol/L isoalantolactone for 24 h,after which we could observe the fragmented nuclei and the increased apoptosis rate.And we also found that isoalantolactone arrested the cell cycle at S phase and increased generation of reactive oxygen species and dissipation of mitochondrial membrane potential (ΔΨm) in Hela cells.While pretreatment with NAC obviously blocked the apoptotic and inhibition effect of isoalantolactone indicating that induction of apoptosis is ROS-dependent,Western blot study showed that isoalantolactone increased the expression of Bax and cleaved Caspase-3 and decreased the expression of Bcl-2 with concomitant release of cytochrome C from mitochondria into cytosol.Conclusion: Isoalantolactone could inhibit the proliferation and induce the apoptosis of human cervical cancer Hela cells in vitro through mediating ROS generation and Mitochondrial dysfunction,the mechanism of which is also accompanied by up-regulation of Bax expression,down-regulation of Bcl-2 expression,activation of Caspase-3 and release of cytochrome C.
Isoalantolactone;ROS;Mitochondrial dysfunction;Hela cells
10.3969/j.issn.1000-484X.2016.10.013
于秀艳(1968年-),女,硕士,主任技师,主要从事肿瘤免疫学研究,E-mail:yuxiuyan1968@sohu.com。
及指导教师:刘晓峰(1972年-),女,博士,副主任医师,主要从事肿瘤免疫学研究,E-mail:liuyang7406@sohu.com。
R737.33
A
1000-484X(2016)10-1467-06
①本论文受吉林省卫生计生委课题(20142021)资助。