类风湿关节炎患者外周血单核细胞亚群的变化及其意义①
2016-11-11于月红
钱 雷 蔺 昕 陈 玮 李 明 于月红
(滨海县人民医院检验科,盐城224500)
类风湿关节炎患者外周血单核细胞亚群的变化及其意义①
钱雷蔺昕②陈玮李明于月红
(滨海县人民医院检验科,盐城224500)
目的:本次研究通过检测类风湿关节炎(RA)患者外周血单核细胞亚群比例及其分泌促炎细胞因子的功能,探讨单核细胞亚群在RA发病过程中的作用。方法:22例RA患者(RA组)和22例健康对照者(HC组),经知情同意后抽取3 ml静脉血,肝素钠抗凝。流式细胞术(FCM)检测单核细胞亚群比例、中间型单核细胞表面HLA-DR、Toll样受体2(TLR2)和髓系细胞触发受体-1(TREM-1)表达,及其细胞内肿瘤坏死因子(TNF)-α平均荧光强度(MFI),并分析RA患者单核细胞亚群比例与血清细胞因子的相关性。正态数据分析采用Students′t-test检验。结果:与HC组相比,RA组中间型单核细胞比例升高[(4.6±1.2)% vs (11.7±1.6)%],差异有统计学意义(P<0.05);HLA-DR表达(MFI)与HC组比较差异无统计学意义(26.8±8.6 vs 30.2±6.1,P>0.05)。RA组TLR2(750.2±110.3 vs 526.8±98.6)、TREM-1(58.4±12.1 vs 40.3±10.2)表达(MFI)高于HC组,差异均有统计学意义(P<0.05);RA组中间型单核细胞胞内TNF-α(46.3±6.4 vs 36.7±8.3)MFI高于HC组,差异有统计学意义(P<0.05)。RA患者中间型单核细胞比例与DAS28评分和血清TNF-α、白细胞介素(IL)-17呈正相关,相关系数分别为0.593(P=0.003)、0.471(P=0.027) 和0.538(P=0.009)。结论:RA患者外周血单核细胞向中间型极化,并处于活化状态,高表达TLR2和TREM-1,分泌较多的促炎细胞因子TNF-α,参与RA的疾病过程。因此,抑制单核细胞向中间型极化或阻断表面受体表达可能是治疗RA的新途径。
类风湿关节炎;单核细胞亚群;Toll样受体2;髓系细胞触发受体-1
类风湿关节炎(Rheumatoid arthritis,RA) 是一种以慢性多关节滑膜炎为主要特征的自身免疫性疾病。目前普遍认为其发病机制是具有特定遗传背景的个体,在遭受外来病原体感染的过程中,抗原提呈细胞加工处理抗原多肽,在激活T淋巴细胞产生抗感染效应的同时,发生针对自身组织细胞的自身免疫应答,引起炎性介质增多,导致血管炎、滑膜增生、软骨及骨破坏,涉及固有免疫系统和适应性免疫系统在内的许多不同途径,其中包括单核细胞[1]。单核细胞通过参与病原微生物的吞噬、抗原提呈、T细胞功能调节等过程发挥重要作用。近年来,人类单核细胞分为三个亚群:经典型(CD14highCD16-)、中间型(CD14highCD16+)和非经典型(CD14lowCD16++),不同的亚群具有不同的表型和功能[2]。本次研究通过检测RA患者外周血单核细胞亚群比例及其分泌细胞因子的功能,探讨单核细胞亚群在RA发病过程中的作用。
1 材料与方法
1.1材料
1.1.1研究对象本次研究经医院伦理委员会批准(滨医伦研2014-02),参加者知情同意。选取2014年1月~2015年3月在滨海县人民医院诊断为RA患者22例(RA组),均符合2009年美国风湿病协会(ACR)和欧洲抗风湿病联盟(EULAR)修订的RA诊断标准,用药前采集标本,并进行DAS28评分。健康对照22例(HC组),无自身免疫性疾病、肿瘤或近期感染史。各组间性别、年龄比较差异无统计学意义(P> 0.05)。肘前静脉采集外周血3 ml,肝素钠抗凝,在24 h内完成检测。临床资料见表1。
1.1.2仪器和试剂异硫氰酸荧光素(FITC)鼠抗人-CD14、叶绿素蛋白偶联物(PerCP-cy5.5)鼠抗人-CD16单克隆抗体及同型对照购自BD公司,藻红蛋白(PE)-鼠抗人髓系细胞触发受体-1(TREM-1)及同型对照购自R&D公司;PE-鼠抗人Toll样受体(TLR)2、别藻蓝蛋白(APC)-鼠抗人HLA-DR和PE-鼠抗人肿瘤坏死因子-α(TNF-α)及同型对照、Fixation/Permeabilization破膜/固定剂、莫能霉素、红细胞裂解液、Perm/WashTM缓冲液购自BD公司;佛波酯(PMA)和离子霉素购自Sigma公司,流式细胞仪FACS Canto为BD公司产品。类风湿因子(RF)、C反应蛋白(CRP)采用免疫比浊法,BNProSpec特定蛋白分析仪及配套试剂检测。液相芯片检测仪为美国Luminex公司产品,血清细胞因子白细胞介素IL-6、IL-2、IL-1β、TNF-α、IL-4、IL-17检测试剂购自Bio-Rad公司。
表1研究对象临床资料
Tab.1Clinical characteristics of RA patients and control subjects

GroupsRApatientsHealthycontrolsPvalueAge(years)33.5±14.232.8±13.3>0.05Male/female5/175/17>0.05DAS285.7±1.80<0.05CRP(mg/L)15.78(1.2-22.6)0.26±0.12<0.05RF(U/ml)459±2410<0.05anti-CCPpositivity(%)72.7%0<0.05ESR(mm/h)35.1±12.310.1±3.3<0.05Monocytes(1×109L-1)0.39±0.140.31±0.09<0.05
1.2方法
1.2.1流式细胞术检测外周血单核细胞亚群比例每100 μl外周血加入10 μl FITC鼠抗人-CD14、10 μl PerCP-cy5.5鼠抗人-CD16单克隆抗体、10 μl PE-鼠抗人TREM-1(或TLR2)和10 μl APC-鼠抗人HLA-DR或其同型对照,室温避光孵育30 min,红细胞裂解液破坏红细胞后,磷酸盐缓冲液(PBS)洗涤,1 500 r/min离心6 min,弃上清,400 μl PBS重悬细胞。用 FACSCanto检测,以单核细胞设门,读取单核细胞亚群比例、TLR2、HLA-DR和TREM-1平均荧光强度(MFI)或阳性细胞频率。
1.2.2流式细胞术检测单核细胞亚群胞内TNF-α MFI取外周血100 μl,加入50 ng/ml PMA、1 μg/ml离子霉素和2.0 μmol/L莫能霉素,刺激培养 4 h,经红细胞裂解液破坏红细胞后,PBS洗涤,1 500 r/min离心6 min弃上清,100 μl PBS重悬细胞。加入10 μl FITC鼠抗人-CD14、10 μl PerCP-cy5.5鼠抗人-CD16,室温避光孵育30 min,PBS洗涤, 加入500 μl破膜/固定剂,室温避光孵育20 min,经Perm/WashTM缓冲液洗涤并重悬,100 μl细胞悬液中加入10 μl PE-鼠抗人TNF-α抗体,室温避光孵育30 min。PBS洗涤后,400 μl PBS重悬细胞。以单核细胞设门,读取单核细胞胞内TNF-α MFI。
1.2.3液相芯片检测血清细胞因子浓度外周血2 ml经1 500 r/min离心5 min,收集血浆,立即储存在-80℃冰箱。按试剂说明书检测IL-6、IL-2、IL-1β、TNF-α、IL-4、IL-17浓度,Lumine×200读取细胞因子浓度,每标本测两次,取均值。

2 结果
2.1类风湿关节炎患者单核细胞向中间型极化外周血细胞经流式抗体标记后,流式细胞仪采用前向散射光(FS)和侧向散射光(SS)区别单核细胞(图1A中R1),测定单核细胞亚群比例(图1B:R3、R4、R5分别为非经典型、中间型和经典型单核细胞)。结果见表2。
RA组中间型单核细胞亚群比例高于HC组,差异有统计学意义(P<0.05);经典型单核细胞亚群比例低于HC组,差异有统计学意义(P<0.05);非经典型单核细胞亚群比例与HC组比较差异无统计学意义(P>0.05)。
表2单核细胞亚群比例比较
Tab.2Percentage of monocyte subpopulation comparisons

GroupsRApatientsHealthycontrolstvaluePvalueClassicalmonocytes(%)77.4±7.585.2±5.33.9830.0003Intermediatemonocytes(%)11.7±1.64.6±1.216.6510.000Nonclassicalmonocytes(%)11.2±2.110.3±2.31.3550.182
2.2中间型单核细胞表面受体表达和HC组相比,RA患者中间型单核细胞TLR2、TREM-1阳性细胞频率差异无统计学意义(P>0.05);TLR2和TREM-1MFI升高,差异有统计学意义(P<0.05)。HLA-DR阳性细胞频率和MFI差异无统计学意义(P>0.05)。结果见图2和表3。
2.3 RA患者中间型单核细胞胞内高表达TNF-α外周血细胞胞内细胞因子经标记后,流式细胞仪采用FS和SS区别单核细胞(图3A中R1),以中间型单核细胞设门(图3B中R4),测定单核细胞胞内细胞因子TNF-α MFI(图3C)。
与HC组相比,RA患者外周血中间型单核细胞胞内TNF-α MFI表达明显升高(46.3±6.4 vs 36.7±8.3),差异有统计学意义(t= 4.296,P=0.000)。
表3中间型单核细胞表面受体表达比较
Tab.3Expression of surface receptor on interme-diate monocytes
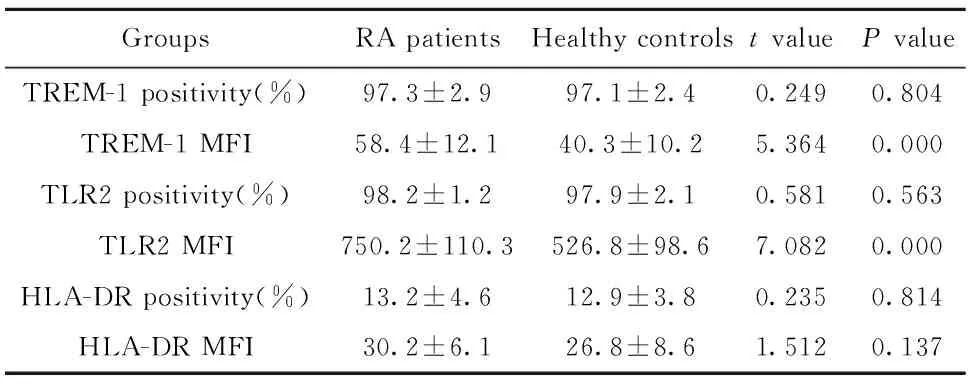
GroupsRApatientsHealthycontrolstvaluePvalueTREM-1positivity(%)97.3±2.997.1±2.40.2490.804TREM-1MFI58.4±12.140.3±10.25.3640.000TLR2positivity(%)98.2±1.297.9±2.10.5810.563TLR2MFI750.2±110.3526.8±98.67.0820.000HLA-DRpositivity(%)13.2±4.612.9±3.80.2350.814HLA-DRMFI30.2±6.126.8±8.61.5120.137

图1 单核细胞亚群检测Fig.1 Analysis of monocytes subsetsNote: A.Monocytes were gated based on FS and SS;B.Monocyte subsets in healthy controls;C.Monocyte subsets in patients with RA.

图2 中间型单核细胞亚群表面受体检测Fig.2 Expression of cell surface molecules on intermedi-ate monocyteNote: A.Expression of monocytes TREM-1;B.Expression of monocytes HLA-DR;C.Expression of monocytes TLR2.

图3 中间型单核细胞内TNF-α表达Fig.3 Expression of TNF-α in intermediate monocyteNote: A.Monocytes were gated based on FS and SS;B.The subsets of intermediate monocytes;C.TNF-α MFI in intermediate monocytes.

图4 RA患者中间型单核细胞亚群与临床指标相关性分析Fig.4 Relationship of certain markers with intermediate monocyte of RA patientsNote: A.Correlation of intermediate monocyte percentage and serum TNF-α;B.Correlation of intermediate monocyte percentage and DAS28;C.Correlation of intermediate monocyte percentage and IL-17.
表4血清细胞因子浓度比较(pg/ml)
Tab.4Comparison of serum cytokine concentrations

CytokineRApatientsHealthycontrolsIL-671.5(48.3-116.4)1)10.4(9.3-18.5)IL-218.3(11.4-28.1)1)11.5(8.2-18.5)IL-1β52.1(33.1-74.2)1)24.6(23.2-28.6)TNF-α31.5(14.4-62.8)1)12.4(12.3-13.8)IL-419.2(15.1-27.3)18.9(14.6-22.4)IL-1728.3(11.5-38.7)1)17.2(6.5-29.3)
Note:The skewed date were presented as medians (M,25-75 percentile).Statistical significance was determined by the Mann-WhitneyU-test,1)P<0.05 RA group vs HC group.
2.4RA患者中间型单核细胞比例与临床数据相关性分析液相芯片检测血清细胞因子浓度(见表4),免疫比浊法检测CRP、RF(见表1),分析中间型单核细胞比例与临床数据相关性。
RA患者中间型单核细胞比例与DAS28评分和血清TNF-α、IL-17呈正相关,相关系数分别为0.593(P=0.003)、0.471(P=0.027) 和0.538(P=0.009),与血清IL-6、IL-4、IL-1β、CRP、IL-2浓度不相关,相关系数分别为0.031 (P=0.235)、0.012(P=0.478)、0.029 (P=0.296)、0.019(P=0.430)、0.017(P=0.515)。见图4。
3 讨论
RA是辅助性T淋巴细胞Th1/Th17为核心介导的免疫系统功能紊乱性疾病,B淋巴细胞、γδT淋巴细胞、单核细胞等免疫细胞也在疾病过程中发挥重要作用。RA患者滑膜组织有大量活化的CD4+T淋巴细胞和MHCⅡ阳性的抗原提呈细胞(APC)浸润,其中包括单核巨噬细胞。早期的研究将单核细胞分为CD14+CD16-和CD14+CD16+两种单核细胞亚群[3]。近年来第三类在表型和功能上具有异质性的单核细胞亚群(CD14highCD16+) 被发现[4]。2010年国际免疫学会命名委员会将人类循环中单核细胞分为三种类型:经典型(CD14highCD16-)、中间型(CD14highCD16+)和非经典型(CD14lowCD16++)[2],分别约占外周血单核细胞的85%、5%和10%左右。
三个亚群在表型、功能及炎症活化潜能方面存在着明显的差异[4]。经典型单核细胞具有很强的吞噬功能;非经典型单核细胞高表达细胞骨架能动性相关基因,能识别炎症信号并迅速迁移到炎症部位,浸润组织后分化为巨噬细胞;中间型单核细胞活化后能产生大量促炎细胞因子,因此具有较高的活化炎症反应的潜能;并高表达编码MHCⅡ类分子相关基因(如HLA-DR和CD74),具有较强的抗原提呈和加工能力,促进T细胞活化、增殖,并促进血管生成[5]。
本次研究发现,与健康对照者相比,RA患者中间型单核细胞比例升高。与此研究一致的是,中间型单核细胞在子痫前期、动脉粥样硬化、川崎病、脓毒性休克、多发性硬化症、Ⅰ型糖尿病等多种自身免疫性和感染性疾病过程中升高,且与病情的严重性相关[6,7]。因此,中间型单核细胞增加可能是自身免疫性和感染性疾病的普遍现象,并在疾病过程中发挥重要的致病作用。
Toll 样受体(Toll-like receptors,TLRs)是一类表达于细胞表面的模式识别受体(Pattern recognition receptor,PRR),可识别病原相关分子模式(Pathogen-associated molecular patterns,PAMPs)。RA患者关节滑液中的成纤维细胞及巨噬细胞TLR2表达升高[8],通过活化RA患者关节滑液中成纤维细胞TLR2,可增加TNF-α、IL-1β和IL-8、基质金属蛋白酶(MMPs)以及其他促炎因子的表达[9]。在RA患者病变组织中含有TLR2的内源性配体。本次实验证实,RA患者外周血中间型单核细胞高表达TLR2,与此研究一致的是,Iwahashi[10]早期研究表明,RA患者外周血CD14+CD16+单核细胞TLR2表达明显上升。TREM-1是一种能激发和放大炎症反应的受体,经配体活化后,促进单核细胞分泌促炎症细胞因子,如TNF-α、IL-1β、IL-6、粒-巨噬细胞集落刺激因子(GM-CSF)、IL-8及单核细胞趋化因子-1(MCP-1)等[11]。本次实验证实,RA患者外周血中间型单核细胞高表达TREM-1。与此研究一致的是,RA小鼠经编码TREM-1细胞外结构域和IgG-Fc的融合基因的腺病毒重组体治疗后,血清炎症因子IL-17、TNF-α、IL-1β水平显著降低,关节面炎症细胞浸润减少,关节病变明显改善[12]。通过阻断败血症鼠模型TREM-1的信号转导通路,不仅能减少炎症因子的产生,同时不降低机体清除病原体的能力[13]。因此,TREM-1可能是RA等疾病治疗的新靶点。
本次实验通过胞内染色证实,RA患者中间型单核细胞高表达TNF-α。通过分析RA患者中间型单核细胞比例与外周血细胞因子TNF-α、IL-17的相关性得到了一致的结论。TNF-α可通过诱导微静脉表达细胞间黏附分子(ICAM-1)和淋巴细胞功能相关抗原(LFA)3,促使中性粒细胞、巨噬细胞聚集,从而参与RA疾病的发生发展。RA患者血清、关节滑液中TNF-α在疾病活动期升高显著,且与RA临床表现相关[14]。IL-17是一种主要由CD4+T淋巴细胞、嗜酸性粒细胞等分泌的促炎性细胞因子,具有强大的募集中性粒细胞及促进多种炎性因子释放的作用,在类风湿关节炎的发病机制中起重要作用[15],针对TNF-α、IL-17的生物制剂对部分患者有肯定的疗效。
本次实验发现中间型单核细胞比例与RA患者DAS28评分具有相关性,说明中间型单核细胞参与RA的发生发展。目前有较多研究通过减少患者体内中间型单核细胞治疗自身免疫性和感染性疾病。用吸附法去除中间型单核细胞可明显改善泛发性脓疱性银屑病患者的临床症状[16]。研究表明,中间型单核细胞是一类比较成熟的单核细胞,可分化为树突状细胞(DC),具有较强的抗原提呈和加工能力[17]。因此,中间型单核细胞可能是部分自身免疫性和感染性疾病的治疗靶点。
综上所述,本次研究表明,RA患者外周血经典型单核细胞比例降低,中间型单核细胞比例升高,并高表达TLR2和TREM-1,分泌较多的促炎细胞因子TNF-α,参与RA的疾病过程。但RA患者中间型单核细胞极化和活化的机制尚不完全清楚。因此,调控RA患者单核细胞极化和细胞表面受体的表达可能是治疗RA的新途径。
[1]Smilek DE,Ehlers MR,Nepom GT.Restoring the balance:immunotherapeutic combinations for autoimmune disease[J].Dis Model Mech,2014,7(5):503-513.
[2]Ziegler-Heitbrock L,Ancuta P,Crowe S,etal.Nomenclature of monocytes and dendritic cells in blood[J].Blood,2010,116(16):e74-80.
[3]Passlick B,Flieger D,Ziegler-Heitbrock HW,etal.Identification and characterization of a novel monocyte subpopulation in human peripheral blood [J].Blood,1989,74(7):2527-2534.
[4]Wong KL,Tai JJ,Wong WC,etal.Gene expression profiling reveals the defining features of the classical,intermediate,and nonclassical human monocyte subsets[J].Blood,2011,118(5):e16-31.
[5]Rogacev KS,Seiler S,Zawada AM,etal.CD14(++)CD16(+) monocytes and cardiovascular outcome in patients with chronic kidney disease [J].Eur Heart J,2011,32(1):84-92.
[6]Melgert BN,Spaans F,Borghuis T,etal.Pregnancy and preeclampsia affect monocyte subsets in human and rats[J].PLos One,2012,7(9):e45229-45239.
[7]Pul R,Morbiducci F,Skuljec J,etal.Glatiramer acetate increases phagocytic activity of human monocytes in vitro and in multiple sclerosis patients[J].PLos One,2012,7(12):e51867-51878.
[8]Ospelt C,Brentano F,Jüngel A,etal.Expression,regulation,and signaling of the pattern-recognition receptor nucleotide-binding oligomerization domain 2 in rheumatoid arthritis synovial fibroblasts[J].Arthritis Rheum,2009,60(2):355-363.
[9]Saber T,Veale DJ,Balogh E,etal.Toll-like receptor 2 induced angiogenesis and invasion is mediated through the Tie2 signalling pathway in rheumatoid arthritis [J].PLoS One,2011,6(8):e23540-23551.[10]Iwahashi M,Yamamura M,Aita T,etal.Expression of Toll-like receptor 2 on CD16+blood monocytes and synovial tissue macrophages in rheumatoid arthritis[J].Arthritis Rheum,2004,50(5):1457-1467.
[11]Qian L,Weng XW,Chen W,etal.TREM-1 as a potential therapeutic target in neonatal sepsis[J].Int J Clin Exp Med,2014,7(7):1650-1658.
[12]Tency I,Verstraelen H,Saerens B,etal.Elevated soluble triggering receptor expressed on myeloid cells (sTREM)-1 levels in maternal serum during term and preterm labor[J].PLoS One,2013,8 (2):e56050-56061.
[13]Palazzo SJ,Simpson T,Schnapp LM.Triggering receptor expressed on myeloid cells type 1 as a potential therapeutic target in sepsis[J].Dimens Crit Care Nurs,2012,31(1):1-6.
[14]Wei ST,Sun YH,Zong SH,etal.Serum levels of IL-6 and TNF-α may correlate with activity and severity of rheumatoid arthritis[J].Med Sci Monit,2015,21(4):4030-4038.
[15]Azizi G,Jadidi-Niaragh F,Mirshafiey A.Th17 Cells in Immunopathogenesis and treatment of rheumatoid arthritis[J].Int J Rheum Dis,2013,16(3):243-253.
[16]Fujisawa T,Murase K,Kanoh H,etal.Adsorptive depletion of CD14+CD16+proin ammatory monocyte phenotype in patients with generalized pustular psoriasis:clinical ef cacy and effects on cytokines[J].Ther Apher Dial,2012,16(5):436-444.
[17]Qu C,Brinck-Jensen NS,Zang M,etal.Monocyte-derived dendritic cells:targets as potent antigen presenting cells for the design of vaccines against infectious diseases[J].Int J Infect Dis,2014,19(2):1-5.
[收稿2016-01-05修回2016-03-04]
(编辑倪鹏)
Abnormality and significance of monocyte subsets in peripheral blood of patients with rheumatoid arthritis
QIAN Lei,LIN Xin,CHEN Wei,LI Ming,YU Yue-Hong.
Department of Laboratory Medicine,Binhai County People′s Hospital,Yancheng 224500,China
Objective:To explore the role of peripheral blood monocyte subsets in the pathogenesis of rheumatoid arthritis (RA),we therefore decided to compare the percentage of monocyte subpopulations in peripheral blood,as well as cytokines secretion function,to that of healthy controls.Methods: 22 patients with RA and 22 cases of healthy controls (HC) were drew 3 ml fresh venous blood into a tube containing heparin.The percentage of monocyte subsets,expression of Toll-like receptor(TLR)2,HLA-DR,triggering receptor expressed on myeloid cells-1(TREM-1) on intermediate monocyte and mean fluorescence intensity(MFI) of intracellular tumor necrosis factor-α (TNF-α) were evaluated with the methods of flow cytometry ( FCM ).The correlation between percentage of monocyte subsets and serum cytokines was explored.Statistical significance between parametric data was determined by the students′t-test.Results: Compared to HC controls,the percentages of intermediate monocytes were significant higher in RA patients [(11.7±1.6)% vs (4.6±1.2)%,P<0.05],as well as the expression(MFI) of TLR2 (750.2±110.3 vs 526.8±98.6) and TREM-1 (58.4±12.1 vs 40.3±10.2) on intermediate monocytes (P<0.05).The expression of HLA-DR on intermediate monocytes of RA patients had no difference with HC controls (P>0.05),while MFI of intracellular TNF-α in intermediate monocytes of RA patients were significant higher than that of HC controls (46.3±6.4 vs 36.7±8.3,P<0.05).In addition,RA patients showed a positive correlation between the percentage of CD14highCD16+monocytes and DAS28 scores(r=0.538,P=0.009),as well as the serum levels of TNF-α,IL-17 (r=0.471,P=0.027;r=0.593,P=0.003).Conclusion: Monocyte subpopulations from RA patients are abnormally skewed toward to intermediate monocytes which has high expression of TLR2 ,TREM-1 and the function of TNF-α secretion.Therefore,intermediate monocytes may play a role in the pathophysiology of RA.By modulating polarization or blocking monocyte cell surface receptors could be a new treatment of RA.
Rheumatoid arthritis;Monocyte subsets;Toll-like receptor 2;Triggering receptor expressed on myeloid cells-1
10.3969/j.issn.1000-484X.2016.10.023
,南京医科大学附属南京医院检验科/南京市第一医院,E-mail:x.lin007@163.com。
钱雷(1970年-),男,硕士,主任技师,主要从事免疫学相关研究,E-mail:qianleiyou@163.com。
R392.8
A
1000-484X(2016)10-1519-06
①本文为盐城市自身免疫性疾病诊治创新团队项目(YCWJ-2015012)。