Wnt3a调控大鼠骨髓间充质干细胞向胆碱能神经元分化的实验研究
2016-11-11王淑辉王薇张海廷程杉尚延昌张拥波李继梅
王淑辉 王薇 张海廷 程杉 尚延昌 张拥波 李继梅
·论著·
Wnt3a调控大鼠骨髓间充质干细胞向胆碱能神经元分化的实验研究
王淑辉王薇张海廷程杉尚延昌张拥波李继梅
目的探讨经典Wnt/β-catenin通路对大鼠MSCs在体外分化为神经元和胆碱能神经元的调节作用。方法取SD大鼠股骨和胫骨的骨髓,利用差速贴壁法分离、扩增及纯化MSCs,绘制生长曲线;应用免疫荧光和Western-Blot的方法检测Wnt3a处理后β-catenin蛋白的分布变化;取第4代MSCs分为3组;A组为空白对照组,用空白DMEM培养基培养细胞;B组为诱导分化对照组,用含100 ng/mL碱性成纤维细胞生长因子(basic fibroblast grown factor, bFGF)、5 umol/L维甲酸(retinoic acid, RA)的DMEM诱导培养基培养细胞;C组为Wnt3a诱导分化组,在上述诱导培养基中加入50 ng/mL Wnt3a培养细胞;用形态学观察和Western-Blot的方法比较各组对MSCs向神经元及胆碱能神经元分化的影响;应用形态学观察和Western-Blot的方法比较各组对MSCs向神经元及胆碱能神经元分化的影响。结果利用差速贴壁法细胞传至P3代时形态趋于一致,呈均匀分布生长。P3代细胞的生长曲线显示,接种后的第1、2 d细胞处于潜伏期;第3、4 d细胞进入对数生长期;第5 d进入平台期。P4代细胞高度表达CD29和CD44(阳性率分别为99.9%和73.2%)。Wnt3a处理组细胞的β-catenin在细胞核的分布较对照组细胞显著增多(P<0.01)。诱导分化细胞组中A组细胞可检测到少量神经元的标记物,但未检测到胆碱能神经元的标志物,B组和C组细胞均可检测到神经元和胆碱能神经元的标志物,B组和C组分化为神经元的比例较A组显著增高(P<0.01);C组分化为胆碱能神经元的比例较B组显著增高(P<0.01)。结论Wnt3a能够促进MSCs内的β-catenin的核转移激活经典Wnt信号通路,促进体外培养的MSCs向胆碱能神经元分化。
骨髓间充质干细胞Wnt3a胆碱能神经元阿尔茨海默病
阿尔茨海默病(Alzheimer’s disease, AD)又称为老年性痴呆,严重影响了老年人的生活能力。流行病学调查显示65岁以上人群中AD的发病率为5%~10%,85岁以上的老年人中发病率增长为25%[1]。随着我国人口老龄化的发展,AD的患病率将逐渐增高,成为威胁人类生命健康的主要疾病之一。
AD的主要病理特征是β淀粉样蛋白(amyloid-β protein, Aβ)聚集成的老年斑(senile plaque, SP)和过度磷酸化的微管相关蛋白tau蛋白组成的神经纤维缠结(neurofibrillary tangle, NFT),两者的存在均会产生神经毒性,最终导致海马神经元的大量缺失。在AD早期内源性海马神经前体细胞分裂、增殖、分化为成熟神经元来补充缺失的海马神经元,具有一定的自我修复作用,可以对抗疾病进展[2]。但疾病后期新生的海马神经元数量不断减少,不能得到代偿,最终出现临床症状。如果能纠正海马神经元的缺失,恢复其正常生理结构,将对改善AD症状有重要意义[3]。
骨髓间充质干细胞(mesenchymal stem cells, MSCs)是一类来源于骨髓的多能干细胞,具有自我更新及多向分化的潜能,目前已成为研究干细胞移植治疗多种疾病的种子细胞。已有研究表明MSCs在特定微环境下能分化为神经干细胞及多种有功能的神经元,并能通过移植改善AD大鼠模型的认知功能。如何调控MSCs向神经干细胞及特定神经元分化成为了研究的难点[4]。相关研究表明Wnt信号通路在神经发生中起着重要的作用[5]。
本实验通过体外分离及培养SD大鼠的MSCs,利用Wnt3a蛋白及其他诱导分子对MSCs进行干预,观察Wnt3a对MSCs向神经元及胆碱能神经元分化的影响,为干细胞移植治疗阿尔茨海默病提供一定的实验及理论依据。
1 材料与方法
1.1SD大鼠MSCs的培养、扩增
5周健康雄性SD大鼠购自北京维通利华实验动物技术有限公司;引颈处死大鼠,无菌条件下分离出大鼠的股骨和胫骨,显露骨髓腔;用10 mL注射器吸取含10%胎牛血清的DMEM培养基,冲出骨髓腔中的细胞,制成单细胞悬液,接种于底面积为25 cm2的培养瓶中,置于37℃,5%CO2饱和湿度培养箱中培养;48 h后首次全量换液,以后每3 d全量换液1次,7 d左右细胞生长至融合;融合后按1∶2或1∶3比例进行传代培养;其后一般3 d传代1次。
1.2细胞生长曲线的绘制
取生长良好的P3代MSCs,消化后按3×104/孔接种于24孔板中,分7组,每组各3个孔;37℃,5%CO2饱和湿度培养箱中培养7 d,其间逐日计数一组细胞,取均值,将7 d所得数值绘制成细胞的生长曲线。
1.3流式细胞仪检测细胞的表面标志物
取生长良好的P4代MSCs,用0.25%胰酶+0.03%EDTA消化后离心,PBS洗3次,MSCs中加入饱和浓度FITC标记的CD11b、CD29、CD44、CD45抗体,室温下避光孵育30 min,再用PBS清洗去除未结合抗体,10 g/L多聚甲醛固定15 min,流式细胞仪检测细胞表面抗原表达。
1.4β-catenin蛋白细胞内分布检测
取生长良好的P4代MSCs分为2组,1组为空白对照组,含10%FBS的DMEM培养基培养细胞;2组为Wnt3a组,用含50 ng/ml Wnt3a蛋白和10%FBS的DMEM培养基培养细胞,用间接免疫荧光和Western-Blot检测β-catenin蛋白的分布变化。抗β-catenin抗体购于英国Abcam公司。
1.5MSCs向神经元及胆碱能神经元细胞的诱导分化检测
取生长良好的P4代MSCs分为3组,A组为空白对照组,用空白DMEM培养基培养细胞;B组为诱导分化对照组,用含100 ng/ml bFGF、5 umol/L RA的DMEM诱导培养基培养细胞;C组为Wnt3a诱导分化组,在上述诱导培养基中加入50 ng/mLWnt3a蛋白培养细胞。上述3组细胞培养过程中每3 d换液1次,每天于倒置显微镜下观察各组细胞形态的变化并照相;应用Western-Blot方法鉴定神经元特异性核蛋白(neuron-specific nuclear protein, NeuN)和胆碱乙酰基转移酶(choline acetyltransferase, ChAT)的表达;抗ChAT抗体和抗NeuN抗体均购于英国Abcam公司。
1.6 统计学处理
采用SPSS 18.0进行统计学分析,对于正态分布资料使用均数±标准差表示其平均水平。2组均数的比较采用两独立样本的t检验,各组均数的比较采用单因素方差分析(ANOVA),以P<0.05表示差异具有统计学意义。
2 结 果
2.1MSCs的形态学及生长特点
利用差速贴壁法进行MSCs原代培养,接种4 h后细胞开始贴壁, 48 h后大量MSCs贴壁,形态为多角形或梭形,7 d左右细胞生长至融合后可传代。原代和P1代细胞呈克隆样生长,一般传代后3 d细胞生长至融合,P2代以后细胞呈均匀分布生长,细胞传至P3代时形态趋于一致,呈短梭形。细胞传至P6、P7代时生长变得缓慢。本研究应用P4代细胞进行后续实验(图1)。

图1 MSCs形态学检测(100×倍)
P3代MSCs生长曲线显示,接种后的第1、2 d细胞处于潜伏期,增殖缓慢;第3、4 d细胞进入对数生长期,增殖旺盛;第5 d进入平台期,增殖减慢(图2)。

图2 SD大鼠MSCs的生长曲线
2.2MSCs表面标志物的检测
经流式细胞仪检测,体外传代培养的P4代细胞具有较好的均一性。其中绝大部分细胞CD11b、CD34和CD45表达为阴性(阳性率分布为6.6%、4.6%、1.9%),高度表达CD29和CD44,两者阳性率分别为99.9%和73.2%(图3)。

图3 流式细胞仪检测P4代MSCs的表面抗原标志
2.3Wnt3a蛋白处理MSCs细胞后胞内β-catenin的分布变化
应用含50 ng/mL Wnt3a蛋白和10%FBS的DMEM培养基培养MSCs48 h后间接免疫荧光显示Wnt3a组在细胞核的位置可见β-catenin的聚集(图4),而对照组未见β-catenin在细胞核位置聚集。为进一步验证上述结果,采用蛋白核质分离Western-Blot结果显示,经Wnt3a处理48 h后胞核内的β-catenin的含量较对照组显著增多,对照组和实验组胞核内β-catenin/HDAC的比值分别为0.541±0.157和1.181±0.158。2组之间有明显差异(P<0.01)(图5)。
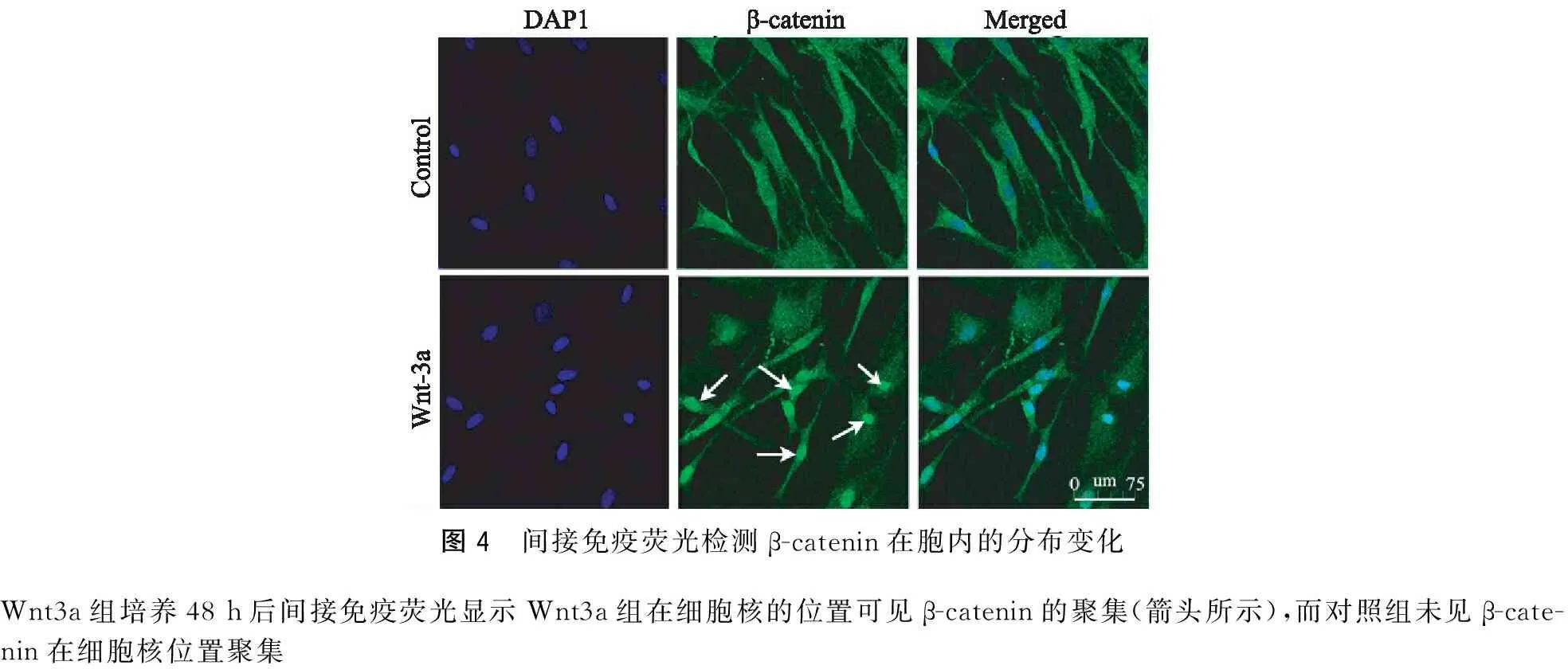
图4 间接免疫荧光检测β-catenin在胞内的分布变化Wnt3a组培养48h后间接免疫荧光显示Wnt3a组在细胞核的位置可见β-catenin的聚集(箭头所示),而对照组未见β-cate-nin在细胞核位置聚集

图5 Western-Blot检测细胞蛋白核质分离后β-catenin的水平与空白对照组比较,**P<0.01
2.4MSCs向神经元及胆碱能神经元诱导分化的检测
将P4代MSCs经不同诱导培养基进行诱导分化7 d后形态学观察显示空白对照组细胞呈梭形,诱导分化对照组和Wnt3a诱导分化组细胞长出突起,呈神经元样细胞,而Wnt3a诱导分化组细胞形态学变化更明显(图6)。

图6 MSCs的诱导分化细胞形态改变(200×倍)
诱导分化12 d后应用Western-Blot检测发现,空白对照组可见少量NeuN的表达而未见ChAT的表达,诱导分化对照组和Wnt3a诱导分化组均可见NeuN和ChAT的表达。空白对照组、诱导分化对照组和Wnt3a诱导分化组的NeuN/actin的比值分别为0.218±0.012、0.712±0.042和0.736±0.039,空白对照组与诱导分化对照组,空白对照组与Wnt3a诱导分化组之间有明显差异(P<0.01),而诱导分化对照组与Wnt3a诱导分化组之间无明显差异。Wnt3a诱导分化组较诱导分化对照组的ChAT表达增多,2组ChAT/actin的比值分别为0.208±0.018和0.112±0.012,两组之间有明显差异(P<0.01)(图7)。
3 讨 论
本研究发现,利用差速贴壁法分离纯化的MSCs细胞传至P3代时形态趋于一致,呈均匀分布生长。生长曲线显示接种后的第1、2 d细胞处于潜伏期;第3、4 d细胞进入对数生长期;第5 d进入平台期。P4代细胞高度表达CD29和CD44。应用Wnt3a处理MSCs后细胞浆中β-catenin转移至细胞核,细胞形态发生显著变化,NeuN和ChAT的表达显著增多。上述研究发现Wnt3a能够促进体外培养的MSCs向胆碱能神经元分化。
MSCs具有自我更新及多向分化的潜能,在不同的微环境下可以分化为骨细胞、软骨细胞、脂肪细胞和神经元等多种细胞[6],因此被认为是细胞移植治疗多种疾病的种子细胞[7]。但骨髓中MSCs的含量很低,约占细胞总数的0.001%~0.01%。本实验通过差速贴壁法成功分离培养了MSCs,并对其进行了鉴定,P4代经流式细胞仪检测细胞具有较好的均一性,表达CD29和CD44,而不表达CD11b、CD34和CD45,符合MSCs的特点。细胞生长曲线显示传代后第3、4 d细胞处于对数生长期,增殖旺盛[8]。
已有研究表明MSCs在适当条件下能在体内外诱导分化为多种类型的神经元。但MSCs向神经元分化的调控机制尚未明确。研究表明Wnt信号通路对MSCs的分化有一定的调控作用[9-10]。根据细胞内β连环蛋白(β-catenin)是否参与信号通路,将Wnt信号传导通路分为经典Wnt信号传导通路和非经典Wnt信号传导通路。其中Wnt3a蛋白与细胞膜上的相应受体结合,可以激活经典Wnt信号通路,促进未被磷酸化的β-catenin入核并启动靶基因的转录,产生多种细胞效应[11]。Ping 等分离正常人及AD患者皮层的胶质祖细胞(glial progenitor cells, GPCs),研究这些细胞分化为神经元的能力,发现相对于正常人,AD患者的GPC自我更新能力及神经发生能力明显下降,AD患者的GPC中有功能的β-catenin水平显著下降,而即将降解的磷酸化的β-catenin水平增高[12]。表明经典Wnt信号通路对AD患者的神经发生具有一定的调节作用。Wexler 等应用锂剂来激活Wnt通路,能够刺激成年小鼠体内海马前体细胞增殖,并能促进海马前体细胞分化为表达微管相关蛋白β-Ⅲ-Tubulin (Tuj1) 的神经元[13]。本实验通过加有Wnt3a蛋白的培养基培养细胞,细胞免疫荧光和Western-Blot检测均证实了Wnt3a蛋白可以促进MSCs的β-catenin入核,说明Wnt3a蛋白可以激活MSCs的经典Wnt信号通路。
通过维甲酸等的诱导作用MSCs可以分化为胆碱能神经元,且分化的胆碱能神经元Wnt3a蛋白表达增加[14]。本实验采取了维甲酸和碱性成纤维细胞因子联合诱导MSCs向胆碱能神经元分化的方法,Wnt3a组另外加入Wnt3a蛋白诱导分化,结果表明3组均有神经元标记物的表达,表明MSCs培养过程中可能存在自然分化现象,但其分化量远少于诱导分化组。相对于空白对照组,维甲酸和碱性成纤维细胞因子联合诱导可以使MSCs向胆碱能神经元分化,并且Wnt3a组对MSCs分化为胆碱能神经元有促进作用。Wnt3a蛋白可以激活MSCs的经典Wnt信号通路,推测经典Wnt信号通路对MSCs向胆碱能神经元分化具有调节作用。

图7 Western-Blot检测各组细胞神经元NeuN和胆碱能神经元ChAT的表达水平A组为空白对照组,B组为诱导分化对照组,C组为Wnt3a诱导分化组;直方图显示各组NeuN/actin和ChAT/actin的比值,与A组比较,**P<0.01;与B组比较,△P<0.01
本实验结果证实MSCs在体外诱导条件下可以分化为胆碱能神经元,并且经典Wnt信号通路的激活可以促进这一过程,推测移植经Wnt3a激活的MSCs,在动物体内同样可以促进其向胆碱能神经元的分化,提高MSCs移植治疗阿尔茨海默病的疗效。
[1]Bateman RJ,Xiong CJ,Benzinger TL,et al.Clinical and biomarker changes in dominantly inherited alzheimer's disease[J].N Engl J Med,2012,367(9):795-804.
[2]Moon M,Cha MY,Mook-Jung I.Impaired hippocampal neurogenesis and its enhancement with ghrelin in 5XFAD mice[J].Journal of Alzheimers Disease,2014,41(1):233-241.
[3]Aimone JB,Li Y,Lee SW,et al.Regulation and function of adult neurogenesis: from genes to cognition[J].Physiol Rev,2014,94(4):991-1026.
[4]Liang CM,Weng SJ,Tsai TH,et al.Neurotrophic and neuroprotective potential of human limbus-derived mesenchymal stromal cells[J].Cytotherapy,2014,16(10):1371-1383.
[5]Hussaini SM,Choi CI,Cho CH,et al.Wnt signaling in neuropsychiatric disorders: ties with adult hippocampal neurogenesis and behavior[J].Neurosci Biobehav Rev,2014,47:369-383.
[6]Sharma RR,Pollock K,Hubel A,et al.Mesenchymal stem or stromal cells:a review of clinical applications and manufacturing practices[J].Transfusion,2014,54(5):1418-1437.
[7]Sutton MT,Bonfield TL.Stem cells: innovations in clinical applications[J].Stem Cells Int,2014,2014:516278.
[8]Shang YC,Wang SH,Xiong F,et al.Wnt3a signaling promotes proliferation, myogenic differentiation, and migration of rat bone marrow mesenchymal stem cells[J].Acta Pharmacol Sin,2007,28(11):1761-1774.
[9]Bhaskar B,Mekala NK,Baadhe RR,et al.Role of signaling pathways in mesenchymal stem cell differentiation[J].Curr Stem Cell Res Ther,2014,9(6):508-512.
[10]Zhu D,Kang Q,Huang PY,et al.Neurogenesis-related genes expression profiling of mouse fibroblastic stem cells induced by Wnt signaling[J].Neurol Res,2009,31(2):200-203.
[11]Andersson T,Duckworth JK,Fritz NA,et al.Noggin and Wnt3a enable BMP4-dependent differentiation of telencephalic stem cells into GluR-agonist responsive neurons[J].Molecular and Cellular Neuroscience,2011,47(1):10-18.
[12]He P,Shen Y.Interruption of beta-catenin signaling reduces neurogenesis in Alzheimer's disease[J].J Neurosci,2009,29(20):6545-6557.
[13]Wexler EM,Geschwind DH,Palmer TD.Lithium regulates adult hippocampal progenitor development through canonical Wnt pathway activation[J].Mol Psychiatry,2008,13(3):285-292.
[14]王晋丽,王春芳,王晓霞,等.Wnt3a在大鼠骨髓源性胆碱能神经元中的表达[J].山西医科大学学报,2008,39(1):7-10, 95.
(2016-03-05收稿)
Experimental study of Wnt3a regulating the cholinergic neuron differentiation of rat bone marrow mesenchymal stem cells
WangShuhui,WangWei,ZhangHaiting,etal.
DepartmentofNeurology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050
ObjectiveTo investigate the effects of canonical Wnt/β-catenin signaling pathway on differentiation of MSCs into neuron and cholinergic neuron. MethodsRat MSCs were isolated and purified through differential anchoring method. Observe the morphological changes of cells under optical microscope, drew the cell growth curves, and detect the surface antigens by FACScan. The distribution of β-catenin was detected by Western blot and immunofluorescence stain after Wnt3a treatment. Then the fourth generation of MSCs was divided into three groups. Group A: cells were cultured in DMEM; Group B: cells were cultured in DMEM supplemented with 100 ng/ml basic fibroblast growth factor (bFGF) and 5 umol/L retinoic acid (RA); Group C: cells were cultured in DMEM supplemented with 100 ng/ml bFGF, 5 umol/L RA and 50ng/ul Wnt3a. The morphological changes of the cells were observed and the markers of neurons and cholinergic neurons were detected by Western blot after inducing neuronal differentiation. ResultsMSCs were purified after passage 3 through differential anchoring method. The growth kinetics of MSCs showed cells grew slowly in the first two days. After inoculation, entered a logarithmic phase from the third day and became slowly in the fifth day. Positive rate of CD29 and CD44 was 99.9% and 73.2%. Compared with control group, Wnt3a treated MSCs showed a higher level of β-catenin in the nucleus (P<0.01). The marker of neurons was detected in Group A, but the marker of cholinergic neurons couldn’ t be detected. The marker of both neuron and cholinergic could be detected in Group B and Group C. Compared to Group A, the level of the neurons' marker was higher in both Group B and Group C (P<0.01). Compared with Group B, the level of the cholinergic neurons' marker was significantly higher in the Group C (P<0.01). ConclusionWnt3a could induce beta-catenin nuclear translocation and activate the canonical Wnt pathway in MSCs. The canonical Wnt signaling pathway enhances the differentiation of MSCs into cholinergic neurons.
MSCsWnt3aCholinergic neuronAlzheimer's disease
国家自然科学基金(81100237);北京市自然科学基金(7142042)
100050北京,首都医科大学附属北京友谊医院神经科[王淑辉王薇(共同第一作者)张海廷张拥波李继梅];首都医科大学基础医学院生物化学与分子生物学系(程杉);解放军总医院老年神经科(尚延昌)
R741
A
1007-0478(2016)05-0309-06
10.3969/j.issn.1007-0478.2016.05.001
