尿蛋白电泳分析和质谱鉴定
2016-11-10王颖黄勇张小容罗高兴贺伟峰吴军
王颖,黄勇,张小容,罗高兴,贺伟峰,吴军
(第三军医大学西南医院全军烧伤研究所/创伤、烧伤及复合伤国家重点实验室/疾病蛋白组学重庆市市级重点实验室,重庆400038)
尿蛋白电泳分析和质谱鉴定
王颖,黄勇,张小容,罗高兴,贺伟峰,吴军△
(第三军医大学西南医院全军烧伤研究所/创伤、烧伤及复合伤国家重点实验室/疾病蛋白组学重庆市市级重点实验室,重庆400038)
目的探究尿蛋白的最佳沉淀方法,且对常规损失蛋白进行鉴定分析。方法采用有机溶剂沉淀法,即用三氯乙酸/90%丙酮法、三氯乙酸/100%丙酮法和90%丙酮法分别沉淀尿液中蛋白质,对90%丙酮法所得到沉淀的可溶部分和不溶部分进行十二烷基硫酸钠-聚丙烯酰胺分离和质谱鉴定。结果90%丙酮沉淀法获得的尿蛋白量相对较高。将90%丙酮法沉淀的尿蛋白不溶部分和可溶部分进行质谱鉴定,可溶部分得到53种蛋白,不溶部分得到49种蛋白,且不溶部分特有的蛋白包括免疫球蛋白κ轻链基因1~5、谷氨酰氨肽酶、突变体1、芳基硫酸酯酶A前体等14种。结论尿液沉淀的不溶部分中特有蛋白的发现有助于尿液蛋白质组的全谱研究,对临床特异蛋白的检测具有重要意义。
蛋白尿/诊断;沉淀;电泳,聚丙烯酰氨凝胶;蛋白质组学;质谱分析法
尿液是血液经肾小球滤过,肾小管和集合管重吸收、排泄及分泌产生的终末代谢产物[1]。因此,能在血清中发现的蛋白也可能在尿蛋白中被检测到。尿液的组成与性状可反映整个泌尿系统状况,尤其是尿液中蛋白质种类和数量的变化携带有泌尿系统疾病发生、发展及预后的各种信息,尿液还能反映其他人体器官的相关情况。尿液来源简单、方便、无损伤,患者容易接受,无不适感及禁忌证。随着尿液蛋白质组学的发展,各种沉淀尿蛋白的方法得到大量探索。刘靖芳等[2]采用丙酮沉淀法、乙腈/0.1%三氟乙酸沉淀法及三氯乙酸/丙酮沉淀法沉淀尿液标本中蛋白质,对沉淀蛋白进行双向电泳,结果显示,三氯乙酸/丙酮沉淀法能提高尿液标本双向电泳蛋白检出灵敏度,提高检测效果。有研究采用50%丙酮沉淀法、超滤离心法提取尿蛋白,结果显示,丙酮沉淀法获得的蛋白质谱鉴定数目更多[3]。有研究采用醋酸、丙酮、乙腈、硫酸铵、氯仿、乙醇、甲醇分别按10%、25%、50%、75%、90%进行蛋白沉淀发现,90%乙醇沉淀的尿蛋白获得最高回收率[4]。Adachi等[5]通过超虑法浓缩尿蛋白,质谱鉴定到1 500种高可信蛋白。Lee等[6]对真空离心、乙醇沉淀、超滤、富集柱4种方法比较蛋白回收率发现,真空离心蛋白回收率最高。尽管蛋白质技术在不断发展、更新,尿蛋白提取方法仍是尿液蛋白质组学发展中的瓶颈技术[7]。为更好地进行疾病相关的尿液蛋白质组学的定量研究,准确反应各种蛋白质在尿液中的真实分布,综合文献报道,本研究针对常用的几种有机溶剂方法对尿液蛋白质富集的影响进行了进一步探讨,通过一维十二烷基硫酸钠-聚丙烯酰胺(twelve alkylsodium sulfate-polyacrylamide,SDS-PAGE)初步观察蛋白提取效果,并针对一些实验中遇到的常规问题进行了具体分析,现报道如下。
1 材料与方法
1.1材料
1.1.1标本来源收集16例健康者(健康体检正常的志愿者)晨中段尿液各40 mL,其中男8例,女8例;年龄25~27岁。等份混合后12 000 g、4℃离心30 min,去掉细胞碎片等杂质,上清液按每管1 mL分装,于-80℃保存待用。
1.1.2仪器与试剂Bradford试剂盒(Thermo,USA)、胰酶(Promega,USA)、电泳使用的试剂(上海生工公司)、沉淀使用的有机试剂(重庆川东化工厂)、超速低温离心机(Beckman,USA)、垂直电泳装置(Bio-Rad,USA)、微量注射器、通风橱、扫描仪(Bio-Rad,USA)、高效液相色谱(hygh-performance liquid chromatography,HPLC)-芯片(Chip)-串联质谱(massspectrometry,MS)/MS(Agilent6330,USA)等。
1.2方法
1.2.1尿蛋白提取将尿液样品按以下3种方法进行蛋白质提取。
1.2.1.1组一(三氯乙酸/90%丙酮法)取男、女尿液各1份于冰上融化,分别加入111 μL 4℃预冷的三氯乙酸溶液达到10%,充分混匀,置4℃冰箱沉淀14 h后经12 000 g、4℃离心30 min弃上清液,沉淀用1 mL 90%丙酮溶液重悬后12 000 g、4℃离心30 min弃上清液,置通风橱内吹干备用。
1.2.1.2组二(三氯乙酸/100%丙酮法)取男、女尿液各1份于冰上融化,分别加入111 μL 4℃预冷的三氯乙酸溶液达到10%,充分混匀,置4℃冰箱沉淀14 h后经12 000 g、4℃离心30 min弃上清液,沉淀用1 mL 100%丙酮溶液重悬后12 000 g、4℃离心30 min弃上清液,置通风橱内吹干备用。
1.2.1.3组三(90%丙酮法)取男、女尿液各1份于冰上融化,分别加入9 mL 4℃预冷的丙酮达到90%,充分混匀,置4℃冰箱沉淀14 h后12 000 g、4℃离心30 min弃上清液,沉淀置通风厨内吹干备用。
1.2.2沉淀物重溶将三组干燥的沉淀用40 μL去离子水溶解,组一、二沉淀物均完全溶解,组三重悬后能观察到明显的不溶物,5 000 g、4℃离心10 min,分离组三可溶和不溶物部分。
1.2.3SDS-PAGE电泳将组一、二、三沉淀的重溶上清液及组三不溶部分用裂解液裂解后分别用10%分离胶进行SDS-PAGE电泳,上样量为各组分全部样品,采用考马斯亮蓝G-250染色。
1.2.4胶内酶解将SDS-PAGE胶b、c所有条带进行胶内酶解(有明显条带者按条带切取样品、肉眼观察无明显条带者盲切样品),分别经脱色、还原、烷基化、胰酶消化等步骤获得蛋白的肽混合物,冷冻真空抽干备用。
1.2.5质谱分析样品用10 μL 0.1%甲酸溶解后用HPLC-Chip-MS/MS进行鉴定。仪器参数:Chip含Zarbox 300SB-C18(30 mm×300 μm,5 μm)富集柱和Zarbox300SBC18(45 mm×75 μm,3.5 μm)分离柱;液相系统的流动相:流动相A为0.1%甲酸水溶液、流动相B为90%乙腈/ 10%/0.1%甲酸水溶液;洗脱梯度:5 min时流动相B由5%升至10%、35 min时流动向B由10%升至40%、40 min时流动相B由40%升至100%、45 min时流动相B回到5%。质谱参数:毛细管电压1 850 V、干燥气温度325℃、流速4 L/min、质量扫描范围400~1 600 m/z。分离器电压设置为40 V,Cap Exit为250 V,Oct1 DC为12 V,Oct2 DC为4.62 V,Trap Drive为85,Oct RF为216 Vpp,Lens1设置为-5 V,Lens 2设置为-60 V。
1.3数据处理质谱数据应用Spectrum Mill MS Proteomics Workbench(Rev A.03.02.060,Agilent)软件进行检索,数据库为IPI-human。参数设置:允许2个不完全裂解位点,且包括在搜索中氧化甲硫氨酸和N-末端谷胺酰胺转化成5-氧-2-吡咯烷羧酸的变量修正。如前向-逆转得分大于2分,列1~2得分大于2分,得分阈值大于7.67,得分百分比峰强度大于70%,认为肽段是有效的。只有当蛋白质具有2个或2个以上有效肽段、总得分大于25分时认为是有效的,可以报告。
2 结果
2.1SDS-PAGE分析组一、二沉淀尿蛋白的效率和条带分布比较,差异均无统计学意义(P>0.05),但沉淀后的尿蛋白男性略微高于女性,且获得的沉淀均可完全重溶。获得的蛋白量明显低于组三,但条带分布较组三清晰,见图1。
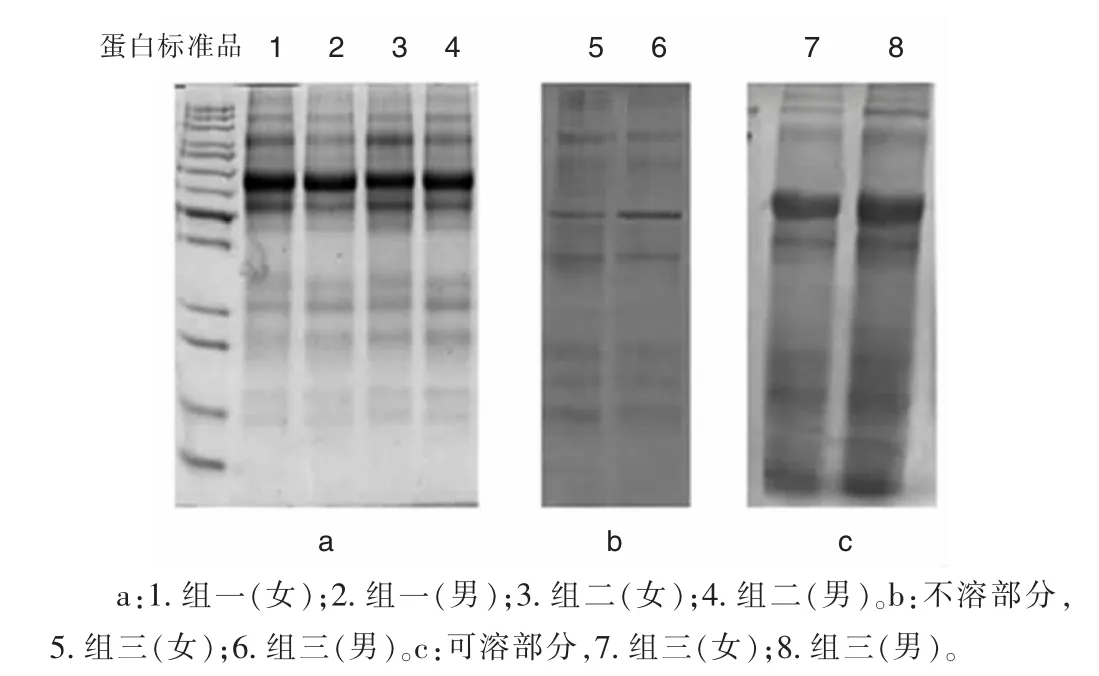
图1 不同有机沉淀法提取尿蛋白的SDS-PAGE图谱
2.2质谱鉴定结果质谱鉴定所有条带后经软件分析搜索鉴定到的蛋白质共69种,其中蛋白质上清液中53种,蛋白质不溶沉淀物中49种。质谱筛选出的沉淀不溶部分中特有的蛋白包括免疫球蛋白κ轻链基因1~5、谷氨酰氨肽酶、突变体1、芳基硫酸酯酶A前体等14种,见表1。沉淀不溶部分和上清液中均鉴定出He等[8]前期实验筛选出的18种肿瘤相关蛋白中的9种,见表2。部分蛋白质的特征质谱图见图2。
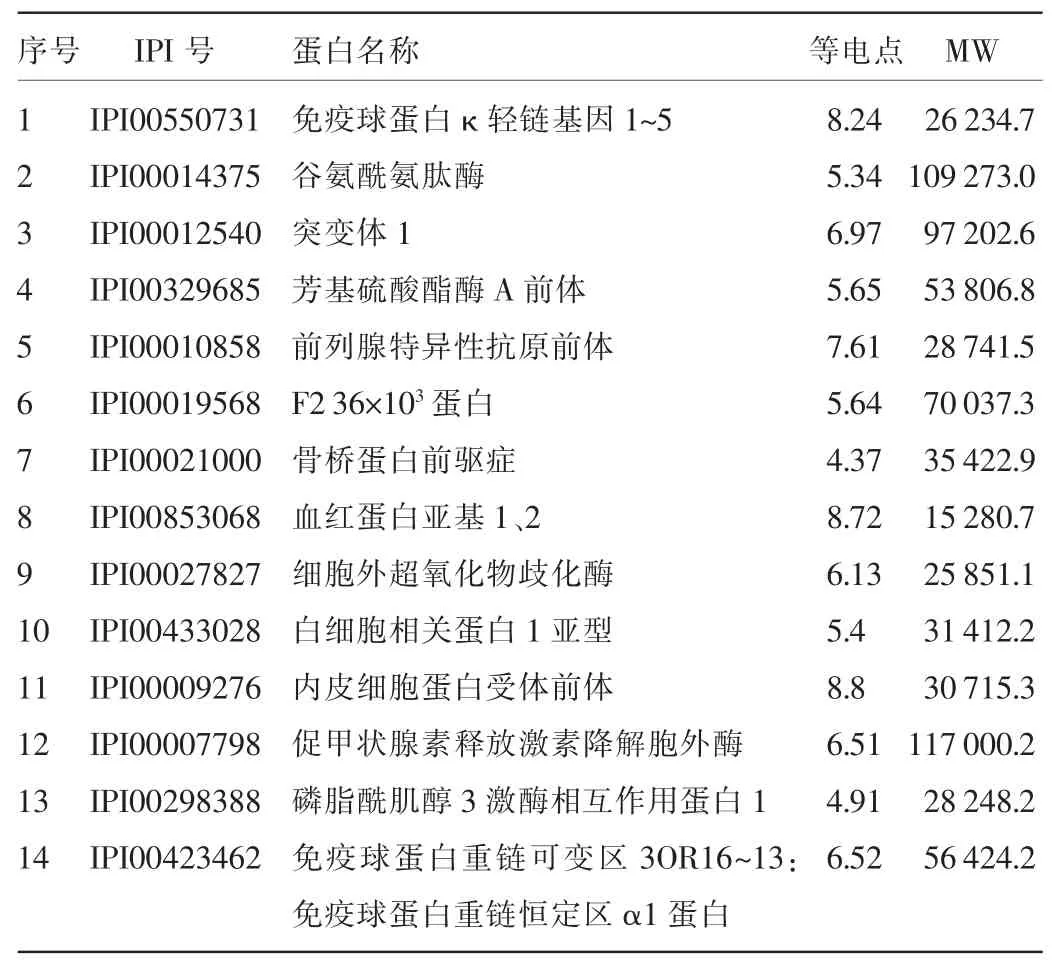
表1 沉淀不溶部分中14种特有蛋白
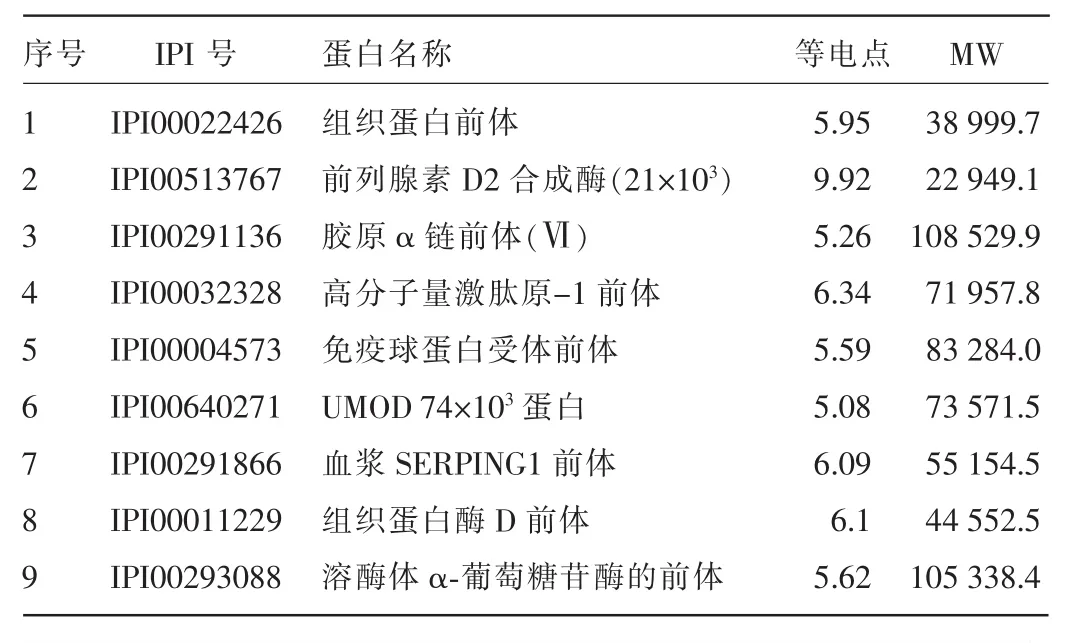
表2 沉淀不溶部分和可溶部分鉴定出与前期研究相关的蛋白
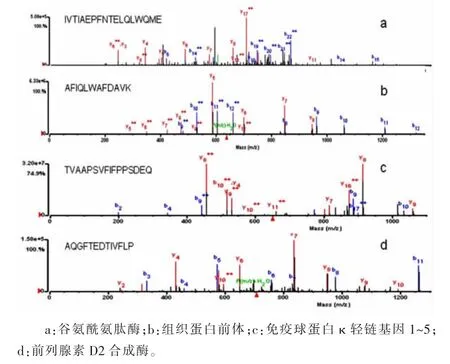
图2 部分蛋白质的特征质谱图
3 讨论
随着蛋白质组学的发展,人们对尿液蛋白质组学的研究也越来越深入。多种蛋白质组学技术被应用于尿液的研究,如双向电泳技术、荧光差异双向电泳技术、HPLC-质谱法、蛋白质芯片-质谱、毛细管电泳-质谱等[9-11]。在尿液中寻找具有诊断价值的生物标志物或建立尿液的蛋白质图谱已得到多方面的探索。目前,尿液蛋白质组学在疾病领域研究最多的是针对各种泌尿系统疾病发生、发展机制方面的研究,如肾小球疾病、肾移植、肾脏肿瘤、膀胱癌、狼疮性肾炎、糖尿病肾炎、急性肾损伤、尿毒症等。然而尿液蛋白质组学发展的瓶颈技术仍是尿蛋白富集技术,大量的方法研究尚未得到合理的统一,标准的尿液标本收集、储存、富集等技术尚需进一步的完善和推广[12-13]。He等[8]经多次尝试超滤离心法富集尿蛋白相对稳定,未观察到不溶性蛋白,但该法成本较高,且有部分蛋白吸附在膜上和其他部件上而丢失,因此,选择合适的富集尿蛋白方法对全面了解尿蛋白至关重要。对有机溶剂沉淀的尿蛋白不溶物一般不进行后续研究,源于不溶部分影响定量的准确性,且大多认为无法进行电泳分析。本研究沉淀的可溶部分和不可溶部分均鉴定出大部分前期研究筛选出的肿瘤标志物,如免疫球蛋白κ轻链基因1~5与人类免疫反应密切相关;谷氨酰氨肽酶为肝脏富含的一种蛋白酶,与肝病的发生、发展具有直接联系;突变体1是近年来在干细胞研究领域倍受关注的细胞膜糖蛋白,属5TM受体家族,在多种组织中的表达已使其成为部分肿瘤干细胞标志物之一。但本研究由于使用样品量少、方法单一和所用的质谱仪检测灵敏度较低,尿蛋白检出量有限,但沉淀中的不溶部分在尿液研究中的作用已不容小觑,尤其是针对疾病生物标志物的研究。尿液蛋白质组学的相关研究大多是针对可重溶的部分蛋白质,而本研究表明,不能重溶的沉淀部分含有大量重要的蛋白质信息,仍具有较大的研究价值。因此,如何发展更优化的尿蛋白提取方法,尽可能减少不能复溶的蛋白量是下一步研究的方向。
[1]Theodorescu D,Wittke S,Ross MM,et al.Discovery and validation of new protein biomarkers for urothelial cancer:a prospective analysis[J].Lancet Oncol,2006,7(3):230-240.
[2]刘靖芳,施秉银.不同蛋白沉淀方法对尿蛋白双向电泳结果的影响[J].山东医药,2010,50(14):101-102.
[3]Thongboonkerd V,McLeish KR,Arthur JM,et al.Proteomic analysis of normal human urinary proteins isolated by acetone precipitation or ultracentrifugation[J].Kidney Int,2002,62(4):1461-1469.
[4]Thongboonkerd V,Chutipongtanate S,Kanlaya R.Systematic evaluation of sample preparation methods for gel-based human urinary proteomics:quantity,quality,and variability[J].J Proteome Res,2006,5(1):183-191.
[5]Adachi J,Kumar C,Zhang Y,et al.The human urinary proteome contains more than 1500 proteins,including a large proportion of membrane proteins[J].Genome Biol,2006,7(9):R80.
[6]Lee RS,Monigatti F,Briscoe AC,et al.Optimizing sample handling for urinary proteomics[J].J Proteome Res,2008,7(9):4022-4030.
[7]Afkarian M,Bhasin M,Dillon ST,et al.Optimizing a proteomics platform for urine biomarker discovery[J].Mol Cell Proteomics,2010,9(10):2195-2204.
[8]He W,Huang C,Luo G,et al.A stable panel comprising 18 urinary proteins in the human healthy population[J].Proteomics,2012,12(7):1059-1072.
[9]张磊,杨闯,王颖,等.高效液相色谱-质谱法在筛选胆管癌肿瘤标志物中的应用[J].第三军医大学学报,2011,33(10):1028-1031.
[10]王玲,倪兆慧,牟姗,等.基于荧光差异二维电泳技术的临床尿液蛋白质组学研究方法探讨[J].中国血液净化,2009,8(7):382-385.
[11]Luan H,Liu LF,Meng N,et al.LC-MS-based urinary metabolite signatures in idiopathic Parkinson′s disease[J].J Proteome Res,2015,14(1):467-478.
[12]贾雄飞,贺伟峰,罗高兴,等.肾移植急性排斥反应早期诊断尿液蛋白质组学研究[J].第三军医大学学报,2008,30(24):2267-2271.
[13]Magdeldin S,Hirao Y,El Guoshy A,et al.Comprehensive data analysis of human ureter proteome[J].Data Brief,2016,6:853-857.
Electrophoretic analysis and mass spectrometric identification of urinary proteins
Wang Ying,Huang Yong,Zhang Xiaorong,Luo Gaoxing,He Weifeng,Wu Jun△
(Institute of Burn Research/State Key Laboratory of Trauma,Burn and Combined Injury/ ChongqingKeyLaboratoryforDiseaseProteomics,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
ObjectiveTo explore the best urine protein precipitation method,and to identify the routine loss protein. MethodsThe organic solvent precipitation method,i.e.,TCA/90%acetone,TCA/100%acetone and 90%acetone,was used to precipitate urinary proteins,and the obtained soluble and insoluble proteins by the 90%acetone method were separated and identified by SDS-PAGE and mass spectrum.ResultsThe urinary proteins amounts obtained by 90%acetone precipitation were relatively higher.The soluble and insoluble parts obtained by 90%acetone precipitation were identified by mass spectrometry.Fiftythree proteins were obtained from the soluble part and 49 proteins from insoluble part,moreover the specific proteins in insoluble part included immunoglobulin kappa light chain1-5(IGKV1-5),glutamyl aminopeptidase(ENPEP),PROM1,arylsulfatase A(ARSA)precursor,etc.ConclusionThe discovery of these proteins in insoluble parts of urine precipitation may contribute to the whole spectrum study of urinary proteome,and has an important clinical significance to the specific protein detection.
Proteinuria/diagnosis;Precipitation;Electrophoresis,polyacrylamidegel;Proteomics;Mass spectrometry
10.3969/j.issn.1009-5519.2016.12.009
A
1009-5519(2016)12-1803-03
王颖(1986-),硕士研究生,主要从事疾病蛋白组学的研究
△,E-mail:junwupro@126.com。
(2016-03-03)
