P311和TGF-β1在IgA肾病肾组织中的表达及意义
2016-11-10王丰平樊均明李正
王丰平,樊均明,李正
(1.成都市第一人民医院肾脏内科,四川610041;2.泸州医学院,四川泸州646000)
P311和TGF-β1在IgA肾病肾组织中的表达及意义
王丰平1,樊均明2,李正1
(1.成都市第一人民医院肾脏内科,四川610041;2.泸州医学院,四川泸州646000)
目的探讨P311和转化生长因子β1(TGF-β1)在IgA肾病(IgAN)肾组织中的表达及意义。方法应用免疫组织化学方法检测57例IgAN肾组织(IgAN组)和5例正常肾组织(对照组)中P311和TGF-β1的表达情况,同时测定IgAN患者24 h尿蛋白定量、血压、血清肌酐(SCr)、肌酐清除率等,分析P311、TGF-β1表达与不同临床分组、病理分级、有无高血压、蛋白尿程度、SCr水平的关系。结果IgAN组患者肾组织中P311表达明显高于对照组,且与病理分级呈正相关;小管间质中P311表达与TGF-β1表达、24 h尿蛋白定量等明显相关;SCr>133 μumol/L组患者肾组织中P311表达高于SCr<133 μmol/L组,差异均有统计学意义(P<0.05)。结论在IgAN肾组织中P311表达与TGF-β1表达、蛋白尿、肾脏病理分级相关。P311是肾组织纤维化过程中的关键因子,且参与了IgAN疾病进展。
肾小球肾炎,IGA;肾小管;纤维化;转化生长因子β1;P311
IgA肾病(immunoglobulin A nephropathy,IgAN)是一种常见的肾小球疾病,是导致终末期肾衰竭的重要原因之一。近年来有研究表明,在IgAN患者肾功能逐渐进展过程中肾间质病变具有决定性作用[1-2]。大量研究已证实,肾小管上皮细胞转分化(tubular epithelial myofibroblast transdifferentiation,TEMT)是肾间质纤维化的重要机制,而转化生长因子β1(transforming growth factorβ1,TGF-β1)是调节TEMT的重要细胞因子[3]。P311是新近发现的一种重要的参与细胞分化的转录因子,相对分子质量为8×103,不属于任何已知的蛋白质家族[4]。有研究发现,P311通过与TGF-β1前体相关蛋白(latency associated protein,LAP)结合,参与了转分化过程[5]。但P311是否表达于IgAN患者肾组织中,是否参与了TEMT目前尚鲜见文献报道。本研究观察了P311和TGF-β1在IgAN肾组织中的表达及其与病变程度、临床指标的相关性,对探讨IgAN的进展机制及研究延缓肾功能损害措施具有一定意义。
1 资料与方法
1.1资料
1.1.1标本来源选取2012~2013年四川大学华西医院肾脏内科、四川省成都市第一人民医院肾脏内科收治的行肾活检穿刺检查的IgAN患者57例(IgAN组),其中男27例,女30例;年龄15~53岁。57例患者均行超声引导下肾穿刺活检术,肾脏组织病理学检查符合IgAN诊断标准(病理类型均依据1997年世界卫生组织制定的IgAN病理分型标准划分),排除狼疮性肾炎、乙型肝炎病毒相关性肾炎、紫癜性肾炎等继发性病变及肾肿瘤。选取2012~2013年四川大学华西医院泌尿外科因肾结核或肾肿瘤行手术治疗患者5例,取远离病变的正常肾组织作为对照组。
1.1.2主要试剂小鼠抗人P311多克隆抗体、SABC(strept avidin-biotin complex)免疫组织化学(免疫组化)试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色剂均购自北京博奥森公司。小鼠抗人TGF-β1单克隆抗体购自美国Santa Cruz Biotechnology公司。载玻片购自上海精轮工业玻璃有限公司,并用1∶10多聚赖氨酸溶液处理。
1.2方法
1.2.1免疫组化SP法检测P311和TGF-β1在肾组织中的表达标本经10%中性甲醛固定,石蜡包埋,切片厚3 μm,常规脱蜡入水,用3%过氧化氢浸泡,微波抗原修复15 min,正常血清封闭液封闭后加入P311多克隆抗体或TGF-β1单克隆抗体,4℃过夜,然后加入辣根过氧化物酶耦联的羊抗小鼠IgG,室温下孵育10 min,磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗后DAB显色,苏木素复染、脱水、透明、中性树脂封片。对照组用PBS代替一抗,其余步骤相同。
1.2.2图像定量分析免疫组化染色结果采用Smartscape图像分析系统进行分析。对每例切片随机选取10个不重叠视野(100×),自动测定阳性面积灰度值,取平均值。
1.2.3观察指标观察并记录57例患者病史包括患者年龄、性别、临床表现及实验室检查结果等,肾穿刺活检前1~3 d检测24 h尿蛋白定量、血尿程度、肌酐清除率等。
1.2.4病理诊断标准对纳入研究对象肾组织标本进行光镜、免疫荧光等检查。病理诊断和分型标准参照Lee氏分级[6]。将Lee氏Ⅰ、Ⅱ级定义为轻度病变组,Ⅲ级定义为中度病变组,Ⅳ、Ⅴ级定义为重度病变组。
1.3统计学处理应用SPSS13.0统计软件进行数据分析,计量资料以±s表示,组间比较采用单因素方差分析;采用Spearman等级相关进行相关性分析。P<0.05为差异有统计学意义。
2 结果
2.1各组患者一般资料比较轻度病变组患者蛋白尿定量、大量蛋白尿百分比、血清肌酐(serum creatinine,SCr)、肾小球滤过率(glomerular filtration rate,GFR)与中、重度病变组比较,差异均有统计学意义(P<0.05),见表1。
表1 各组患者一般资料比较(±s)
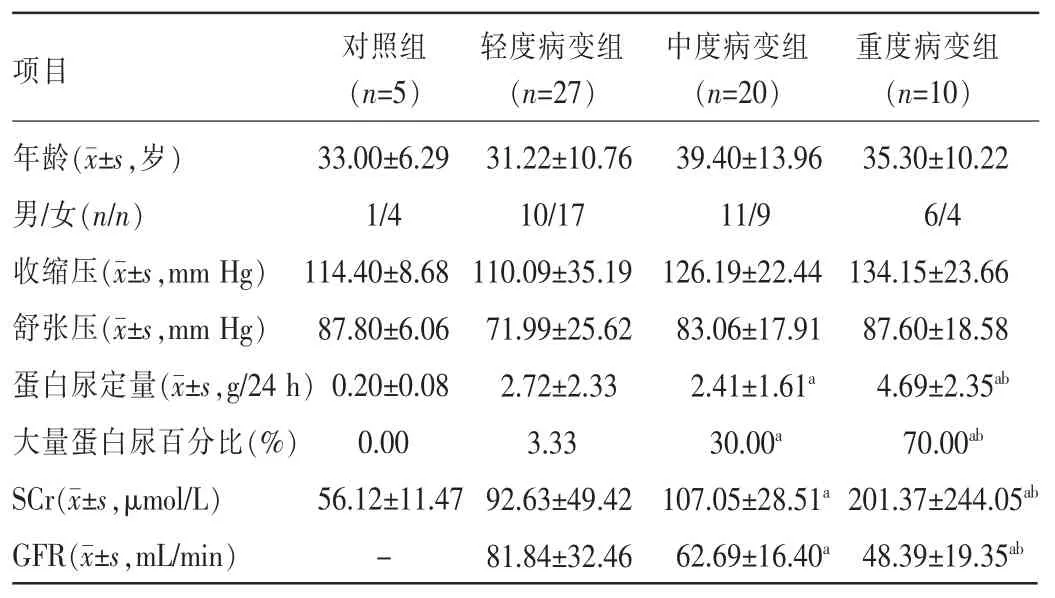
表1 各组患者一般资料比较(±s)
注:与轻度病变组比较,aP<0.05;与中度病变组比较,bP<0.05;-表示无此项;1 mm Hg=0.133 kPa。
项目对照组(n=5)轻度病变组(n=27)中度病变组(n=20)重度病变组(n=10)年龄(±s,岁)男/女(n/n)收缩压(±s,mm Hg)舒张压(±s,mm Hg)蛋白尿定量(±s,g/24 h)大量蛋白尿百分比(%)SCr(±s,μmol/L)GFR(±s,mL/min)33.00±6.29 1/4 114.40±8.68 87.80±6.06 0.20±0.08 0.00 56.12±11.47 -31.22±10.76 10/17 110.09±35.19 71.99±25.62 2.72±2.33 3.33 92.63±49.42 81.84±32.46 39.40±13.96 11/9 126.19±22.44 83.06±17.91 2.41±1.61a30.00a107.05±28.51a62.69±16.40a35.30±10.22 6/4 134.15±23.66 87.60±18.58 4.69±2.35ab70.00ab201.37±244.05ab48.39±19.35ab
2.2各组患者肾组织中P311、TGF-β1表达比较对照组患者肾组织中P311不表达,仅有少量TGF-β1表达于肾小球系膜细胞及肾小管上皮细胞质中,见图1。IgAN组患者肾组织中P311阳性物质呈棕色或棕褐色颗粒,主要定位于小管上皮细胞质中,而在肾小球中并没有检测到P311阳性染色,见图2。IgAN组患者肾组织小管间质中存在更强的TGF-β1染色,TGF-β1阳性染色不仅定位于小管上皮细胞质中,在肾小球系膜细胞、脏层和壁层上皮细胞中也存在阳性染色,见图3。轻、中、重度病变组患者肾组织中P311、TGF-β1表达比较,差异均有统计学意义(P<0.05),见表2。
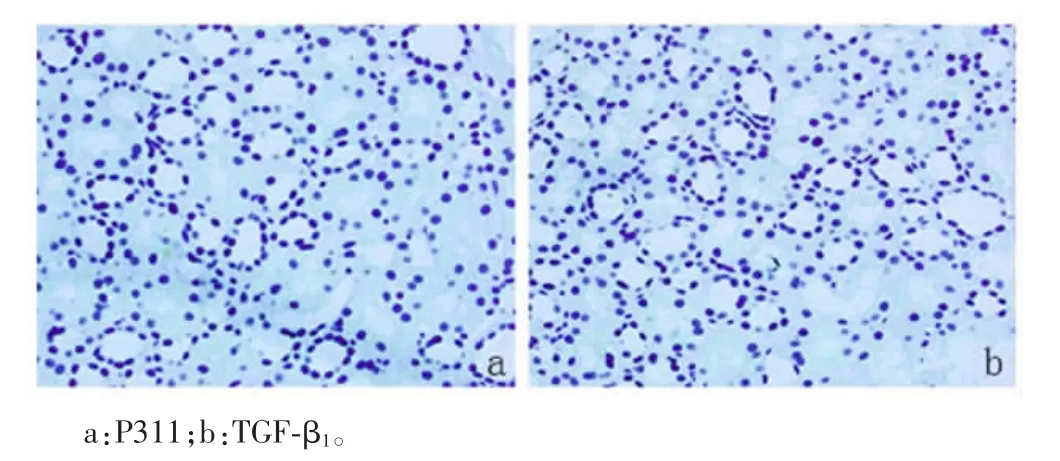
图1 对照组肾组织中P311、TGF-β1的表达(免疫组化SP法,200×)
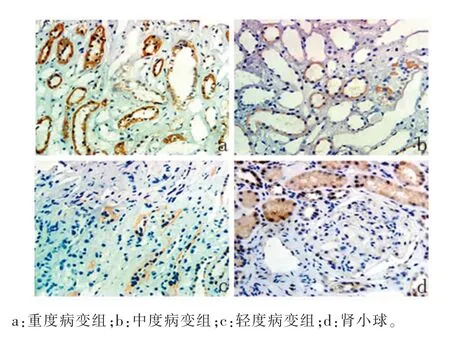
图2 各IgAN亚组肾组织中P311的表达(免疫组化SP法,200×)
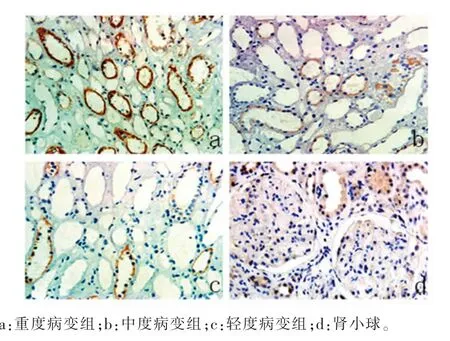
图3 各IgAN亚组肾组织中TGF-β1的表达(免疫组化SP法,200×)
表2 各组患者肾组织中P311、TGF-β1表达比较(±s)
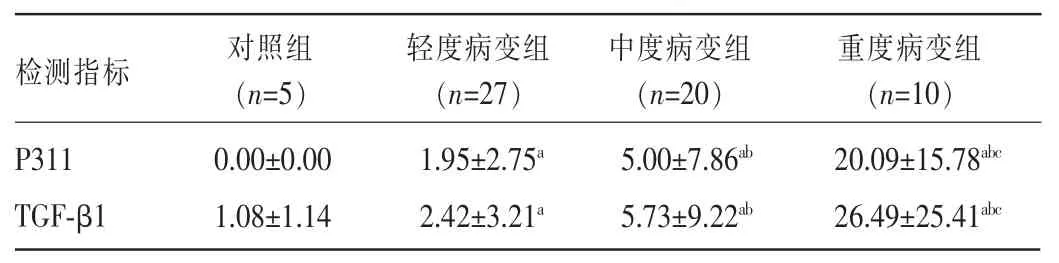
表2 各组患者肾组织中P311、TGF-β1表达比较(±s)
注:与对照组比较,aP<0.05;与轻度病变组比较,bP<0.05;与中度病变组比较,cP<0.05。
检测指标对照组(n=5)轻度病变组(n=27)中度病变组(n=20)重度病变组(n=10)P311 TGF-β1 0.00±0.00 1.08±1.14 1.95±2.75a2.42±3.21a5.00±7.86ab5.73±9.22ab20.09±15.78abc26.49±25.41abc
2.4P311与TGF-β1表达的一致性IgAN组患者肾组织中P311、TGF-β1均存在明显高表达,二者在小管上皮细胞中均存在强阳性染色,见图2、3。P311表达与TGF-β1表达明显相关(r=0.921,P<0.01)。
2.5P311表达与临床指标的相关性IgAN组患者肾组织中P311表达与患者24 h尿蛋白定量呈正相关(r= 0.291,P<0.05)。SCr>133 μmol/L组(19例)P311表达明显高于SCr<133 μmol/L组(38例),分别为(14.59± 15.01)μmol/L、(4.63±8.63)%,差异有统计学意义(t= 2.93,P<0.05)。P311表达与SCr、GFR估计值呈正相关(r=0.232、0.181,P<0.05)。
3 讨论
IgAN是最常见的原发性肾小球肾炎,占肾活检患者的1/3,15%~40%IgAN患者最终发展为终末期肾病[1]。系膜细胞的激活和细胞因子的分泌参与了IgAN的发生、发展[7]。在肾小球损伤过程中炎症细胞与介质渗透到肾间质,促使各种炎性细胞因子的释放。这些炎性细胞因子刺激肾小管上皮细胞转分化为肌成纤维细胞,导致细胞外基质(extracellular matrix,ECM)增多并在小管间质组织中积聚。炎性细胞因子的分泌、肾小管上皮细胞转分化、ECM的积聚最终导致小管间质纤维化[7]。IgAN小管间质纤维化被认为是导致终末期肾衰竭的最终通路[7]。
多种细胞因子参与了小管间质纤维化的进展,TGF-β1是控制这一过程的重要细胞因子[2,8-10]。TGF-β1是一种多功能细胞因子。在炎症状态下机体以无活性形式分泌TGF-β1复合物,其含有LAP。通过细胞外修饰剪切掉LAP,TGF-β1被激活[11]。TGF-β1和LAP的非共价键在体外能被热、极端pH和其他一些因素打断。然而在体内TGF-β1和LAP的非共价键主要通过激活作用而断裂。活化的TGF-β1通过与具有丝氨酸/苏氨酸激酶活性的Ⅰ、Ⅱ型受体结合,激活细胞内Smad信号传导途径,促进纤维化的发生、发展[12]。
由于LAP能调节TGF-β1的活性,使LAP具有调节TGF-β1多种效应的关键作用。LAP在病理状态下具有重要作用。对皮肤纤维化的动物模型给予LAP治疗,LAP抑制了部分TGF-β1介导的纤维化信号。LAP具有趋化因子活性和抗炎活性,且其功能均独立于TGF-β1。新近研究发现,P311通过与LAP结合,改变LAP构象,调控TGF-β1激活,诱导成纤维细胞表型转变为肌成纤维细胞,提示P311可能参与了纤维化过程[4]。
P311是新近发现的一种参与细胞分化的重要转录因子。P311基因定位于5号染色体长臂5q22区,是编码含68个氨基酸的蛋白,相对分子质量为8×103,该蛋白不属于任何已知的蛋白质家族,目前,其生物学功能尚不十分清楚。P311的N末端存在PEST结构域[富含脯氨酸、谷氨酸、丝氨酸、苏氨酸的区域],该结构域是泛素/蛋白酶通路的高效作用靶点[4,13]。在体外培养的NIH3T3细胞中P311能与LAP结合,诱导肌成纤维细胞表型,上调α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、表皮生长因子、血管内皮生长因子、血小板衍生生长因子受体表达,上调整合素表达,增加细胞增殖[4,13]。表明P311参与了纤维化过程,但是否参与了肾间质纤维化和小管上皮细胞转分化,特别是是否参与了IgAN的发生、发展,目前尚不清楚。
本研究结果显示,IgAN患者肾组织中的P311表达明显高与对照组。另外IgAN患者肾组织中的P311表达与病理改变相关,病变程度越重,P311表达越高。P311表达上调的机制目前尚不十分清楚。作者认为,在IgAN早期,患者处于前炎症状态,可能是P311表达上调的原因。本研究结果显示,IgAN患者肾组织中TGF-β1表达也上调。有趣的是,P311表达与TGF-β1表达明显相关,不仅表现在量上,也表现在表达部位上。已有研究证明,TGF-β1是肾间质纤维化中的关键因子[2,8-10]。本研究结果显示,P311可能与TGF-β1相互作用,并诱导小管间质纤维化。
在IgAN早期,患者处于前炎症状态,导致细胞增殖和细胞因子的分泌。同时前炎症状态也诱导P311的表达。由于P311能与LAP结合,可能通过几种机制促进了肾小管间质纤维化。一方面P311与LAP结合后改变了LAP构象,抑制了LAP功能。被P311结合的LAP不能抑制TGF-β1的致纤维化信号,不能阻断炎性反应。因此,被P311结合的LAP促进了炎症和纤维化;另一方面P311表达上调,可能促进了无活性TGF-β1的激活。整合素在无活性TGF-β1的激活方面非常重要。上调的P311能增加α-SMA和整合素表达,增加细胞增殖,可能促进了TGF-β1的激活。活化的TGF-β1进一步促进了TEMT,上调ECM合成,最终导致肾小管间质纤维化。
本研究另一个重要发现是P311表达与临床数据密切相关。IgAN患者肾组织中P311表达与24 h尿蛋白定量、肾小管间质纤维化程度相关,SCr>133 μmol/L组P311表达高于SCr<133 μmol/L组。IgAN患者P311、TGF-β1表达明显高于对照组,且2种蛋白的表达与临床指标均相关。
[1]Kaissling B,Lehir M,Kriz W.Renal epithelial injury and fibrosis[J].Biochim Biophys Acta,2013,1832(7):931-939.
[2]Okada H,Senmaru T,Fukui M,et al.Senescence marker protein-30/gluconolactonase deficiency exacerbates diabetic nephropathy through tubular injury in a mouse model of type1 diabetes[J].J Diabetes Investig,2015,6(1):35-43.
[3]Fan JM,Huang XR,Ng YY,et al.Interleukin-1 induces tubular epithelialmyofibroblast transdifferentiation through a transforming growth factorbeta1-dependent mechanism in vitro[J].Am J Kidney Dis,2001,37(4):820-831.
[4]Pan D,Zhe X,Jakkaraju S,et al.P311 induces a TGF-beta1-independent,nonfibrogenicmyofibroblastphenotype[J].JClinInvest
,2002,110(9):1349-1358.
[5]Taylor GA,Hudson E,Resau JH,et al.Regulation of P311 expression by Met-hepatocyte growth factor/scatter factor and the ubiquitin/proteasome system[J].J BioChem,2000,275(6):4215-4219.
[6]Floege J.Prognostic assessment of IgA nephropathy:how much does histology add?[J].Kidney Int,2016,89(1):19-21.
[7]Wang W,Zhou PH,Xu CG,et al.Baicalein ameliorates renal interstitial fibrosis by inducing myofibroblast apoptosis in vivo and in vitro[J/OL]. BJU Int,(2015-07-14)[2016-01-23].http://www.ncbi.nlm.nih.gov/pubmed/?term=Baicalein%20ameliorates%20renal%20interstitial%20fibrosis% 20by%20inducing%20myofibroblast%20apoptosis%20in%20vivo%20 and%20in%20vitro.%20BJU%20Int.
[8]Lan HY.Tubular epithelial-myofibroblast transdifferentiation mechanisms in proximal tubule cells[J].Curr Opin Nephrol Hypertens,2003,12(1):25-29.
[9]Ning W,Tao L,Liu C,et al.Effect of enalapril on the expression of TGF-beta1,p-Smad2/3 and Smad7 in renal interstitial fibrosis in rats[J].Zhang Nan Da Xue Xue Bao Yi Xue Ban,2009,34(1):27-34.
[10]Sato M,Muragaki Y,Saika S,et al.Targeted disruption of TGF-β1/Smad3 signaling protects against renal tubulointerstitial fibrosis induced by unilateral ureteral obstruction[J].J Clin Invest,2013,112(10):1486-1494.
[11]Ali NA,Gaughan AA,Orosz CG,et al.Latency associated peptide has in vitro and in vivo immune effects independent of TGF-beta1[J].PloS ONE,2008,3(4):e1914.
[12]Wipff PJ,Hinz B.Integrins and the activation of latent transforming growth factorβ1-anintimate relationship[J].Eur J Cell Biol,2008,87(8/9):601-615.
[13]Paliwal S,Shi J,Dhru U,et al.P311 binds to the latency associated protein and downregulates the expression of TGF-beta1 and TGF-beta2[J]. Biochem Biophys Res Commun,2004,315(4):1104-1109.
Expression and significance of P311 and TGF-β1 in renal tissue of IgA nephropathy
Wang Fengping1,Fan Junming2,Li Zheng1(1.Department of Nephrology,Chengdu Municipal First People′s Hospital,Chengdu,Sichuan 610041,China;2.Luzhou Medical College,Luzhou,Sichuan 646000,China)
ObjectiveTo investigate the expression and significance of P311 and TGF-β1 in renal tissue of immunoglobulin-A nephropathy(IgAN).MethodsThe expression levels of P311 and TGF-β1 were detected in the renal tissues of 57 cases of IgAN(IgAN group)and 5 cases of normal renal tissue(control group)by using the immunohistochemistry method.Meanwhile 24 h proteinuria,blood pressure,serum creatinine(SCr)and CCR in the IgAN patients were detected.Then the relation between P311 and TGF-β1 with different clinical groups,pathological grades,hypertension,proteinuria severity and SCr was analyzed. ResultsThe P311 expression in renal tissue of IgAN patients was significantly higher than that in the control group and was positively correlated with the pathological grade.The P311 expression in tubulointerstitial tissue was significantly correlated with TGF-β1 and proteinuria.The P311 expression in the SCr>133 μmol/L group was higher than that in the SCr<133 μmol/L group,the difference was statistically significant(P<0.05).ConclusionThe P311 protein expression in renal tissue of IgAN is correlates with TGF-β1 expression,proteinuria and renal pathological grade.P311 is a key factor in the renal tissue fibrosis process,moreover participates in the IgAN progression.
Glomerulonephritis,IGA;Kidney tubules;Fibrosis;Transforming growth factor beta1;P311
10.3969/j.issn.1009-5519.2016.12.007
A
1009-5519(2016)12-1797-03
王丰平(1979-),博士研究生,主治医师,主要从事肾病临床及基础研究工作。
(2016-02-17)
