心肌缺血再灌注损伤大鼠中20-HETE对ROS生成及NADPH氧化酶活性的影响*
2016-11-10韩勇贺滟郭立荣刘万立赵红艳何娅
韩勇,贺滟,郭立荣,刘万立,赵红艳,何娅
(遵义医学院,贵州遵义563003)
心肌缺血再灌注损伤大鼠中20-HETE对ROS生成及NADPH氧化酶活性的影响*
韩勇,贺滟,郭立荣,刘万立,赵红艳,何娅
(遵义医学院,贵州遵义563003)
目的探讨20-羟二十烷花生四烯酸(20-HETE)加重大鼠离体心肌缺血再灌注损伤(MIRI)的作用机制,即20-HETE对活性氧簇(ROS)生成及还原型辅酶Ⅱ(NADPH)的影响。方法将78只雄性Wistar大鼠随机分为正常对照组(Con组)、缺血再灌注模型组(IR组)、IR+不同剂量20-HETE(10、30、50 nmol/L)组、IR+20-HETE(50 nmol/L)+夹竹桃麻素(APO)组,每组13只。建立大鼠离体心脏MIRI模型,缺血前在灌流液中加入相应剂量的20-HETE。采用Power-Lab/8sp生理记录仪实时监测心肌血流动力学指标;氯化三苯基四氮唑(TTC)法检测心肌梗死面积;二氢乙锭(DHE)荧光探针法检测心肌组织荧光强度表达ROS水平;Western blotting检测NADPH氧化酶亚基p47phox磷酸化水平;细胞色素C还原法检测过氧化物生成的产物量表达NADPH氧化酶活性。结果20-HETE剂量依赖性地加重了再灌注后心肌损伤,IR+不同剂量20-HETE组大鼠心肌血流动力学指标较IR组显著下降,心肌梗死面积较IR组显著增加,ROS的生成较IR组进一步增加,差异均有统计学意义(P<0.01或0.05)。而灌流液中加入NADPH氧化酶抑制剂APO后,ROS显著减少,与IR+20-HETE(50 nmol/L)组比较,差异有统计学意义(P<0.05)。与IR组比较,IR+20-HETE(50 nmol/L)+APO组大鼠心脏中p47phox亚基磷酸化水平及NADPH氧化酶活性均有显著升高,差异有统计学意义(P<0.05)。结论20-HETE可通过激活NADPH氧化酶诱导过量ROS的生成,加重MIRI。
心肌缺血;心肌再灌注损伤;羟基花生四烯酸类;NADPH氧化酶;活性氧簇
心肌缺血再灌注损伤(MIRI)是目前临床上采用介入手术(如冠状动脉内支架或经皮冠状动脉腔内球囊成形术)等手段治疗缺血性心肌病时面临的主要问题[1]。MIRI的发病机制目前仍未得到彻底阐明。随着对MIRI机制研究的深入,近年来一种新被发现的由花生四烯酸代谢生成的内源性活性物质——20-羟二十烷花生四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)引起学者的关注。有研究发现在MIRI进程中,心肌组织20-HETE水平升高,其合成酶CYP4A和CYP4F表达和活性显著增强,抑制20-HETE的生成可改善再灌注后心肌功能的恢复,而外源性加入20-HETE则加重MIRI[2-3]。以上研究表明20-HETE参与MIRI的发展进程。因此本研究拟通过Langendorff灌流系统建立大鼠离体心脏MIRI模型,观察20-HETE对心肌组织活性氧簇(reactiveoxygenspecies,ROS)和还原型辅酶Ⅱ(nicotinamide adenosine denudeotide hydro-phosphoric acid,NADPH)氧化酶活性的影响,探讨20-HETE加重大鼠离体MIRI的作用机制。
1 材料与方法
1.1材料
1.1.1实验动物及分组将78只雄性SD大鼠(体质量250~300 g,由第三军医大学大坪医院医学实验动物中心提供)随机分为正常对照组(Con组)、缺血再灌注模型组(IR组)、IR+不同剂量20-HETE(10、30、50 nmol/L)组、IR+20-HETE(50 nmol/L)+夹竹桃麻素(apocynin,APO)组,每组13只。
1.1.2试剂及仪器20-HETE及APO购自美国Sigma公司,ROS检测试剂盒及NADPH氧化酶活性检测试剂盒购自南京建成生物工程研究所;特异性p47phox和磷酸化p47phox抗体、辣根过氧化物酶(HRP)标记的二抗(羊抗鼠IgG-HRP)购自圣克鲁斯生物技术公司;其他为国产分析纯。Langendorff灌流装置、PowerLab/8sp生理记录仪购自澳大利亚ADInstruments公司,DU-600型紫外分光光度计购自美国Beckman公司,电子分析天平购自德国Sartorius公司,电泳槽、电泳仪、电转系统及曝光机购自美国Bio-Rad公司。
1.2方法
1.2.1大鼠离体心脏MIRI模型建立实验前将大鼠置于安静、自然光、室温环境下饲养48 h,自由饮食。腹腔注射乌拉坦(1 g/kg)麻醉SD大鼠,固定大鼠后,沿剑突下肋缘剪开腹壁、膈肌,向上沿腋前线剪开胸壁暴露心脏,剪下心脏并保留3~4 mm主动脉,在含有肝素(50 U/mL)的KH液(NaCl 118.0 mmol/L、NaHCO325.0 mmol/L、Kcl 4.7 mmol/L、KH2PO41.2 mmol/L、MgSO2·7H2O 1.2 mmol/L、CaCl22.0 mmol/L、葡萄糖溶液11.0 mmol/L)中修剪后,迅速将离体大鼠心脏主动脉套管并挂于Langendorff装置上,进行主动脉逆行灌流,控制温度37℃,灌流液为氧饱和的KH液。待心脏跳动稳定后,经由左心房插入左心室一个充水球囊,使用PowerLab系统记录心肌血流动力学指标。
1.2.2MIRI模型灌注方案及实验分组处理将大鼠离体心脏于Langendorff灌流装置系统缺血前平衡20min,待心脏跳动稳定后全心缺血35min,各组大鼠离体心脏再灌注15 min后用于检测ROS水平,再灌注40 min后用于检测NADPH氧化酶活性,再灌注120 min后用于检测心肌梗死面积。Con组心脏不作缺血处理,KH液灌注95min;IR组心脏平衡20 min,全心缺血35 min再灌注40 min;IR+20-HETE组心脏缺血前10 min在灌流液中加入不同剂量的20-HETE(10、30、50 nmol/L);IR+20-HETE+APO组心脏缺血前10 min在灌流液中加入20-HETE(50 nmol/L)及APO(100 μmol/L)。
1.2.3氯化三苯基四氮唑(TTC)法检测大鼠心肌梗死面积各组大鼠离体心脏再灌注结束于-20℃冷冻1 h后,进行心肌组织切片(厚度2~3 mm),在37℃条件下,于1%TTC的磷酸盐缓冲液(PBS)中孵育15 min,然后用10%甲醛固定。染色后存活的心肌组织呈红色,梗死区呈白色,通过非染色区域占心室切片总面积比值计算心肌梗死面积。
1.2.4二氢乙锭(DHE)荧光探针法检测心肌组织荧光强度表达ROS水平四组心脏再灌注结束后,将心肌组织剪成小块,置于组织包埋剂中,液氮冷冻后切成厚度为10 μm的心肌切片,然后于37℃条件下,在1.6 μmol/L DHE的PBS中避光孵育染色30min,通过激光共聚焦显微镜(488nm激发光,560~660 nm滤波接收)获取荧光照片。
1.2.5Western blotting检测p47phox亚基磷酸化水平
三组大鼠离体心脏再灌注结束后,取心肌组织100 g,提取组织蛋白质,采用二喹啉甲酸(BCA)法进行蛋白定量。Western blotting检测NADPH氧化酶p47phox亚基磷酸化水平,具体方法如下:十二烷基硫酸钠凝胶电泳分离组织提取蛋白,使用半干转仪将凝胶中的蛋白质转移至PVDF膜,5%脱脂奶粉封闭2 h后,加入一抗p47phox(1∶1 000)及磷酸化p47phox(1∶1 000),4℃下孵育过夜。PBS洗膜后加入HRP标记二抗(1∶2 000),37℃孵育1 h,采用增强型化学发光法(ECL)检测试剂盒曝光,采用Quantity One软件对蛋白质条带进行分析。
1.2.6细胞色素C还原法检测过氧化物生成的产物量表达NADPH氧化酶活性三组大鼠离体心脏再灌注结束后,取心肌组织100 g,提取组织蛋白质,采用BCA法进行蛋白质定量(终浓度1 mg/mL,100 μL)过程中加入细胞色素C(500 μmol/L)和NADPH(100 μmol/L),分别在加入和不加入超氧化物歧化酶(SOD,200 U/mL)情况下,室温孵育30 min,550 nm波长下检测吸光度,通过不同吸光度值表达过氧化物产物含量,高铁细胞色素C到亚铁细胞色素C变化的摩尔吸光系数(ε)为21 000 L/(mol·cm)。
1.3统计学处理应用SPSS15.0统计软件进行数据分析,计数资料以表示,组间比较采用单因素方差分析(ANOVA)及LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠离体心脏再灌注后各项心肌血流动力学和心肌梗死面积变化比较大鼠离体心脏再灌注末期,与Con组比较,IR组心脏的各项心肌血流动力学指标缺血再灌注后占缺血前平衡期百分比出现显著下降,左心室发展压(LVDP)下降至(48.6±3.4)%,左心室舒张末期压(LVEDP)升高至(41.8±3.3)%,左心室内压最大上升或下降速率(±dP/dtmax)分别降低至(51.9±2.1)%和(47.1±3.6)%,差异均有统计学意义(P<0.05)。与IR组比较,IR+不同剂量20-HETE组剂量依赖性地进一步加重了再灌注后心肌血流动力学指标的下降,差异均有统计学意义(P<0.01)。其中IR+20-HETE(50 nmol/L)组导致心肌血流动力学指标下降显著。见表1。
离体心脏全心缺血35 min再灌注120 min后,与Con组比较,IR组心肌梗死面积增加,达到(39.8±2.3)%,差异有统计学意义(P<0.05)。而加入20-HETE的各组剂量依赖性地增加了再灌注后心肌梗死面积,其中IR+20-HETE(50nmol/L)组心肌梗死面积达到了(58.1± 4.1)%,与IR组比较,差异有统计学意义(P<0.05)。见表1。
2.2四组大鼠离体心脏再灌注后心肌组织ROS生成的变化比较大鼠离体心脏再灌注后,DHE荧光探针法检测发现,IR组荧光强度(105.0±3.5)高于Con组(19.0±2.2),差异有统计学意义(P<0.05);灌流液中加入20-HETE(50 nmol/L)后心肌组织荧光强度为(145.0± 7.3),较IR组增加了38%,差异有统计学意义(P<0.05);而当灌流液中加入NADPH氧化酶的抑制剂APO(100 μmol/L)后,荧光强度降低至(82.0±5.3),减少了43%,与IR+20-HETE(50 nmol/L)组比较,差异有统计学意义(P<0.05)。四组心肌组织荧光强度比较,差异有统计学意义(F=562.802,P=0.000)。见图1。
表1 离体心脏再灌注后各组大鼠各项心肌力学和心肌梗死面积变化比较()
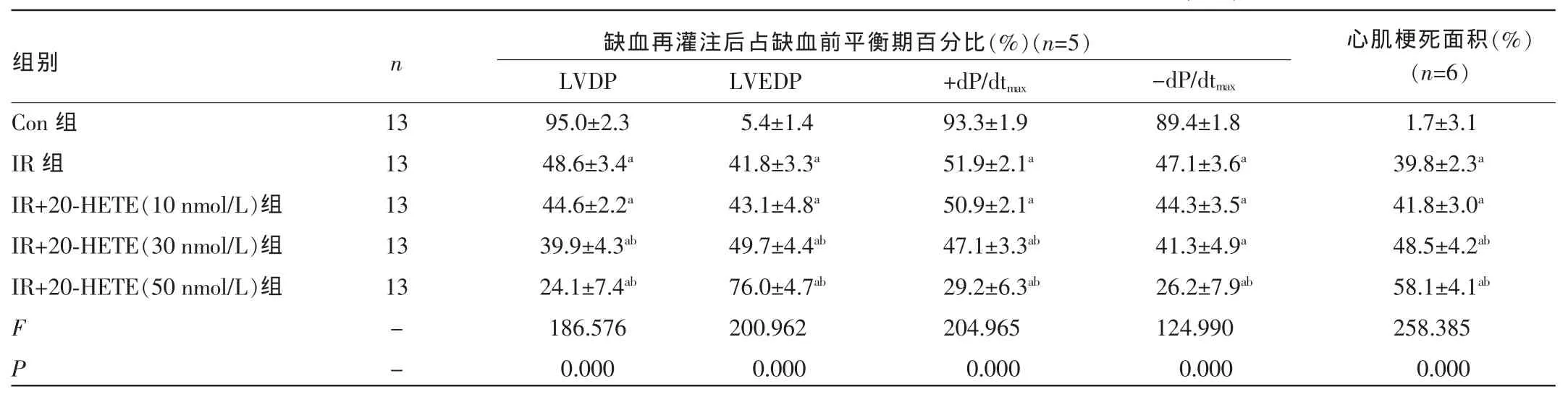
表1 离体心脏再灌注后各组大鼠各项心肌力学和心肌梗死面积变化比较()
注:-表示无此项;与Con组比较,aP<0.05;与IR组比较,bP<0.05。
组别n 缺血再灌注后占缺血前平衡期百分比(%)(n=5)-dP/dtmax心肌梗死面积(%)(n=6)Con组IR组IR+20-HETE(10 nmol/L)组IR+20-HETE(30 nmol/L)组IR+20-HETE(50 nmol/L)组1.7±3.1 39.8±2.3a41.8±3.0a48.5±4.2ab58.1±4.1ab258.385 0.000 13 13 13 13 13 F P --LVDP 95.0±2.3 48.6±3.4a44.6±2.2a39.9±4.3ab24.1±7.4ab186.576 0.000 LVEDP 5.4±1.4 41.8±3.3a43.1±4.8a49.7±4.4ab76.0±4.7ab200.962 0.000 +dP/dtmax93.3±1.9 51.9±2.1a50.9±2.1a47.1±3.3ab29.2±6.3ab204.965 0.000 89.4±1.8 47.1±3.6a44.3±3.5a41.3±4.9a26.2±7.9ab124.990 0.000

图1 四组大鼠离体心脏再灌注后心肌组织荧光照片(200×)
2.3三组大鼠离体心脏再灌注后p47phox亚基磷酸化及NADPH氧化酶活性的变化Western blotting检测结果发现,IR组心肌组织中磷酸化的p47phox亚基占总p47phox灰度值百分比[(53.5±4.4)%]高于Con组[(22.5±2.3)%],差异有统计学意义(P<0.05);当灌流液中加入20-HETE(50 nmol/L)后心肌组织中磷酸化的p47phox亚基占总p47phox灰度值百分比增加至(72.7±7.3)%,显著高于IR组,差异有统计学意义(P<0.05)。细胞色素C还原法检测发现,IR组心脏每毫克蛋白中超氧离子(O2-)产物的纳摩尔数由Con组的(11.2±1.2)nmol升高至(18.3±1.4)nmol;IR+20-HETE(50 nmol/L)组大鼠心脏每毫克蛋白中O2-产物的纳摩尔数进一步升高至(26.9± 2.8)nmol,较IR组提高了47%,差异均有统计学意义(P<0.05),见表2。
表2 三组大鼠离体心脏再灌注后p47phox亚基磷酸化水平和NADPH氧化酶活性变化比较()
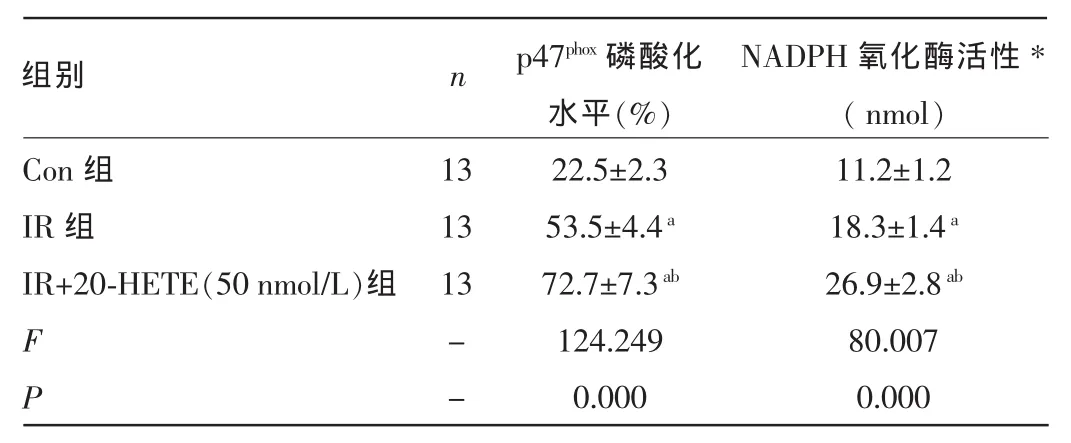
表2 三组大鼠离体心脏再灌注后p47phox亚基磷酸化水平和NADPH氧化酶活性变化比较()
注:*表示每毫克蛋白中O2-产物的纳摩尔数;-表示无此项;与Con组比较,aP<0.05;与IR组比较,bP<0.05。
组别n Con组IR组IR+20-HETE(50 nmol/L)组13 13 13 F P --p47phox磷酸化水平(%)22.5±2.3 53.5±4.4a72.7±7.3ab124.249 0.000 NADPH氧化酶活性*(nmol)11.2±1.2 18.3±1.4a26.9±2.8ab80.007 0.000
3 讨论
20-HETE是由细胞色素P450(CYP450)ω-羟化酶催化花生四烯酸生成的产物,目前研究认为其在调节肾、脑、骨骼肌和肠系膜等动脉血管平滑肌肌源性收缩中发挥了重要的作用,是一种非常有效的收缩血管的物质[4-6]。近年来的研究发现,20-HETE可能参与了再灌注后的心肌损伤。有学者首先报道了CYP450酶家族中CYP4A和CPY4F亚型在心肌组织中的表达,并且在犬的心脏缺血再灌注后,心肌组织中20-HETE的合成和释放增加,当使用20-HETE合成酶抑制剂HET0016或使用20-HETE的拮抗剂20-HEDE阻断其作用后,可明显改善心肌功能的紊乱,并减少心肌梗死面积[2-3]。此外,在糖尿病大鼠的心肌缺血再灌注中也发现,抑制20-HETE的作用可有效促进心肌功能的恢复[7]。相反,外源性加入20-HETE可明显加重MIRI[2-3]。本研究在大鼠离体心脏MIRI模型上的研究结果与相关报道一致[2-3],首先发现20-HETE可剂量依赖性地降低再灌注后心肌功能的恢复,与IR组比较,50 nmol/L的20-HETE导致心肌再灌注后功能显著下降,再灌注结束时LVDP、±dP/dtmax出现明显下降,而LVEDP明显提高;同时心肌梗死面积进一步增加,表明20-HETE参与了MIRI的进程,但是20-HETE加重MIRI及降低心肌功能的机制尚需进一步探究。
Gross等[8]报道,在MIRI进程中,抑制20-HETE作用的心肌保护机制与激活钾离子通道的活性有关,当使用腺苷三磷酸(ATP)敏感性钾通道阻断剂HMR1098后有效抑制了这种效应。而在MIRI诱导的心肌细胞凋亡方面的研究发现,CYP450 ω-羟化酶抑制剂的心肌保护作用与激活细胞ERK1/2信号通路相关[9]。另外,Bao等[10]对培养的乳鼠心肌细胞凋亡的研究发现,20-HETE可通过线粒体依赖机制诱导心肌细胞凋亡。如上研究为揭示20-HETE加重MIRI提供了实验证据,然而MIRI是一个复杂的现象,具体机制尚待深入的研究。
在缺氧和氧化应激中,心肌细胞内的ROS水平发生改变,且ROS被公认为是一种重要的介导心血管病理进程的因子,如心肌梗死损伤、心肌肥大、心肌重塑和心力衰竭等[11]。近年来研究表明,CYP450酶激活可促进ROS生成,并参与多种疾病的发生,如帕金森病、糖尿病等[12-13]。心脏中潜在的ROS生成来源包括线粒体呼吸链、NADPH氧化酶、黄嘌呤氧化酶、一氧化氮合酶等[14-15],其中NADPH氧化酶是心肌中重要的诱发过氧化物生成的来源。NADPH氧化酶包括5种亚型,分别是NOX1、NOX2、NOX3、NOX4和NOX5,此外还包括4个调节亚基(p40phox、p47phox、p67phox、rac1/rac2)[16],其中p47phox亚基磷酸化在激活NADPH氧化酶中起到关键作用。本研究结果发现,缺血再灌注诱导心肌组织内ROS大量地生成,在此基础上加入20-HETE(50 nmol/L)后心肌组织中的荧光强度进一步增加38%,而当应用NADPH氧化酶抑制剂APO干预后,再灌注后心肌组织的荧光强度降低至82.0±5.3,减少了43%,与相关报道一致[17-18]。接下来为了探究20-HETE诱导的ROS生成是否与其激活NADPH氧化酶相关,本研究检测了20-HETE对NADPH氧化酶活性及p47phox亚基磷酸化作用的影响,结果发现,IR+20-HETE(50 nmol/L)组心肌组织中磷酸化的p47phox亚基占总p47phox灰度值百分比显著高于IR组。通过对NADPH氧化酶全酶活性检测发现,再灌注后IR+20-HETE(50 nmol/L)组心肌组织每毫克蛋白中O2-产物的纳摩尔数较IR组提高了47%。这些结果表明,在MIRI进程中,20-HETE可以激活心肌细胞NADPH氧化酶并导致ROS生成增多,与其他组织的研究一致,如在肺动脉上皮细胞中,20-HETE可增加ROS生成,这种效应可被APO和聚乙二醇-超氧化物歧化酶结合物所阻断[19]。
综上所述,本研究通过建立大鼠离体心脏Langendorff灌流模型进行实验,结果发现,20-HETE通过激活NADPH氧化酶诱导ROS生成,加重MIRI这一信号通路,造成心肌功能下降,心肌梗死面积增加,为临床治疗缺血性心肌病提供了一定的理论依据。
[1]Garcia-Dorado D,Rodríguez-Sinovas A,Ruiz-Meana M,et al.Protection against myocardial ischemia-reperfusion injury in clinical practice[J]. Rev Esp Cardiol(Engl Ed),2014,67(5):394-404.
[2]Nithipatikom K,Endsley MP,Moore JM,et al.Effects of selective inhibition of cytochrome P-450 omega-hydroxylases and ischemic preconditioning in myocardial protection[J].Am J Physiol Heart Circ Physiol,2006,290(2):H500-505.
[3]Nithipatikom K,Gross ER,Endsley MP,et al.Inhibition of cytochrome P450 omega-hydroxylase:a novel endogenous cardioprotective pathway[J]. Circ Res,2004,95(8):e65-71.
[4]Ding Y,Wu CC,Garcia V,et al.20-HETE induces remodeling of renal resistance arteries Independent of blood pressure elevation in hypertension[J].Am J Physiol Renal Physiol,2013,305(5):F753-763.
[5]Edson KZ,Rettie AE.CYP4 enzymes as potential drug targets:focus on enzyme multiplicity,inducers and inhibitors,and therapeutic modulation of 20-hydroxyeicosatetraenoic acid(20-HETE)synthase and fatty acid ω-hydroxylase activities[J].Curr Top Med Chem,2013,13(12):1429-1440.
[6]Roman RJ,Akbulut T,Park F,et al.20-HETE in acute kidney injury[J]. Kidney Int,2011,79(1):10-13.
[7]Yousif MH,Benter IF,Roman RJ.Cytochrome P450 metabolites of arachidonic acid play a role in the enhanced cardiac dysfunction in diabetic rats following ischaemic reperfusion injury[J].Auton Autacoid Pharmacol,2009,29(1/2):33-41.
[8]Gross ER,Nithipatikom K,Hsu AK,et al.Cytochrome P450 omegahydroxylase inhibition reduces infarct size during reperfusion via the sarcolemmalKATPChannel[J].JMolCellCardiol,2004,37(6):1245-1249.
[9]Lv X,Wan J,Yang J,et al.Cytochrome P450 omega-hydroxylase inhibition reduces cardiomyocyte apoptosis via activation of ERK1/2 signaling in rat myocardial ischemia-reperfusion[J].Eur J Pharmacol,2008,596(1/3):118-126.
[10]Bao Y,Wang X,Li W,et al.20-Hydroxyeicosatetraenoic acid induces apoptosis in neonatal rat cardiomyocytes through mitochondrial-dependent pathways[J].J Cardiovasc Pharmacol,2011,57(3):294-301.
[11]Akki A,Zhang M,Murdoch C,et al.NADPH oxidase signaling and cardiac myocyte function[J].J Mol Cell Cardiol,2009,47(1):15-22.
[12]Raza H,Prabu SK,Robin MA,et al.Elevated mitochondrial cytochrome P450 2E1 and glutathione S-transferase A4-4 in streptozotocin-induced diabetic rats:tissue-specific variations and roles in oxidative stress[J]. Diabetes,2004,53(1):185-194.
[13]Shahabi HN,Andersson DR,Nissbrandt H.Cytochrome P450 2E1 in the substantia nigra:relevance for dopaminergic neurotransmission and free radical production[J].Synapse,2008,62(5):379-388.
[14]Levraut J,Iwase H,Shao ZH,et al.Cell death during ischemia:relationship to mitochondrial depolarization and ROS Generation[J].Am J Physiol Heart Circ Physiol,2003,284(2):H549-558.
[15]Chen JX,Zeng H,Tuo QH,et al.NADPH oxidase modulates myocardial Akt,ERK1/2 activation,and angiogenesis after hypoxia-reoxygenation[J]. Am J Physiol Heart Circ Physiol,2007,292(4):H1664-1674.
[16]Rodiño-Janeiro BK,Paradela-Dobarro B,Castiñeiras-Landeira MI,et al. Current status of NADPH oxidase research in cardiovascular pharmacology[J]. Vasc Health Risk Manag,2013,9:401-428.
[17]Li X,Lu J,ShangP,et al.The selective NADPH oxidase inhibitor apocynin has potential prophylactic effects on melamine-related nephrolithiasis in vitroandinvivo[J].MolCellBiochem,2015,399(1/2):167-178.
[18]Uysal A,Sahna E,Ozguler IM,et al.Effects of apocynin,an NADPH oxidase inhibitor,on levels of ADMA,MPO,iNOS and TLR4 induced by myocardialischemiareperfusion[J].Perfusion,2015,30(6):472-477.
[19]Medhora M,Chen Y,Gruenloh S,et al.20-HETE increases superoxide production and activates NAPDH oxidase in pulmonary artery endothelial cells[J].AmJPhysiolLungCellMolPhysiol,2008,294(5):L902-911.
Effect of 20-HETE on ROS production and NADPH oxidase activity in rats with myocardial ischemia reperfusion injury*
Han Yong,He Yan,Guo Lirong,Liu Wanli,Zhao Hongyan,He Ya
(Zunyi Medical College,Zunyi,Guizhou 563003,China)
ObjectiveTo investigate the reaction mechanism of 20-HETE for aggravating isolated rat myocardial ischemia reperfusion injury(MIRI),i.e.,its influence on the active oxygen speciece(ROS)production and NADPH.Methods
Seventy-eight male Wistar rats were randomly divided into the normal control group(Con group),ischemia-reperfusion model group(IR group),IR+different doses of 20-HETE groups(10,30,50 nmol/L)and IR+20-HETE(50 nmol/L)+apocynin(APO)group,13 cases in each group.The isolated rat heart MIRI model was established.Corresponding dose of 20-HETE was added into the perfusion solution before ischemia.The myocardial ischemic hemodynamic indexes were realtimely monitored by the Powerlab/ 8sp physiological grapher;the myocardial infarction area was measured by the TTC method;the DHE fluorescent probe method was used to detect myocardial tissue fluorescence intensity for expressing the ROS level.The phosphorylation level of p47phox as subunit of NADPH oxidase was detected by the Western blotting;the cytochrome C reduction was used to detect peroxide generated product quantity for expressing the ROS level.Results20-HETE dose-dependently aggravated ischemia reperfusion(IR)-induced myocardial injury.Compared with the IR group,the myocardial hemodynamic indexes in the IR+different doses of 20-HETE groups were significantly decreased,while the myocardial infarction area was significantly increased,the ROS production was further increased,the differences were statistically significant(P<0.01 or P<0.05).After adding APO as an inhibitor of NADPH oxidase,ROS was significantly decreased,which showed the statistical difference compared with the IR+20-HETE(50 nmol/L)group(P<0.05).Compared with the IR group,the cardiac phosphorylation level of p47phox subunit and NADPH oxidase activity in the IR+20-HETE(50 nmol/L)+APO group were significantly increased,the differences were statistically significant(P<0.05). Conclusion20-HETE aggravates MIRI by activating NADPH oxidase to induce excessive ROS production.
Myocardial ischemia;Myocardial reperfusion injury;Hydroxyeicosatetraenoic acids;NADPH oxidase;Reactive oxygen species
10.3969/j.issn.1009-5519.2016.18.001
A
1009-5519(2016)18-2781-04
国家自然科学基金资助项目(81460040);贵州省科学技术基金项目(黔科合LH字[2014]7544号)。作者简介:韩勇(1974-),博士研究生,主要从事心肌缺血及心肌梗死机制的研究。
(2016-06-01)
