原发性干燥综合征合并甲状腺疾病的临床特点分析
2016-11-10叶杨高晓梅杨南萍
叶杨,高晓梅,杨南萍
(西南医科大学附属医院风湿免疫科,四川 泸州 646000)
原发性干燥综合征合并甲状腺疾病的临床特点分析
叶杨,高晓梅,杨南萍
(西南医科大学附属医院风湿免疫科,四川 泸州 646000)
目的探讨原发性干燥综合征(pSS)合并甲状腺疾病的临床特点。方法选取2013~2015年在西南医科大学附属医院风湿免疫科确诊为原发性干燥综合征和系统性红斑狼疮(SLE)的600例住院患者,分为干燥综合征合并甲状腺疾病组(A组,200例)、系统性红斑狼疮合并甲状腺疾病组(B组,200例)、干燥综合征未合并甲状腺疾病组(C组,200例),分析干燥综合征合并甲状腺疾病的临床及实验室检查特点。结果A组患者平均病程及发病年龄高于B组,差异有统计学意义(P<0.05);A组甲状腺功能亢进62例(31%),甲状腺功能减退108例(54%),亚临床甲状腺功能减退20例(10%),甲状腺肿瘤10例(5%);B组甲状腺功能亢进72例(36%),甲状腺功能减退90例(45%),亚临床甲状腺功能减退32例(16%),甲状腺肿瘤6例(3%)。与B组比较,A组各类甲状腺疾病发生率的差异无统计学意义(P>0.05),但A组甲状腺功能减退症患者FT3、TSH、TPOAb较高,差异有统计学意义(P<0.05);在实验室检查方面,与B、C组比较,A组促甲状腺激素(TSH)、甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)明显升高(P<0.05),唾液腺流率及泪液分泌下降,但差异无统计学意义(P>0.05);与B组比较,FT3、C3、C4、R F及R O-52阳性率较高(P<0.05),R F、Hb、PLT水平明显升高(P<0.05),蛋白尿、血尿发生率明显下降(P<0.05),血肌酐及尿素氮水平明显降低(P<0.05);与C组比较,ANA滴度、免疫球蛋白G及SSA阳性率显著升高(P<0.05)。结论pSS可以合并甲状腺疾病,以甲状腺功能减退为主要表现。pSS合并甲状腺疾病在实验室检查方面有一定特点,且可导致内脏器官损害,因此值得临床医生高度重视。
原发性;干燥综合征;甲状腺疾病
干燥综合征(sjogren's syndrome,SS)是一种累及外分泌腺的自身免疫性疾病,临床表现为持续性的口干及眼干,并由此出现龋齿、牛肉舌、腮腺肿大等一些特征性表现,部分女性患者甚至可出现阴道干燥症。该病可导致多系统多器官损害,其中以肺脏、肾脏、血液系统损害尤为显著[1]。该病分为原发性和继发性,继发性干燥综合征常常由其他自身免疫性疾病、肿瘤性疾病、药物等因素所导致。近几年该病发病率呈明显上升趋势,在我国约为0.29%~0.77%[2],以中老年女性多见。而随着SS发病率的不断上升,出现越来越多的原发性干燥综合征(primary sjogren's syndrome,pSS)合并甲状腺疾病的情况,且发病率不低。由于pSS合并甲状腺疾病早期常无显著的临床表现,且病情复杂,因此临床上容易被忽视,导致患者得不到及时诊治,从而使病情进一步加重,造成无法弥补的损失。因此,提高广大临床医师对其的关注及重视程度则显得尤为重要。
1 资料与方法
1.1临床资料
选取2013~2015年在西南医科大学附属医院风湿免疫科确诊为原发性干燥综合征和系统性红斑狼疮(systemic lupus erythematosus,SLE)的600例住院患者,分为干燥综合征合并甲状腺疾病组(A组,200例)、系统性红斑狼疮合并甲状腺疾病组(B组,200例)及干燥综合征未合并甲状腺疾病组(C组,200例)。A组为研究组,B、C组为对照组,其中,男性132例,女性468例,男:女为1∶3.55;年龄28~59岁,平均(43.4±9.8)岁,病程6~252个月。入选患者均符合美国风湿病学会(ACR)1982年的SLE诊断标准[3]或2002年修订的干燥综合征国际诊断标准[3]。
1.2方法
收集600例pSS和SLE的病历资料,资料内容包括甲状腺功能指标(FT3、FT4、TSH、TGAb、TPOAb)、唾液流率值、泪液分泌值、血沉(ESR)、C反应蛋白(CRP)、自身抗体谱、免疫球蛋白A、G、M(lgA、lgG、lgM)、类风湿因子(RF)、胆固醇(CH)、三酰甘油(TG)、补体C3及C4、ANA滴度、血红蛋白(Hb)、血小板(PLT)、白细胞(WBC)、尿素氮(BUN)、肌酐(Cr)等。各检查值参考同期的正常值,各类型甲状腺疾病诊断参照甲状腺功能检测,如甲状腺功能检测尚不能确定甲状腺疾病者,均已行甲状腺B超或甲状腺病理活检明确诊断。甲状腺功能指标在本院核医学科通过电化学发光免疫法测得,其余指标均来源于本院免疫学及临检实验室。
1.3统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,各组计数资料及率的比较采用χ2检验,各组计量资料比较采用单因素方差分析,非正态分布计量资料的比较采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1各组一般情况比较
与B组比较,A组患者平均病程及发病年龄较长,差异有统计学意义(P<0.05);与B、C组比较,A组患者在性别构成比方面的差异无统计学意义(P> 0.05)。
2.2各组甲状腺疾病临床表现及甲状腺功能指标比较
与B组比较,A组各类甲状腺疾病发生率的差异无统计学意义(P>0.05),两组均以甲状腺功能减退为主要表现,A组FT3及甲状腺功能减退症患者FT3、TSH、TPOAb较高,差异有统计学意义(P<0.05);与B、C组比较,A组促甲状腺激素(TSH)、甲状腺球蛋白抗体(TGAb)、甲状腺过氧化物酶抗体(TPOAb)明显升高,差异有统计学意义(P<0.05)。见表2。
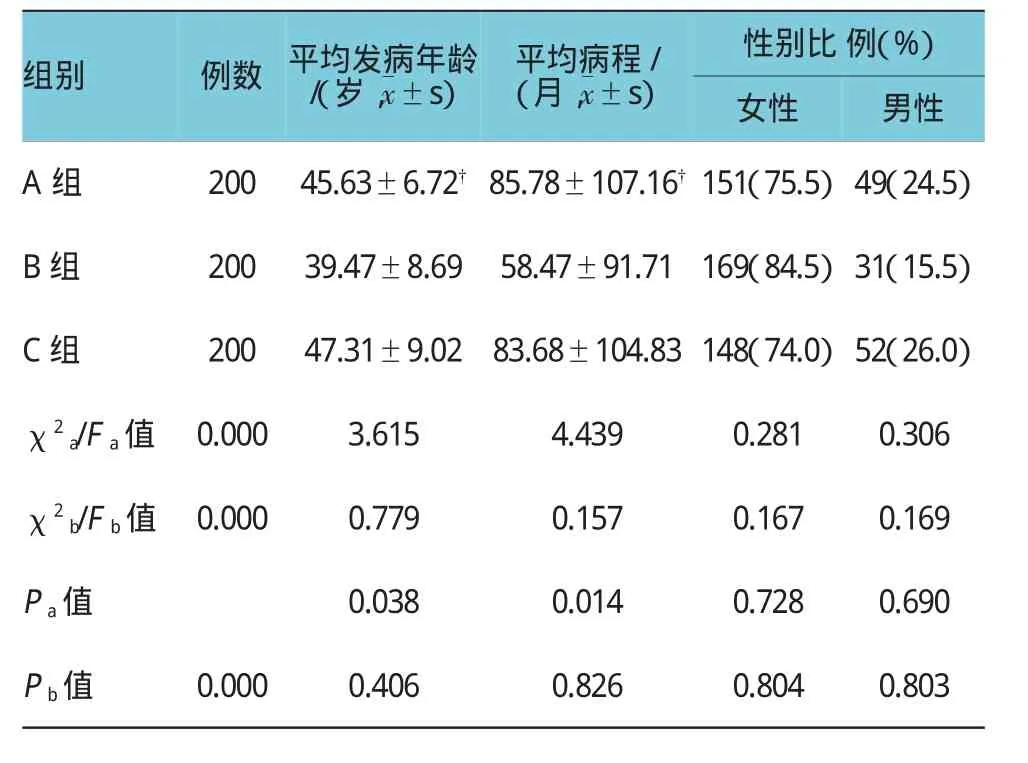
表1 各组一般情况比较
表2 各组甲状腺疾病临床表现及甲功指标比较[例(%)s]

表2 各组甲状腺疾病临床表现及甲功指标比较[例(%)s]
注:1)与B组比较,P<0.05;2)与C组比较,P<0.05
组别甲状腺功能异常例数例(%)甲状腺功能亢进甲状腺功能减退亚临床型甲减甲状腺肿瘤甲状腺功能指标比较FT3/(pg/ml)FT4/(ng/dl)TSH/(mIU/l)TGAb/(IU/ml)TPOAb/(IU/ml)A组200(100.0)62(31.0)108(54.0)20(10.0)10(5.0)4.04±0.711)1.94±0.39 11.42±0.511)2)34.78±2.461)2)36.47±7.231)2)B组200(100.0)72(36.0)90(45.0)32(16.0)6(3.0)1.12±0.152.51±0.474.97±0.2419.32±2.9118.42±3.15 C组-----3.06±0.261.62±0.544.49±0.355.85±0.7613.26±2.59 χ2a/Fa值0.0000.1560.1250.2950.1498.6740.7316.5475.6276.069 χ2b/Fb值-----1.5640.8156.9816.1275.843 Pa值0.0000.8290.8860.7030.8520.0000.4260.0000.0000.000 Pb值-----0.1580.3830.0000.0000.000组别甲亢患者的比较FT3/(pg/ml)FT4/(ng/dl)TSH/(mIU/L)TGAb/(IU/ml)TPOAb/(IU/ml)甲减患者的比较FT3/(pg/ml)FT4/(ng/dl)TSH/(mIU/L)TGAb/(IU/ml)TPOAb/(IU/ml)A组10.48±1.32 9.42±1.160.19±0.0819.56±3.5738.51±6.731.29±0.181)0.48±0.12 24.94±3.651)56.49±10.6227.63±8.491)B组11.26±1.67 10.03±1.25 0.18±0.0617.82±3.4241.26±7.450.17±0.05 0.43±0.11 17.34±3.37 58.52±11.6315.37±4.15 C组----------χ2a/Fa值0.7640.9330.8590.5190.26119.9670.9895.7750.1304.516 χ2b/Fb值----------Pa值0.4120.2580.3360.6200.7270.0000.2310.0000.8770.012 Pb值----------
2.3各组自身抗体阳性率比较
与B组比较,A组RO-52、RF阳性率明显升高,差异有统计学意义(P<0.05);与C组比较,A组SSA阳性率明显升高,差异有统计学意义(P<0.05)。与B组比较,A组各滴度患者的比例差异无统计学意义(P>0.05);与C组比较,A组+1∶3 200滴度的患者比例明显增高,+1∶320滴度的患者比例明显减少,差异有统计学意义(P<0.05)。见表3。
2.4各组抗核抗体滴度比较
与B、C组比较,A组唾液腺流率及泪液分泌虽低于B、C组,但差异无统计学意义(P>0.05);与B组比较,A组RF、C3、C4、Hb、PLT水平较高,差异有统计学意义(P<0.05),蛋白尿、血尿发生率明显下降,血肌酐及尿素氮水平明显降低,差异有统计学意义(P<0.05);与C组比较,A组lgG水平明显升高,差异有统计学意义(P<0.05)。见表4。
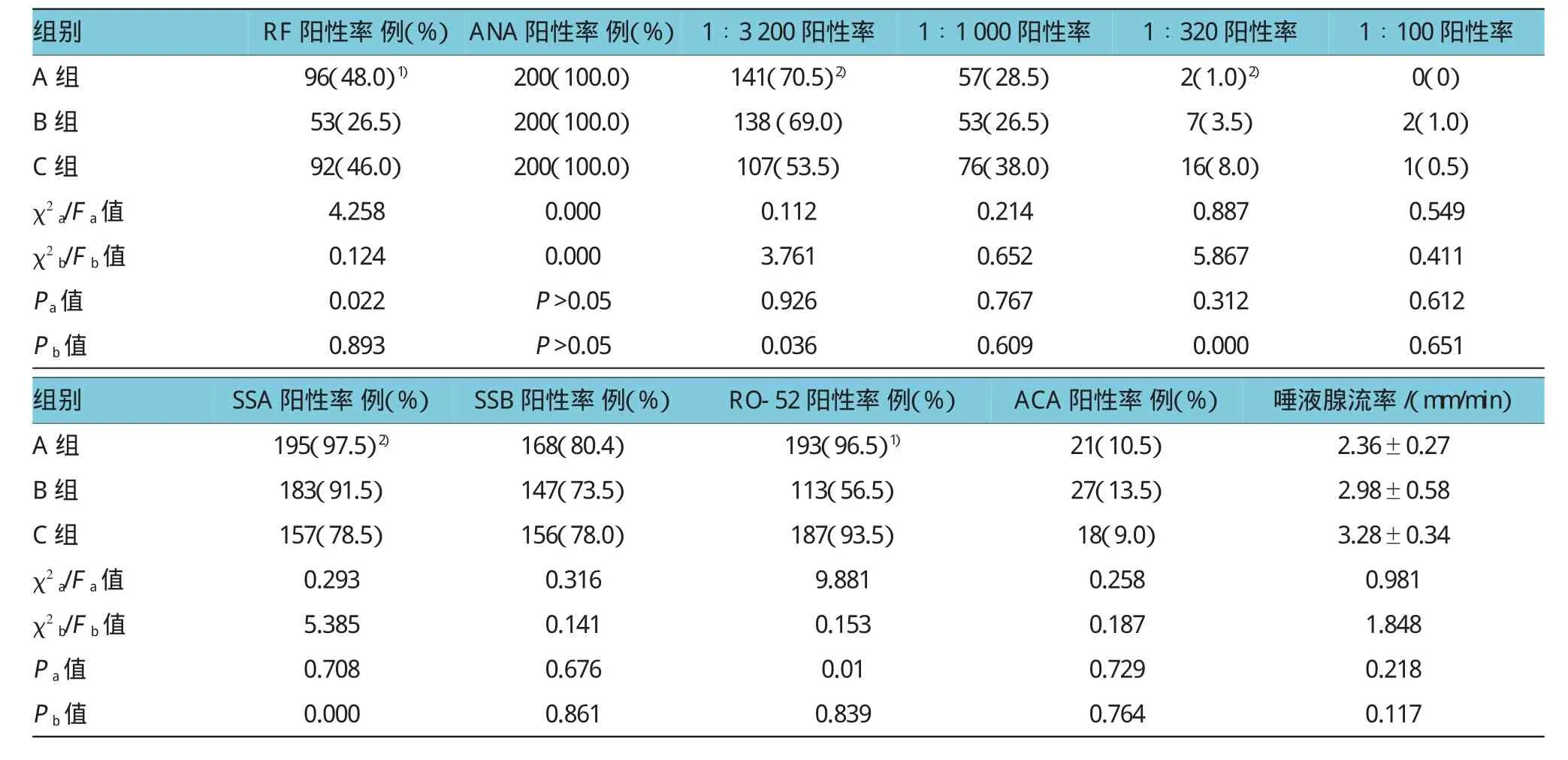
表3 各组自身抗体阳性率及抗核抗体滴度比较例(%)
表4 各组实验室其它重要指标比较[例(%)±s]

表4 各组实验室其它重要指标比较[例(%)±s]
注:1)与B组比较,P<0.05;2)与C组比较,P<0.05
血尿例(%)A组187(93.5)131.46±37.721)2.69±0.82185.41±48.531)16(8.0)1)9(4.5)1)1(0.5)1)B组192(96.0)87.35±26.582.41±0.6954.49±21.07194(97.0)194(97.0)186(93.0)C组173(86.5)137.18±34.762.88±0.87194.36±50.169(4.5)8(4.0)3(1.5)χ2a/Fa值0.1907.6350.65812.73814.57817.39413.513 χ2b/Fb值0.2860.2380.5830.1830.3580.1290.283 Pa值0.7900.0000.5180.0000.0000.0000.000 Pb值0.7080.7380.6070.7710.6830.8830.726组别血尿素氮/(mmol/L)组别血液系统损害例(%)血红蛋白/(g/L)白细胞/(×109/L)(×109/L)肾脏损害例(%)血小板/蛋白尿例(%)lgG/(g/L)A组5.35±1.871)53.47±20.521)56.63±3.4616.13±0.452.47±0.326.41±0.7928.34±2.622)B组19.74±7.29247.68±61.8463.31±2.6213.49±0.372.86±0.296.57±0.6830.04±1.65 C组4.89±1.6246.85±17.5154.78±4.0312.78±0.511.98±0.225.58±0.6517.11±1.09 χ2a/Fa值3.85716.0480.3420.4360.7580.7290.173血肌酐/(μmoI/L)ESR/(mmol/L)CRP/(mg/L)TG/(mmol/L)CH/(mmol/L)b/Fb值0.4390.2480.1540.5170.8160.8762.972 Pa值0.0290.0000.6970.6410.4140.4230.765 Pb值0.6320.730.8370.6210.3670.3170.046组别lgG/ χ2(g/L)lgA/(g/L)lgM/(g/L)C3/(g/L)C4/(g/L)RF/(IU/ml)A组28.34±2.622)8.56±1.253.23±0.731.47±0.221)0.29±0.061)107.47±16.711)B组30.04±1.658.79±1.184.07±0.640.43±0.080.06±0.0158.31±9.45 C组17.11±1.097.93±1.362.89±0.511.38±0.140.31±0.0598.12±13.07 χ2a/Fa值0.1730.7270.74110.85926.3496.007 χ2b/Fb值2.9720.8140.8021.3780.8960.253 Pa值0.7650.4310.4210.0000.0000.000 Pb值0.0460.3840.3950.1870.2920.731
3 讨论
弥漫性结缔组织病是临床上较常见的一组自身免疫性疾病,其包括pSS、SLE、RA、PM/DM、SSC等疾病,可侵犯多系统、多器官、多组织,且临床表现复杂多样,轻者影响生活质量,重者威及生命,因此对弥漫性结缔组织病的研究就显得十分重要。近几年,随着弥漫性结缔组织病合并甲状腺疾病越来越常见[4],pSS合并甲状腺疾病也越来越受到关注,其临床报道也逐渐增多,但总结近几年报道,更多关注的是甲状腺疾病本身及甲状腺功能的改变,有关自身抗体谱及相关免疫学指标的变化关注较少。有研究发现[5],在甲状腺疾病中,pSS发病率是正常人群的10倍,pSS合并甲状腺疾病是正常人群的9倍。近年来,有国外研究显示[6]一半以上的pSS患者可出现甲状腺功能和/或抗体的异常,而国内报道该比例约为36.6%[7]。在一项长达16年的前瞻性研究中[8],约30%pSS合并甲状腺疾病,而结合国内外相关报道,pSS合并甲状腺疾病多表现为甲状腺功能减退[9]、慢性淋巴细胞性甲状腺炎,同时也有不少关于甲状腺功能亢进的报道。当pSS合并慢性淋巴细胞性甲状腺炎时,主要表现为亚临床或临床型甲状腺功能减退,且血清中可出现典型甲状腺抗体。本研究中甲状腺功能减退占甲状腺功能异常的比例高达50.4%,且甲状腺功能亢进(31%)和亚临床甲状腺功能减退(10%)也不少见,同时血清中出现高水平甲状腺抗体(TPOAb及TGAb),与既往文献报道基本相符。
与pSS相同,自身免疫性甲状腺疾病也是一种器官特异性免疫性疾病,虽然两种疾病针对不同的靶器官,但两者在免疫遗传学、血清学、病理学等方面有许多相似之处[10],在自身免疫性甲状腺疾病的遗传和免疫反应中,不仅有大量细胞因子的参与(包括IL-1、TNF-λ、TNF-α等),而且对HLA-DR3、DR5、B8、DQI等遗传基因易感,而这些细胞因子及遗传基因与pSS的发生同样密不可分[11],其中有研究证实[12-13],IL-1、TNF-λ、TNF-α等细胞因子能够抑制甲状腺细胞功能,同时在pSS患者外分泌腺中高度表达,而HLA-DR3与pSS及甲状腺功能减退均有关;另一方面,pSS常存在血清SSA、SSB等自身抗体的阳性,而这些抗体与甲状腺疾病的发生同样息息相关[12]。甲状腺与pSS常易累及的腮腺和唾液腺在病理学改变上有相似之处,都有活化的T淋巴细胞浸润和HLAII型分子的表达[13],说明甲状腺疾病与pSS的发生可能有共同的免疫学发病机制,而本研究中无论是pSS合并甲状腺疾病还是SLE合并甲状腺疾病,都呈现出唾液流率及泪液分泌的明显下降,可能与本机制有关;另一方面,部分SLE合并甲状腺疾病的患者血清抗体中出现SSA及RO-52抗体的阳性,虽然还达不到原发性干燥综合征的诊断标准,但不排除继发性干燥综合症的可能,因此A、B组唾液流率及泪液分泌较C组轻度下降,可能与上述两种情况相关,但其真实性还需进一步研究证实。目前,认为甲状腺抗体在pSS合并甲状腺功能异常中发挥极其重要作用,而TGAb和TPOAb两种抗体尤为明显,它们也被认为是自身免疫性甲状腺疾病的重要诊断指标,国外报道pSS合并TPOAb或TGAb的阳性率分别为34.5%和21.4%,且与甲状腺组织损伤严重程度成正比[14],同时,上述两种抗体的持续存在是诱导自身免疫性炎症、使疾病趋于慢性化的关键因素,在自身免疫性甲状腺炎患者中,往往上述抗体滴度很高,甚至可达100%,亚临床甲减如存在高滴度TGAb和TPOAb,将很可能进展为临床型甲减。pSS是一种弥漫性结缔组织病,无论自身免疫性甲状腺炎,还是原发性甲状腺功能减退,都可合并存在。在D-ARBONNEAU等[8]研究中,pSS合并甲状腺功能异常组TGAb和TPOAb水平显著升高,这与本研究结果相似,但具体机制尚不清楚。虽然甲状腺疾病与pSS密切相连,但是甲状腺疾病的有无与pSS的病情活动度、发生、发展无关。
本研究中,干燥综合征合并甲状腺疾病组ANA滴度、lgG及SSA抗体阳性率较单纯干燥综合征组明显增高,其中前者滴度以+1:3200居多,充分显示了当PSS合并甲状腺疾病时,患者体内存在高滴度的ANA抗体[15]。同时,有文献报道显示[15],甲状腺疾病可能会导致类风湿因子的明显升高及SSA阳性率的增高,而本研究中SSA阳性率的增高与报道基本一致,但类风湿因子(RF)的升高与文献报道尚不符合,这可能与样本量不足有关,也可能与RF敏感性较高,易受多种因素影响所致。再次,有报道显示[15],单纯甲状腺功能减退时,血清lgA水平会下降,三酰甘油水平会升高,而单纯pSS通常表现为lgA的升高,因此当pSS患者出现lgA的下降及三酰甘油水平升高时,不排除合并有甲状腺功能减退的可能性,由于本研究未单独涉及到干燥综合征合并甲状腺功能减退的研究,故lgA及三酰甘油未见明显变化。最后,当干燥综合征仅合并桥本甲状腺炎时,血清中免疫球蛋白及三酰甘油会显著升高,而单纯性干燥综合征较之具有更低的C4水平;另一方面,干燥综合征合并桥本甲状腺炎血清中C4水平正常,则病情较轻,反之,C4水平低下,则死亡率明显升高[15]。由于本研究同样未单独对干燥综合征合并桥本甲状腺炎进行研究,因此导致研究结果中仅有lgG明显升高,这需要在以后的研究中进一步完善。另一方面,本研究中同时选择了SLE合并甲状腺疾病作为研究对照,原因在于近年来该病的报道也不少见,且有自身特点,其机制可能是SLE与甲状腺疾病同属于免疫系统疾病,可能两者都含有一些相似的组织相容性抗原而形成自身抗体。同时,SLE还能导致免疫功能紊乱使抑制性T细胞功能受损和B细胞功能亢进,从而产生大量自身抗体,这些抗体通过损伤甲状腺滤泡上皮导致甲状腺直接破坏,甲状腺激素合成降低,另一方面,有研究发现大多数SLE出现甲状腺功能异常在SLE发病后,也进一步提示SLE可能在甲状腺疾病发病过程中有着重要作用[16]。宋芹等[4]报道,SLE合并甲状腺疾病主要表现为低T3综合征,本研究中,不仅SLE合并甲状腺疾病组出现FT3降低,而且SLE合并甲状腺功能减退症时,同样出现FT3的明显降低,与报道基本一致,但FT3的降低与病情活跃性及严重程度的关系还需要进一步研究证实。此外,在本研究中,PSS合并甲状腺疾病组平均病程及发病年龄明显高于SLE合并甲状腺疾病组,这可能与SLE患者体内存在更多炎症因子及自身抗体,能在更短时间内破坏甲状腺组织有关;另一方面,PSS好发于中老年女性,而SLE好发于青年、育龄期女性,这可能是导致两组患者发病年龄不同的原因。SLE合并甲状腺疾病组的C3、C4、RF、Hb、PLT水平及RO-52、RF抗体阳性率较干燥综合征合并甲状腺疾病组明显降低,而蛋白尿、血尿发生率及血尿素氮、肌酐明显升高,这可能与SLE疾病本身及RF、RO-52较易出现在干燥综合征中有关,而与甲状腺疾病本身无关。本研究还发现,两组患者WBC差异无统计学意义,这可能与PSS及SLE均易导致WBC损害有关,但结果尚需进一步研究证实。为进一步了解PSS合并甲状腺疾病的临床特点,本研究分别对该组及SLE合并甲状腺疾病组甲亢、甲减患者甲功指标进行比较,发现SLE合并甲状腺功能减退组FT3、TSH、TPOAb较PSS合并甲状腺功能减退组明显降低,这可能说明SLE导致的甲状腺组织损害较PSS更为严重,但遗憾的是,两组甲亢患者的甲功指标并未呈现相似表现,故其真实性还需要进一步研究证实。而查阅国内外相关文献,目前未有免疫性疾病合并甲状腺疾病之间病情严重程度对比的报道,但不少文献报道[1,18-19],无论干燥综合征、系统性红斑狼疮或是其他弥漫性结缔组织病合并甲状腺疾病,均可出现严重的脏器损害,如眼部、心脏、肾脏、血液系统等,且上述表现并不少见。在本研究中,两组患者均出现不同程度的血液系统、肾脏损害,尤以SLE合并甲状腺疾病组显著,这与文献报道基本一致。
总之,pSS合并甲状腺疾病临床表现以甲状腺减退为主,且实验室检查有一定特点,因此定期进行甲状腺功能、实验室相关指标及自身抗体谱的检测则显得尤为重要。当pSS患者出现ANA滴度、免疫球蛋白及RF水平明显升高,或者出现lgA水平下降及三酰甘油水平升高时,需高度怀疑合并甲状腺疾病的可能性,尤其是临床上出现持续的眼球胀痛伴视物模糊、双手震颤、乏力、纳差及多食、怕热怕冷、情绪亢奋及低落的症状及体征时更应提高警惕;其次,对于TGAb和TPOAb滴度高的pSS患者应密切监测病情变化,避免甲减等甲状腺疾病的发生及诊断的遗漏;再次,当遇到甲状腺疾病不能完全解释的临床表现时,常规需排除pSS等自身免疫性疾病;最后,一旦明确存在甲状腺疾病或pSS等自身免疫性疾病后,临床医师应高度警惕可能出现的脏器损害。
[1]倪敏,梁军.原发性干燥综合征合并甲状腺功能异常的临床分析[J].中华内分泌代谢杂志,2013,29(7):557-559.
[2]蒋明,朱立平,林孝义.风湿病学[M].北京:科学出版社,1995:1113.
[3]叶任高,内科学[M].第6版.北京:人民卫生出版社,2004:892-896.
[4]宋芹,毛玉景,郭向华,等.结缔组织病与甲状腺疾病的相关性[J].中华临床免疫和变态反应杂志,2014,8(1):52-56.
[5]袁凤易,徐丹,洪小平,等.原发性干燥综合征合并甲状腺疾病的临床研究[J].中国实用医药,2009,4(2):47-48.
[6]徐立勤,胡春燕.原发性干燥综合征合并甲状腺功能异常的临床研究[J].浙江预防医学,2005,17(8):62-63.
[7]唐福林,汪国生,孙丽蓉,等.原发性干燥综合征合并甲状腺功能异常的临床分析[J].中华风湿病学杂志,1998,2(6):71-74.
[8]D-ARBONNEAU F,ANSART S,LEBERRE R,et al.Thyroid dysfunctionin in primary sjogren's syndrome:a long-term follow upstudy[J].Arthritis Rheum,2003,49(6):804-809.
[9]颜淑敏,张文,李梦涛,等.原发性干燥综合征573例临床分析[J].中华风湿病学杂志,2010,14(2):223-227.
[10]刘素筠,程太华,朱亦.自身免疫性甲状腺疾病与干燥综合征相关分析[J].中华风湿病学杂志,1999,1(3):55.
[11]唐福林.原发性干燥综合征的发病机制[J].中华风湿病学杂志,2000, 4(1):50-52.
[12]巴建明.细胞因子对甲状腺的作用[J].国外医学内科学分册,1997, 24(11):475.
[13]KOHRIYAMA K,KATAYAMA Y,TSURUSAKO Y.Relationship between primary sjogren's syndrome and auto immune thyroid disease[J].Nippon Rinsho,1999,57(8):1878-1881.
[14]MDA P E,ARNOLDO-KRAUS M D,LÓPEZIA G.et al.Autoimmune thyroiddisease inprimary sjgrencssyndrome[J].Am J Med,1995,99(5):480-484.
[15]李雅雯,李向培.干燥综合征合并自身免疫性甲状腺疾病的研究进展[J].安徽医学,2013,34(8):1262-1264.
[16]AL-AWADHI A M,OLUSI S,HASAN E A,et al.Frequency of abnormal thyroid function tests in kuwaiti Arabs with autoimmune diseases[J].Med Pfine Pract,2008,17(1):61-65.
[17]王德双,刘素荣,穆光远,等.新诊断桥本氏甲状腺炎临床特点分析[J].辽宁中医杂志,2014,41(2):291-292.
[18]沈敏宁,苏定雷,王小琴.系统性红斑狼疮合并甲状腺疾病发病的临床分析[J].江苏医药,2010,36(17):2089-2090.
[19]张晶晶,肖卫国.结缔组织病与自身免疫性甲状腺疾病临床相关分析[J].中外妇儿健康,2011,19(7):10-11.
(张西倩编辑)
Clinical characteristic analysis of primary sjogren's syndrome with thyroid diseases
Yang Ye,Xiao-mei Gao,Nan-ping Yang
(Immunology Department,Affliated Hospital of Southwest Medical University,Luzhou,Sichuan 646000,China)
Objective To discuss clinical characteristics of primary sjogren's syndrome(pSS)with thyroid diseases. Methods During 2013 to 2015,600 hospitalized patients from immunology department of Affiliated Hospital of Southwest Medical University who diagnosed with primary sjogren's syndrome and systemic lupus erythematosus(SLE)were collected.All patients were divided into sjogren's syndrome with thyroid disease group(group A,200 cases),systemic lupus erythematosus with thyroid disease group(group B,200 cases),and sjogren's syndrome without thyroid disease group(group C,200 cases),in order to analyze clinical and laboratory characteristics of sjogren syndrome with thyroid diseases.Results The average course and onset age of disease were higher from group A than that from group B,and the difference was statistical significance(P<0.05).Group A included 62 cases with hyperthyroidism(31%),108 with hypothyroidism(54%),20 with subclinical hypothyroidism(10%),and 10 with thyroid cancer(5%).Group B included 72 cases with hyperthyroidism(36%),90 with hypothyroidism(45%),32 withsubclinical hypothyroidism(16%),and 6 with thyroid cancer(3%).Their differences had no statistical significance in incidence of all kinds of thyroid diseases between group A and group B(P>0.05),but patients with hypothyroidism from the group A hadhigher FT3,TSH and TPOAb than that from group B,and the difference was statistical significance(P<0.05).Compared with group B and C,group A had a significant higher lever of thyroid stimulating hormone(TSH),thyroglobulin antibody(TGAb)and thyroid peroxidase antibody(TPOAb)(P<0.05).Compared with group B,group A had a significantly higher lever of FT3,C3,C4,RF and RO-52 positive rate(P<0.05),and significantly increased on RF,Hb and PLT(P<0.05).The incidence of proteinuria and hematuria obviously decreased(P<0.05),and the lever of serum creatinine and urea nitrogen also significantly decreased(P<0.05);Compared with group C,they were significantly higher on ANA titer,immunoglobulin G and SSA positive rate(P<0.05).Conclusions pSS could follow with thyroid disease,which is mostly showed as hypothyroidism.When pSS occurs with thyroid disease,it has certain characteristics in the laboratory examination,and leads to visceral organ damage.
primary;sjogren's syndrome;thyroid disease
R 593
A
10.3969/j.issn.1005-8982.2016.20.015
1005-8982(2016)20-0071-07
2016-02-08
