PAS疗法对脑梗死患者超敏C反应蛋白、同型半胱氨酸及颈动脉粥样硬化的影响*
2016-11-10鲁远君帅杰吕向洋文治成贺传沙
鲁远君,帅杰,吕向洋,文治成,贺传沙
(1.重庆市长寿区人民医院神经内科,重庆 401220;2.第三军医大学新桥医院神经内科,重庆 400037)
PAS疗法对脑梗死患者超敏C反应蛋白、同型半胱氨酸及颈动脉粥样硬化的影响*
鲁远君1,帅杰2,吕向洋2,文治成1,贺传沙1
(1.重庆市长寿区人民医院神经内科,重庆 401220;2.第三军医大学新桥医院神经内科,重庆 400037)
目的探讨普罗布考、拜阿司匹林、阿托伐他汀联合(PAS)疗法对急性脑梗死患者血清超敏C反应蛋白(hs-CR P)、血浆同型半胱氨酸(Hcy)水平、颈动脉内膜中层厚度(IMT)及粥样硬化斑块的影响。方法分析135例初发脑梗死患者,随机分为对照组和PAS组,分别在入院后第2天及治疗后1个月清晨抽取患者空腹静脉血3ml,采用酶免疫测定法测定血浆同型半胱氨酸水平;免疫比浊法测定血清hs-CR P水平;超声检测颈动脉IMT及斑块积分。结果对照组治疗1个月后血清hs-CR P水平明显低于治疗前(t=4.887,P=0.013);PAS组治疗1个月后血清hs-CR P水平明显低于治疗前(t=9.323,P=0.000);治疗1个月后PAS组血清hs-CR P水平明显低于对照组(t=3.326,P=0.004);对照组(t=1.670,P=0.212)、PAS组(t=0.978,P=0.449)治疗1个月后血浆Hcy水平与治疗前比较,差异无统计学意义;对照组治疗1个月后颈动脉IMT(t=2.987,P=0.031)及斑块积分(t=3.562,P=0.009)与治疗前比较明显下降;PAS组治疗1个月后颈动脉IMT(t=10.210,P=0.000)及斑块积分(t=8.756,P=0.000)与治疗前比较明显降低;治疗1个月后PAS组颈动脉IMT及斑块积分明显低于对照组(t=2.341,P=0.034;t=2.792,P=0.021)。结论AS疗法(拜阿司匹林+阿托伐他汀)及PAS疗法对急性脑梗死患者具有明显的抗炎作用,PAS疗法优于AS疗法;PAS疗法对颈动脉粥样硬化具有治疗作用,而对血浆Hcy水平没有显著影响。
脑梗死;PAS疗法;超敏C反应蛋白;同型半胱氨酸;动脉粥样硬化
阿司匹林、他汀类药物在临床治疗中,已经证明是有效的预防动脉粥样硬化和抗血栓治疗的代表药物。普罗布考是人工合成的抗氧化剂,具有抗氧化作用[1-3]。国外研究显示[4],单一使用他汀类药物及普罗布考逆转斑块的幅度有限,但两者合用在动物实验中显示,内膜厚度下降、巨噬细胞减少、有斑块逆转的作用。本实验拟通过研究普罗布考、阿司匹林、阿托伐他汀联合疗法(PAS三联疗法)对脑梗死患者颈动脉粥样硬化、血清超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)及血浆同型半胱氨酸(Homocysteine,Hcy)水平的影响,为缺血性脑卒中的防治提供科学合理的干预措施。
1 资料与方法
1.1一般资料
脑梗死患者135例。其中,男性70例,女性65例;年龄39~76岁,平均(59.71±10.55)岁,均为重庆市长寿区人民医院住院患者。纳入标准:①发病3d内入院,首次患脑梗死;经头颅CT或MRI证实,并与临床症状定位一致;②患者有脑血管病高危因素,如:高血压病、眼底动脉硬化、高脂血症、糖尿病、吸烟及肥胖等,且经颈部超声检查证实颈动脉存在粥样硬化斑块;③6个月以内未患心肌梗死以及其他动脉粥样硬化性血管病;④无肿瘤、急慢性炎症性疾病及结缔组织病;⑤无心力衰竭、肝肾功能不全;⑥同意并签署知情同意书。入院后按简单随机化分组方法将脑梗死患者分为对照组65例、PAS组70例。患者年龄、性别、血管危险因素及脑梗死分型等方面比较差异无统计学意义。普罗布考(之乐,山东齐鲁制药),拜阿司匹林(拜耳医药保健有限公司),阿托伐他汀(立普妥,辉瑞制药有限公司)。本研究经重庆市长寿区人民医院伦理委员会批准。
1.2方法
1.2.1治疗方法对照组:入院后按照脑梗死常规治疗+拜阿司匹林100 mg/d+阿托伐他汀20 mg/d(AS疗法);PAS组:常规治疗+PAS疗法(普罗布考0.5 g/次,2次/d+拜阿司匹林100 mg/d+阿托伐他汀40mg/d);两组的常规治疗一致。
1.2.2标本采集、检测脑梗死患者入院后第2天及治疗后1个月清晨安静状态下分别采集空腹肘静脉血3ml待检;采血前2d禁止进食高蛋白饮食。采用酶免疫测定法测定血浆同型半胱氨酸水平;免疫比浊法测定血清超敏C反应蛋白水平。
1.2.3颈动脉IMT及粥样硬化斑块检测由专人操作,使用GE-vivid7彩色多普勒超声诊断仪(美国GE公司),探头频率7.0~9.0 MHz,入院后第2天及治疗1个月后测定,颈动脉距离分叉处1.5 cm测定内膜中层厚度(intima-media thickness,IMT),IMT> 1.0 mm为内膜中层增厚;颈动脉粥样硬化斑块采用Crouse积分法[5](将IMT>1.2mm定义为斑块形成,分别将颈动脉孤立的动脉粥样硬化斑块最大厚度相加,不考虑斑块长度,得到两侧颈动脉斑块总积分)。
1.3统计学方法
采用SPSS 17.0统计软件进行数据处理,计量资料以均数±标准差(±s)表示,治疗前后比较用配对样本均数t检验,治疗后两组间比较用独立样本均数t检验,计数资料的比较用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1临床观察资料及不良反应
研究期间共收治急性脑梗死患者550例,符合条件的患者164例,排除拒绝签署知情同意书患者23例、1个月时失访5例及2例因不良反应退出。不良反应:实验中对照组3例出现消化道症状:恶心、腹部不适,嘱晚餐后服用症状消失;PAS组3例出现上肢及小腿肌肉疼痛,并伴有血肌酸磷酸激酶升高,2例未作处理症状消失,肌酸磷酸激酶恢复正常,其中1例症状加重退出,6例出现消化道症状,嘱患者中餐、晚餐后分别服用阿托伐他汀、拜阿司匹林,患者症状消失,其中1例因消化道出血并发贫血退出。
2.2实验组年龄、性别、NIHSS、血管危险因素及脑梗死分型比较
对照组、PAS组治疗前,两组患者比较年龄、性别、神经功能缺失评分、血管疾病危险因素及脑梗死TOAST分型,差异无统计学意义。神经功能缺失评分采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS);比较对照组、PAS组分别具有1项、2项和3项的血管疾病危险因素(高血压病、高脂血症、糖尿病、吸烟及肥胖);比较对照组、PAS组TOAST分型:大动脉粥样硬化性卒中(large-artery atherosclerosis,LAA);心源性脑栓塞(Cardioembolism,CE);小动脉闭塞型卒中(small-artery occlusion,SAO);原因不明的缺血性卒中(stroke of other undetermined etiology,SUE)。见表1~3。
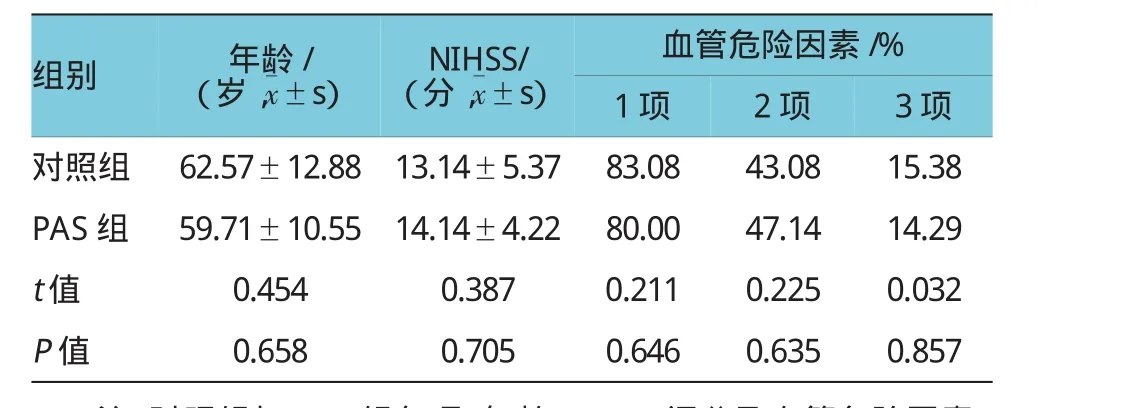
表1 对照组、PAS组治疗前年龄、NIHSS及血管危险因素比较
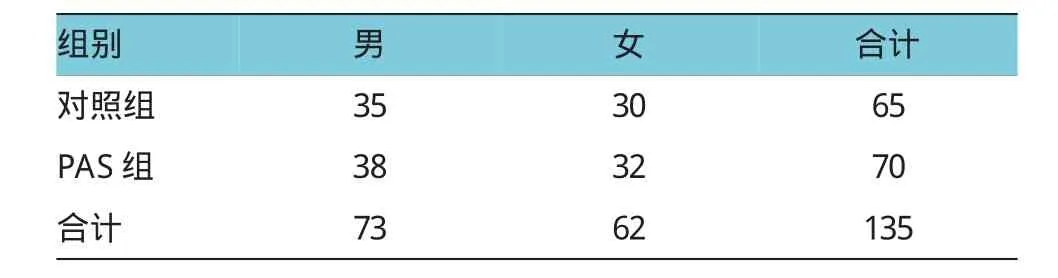
表2 对照组、PAS组治疗前性别比较例
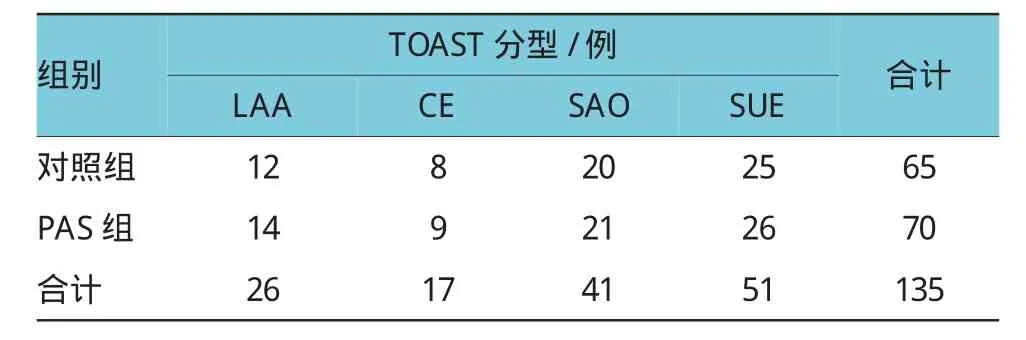
表3 对照组、PAS组治疗前脑梗死TOAST分型比较
2.3对照组、PAS组治疗前后NIHSS、TC、TG、ALT及AST比较
对照组、PAS组治疗1个月后神经功能缺失评分明显低于治疗前(t=3.038,P=0.029;t=4.072,P= 0.010);对照组、PAS组治疗1个月后总胆固醇(total cholesterol,TC)、三酰甘油(Triglyceride,TG)水平明显低于治疗前,差异有统计学意义,且PAS组治疗后总胆固醇降低更明显(t=0.521,P=0.048),而PAS组治疗后TG水平较对照组差异无统计学意义(t= 0.542,P=0.603);对照组、PAS组治疗1个月后丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate amino transferase,AST)水平明显高于治疗前,差异有统计学意义,且PAS组治疗后升高更明显(t=2.251,P=0.048;t=2.560,P= 0.035)。见表4。
表4 对照组、PAS组治疗前后NIHSS、TC、TG、ALT及AST比较(±s)
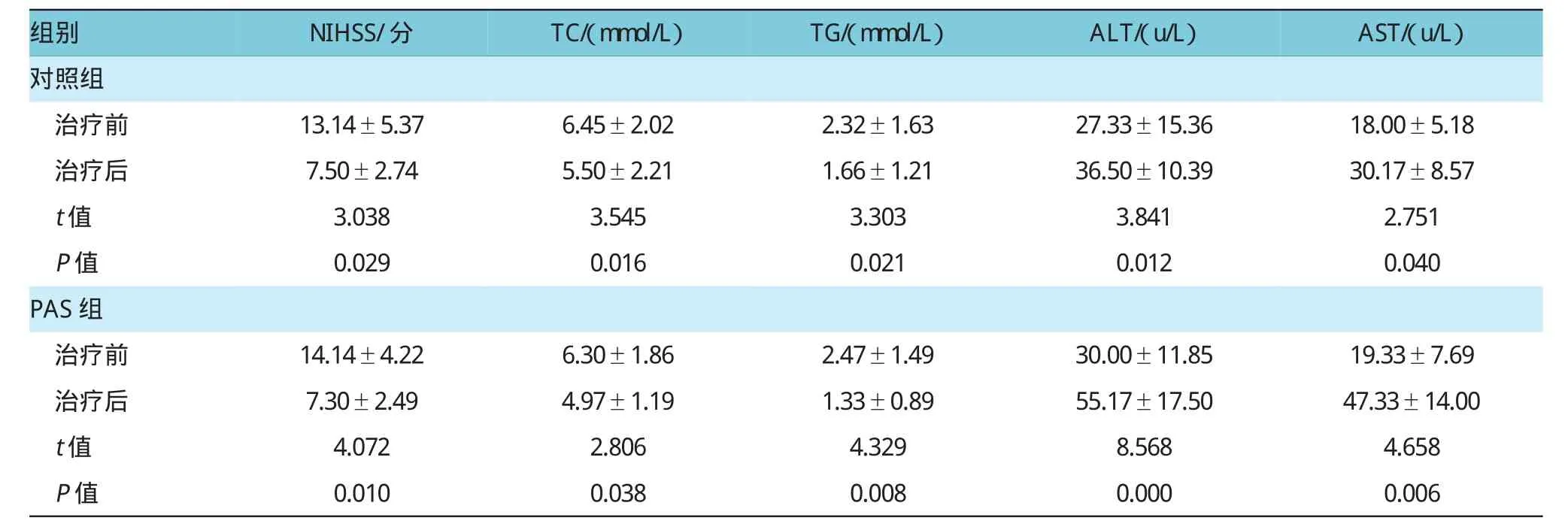
表4 对照组、PAS组治疗前后NIHSS、TC、TG、ALT及AST比较(±s)
注:NIHSS:组内治疗前后比较,P<0.05;TC:组内治疗前后比较,P<0.05;两组治疗后比较,P<0.05;TG:组内治疗前后比较,P<0.05;两组治疗后比较,P>0.05;ALT/AST:组内治疗前后比较,P<0.05;两组治疗后比较,P<0.05
组别NIHSS/分TC/(mmol/L)TG/(mmol/L)ALT/(u/L)AST/(u/L)对照组治疗前13.14±5.376.45±2.022.32±1.6327.33±15.3618.00±5.18治疗后7.50±2.745.50±2.211.66±1.2136.50±10.3930.17±8.57 t值3.0383.5453.3033.8412.751 P值0.0290.0160.0210.0120.040 PAS组治疗前14.14±4.226.30±1.862.47±1.4930.00±11.8519.33±7.69治疗后7.30±2.494.97±1.191.33±0.8955.17±17.5047.33±14.00 t值4.0722.8064.3298.5684.658 P值0.0100.0380.0080.0000.006
2.4对照组、PAS组治疗前后血尿素氮、血清肌酐及肌酸磷酸激酶比较
对照组、PAS组治疗1个月后血尿素氮(t=0.968,P=0.377;t=0.988,P=0.369)、血清肌酐(t=0.345,P= 0.744;t=0.591,P=0.580)及磷酸肌酸激酶(t=2.150,P=0.084;t=1.472,P=0.201)水平与治疗前比较,差异无统计学意义。见表5。
表5 对照组、PAS组治疗前后血尿素氮、血清肌酐及肌酸磷酸激酶比较(±s)
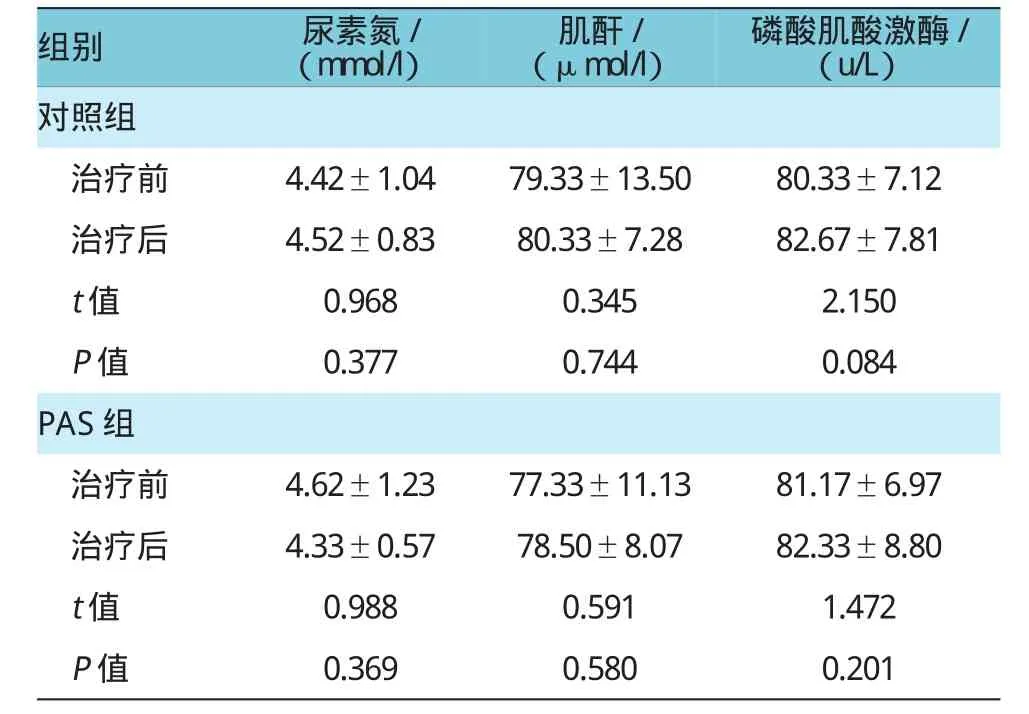
表5 对照组、PAS组治疗前后血尿素氮、血清肌酐及肌酸磷酸激酶比较(±s)
注:尿素氮/肌酐/磷酸肌酸激酶:每组治疗前后比较,P>0.05
组别尿素氮/(mmol/l)肌酐/(μmol/l)磷酸肌酸激酶/(u/L)对照组治疗前4.42±1.0479.33±13.5080.33±7.12治疗后4.52±0.8380.33±7.2882.67±7.81 t值0.9680.3452.150 P值0.3770.7440.084 PAS组治疗前4.62±1.2377.33±11.1381.17±6.97治疗后4.33±0.5778.50±8.0782.33±8.80 t值0.9880.5911.472 P值0.3690.5800.201
2.5对照组、PAS组治疗前后血清超敏C反应蛋白比较
对照组治疗1个月后血清超敏C反应蛋白水平明显低于治疗前(t=4.887,P=0.013);PAS组治疗1个月后血清超敏C反应蛋白水平明显低于治疗前(t=9.323,P=0.000),差异有统计学意义;治疗1个月后PAS组血清超敏C反应蛋白水平明显低于对照组(t=3.326,P=0.004),差异有统计学意义。见表6。
表6 对照组、PAS组治疗前后同型半胱氨酸、超敏C反应蛋白水平、颈动脉IMT及斑块积分比较(±s)
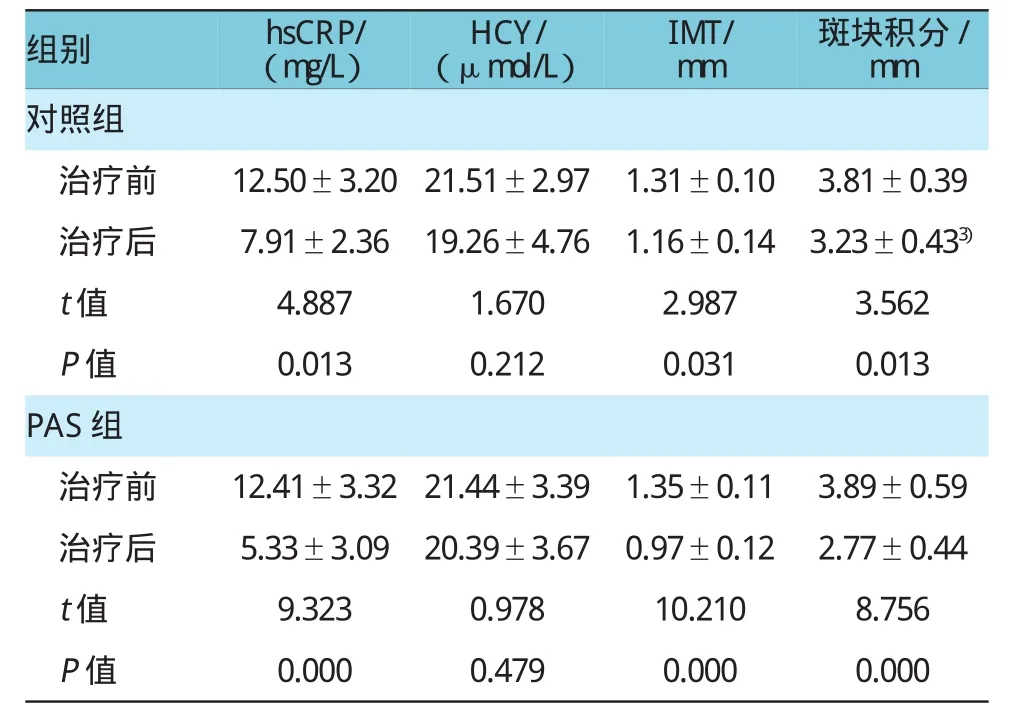
表6 对照组、PAS组治疗前后同型半胱氨酸、超敏C反应蛋白水平、颈动脉IMT及斑块积分比较(±s)
注:hsCRP:组内治疗前后比较,P<0.05;两组治疗后比较,P< 0.05;HCY:组内治疗前后比较,P>0.05;IMT/斑块积分:组内治疗前后比较,P<0.05,两组治疗后比较,P<0.05
组别hsCRP/(mg/L)HCY/(μmol/L)IMT/ mm斑块积分/ mm对照组治疗前12.50±3.20 21.51±2.971.31±0.103.81±0.39治疗后7.91±2.3619.26±4.761.16±0.143.23±0.433)t值4.8871.6702.9873.562 P值0.0130.2120.0310.013 PAS组治疗前12.41±3.32 21.44±3.391.35±0.113.89±0.59治疗后5.33±3.0920.39±3.670.97±0.122.77±0.44 t值9.3230.97810.2108.756 P值0.0000.4790.0000.000
2.6对照组、PAS组治疗前后同型半胱氨酸水平比较
对照组(t=1.670,P=0.212)、PAS组(t=0.978,P= 0.449)治疗1个月后血浆同型半胱氨酸水平与治疗前比较,差异无统计学意义。见表6。
2.7对照组、PAS组治疗前后颈动脉IMT及斑块积分比较
对照组治疗1个月后颈动脉IMT(t=2.987,P= 0.031)及斑块积分(t=3.562,P=0.009)与治疗前比较,差异有统计学意义;PAS组治疗1个月后颈动脉IMT(t=10.210,P=0.000)及斑块积分(t=8.756,P= 0.000)与治疗前比较明显降低,差异有统计学意义;治疗1个月后PAS组颈动脉IMT及斑块积分明显低于对照组(t=2.341,P=0.034;t=2.792,P=0.021),差异有统计学意义。见表6。
3 讨论
阿司匹林是在缺血性卒中预防和治疗的众多药物中研究最充分、证据最多的一类药物,其确切机制尚不明确,可能由于本品作用于炎症组织,通过抑制前列腺素或其他能引起炎症反应的物质合成而起抗炎作用;他汀类药物除具有明确的调脂作用外,其还有改善内皮功能障碍,增加一氧化氮的生物利用度,抗氧化性能,抑制炎症反应,稳定动脉粥样硬化斑块等多效性[6]。普罗布考除了具有调血脂作用以外,还具有显著的抗脂质过氧化作用,可抑制致炎因子、致动脉粥样硬化因子的基因表达和自由基介导的炎症,改善内皮舒张功能,从而抑制泡沫细胞和动脉粥样硬化斑块的形成。
动脉粥样硬化斑块的形成是一个涉及脂代谢异常、非特异性炎症反应、血管平滑肌细胞异常增殖等多种因素调控的综合过程,其过程的实质是全身血管的慢性炎症和免疫反应,颈动脉内膜中层厚度是反映颈动脉粥样硬化的最早期指标,与脑卒中、冠状动脉粥样硬化性心脏病、认知功能障碍等疾病密切相关。美国食品和药物管理局批准利用超声显像技术测定IMT作为评估动脉粥样硬化病变的替代指标,并用于预测心脑血管事件风险,PAS三联疗法的作用能抑制氧化的低密度脂蛋白的形成,对于动脉粥样硬化的形成,具有明显的干预作用[7]。
C反应蛋白(C-reactive protein,CRP)是由肝脏合成的一种全身性炎症反应急性期的非特异性标志物,CRP与脂蛋白结合,激活补体系统,产生大量终末攻击复合物,引起血管内膜损伤,释放氧自由基,促使血管痉挛,脂质代谢异常,导致动脉粥样硬化加重,因此,CRP被认为是与炎症反应程度关系最为密切的炎症因子[8],几项前瞻性、巢式病例对照研究表明[9-12],炎症标记物CRP与增加的卒中风险相关,而且,脑梗死后脑组织局部炎症级联反应是造成脑继发性损伤的主要原因之一。腔隙性脑梗死症状出现后3个月,hsCRP水平明显升高[13]。WANG等[14]研究小组发现高水平的CRP可能会使颈内动脉壁增厚的危险增加,CRP水平增高预示颈动脉狭窄≥25%,并且CRP水平越高,动脉壁增厚的趋势越明显。本研究显示,对照组、PAS组治疗后,血清hsCRP水平明显降低,而且,PAS组治疗后血清hsCRP水平明显低于对照组,而且总胆固醇、三酰甘油水平、颈动脉IMT及斑块积分均明显降低,提示AS疗法、PAS疗法具有抗炎作用,而且对高脂血症、颈动脉粥样硬化有一定的治疗作用。PAS疗法带给患者益处的同时,也应该认识到PAS疗法增加不良反应的发生,如肝功能的损害,本研究表明PAS疗法导致ALT、AST的增高,其增高的水平在可接受的范围,临床上需要定期监测肝功能,防止严重不良反应的发生。
动脉粥样硬化的危险因素除了已证实的高胆固醇血症,高血压、糖尿病、嗜烟和家族史外,高同型半胱氨酸血症也是一个独立危险因素。Hcy对脑梗死患者的预后有负面影响,随着病情加重,血浆Hcy检出率相应增加[15];腔隙性脑梗死症状发生后1个月,测定同型半胱氨酸/肌酸升高[13],Hcy也是脑卒中再发的独立危险因素,Hcy增加10μmol/L,再发卒中的危险性增加30%[16]。目前,有关他汀类药物对血浆同型半胱氨酸的影响尚未得到证实,BHANDARI等[17]研究认为,高同型半胱氨酸血症大鼠口服阿托伐他汀治疗,可明显降低血浆Hcy水平,相反,另外的研究却认为,他汀类药物对血浆同型半胱氨酸水平没有明显影响[18-21],甚至VAN等[22]研究发现,外周动脉疾病患者接受阿托伐他汀80 mg/d治疗6周,血浆同型半胱氨酸水平明显升高,同时叶酸水平也升高。本次对急性脑梗死患者研究发现,血浆HCY水平明显升高,应用AS疗法、PAS疗法治疗1月后,血浆Hcy水平没有显著变化,本研究只观察PAS疗法治疗1个月血浆Hcy的水平,以后的研究需要延长观察周期,动态地观察血浆Hcy的变化。
[1]IQBAL M,OKAZAKI Y,OKADA S,et a1.Probucol modulates iron itrilotriacetate(Fe-NTA)-dependent renal carcinogenesis and hyperproliferative response:diminution of oxidative stress[J].Mol Cell Biochem,2007,304(1/2):61-69.
[2]YOSHIKAWA T,MITANI K,KOTOSAI K,et a1.Antiatherogenic effects of cilostazol and probucol alone,and in combination in low density lipoprotein receptor-deficient mice fed with a high fat diet[J].Horm Metab Res,2008,40(7):473-478.
[3]TANOUS D,HIME N,STOCKER R,et al.Anti-atherosclerotic and anti-diabetic properties of probucol and related compounds [J].Redox Rep,2008,13(2):48-59.
[4]SAWAYAMA Y,TATSUKAWA M,KIKUCHI K,et a1.Effect oncarotidatherosclerosisofprobucolpluslevofloxacinfor Chlamydia pneumoniae infection[J].J Infect Chemother,2007,13 (2):92-98.
[5]CROUSE J R,HARPOLD G H,KAHL F R,et al.Evaluation of a scoring system for extracranialcarotid atherosclerosis extent with B-mode ultrasound[J].Stroke.1986,17(2):270-275.
[6]DAVIGNON J.Beneficialcardiovascular pleiotropic effects of statins[J].Circulation,2004,109(23):39-43.
[7]孟晓萍,王素香,张基昌.普罗布考联合降脂药物对动脉粥样硬化病人的干预治疗[J].中华医学杂志,2009,89(28):1986-1988.
[8]VILAHUR G,HERN?NDEZ-VERA R,MOLINS B,et al.Shortterm myocardialischemia induces cardiac modified C-reactive protein expression and proinflammatory gene(cyclo-oxygenase-2, monocyte chemoattractant protein-1,and tissue factor)upregulation in peripheral blood mononuclear cells[J].JThromb Haemost, 2009,7(3):485-493.
[9]RIDKER P M,CUSHMAN M,STAMPFER MJ,et al.Inflammation,aspirin,and the risk of cardiovascular disease in apparently healthy men[J].N Engl J Med,1997,336(14):973-979.
[10]RIDKER P M,HENNEKENS C H,BURING J E,et al.C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women[J].N Engl J Med,2000, 342(12):836-843.
[11]ROST N S,WOLF P A,KASE C S,et al.Plasma concentration of C-reactive protein and risk of ischemic stroke and transient ischemic attack:the framingham study[J].Stroke,2001,32(11): 2575-2579.
[12]FORD E S,GILES W H.Serum C-reactive protein and self-reported stroke:findings from the Third National Health and Nutrition examination survey[J].Arterioscler Thromb Vasc Biol, 2000,20(4):1052-1056.
[13]LAVALLÉE P C,LABREUCHE J,FAILLE D,et al.Circulating markers of endothelial dysfunction and platelet activation in patients with severe symptomatic cerebral small vessel disease[J].Cerebrovasc Dis,2013,36(2):131-138.
[14]WANG T J,NAM B H,WILSON P W,et al.Association of C-reactive proteinwithcarotidatherosclerosisinmenand women:the framingham heart study[J].Arterioscler Thromb Vasc Biol,2002,22(10):1662-1667.
[15]SYDORSKYY Y,DILWORTH D J,YI E C,et al.Intersection of the Kap 123 p-mediated nuclear import and ribosome export pathways[J].Mol Cell Biol,2003,23(6):2042-2054.
[16]BOYSEN G,BRANDER T,CHRISTENSEN H,et al.Homocysteine and risk of recurrent stroke[J].Stroke,2003,34(5):1258-1261.
[17]BHANDARI U,PATHAN R A,KUMAR V,et al.Ameliorative role of atorvastatin on methionine-induced hyperhomocysteinemia and hematological changes in albino rats[J].Indian Exp Biol, 2011,49(2):132-139.
[18]LORGERIL M,SALEN P,PAILLARD F,et al.Lipid-lowering drugs and homocysteine[J].Lancet,1999,353(9148):209-210.
[19]MALIKJ,MELENOVSKYV,WICHTERLED,et al.Both fenofibrate and atorvastatin improve vascular reactivity in com bined hyperlipidaemia(fenofibrate versus atorvastatin trial-FAT)[J]. Cardiovasc Res,2001,52(2):290-298.
[20]GIRAL P,BRUCKERT E,JACOB N,et al.Homocysteine and lipid lowering agents.A comparison between atorvastatin and fenofibrate in patients with mixed hyperlipidemia[J].Atherosclerosis,2001,154(2):421-427.
[21]SASAKI S,KUWAHARA N,KUNITOMO K,et al.Effects of Atorvastatinonoxidizedlow-densitylipoprotein,low-density lipoprotein subfractions distribution,and remnant lipoprotein in patients with mixed hyperlipoproteinemia[J].Am J Cardiol,2002, 89(4):386-389.
[22]VAN DER LOO B,SPRING S,KOPPENSTEINER R.High-dose atorvastatin treatment in patients with peripheral arterial disease: effects on platelet aggregation,blood rheology and plasma homocysteine[J].Clin Hemorheol Microcirc,2011,47(4):241-251.
(张蕾编辑)
Effect of PAS therapy on serum high-sensitivity C-reactive protein plasma homocysteine and carotid atherosclerosis in cerebral infarction patients*
Yuan-jun Lu1,Jie Shuai2,Xiang-yang Lyu2,Zhi-cheng Wen1,Chuan-sha He1
(1.Department of Neurology,People's Hospital of Changshou Chongqing,Chongqing 401220,China;2.Department of Neurology,Xinqiao Hospital,PLA Third Military Medical University,Chongqing 400037,China)
Objective To explore the effect of probucol,aspirin and atorvastatin(PAS)combination therapy on serum high-sensitivity C-reactive protein,plasma homocysteine,carotid intima-media thickness and plaque summary score in patients with acute cerebral infarction.Methods Total 135 patients with initial cerebral infarction were randomly divided into control group and PAS group.Fasting 3 ml venous blood was taken at the second day after admission and the first month after treatment.Enzyme immunoassay,immunoturbidimetric assay and color doppler ultrasonic diagnostic apparatus were used to detect plasma homocysteine level,serum high-sensitivity C reactive protein level,and detect carotid intima-media thickness and plaque summary score respectively.Results High-sensitivity C reactive protein in the control group and the PAS group were significantly decreased at the first month,and high-sensitivity Creactive protein in the PAS group was significantly decreased than the control group at the first month.Plasma homocysteine has no significant difference at the first month.Carotid intima-media thickness and plaque summary score in the control group and PAS group were significantly decreased at the first month than that before treatment,and carotid intima-media thickness and plaque summary score in the PAS group was significantly decreased at the first month.Conclusions AS(aspirin+atorvastatin)therapy and PAS therapy have significant anti-inflammatory effect on cerebral infarction patients.PAS therapy is superior to AS therapy in anti-inflammatory effects,and PAS therapy has a therapeutic effect on carotid atherosclerosist,but PAS therapy has no significant effect on plasma homocysteine level with cerebral infarction patients.
cerebral infarction;PAS therapy;high-sensitivity C-reactive protein;homocysteine;atherosclerosis
R 743.3;R 543.4
A
10.3969/j.issn.1005-8982.2016.20.014
1005-8982(2016)20-0065-06
2016-02-09
重庆市步长杯脑血管病科研项目(No:2012-3-012)
