轻度认知障碍的神经心理表现及解剖结构损害的分型研究
2016-11-10张贵丽张宏伟
董 娜, 张贵丽, 张宏伟
轻度认知障碍的神经心理表现及解剖结构损害的分型研究
董 娜1, 张贵丽2, 张宏伟3
目的 探讨不同类型的轻度认知功能障碍(mild cognitive impairment,MCI)患者人口统计学、认知损害及解剖结构损害的磁共振特点。方法 对纳入的188例MCI患者和106例认知正常对照者进行多项神经心理学量表测试,按照认知受损区域及数目将MCI分为单领域遗忘型轻度认知功能障(amnestic mild cognitive impairment with single domain,aMCI-SD)组(n=48);多领域遗忘型轻度认知功能障(amnestic mild cognitive impairmen with multiple domain,aMCI-MD)组(n=82);单领域非遗忘型轻度认知功能障(non-amnestic mild cognitive impairment with single domain,naMCI-SD)组(n=24);多领域非遗忘型轻度认知功能障(non-amnestic mild cognitive impairment with multiple domain,naMCI-MD)组(n=34)。比较5组的人口统计学、神经心理及解剖结构的磁共振特点。结果 与对照组比较,MCI患者起病年龄高且教育程度低(P<0.05)。MCI的4种亚型整体认知功能评分无差异但较对照组均有受损。MoCA亚项视空间与执行能力测试中,aMCI-MD组和naMCI-MD受损较重,其次为naMCI-SD组(P<0.05)。在MRI检测中aMCI-MD组和aMCI-SD组均较对照组的颞叶内侧萎缩(Medial temporal lobe atrophy,MTA)的视觉评分高(P<0.05),但是naMCI-SD与naMCI-MD的MTA评分与对照组比较无差异(P>0.05)。4个MCI亚组的脑白质病变、皮质脑梗死、脑皮质萎缩发生率均大于对照组。naMCI-MD组的脑白质疏松病及脑萎缩病变较aMCI-SD组和aMCI-MD组的发病率均高。aMCI-SD组中皮质下腔隙性脑梗死病变的发生率较naMCI-MD和naMCI-SD组低。结论 不同亚型的MCI患者显示海马、颞叶内侧面萎缩变性及血管病相关的病理改变的差异,揭示了临床认知损坏与病理学改变存在一致性,为MCI的正确诊断及治疗选择提供详尽的临床依据。
轻度认知功能障碍; 亚型; 磁共振; 神经心理测试; 颞叶内侧萎缩
随着人口老龄化和全民生活质量的提高,人们对痴呆的认知程度有所增加,并越来越关注痴呆的前驱状态——轻度认知功能障碍。1996年Petersen首次提出轻度认知功能障碍(MCI)的概念[1,2],MCI被认为是处于正常认知衰退与早期痴呆之间的一种极不稳定的过渡状态,尚无明确符合痴呆症状及体征,但是很大比例的MCI将会进展为痴呆。临床上,MCI按照是否有情景记忆损害分为遗忘型轻度认知功能障(aMCI)和非遗忘型轻度认知功能障(naMCI),按照累及认知域的数目将aMCI分为单领域遗忘型轻度认知功能障(aMCI-sd)和多领域遗忘型轻度认知功能障(aMCI-md);naMCI也分为单领域非遗忘型轻度认知功能障(naMCI-sd)和多领域非遗忘型轻度认知功能障(naMCI-md)。以往Petersen 和Morris[3,4]研究发现不同亚型的MCI其病因型及病理学特点是具有明显的异质性。MRI影像可以作为一种检测不同类型MCI的脑组织病理解剖结构损害的重要手段,在研究中应用越来越普遍。但以往的研究[5,6]并未将不同类型的MCI的MTA视觉评分、脑白质病变、脑萎缩及皮质下腔隙性脑梗死综合研究。因此本研究将进一步揭示不同类型的MCI的病因学差异特点,评价各亚型MCI的临床神经心理表现,并应用MRI检测分析其MTA视觉评分、脑白质病变、脑萎缩及皮质下腔隙性脑梗死改变特点。有利于早期发现MCI并揭示其病因学及病理学特征不同,有利于早期预测其进展及采取干预措施。
1 对象与方法
1.1 对象 根据Petersen[7,8]提出的MCI的诊断标准”将2011~2014年天津市环湖医院神经内科门诊的55~82岁诊断为MCl的患者及自愿参加本研究的认知正常对照者作为研究对象。MCl患者纳入标准:(1) 年龄55~82岁,自愿参加本研究知情同意;(2) 有记忆力下降的主诉;(3) 日常生活活动能力基本正常;(4) CDR评分0.5分。排除标准:(1) 其他中枢神经系统器质性疾病(帕金森病、脑炎、肿瘤、癫痫等);(2) 严重精神科疾病及痴呆者;(3) 药物滥用者;(4) 有MRI影像检查禁忌证者;(5) 拒绝参与调查者。根据纳入与排除标准符合共纳入MCI患者188人,并分为4个亚组:(1) aMCI-SD组 (n=48);(2) aMCI-MD组 (n=82);(2) naMCI-SD组 (n=24);(4) naMCI-MD组 (n=34) 。认知正常对照组(control组,n=106)的入组标准:年龄55~82岁,自愿参加本研究知情同意,无记忆力下降主诉且无计算力、定向力、执行功能减退等症状。神经心理认知评估正常,能够独立正常生活,且无服用影响认知药物病史者。
1.2 方法 通过横断面调查,获得MCI的人口统计学特点,并对其神经心理认知评估,同时应用MRI扫描比较其MTA视觉评分、脑白质病变、脑萎缩及皮质下腔隙性脑梗死等解剖病理损害。
1.2.1 神经心理评估 在双盲分析情况下,由专业神经心理医师对所有入组对象进行神经心理学检查。测试主要观察5个认知领域如记忆、注意力、语言、视空间结构能力及执行功能。(1)总体认知功能的评估:本研究选择应用Mini-Mental Status Exam (MMSE)及 MoCA等进行覆盖多认知域的测试量表对参与者进行总体认知功能的评估同时进行亚项目的测试计分;(2)情景记忆的测评:应用延迟回忆进行评估;(3) 语言能力的评估:应用波士顿命名测试 (Boston Naming Test,BNT) 对受试者的语言能力进行评估;(4)视空间、执行功能评定:应用画钟实验(Clock Drawing Test,CDT)及MoCA亚项目评估受试者的视空间和执行能力;(5)日常生活能力的评定:应用日常生活功能量表(Activities of Daily Living,ADL);(6)认知损害程度评定:应用临床痴呆评定量表(Clinical Dementia Rating scale,CDR)来检测受试者认知损害或痴呆的严重程度。
1.2.2 MCI的诊断标准 根据欧洲阿尔茨海默病联合会MCI工作组的MCI诊断标准[2,9]包括以下3点:(1)认知功能下降:主诉或知情者报告的认知损害,而且客观检查有认知损害的证据;和(或)客观检查证实认知功能较以往减退;(2)日常基本能力正常,复杂的工具性日常能力可以有轻微损害;(3)无痴呆。
1.2.3 MRI影像 结构MRI的图像采集:所有研究对象均使用美国GE公司signa l 5T HorizonLx磁共振成像系统行扫描。且均行矢状位T2加权像,横轴位T1加权像、T2加权像,施行轴位液体衰减翻转回复成像(FLAIR)及弥散权重成像(DWI)序列平面回波成像扫描。冠状位T1加权像。加权像同波时间(TE)为16~25 ms,重复时间(11R)为400~600 ms;B加权像TE为85~102 ms,TR为2000~4000 ms:FLAIR序列TE为1000 ms,TR为10000 ms,反转时间(TI)为2000 ms。DWI序列单次激发,弥散梯度因子(B)=800或1000。扫描矩阵为(192~256)×(192~256),采样2~3次,扫描层厚为6 mm,间距2 mm。MTA视觉评分可以作为结构MRI影像中定量评估海马及内侧颞叶变性萎缩的参数指标,参照表1可见评分范围0~4分之间5个等级,MTA评分大于或等于2分时提示有海马的萎缩及高度减低[10]。根据MTA视觉评分标准(见表1)对各组受试者的海马的体积及内侧颞叶的萎缩情况进行视觉定量评分分析。同时MRI也显示了各受试者的脑白质病变、腔隙性梗死及皮质脑组织萎缩情况。

表1 颞叶内侧萎缩视觉评分表(MTA)

2 结 果
2.1 人口统计学结果 表2显示在188例MCI的研究对象中,aMCI-SD为48例(25.5%),aMCI-MD为82例(43.6%),naMCI-SD为24例(12.7%),naMCI-MD为34例(18.0%)。MCI各亚组起病年龄高于对照组,教育程度明显低于对照组(P<0.05),各亚组与对照比较无性别差异(P>0.05)。
2.2 神经心理评估分析 神经心理评估测试显示,MMSE和MoCA测试中,显示aMCI表现突出的情景记忆评分减低,可能有或无其他区域受损。 aMCI-SD组表现突出的情景记忆评分减低,而其他认知区的得分基本正常,且aMCI-SD组较aMCI-MD的延迟回忆评分损害严重。 MoCA总分在naMCI-SD组和aMCI-SD组较高,其次为naMCI-MD组;其中aMCI-MD组的最低。MoCA亚项目视空间与执行能力的测试中,与对照组比较,aMCI-SD组无损坏表现,naMCI-SD组损坏较轻,而aMCI-MD组和naMCI-MD组损坏程度相似且较重。其中,画钟实验(CDT)的评分,在naMCI-MD组表现损害最重,其次aMCI-MD组而naMCI-SD组损坏最轻。在波士顿命名测试(BNT)中,aMCI-MD组、naMCI-MD组及naMCI-SD损坏的程度无差异(P>0.05)。
2.3 MRI分析 我们的研究过程中,结构MRI颞叶内侧萎缩的视觉分析MTA评分显示,所有 MCI患者MTA评分值在0~3分之间,均未达到4分。aMCI-MD组和aMCI-SD组均较对照组MTA评分高,而且aMCI-MD组的评分最高,但是naMCI-SD与naMCI-MD的MTA评分与对照比较无明显统计学差异。4个亚组的脑白质病变、皮质脑梗死、脑皮质萎缩比率均大于对照组。naMCI-MD组的脑白质疏松病及脑萎缩病变均较aMCI-SD组和aMCI-MD组的发病率均高。aMCI-SD组中皮质下腔隙性脑梗死病变的发生率较naMCI-MD和naMCI-SD组低。

表2 人口统计学结果
与对照组比较*P<0.05
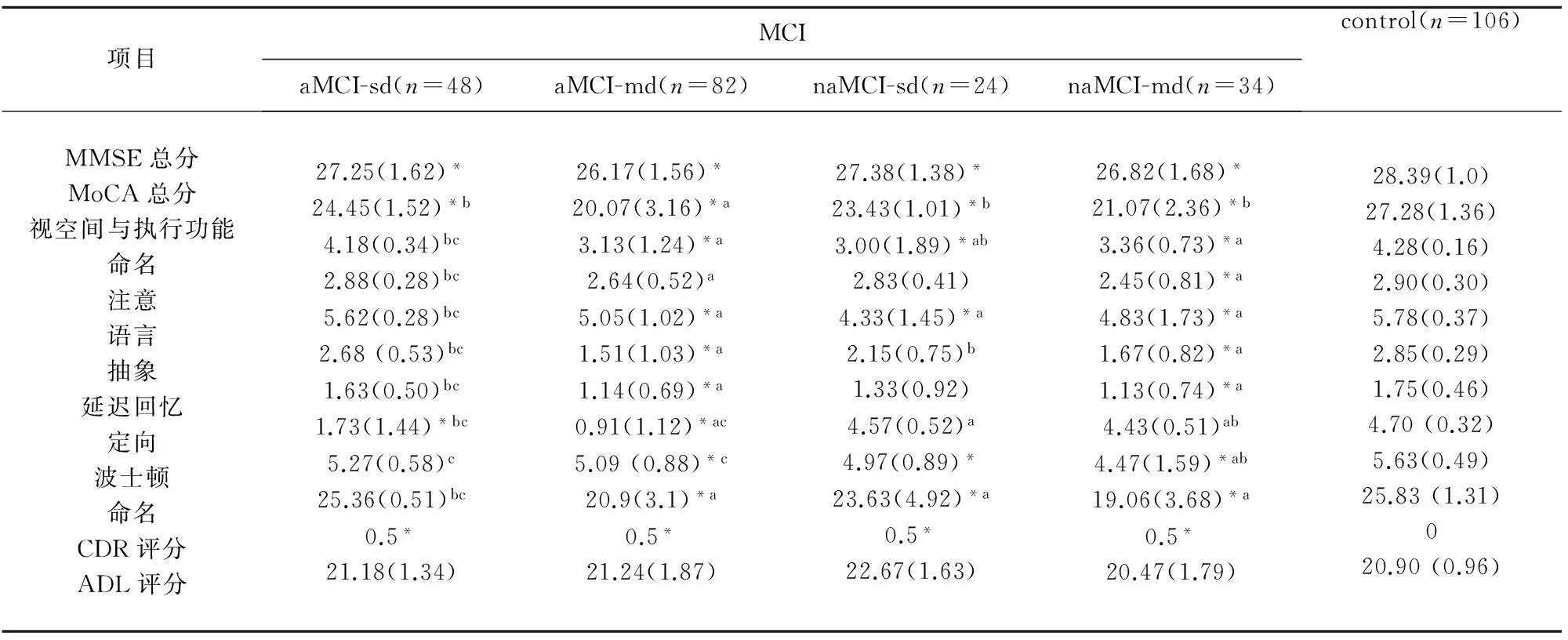
表3 神经心理量表评分结果
与对照组比较*P<0.05;与aMCI-sd比较aP<0.05;与aMCI-md比较bP<0.05;与naMCI-md比c较P<0.05
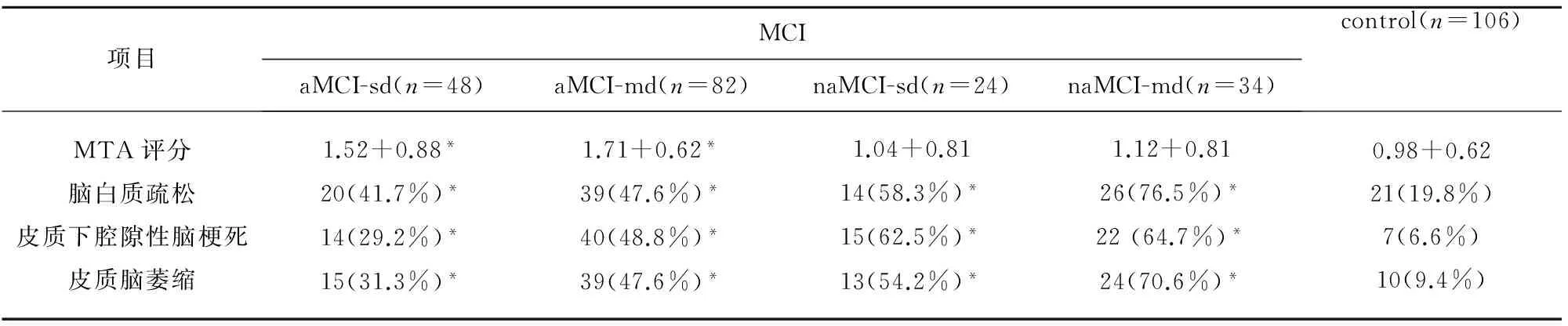
表4 不同类型MCI患者的MRI扫描结果
与对照组比较*P<0.05

表5 不同类型MCI患者的MRI扫描结果比较
①为aMCI-sd,②为aMCI-md,③为naMCI-sd,④为naMCI-md
3 讨 论
本研究采用横断面分析对于中国认知障碍门诊入选的55~82岁的MCI患者及自愿参加本研究的认知正常对照者,并将MCI分为aMCI-MD、aMCI-SD、naMCI-MD及naMCI-SD组4个亚型进行研究。人口学统计研究单因素分析后显示高龄及低文化程度是各型MCI认知损坏的共同危险因素,aMCI-MD和naMCI-MD的女性患病率偏高,且各型MCI的发病年龄及教育年限方面无明显区别。
同以往的研究[8,11]相似,我们的神经心理测试研究中发现遗忘型MCI(包括aMCI-sd和aMCI-md)以情景记忆损害为核心症状,aMCI-MD患者主要表现为延迟回忆障碍,同时合并的执行功能、视空间功能受损最多见,也有报道[12,13]指出除记忆区域受损外还有其他领域受损的aMCI-MD患者有更高的进展为痴呆的风险,而那些单纯遗忘型的MCI即aMCI-SD患者较aMCI-MD更容易恢复为认知正常。而非遗忘型MCI(包括naMCI-sd和naMCI-md)的发病率较遗忘型MCI低,特别是单领域非遗忘型MCI(naMCI-SD)在临床中更加罕见[14]。我们研究也发现非遗忘型MCI无明显情景记忆功能受损,主要表现为视空间和执行功能受损而注意力及抽象、定向力及语言功能的损坏次之。而且naMCI-MD以执行功能的损坏为典型表现,另外语言功能及视空间功能损坏也比较严重,而注意力及抽象、定向力损坏较轻。不同亚型的MCI表现出明显的异质性[3,4,15,16],除了临床表现特点不同外,其病因学和病理学改变也存在明显的本质不同。aMCI主要表现阿尔茨海默病(Alzheimer’s disease,AD)的早期病理特征,多易于进展为AD。而naMCI的情景记忆损坏不明显,主要表现出与血管病相关的病理特征或其他疾病病理,通常更易于进展为非AD型痴呆如血管性痴呆或路易体痴呆等[17]。故下面我们的研究将应用MRI的研究不同亚型MCI的MTA视觉评分、脑白质疏松病变、皮质脑萎缩及皮质下腔隙性脑梗死来阐明其不同病理学改变特点。
首先我们应用MRI扫描比较各种类型 MCI患者的颞叶内侧面及海马萎缩变性严重程度的MTA视觉评分发现两种遗忘性MCI均匀有明显颞叶内侧面及海马萎缩,多领域遗忘型MCI患者的颞叶内侧面及海马萎缩更加明显。与以往关于不同亚型的MCI脑组织结构的比较研究[18,19]基本一致,遗忘型MCI最常见的脑局部变化是海马和颞叶内侧皮质的萎缩,而且研究报道也指出海马的萎缩是早期的AD发生病理变化的标志[19,20]。所以推断遗忘型MCI可能与AD有共同的病理基础,解释了遗忘型MCI易于进展转化为AD型痴呆的病理原因。正如以往研究显示遗忘型MCI的内嗅皮质和海马体积的变化还是预示正常的认知状态进展为MCI及MCI转化为AD的可靠指标[13,21],而且左侧海马体积的预测价值更高[18]。我们研究显示aMCI-sd患者发生皮质下脑梗死的比例较其他两种非遗忘亚型的MCI少,且aMCI-sd患者发生脑白质疏松及皮质脑萎缩相较多领域非遗忘性的MCI患者的比率低,也说明aMCI-sd认知损坏主要是以海马萎缩、颞叶内侧变性萎缩是为主要病理基础,而非脑组织的血管病变。我们研究也发现aMCI-sd与aMCI-md的海马萎缩、颞叶内侧变性萎缩程度相似,但aMCI-md同时也合并较多发生的皮质下脑梗死,所以我们分析认为aMCI-md的认知损害是以海马萎缩、颞叶内侧变性萎缩为主导病理损害,同时有脑血管病变共同作用。与正常对照组比较,单领域和多领域非遗忘型MCI的MTA评分无明显差异,可以推断单领域非遗忘型和多领域非遗忘型MCI的认知损坏的解剖学病理基础可能与颞叶内侧面及海马萎缩相关性不大,但是非遗忘型MCI有较大比例的合并皮质下脑梗死、脑萎缩、脑白质疏松,也暗示非遗忘型MCI的病理本质不同于AD,脑组织的血管病变是导致其认知领域损害的主要病理基础,故可以推断非遗忘型MCI进展为非AD型痴呆如血管性痴呆、额颞叶痴呆或路易体痴呆及混合性痴呆的可能性较大。我们的研究揭示了神经心理上定义的各型MCI的病理学特点,说明不同类型MCI的病理解剖学改变导致其不同神经心理表现,同时也提供了其进展为痴呆的预测客观证据。
本研究首次对4种亚型的MCI患者从人口统计学、神经心理量表评定、MRI影像等方面进行横断面分析及综合比较,总结了不同亚型的MCI患者临床表现和病理学的异质性特点和特征,我们的研究将为MCI的正确诊断及分型提供了更加详尽的临床依据和客观证据,而且推断结合MRI扫描也可以作为预测MCI转化的指标,针对其病理改变不同早期干预治疗,以降低和延缓 MCI向痴呆的转化,对提高老年人的寿命和生活质量具有深远的意义。
[1]Petersen R,Smith G,Waring S,et al. Mild cognitive impairment clinical characterization and outcome[J]. Archives Neuro,1999,56:303-308.
[2]Petersen R. Mild cognitive impairment as a diagnostic entity[J]. J Int Med,2004,256:183-194.
[3]Petersen RC,Morris JC. Mild cognitive impairment as a clinical entity and treatment target[J]. Archives Neuro,2005,62:1160-1163.
[4]Petersen R,Ivnik R,Boeve B,et al. Outcome of clinical subtypes of mild cognitive impairment[J]. Neurology,2004,62:295.
[5]Lehman M,Koedam EL,Barnes J,et al. Visual ratings of atrophy in MCI:prediction of conversion and relationship with CSF biomarkers[J]. Neurobiol Aging,2013,34:73-82.
[6]Norman MA,Evan JD,Miller WS,et al. Demographically corrected norms for the California Verbal Learning Test[J]. J Clin & Exp Neuropsy,2000,22:80-95.
[7]Petersen RC,Smith GE,Waring SC,et al. Aging,memory,and mild cognitive impairment[J]. Int Psychogeriatr,1997,9:65-69.
[8]Stoub TR,Rogalski EJ,Leurgans S,et al. Rate of entorhinal and hippocampal atrophy in incipient and mild AD:Relation to memory function[J]. Neurobiology of Aging,2008,31(7):1089-1098
[9]Winblad B,Palmer K,Kivipelto M,et al. Mild cognitive impairment:beyond controversies,towards a consensus:report of the International Working Group on Mild Cognitive Impairment[J]. J Intern Med,2004,256(3):240-246.
[10]Pereira JB,Cavallin L,Spulber G,et al. Influence of age,disease onset and ApoE4 on visual medial temporal lobe atrophy cut-offs[J]. J Intern Med,2014,275:317-330.
[11]Toure K,Coume M,Sow PG,et al. Prevalence of dementia varied with age,education and social network in Senegalese elderly population of patients utilizing the Medico-Social and University Centre of IPRES,Dakar-Senegal[J]. Int J Med & Medical Sci,2012,4(2):33-38.
[12]Jak AJ,Bondi MW,Delano-Wood L,et al. Quantification of five neuropsychological approaches to defining mild cognitive impairment[J]. American J Geriatric Psychiatry,2009,17(5):368-375.
[13]Martin SB,Smith HR,Schmitt FA,et al. Evidence that volume of anterior medial temporal lobe is reduced in seniors destined for mild cognitive impairment[J]. Neurobiol Aging,2010,31(7):1099-1106.
[14]Ramlall S,Chipps J,Pillay BJ,et al. Mild cognitive impairment and dementia in a heterogeneous elderly population:prevalence and risk profile[J]. African J Psychiatry,2013,16(6):456-465.
[15]Palmer K,Backman L,Winblad B,et al. Mild cognitive impairment in the general population:Occurrence and progression to Alzheimer disease[J]. American J Geriatric Psychiatry,2008,16:603-611.
[16]Ravaglia G,Forti P,Maioli F,et al. Conversion of mild cognitive impairment to dementia:Predictive role of mild cognitive impairment subtypes and vascular risk factors[J]. Dementia & Geriatric Cogn Disord,2006,21:51-58.
[17]Storandt M,Grant EA,Miller JP,et al. Longitudinal course and neuropathologic outcomes in original vs. revised MCI and in pre-MCI[J]. Neurology,2006,67:467-473.
[18]. Korf ES,Wahlund LO,Visser PJ,et al. Medial temporal lobe atrophy on MRI predicts dementia in patients with mild cognitive impairment[J]. Neurology,2004,63:94-100.
[19]Becker JT,Davis SW,Hayashi KM,et al. Three-dimensional patterns of hippocampal atrophy in mild cognitive impairment[J]. Arch Neurol,2006,63:97-101.
[20]Reitz C,Tang M,Manly J,et al. Hypertension and the risk of mild cognitive impairment[J]. Archives Neuro,2007,64:1734-1740.
[21]Whitwell JL,Przybelski SA,Weigand SD,et al. 3D maps from multiple MRI illustrate changing atrophy patterns as subjects progress from mild cognitive impairment to Alzheimer’s disease[J]. Brain,2007,130:1777-1786.
The Study of Neuropsychological Performence and Anatomic Structure Impaiment by MRI in Different Subtypes of Mild Cognitive Impairment
DONGNa,ZHANGGuili,ZHANGHongwei.
(DepartmentofElectrophysiology,HuanHuHospital,Tianjin300140,China)
Objective To evaluate the demographic features,cognitive impairments and To evaluate the demographic features,cognitive impairments and structure of the pathological anatomy by MRI in different MCI subtypes. Methods The 188 subjects with MCI and 106 normal cognitive controls were systematically evaluated with Neuropsychological tests and performed by MRI scans. According to Petersen’s standards,MCI patients were divided into 48 cases with aMCI-sd,82 cases with aMCI-md,24cases with naMCI-sd,34 cases with naMCI-md groups. To compare different demography,cognitive impairments and structure of the pathological anatomy among the five groups. Results Compared with control,all the subtypes of MCI were higher in age onset but lower in education (P<0.05). All MCI subtypes appeared global cognitive impairment compared with control. There were no statistical differences in global scores among MCI subtypes. MoCA scores in the aMCl-sd and naMCl-sd group were higher than others,which in aMCI-MD was the lowest. In visuospatial and executive function test,there were no statistical differences between control and aMCI-sd groups (P<0.05). The aMCI-MD and naMCI-MD groups coordinatively display greater more severe impairment than naMCI-SD group in visuospatial and executive function. Through MRI scans,our studies showed higher visual rated MTA sores were observed in aMCI-MD and aMCI-SD subjects compared with controls,while no significant difference presented in naMCI-MD and naMCI-SD subjects. Compared with controls,the higher prevalence of white matter hyperintensities (WMH),cortical cerebral infarction and cerebral cortical atrophy were showedshown. Lower prevalence of white matter hyperintensities (WMH) and cerebral cortical atrophy were observed in aMCI-MD and aMCI-SD subjects than naMCI-MD subjects. Compared with aMCI-SD subjects,higher prevalence of cortical cerebral infarction in naMCI-MD and naMCI-SD subjects were observed. Conclusion Different subtypes of MCI demonstrate the different characteristics of hippocampus,medial temporal lobe atrophy and pathology of cerebrovascular. The study further underlie the association of clinical cognitive impairment and pathology. The detailed evidences were supplied for diagnosis and treatment strategies of MCI.
Mild cognitive impairment; Subtype; Neuropsychological tests; MTA; MRI
1003-2754(2016)01-0049-05
2015-09-10;
2015-12-11
(1.天津市环湖医院电生理科,天津 300140;2.首都医科大学宣武医院神经内科,北京 100053;3.北京市海淀区妇幼保健院乳腺科,北京 100060)
张贵丽,E-mail:guiliz1980@163.com
R749.1
A
