一氧化氮合酶基因转染预防兔蛛网膜下腔出血后脑血管痉挛的实验研究
2016-11-10伍伟俊钱锁开
伍伟俊, 张 珑, 钱锁开
一氧化氮合酶基因转染预防兔蛛网膜下腔出血后脑血管痉挛的实验研究
伍伟俊1, 张 珑2, 钱锁开2
目的 通过血管内转染内皮型一氧化氮合酶(eNOS)基因的方法,结合脑动脉病理学和超微结构观察,探讨eNOS基因转染对蛛网膜下腔出血后脑血管痉挛的影响及其可能机制。方法 采用枕大池二次注血法建立兔蛛网膜下腔出血后迟发性脑血管痉挛模型。通过颈动脉微泵持续滴注方法进行基因转染。45只兔随机分为对照组、SAH组、AdeNOS组。各组分别于造模7 d后进行灌注固定取脑动脉行病理学和超微结构观察;测量大脑中动脉直径,同时免疫组化检测eNOS的表达。结果 枕大池二次注血法造模后,血液广泛聚积于蛛网膜下腔,以基底池为主;免疫组化证实AdeNOS组7 d重组eNOS基因表达,重组eNOS主要表达于内皮质。7 d脑组织HE染色显示AdeNOS组脑动脉平均直径较SAH组增大;电镜下SAH组血管痉挛明显,海马神经元细胞肿胀,结构不完整,细胞核固缩,线粒体空泡化,AdeNOS组损伤明显减轻。结论 采用颈动脉微泵持续滴注方法转染eNOS基因至兔脑动脉可缓解蛛网膜下腔出血后迟发性脑血管痉挛,且这一效应可能通过增加内皮细胞重组内皮型一氧化氮合酶表达水平而实现。
蛛网膜下腔出血; 脑血管痉挛; eNOS
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是威胁人类健康的重要疾病之一,死亡及致残率极高。 SAH的主要致死及致残因素是出血本身、脑血管痉挛(cerebral vasospasm,CVS),其中脑血管痉挛是蛛网膜下腔出血住院患者的最主要致死及致残因素[1~3]。颅内动脉瘤破裂造成SAH后脑血管痉挛的发生率极高,在血管造影上证实有血管痉挛的比率可高达30%~70%,约20%~30%出现明显神经损害的症状及体征,甚至危及患者的生命。自从Ecker等[4]于1951年首先报道了蛛网膜下腔出血后出现脑血管痉挛的现象以来,国内外对SAH诱发的脑血管痉挛的机制进行了大量的研究。SAH后红细胞的溶解和血红蛋白的释放及氧化过程与脑血管痉挛的时间进程一致,故目前认为血红蛋白是SAH后迟发性血管痉挛的主要启动因素。近年来,脑血管病特别是脑动脉瘤的治疗手段发展迅速,通过血管内介入方法已经成为许多发达国家的首选治疗方法之一。因此,对于动脉瘤破裂导致的蛛网膜下腔出血患者,在血管内介入治疗动脉瘤的同时,将防治血管痉挛的外源eNOS(endothelial nitric oxide synthase,eNOS)基因导入脑血管,将可能达到提高治疗的效果。本实验通过建立二次SAH模型,观察SAH后脑动脉的病理变化及内皮型一氧化氮合酶基因对它的影响,进一步探讨SAH 后CVS发生的机制。
1 材料与方法
1.1 动物及分组 新西兰大白兔45只(购自南昌大学医学院实验动物中心),雌雄不限,体质量2.5~3.3 kg。按将动物随机分为3组:(1)对照组;(2)SAH组,制作SAH模型。(3)AdeNOS组,携带eNOS基因重组腺病毒(eNOS gene recombinant adenovirus,AdeNOS)由第二军医大学微生物教研室提供,制作SAH模型前用AdeNOS预处理。
1.2 兔SAH模型的制备 大白兔枕部剃毛,消毒后于枕部中线作一直切口,长2.5 cm,锐性分离直达寰枕筋膜,充分显露寰枕部,用18 G套管针与躯体成角约30°穿刺枕大池;退出针芯,此时可见清亮脑脊液流出,取自体耳中央动脉的血2.5 ml(非抗凝),缓慢注入枕大池内;退出套管针,局部压迫后,缝合切口,取侧卧头低30°位放置30 min,使血液集积在脑基底池。SAH组和AdeNOS且均在首次注血后48h,由兔耳中央动脉取血2.5 ml,按上述方法,再次注入枕大池内。对照组动物先后2次枕大池内注入等量生理盐水。
1.3 血管内滴注AdeNOS 制作方法:0 d,兔第一次枕大池注血前,颈部正中切开,暴露右侧颈总动脉、颈内、外动脉系统。颈外动脉远端结扎,动脉夹夹于颈总动脉近心端。颈外动脉结扎近端剪一小切口,取留置针从切口逆行插入,头端置于颈外动脉起始部,固定微导管,微导管另一端通过注射针头、二通连于微泵上的注射器。采用分段临时阻断滴注法[5],微泵速度为0.6 ml/h,重组腺病毒滴度为8×1010pfu/ml。在滴注携带目的基因腺病毒的开始时用临时阻断夹阻断颈总动脉血流20 min,然后放开血流20 min,后再阻断颈总动脉血流20 min,微泵持续滴注重组腺病毒共1 h,共0.6 ml。滴注完毕后,退出留置针,颈外动脉残端用丝线结扎。缝合颈部切口。颈部操作完成后行第一次枕大池自体血注入。
1.4 动物的观察 按照Endo[6]神经功能评分标准,记录手术前后各组动物饮食(以标准颗粒饲料、自来水喂养) 、精神状态、活动情况及神经功能变化等指标。将SAH 后兔进食量减少的程度分为4 级:1 级为全量(100%);2 级为>50%但<100%;3 级为<50%;4 级为0。神经功能根据动物精神状态及运动情况分为4级:1 级,活动正常(无神经功能障碍);2 级:轻度或可疑神经功能障碍(如精神差、嗜睡、活动减少等);3 级:中度神经功能障碍(肢体无力、跛行、单瘫等);4 级:重度神经功能障碍(划圈运动、行走困难、四肢瘫痪等)。
1.5 灌注固定及电镜标本制作 所有白兔造模7 d后,以3%戊巴比妥钠麻醉,暴露心脏,灌注固定。先以生理盐水1000 ml 快速滴注,继以4%多聚甲醛1000 ml灌注,前500 ml 快速滴完,后500 ml 缓慢滴注,灌注时间约为2 h。迅速开颅取右侧大脑中动脉及周围少许脑细胞,并于电镜固定液中后固定8 h。将固定的组织经0.1 mol/l磷酸缓冲液漂洗,除去残留固定剂;乙醇梯度脱水;将组织置入纯丙酮液中浸透过夜,Epan812脱色,制成半薄切片,光镜固定视野后经枸橼酸铅乙酸铀染色。日立H600电镜观察并摄片。
1.6 光镜标本制作 断头取脑后立即置于10%甲醛溶液内固定过夜,各组分别取右侧大脑中动脉,置于4%多聚甲醛内固定4 h后,经梯度酒精脱水,二甲苯透明,石蜡包埋。修成厚4 μm块,行HE染色以及免疫组化检测eNOS。常规酒精脱水,石蜡包埋,染色过程包括5个内容:脱蜡,染色,脱水,透明和封固。
1.7 免疫组化判断标准及方法 从染色阳性细胞数判定染色强度,阳性细胞数的计量方法为:每个标本随机选取1张切片,每张切片观察5个高倍镜视野,计数100个细胞中阳性细胞数的数目,阳性细胞数为0者记为(-);<5%为(+);5~<25%为();25~<50%为();≥50%为()。同一张照片由2位病理科医师独立观察后一起做出判断。结果判断:eNOS阳性染色定位于胞浆,因此表达阳性的细胞主要在胞浆着色,呈弧形或散在棕黄色。

2 结 果
2.1 动物的一般情况 SAH后所有兔均有不同程度的神经功能异常,其表现为反应淡漠,食纳差、运动减少、毛发杂乱,颈项强直,肢体瘫痪等。大部分兔注血后出现四肢抽搐,角弓反张,约15~30 s后缓解。动物行为异常以注血管当日明显,次日略有缓解,二次注血后症状更为加重,以3~7 d为著。AdeNOS组1 d内行为异常较SAH组明显,如拒食,嗜睡等,可能与颈部手术有关,3 d后均有所缓解。
2.2 兔脑血管病理变化
2.2.1 光学显微镜下所见 对照组未见明显组织学改变,大脑中动脉管壁较薄,血管内膜完整,内皮细胞无坏死、脱落,形成连续的单细胞层,胞核无固缩、浓染;内弹力层平整、无皱缩和断裂;血管平滑肌细胞呈扁平状,细胞器完整(见图1、图2)。SAH组大脑中动脉管腔变窄,同时管壁增厚;血管内膜出现皱褶,内皮细胞向管腔突起,胞质中见有空泡形成,部分细胞胞核浓染固缩;内弹力层皱起,平滑肌细胞肥大、扭曲变形(见图3、图4)。AdeNOS组大脑中动脉管壁未见增厚,血管内膜完整,内皮细胞无坏死、脱落,内弹力层平整、无皱缩和断裂;血管平滑肌细胞呈扁平状,细胞器尚完整(见图5、图6)。用Image Pro Plus 6.0全自动图象分析系统测定大脑中动脉内径长。对照组、SAH组及AdeNOS组血管直径分别为(0.52±0.034) mm、(0.34±0.021) mm、(0.49±0.045) mm。SAH组与对照组、AdeNOS组血管直径之间比较,有显著性差异(P<0.05);但AdeNOS组与对照组比较,二者无显著性差异(P>0.05)。
2.2.2 透射电镜下超微结构 对照组见血管内皮细胞及平滑肌细胞结构基本正常,胞核完整,平滑肌纤维排列整齐,核周细胞器丰富、完整(见图7、图8)。SAH组表现为血管内皮细胞变方圆,肿胀、变性、部分坏死,胞浆电子密度下降,有的细胞内含有空泡,细胞间紧密连接欠完整,部分内膜脱落。平滑肌细胞不规则,肿胀明显,部分细胞器丧失,细胞结构不完整(见图9~图11)。AdeNOS组痉挛程度明显轻于SAH组,但与对照组比较仍可发现血管内皮细胞连接轻散,无内皮细胞脱落,线粒体轻度肿胀,结构基本正常,仅见少量空泡。弹力膜无明显扭曲变形,平滑肌细胞内肌丝排列稍紊乱,细胞核内常染色质少(见图12)。
2.3 兔大脑中动脉eNOS表达变化 免疫组化染色显示,AdeNOS组右侧大脑中动脉可见血管横切面均有棕色染色,血管内膜棕色显著,证实重组eNOS表达于脑动脉,主要表达于内皮质,平滑肌层和外膜少量表达。SAH大脑中动脉少量棕色染色(见图13~图15)。eNOS在3组大脑中动脉中总体的表达(见表1)。采用χ2检验,SAH组与AdeNOS组血管比较,有显著性差异(P<0.05),SAH组与比较无显著性差异(P>0.05),AdeNOS组与对照组血管比较无显著性差异(P>0.05)。

表1 eNOS在大脑中动脉的表达
3 讨 论
SAH所致的CVS是一个非常复杂的生化病理变化的综合结果。随着显微神经外科及神经介入治疗的迅速发展,手术本身造成的死亡及伤残率都有明显的降低,而脑血管痉挛的预防及治疗就成为制约SAH治疗效果的重要环节。经过几十年的研究,脑血管痉挛的病因及发病机制还未十分确切,然而,大量研究表明高分子溶血产物氧合血红蛋白是引起脑血管痉挛最初始的关键因素[7]:(1)氧合血红蛋白,在蛛网膜下腔出血后红细胞分解产生,与NO结合,阻止其进入血管平滑肌细胞;(2)血管内皮细胞受损而NO合酶活性下降,NO产量减少;(3)红细胞释放的氧合血红蛋白及其代谢产生的自由基使NO灭活,并可刺激ET产生;(4)出血刺激及其他缩血管物质的释放以及血NO减少,可促使内皮细胞ETmRNA表达。 此外,SAH后脑血管内皮所经历的明显的病理改变可能导致内皮表面的生化改变,破坏维持脑血管系统舒张和收缩的的自身平衡机制[8]。NO已被证明为EDRF,它的持续释放为维持脑血管调节所必须。NO 从内皮细胞释放后进入邻近的平滑肌细胞,激活可溶性鸟苷酸环化酶(GC),GC 产生环鸟苷酸(cGMP),激活细胞内钙泵使游离钙进入细胞,并使平滑肌舒张。催化NO生
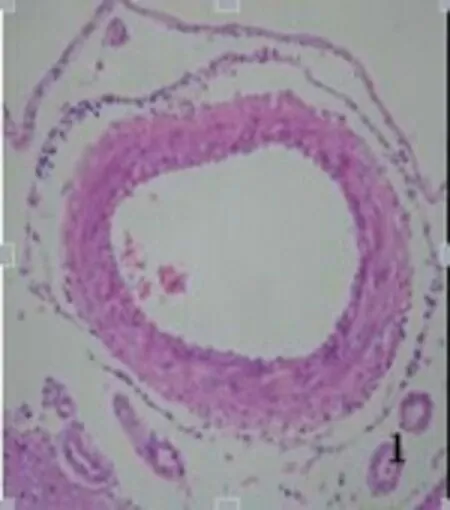
图1 对照组大脑中动脉×200
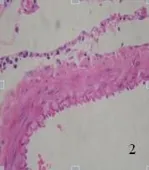
图2 对照组大脑中动脉×400

图3 SAH组大脑中动脉×200
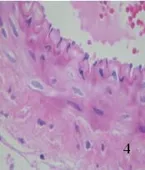
图4 SAH组大脑中动脉×400
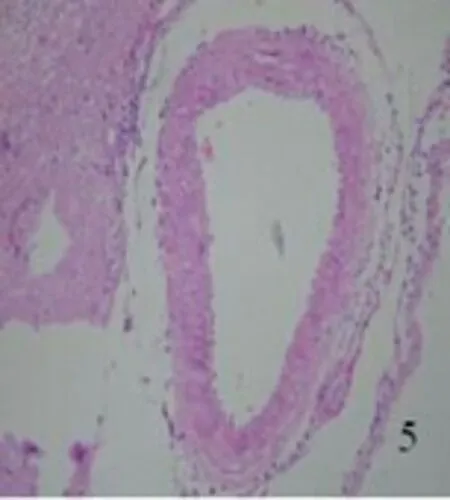
图5 AdeNOS组大脑中动脉×200
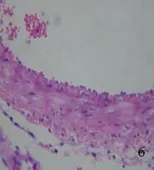
图6 AdeNOS组大脑中动脉×400
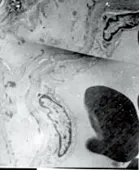
图7 对照组大脑中动内膜及内皮细胞TEP×6000
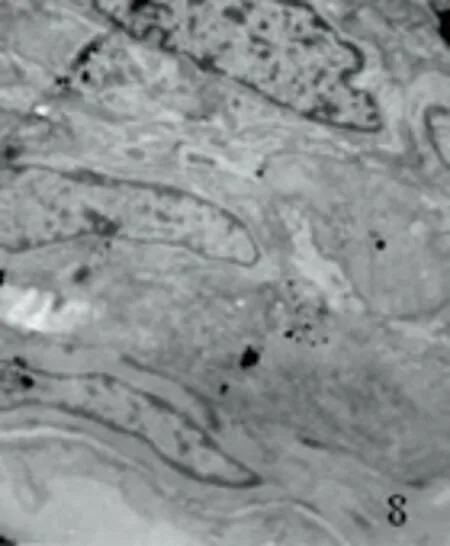
图8 对照组大脑中动平滑肌TEP×8000
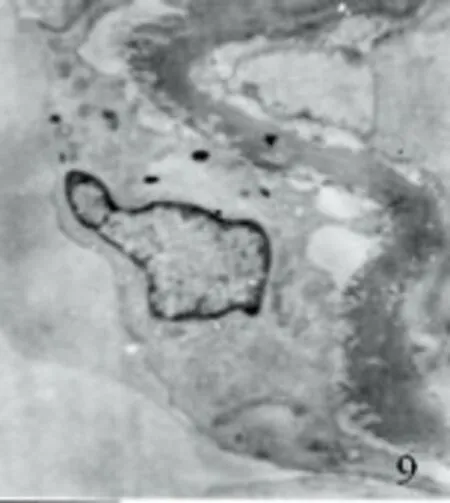
图9 SAH组大脑中动脉内皮细胞脱落TEP×6000

图10 SAH组大脑中动脉内膜皱褶TEP×3500

图11 SAH组大脑中动脉内膜及管腔狭窄TEP×6000
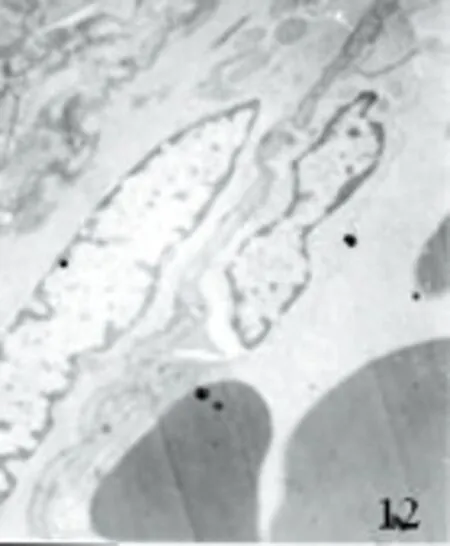
图12 AdeNOS组大脑中动脉TEP×8000
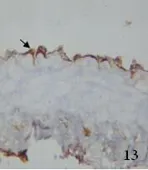
图13 对照组大脑中动脉eNOS免疫组化×400
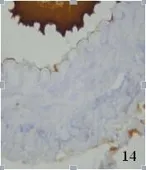
图14 SAH组大脑中动脉eNOS免疫组化×400
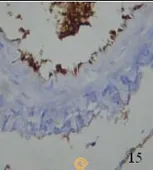
图15 AdeNOS组大脑中动脉eNOS免疫组化×400
物合成的酶称为一氧化氮合酶(NOS)。NOS以L-精氨酸(L-Agr)和分子氧为底物,生成NO和瓜氨酸,是NO合成过程中的重要限速因素。SAH后痉挛期血管壁中eNOS减少,证明了NO在SAH后脑血管痉挛发挥了重要作用[9]。
近年来研究发现鞘内注射补充外源性NO 能够防止CVS发生[10,11]。Zimmerman[12]发现将NO控释体置于痉挛血管周围能有效抑制血液因素引起的血管痉挛。但是SAH后CVS可能持续14 d左右时间,现有的NO供体普遍存在半衰期短的缺欠,反复鞘内给药增加了感染和颅内压波动的风险,而其全身给药由于对外周血压的影响很大,无法达到在蛛网膜下腔内有效治疗浓度。故而寻找一种安全、有效、持续的合成NO的物质相当重要。Khurana等在腺病毒介导的重组内皮细胞NO合成酶的基因转移中,成功表达了NOS,把重组后的腺病毒载体注入蛛网膜下腔,脑脊液中NO浓度明显升高,对照组出现明显脑血管痉挛,而治疗组则没有,7 d在动脉外膜及软脑膜通过Western blot和免疫组化分析显示eNOS的表达[13]。这些发现为eNOS转染治疗血管痉挛和内皮源性功能障碍提供了坚实基础。然而,上述研究仅仅是将重组腺病毒注入脑池,而血管内滴入转染内膜尚在起步阶段。Kuoll等[5]将滴度1×1010pfu /ml包有eNOS腺病毒注入阻断血流的大鼠颈动脉,共转染20 min,4 d后免疫染色证实动脉表达重组基因,颈动脉基础cGMP水平显著提高。Soat等[14]将携带eNOS的腺病毒注入阻断血流的高胆固醇血症兔的颈动脉,结果证实重组eNOS表达于兔颈动脉,并改善了内皮依赖性的血管舒张。Barr等将重组B-gal的腺病毒经导管有冠状动脉导入兔心脏,5 d发现冠状动脉有B-gal的表达[15]。张珑等将携带eNOS的腺病毒微泵持续滴入大鼠颈动脉,7 d后动脉内膜可见eNOS的表达[16]。在本实验中,血管内AdeNOS组脑血管直径较SAH组明显增粗,免疫组化证实血管内膜eNOS阳性表达明显增多,提示eNOS在蛛网膜下腔出血后脑血管痉挛中有相当重要的作用。eNOS的增多,进而合成和释放的NO增多,从而在一定程度上维持了SAH后血管舒张与收缩的平衡。
蛛网膜下腔出血迟发性脑血管痉挛发病机制复杂,目前尚未完全阐明,治疗手段局限,随着神经介入技术的广泛开展,在SAH患者超早期全脑血管造影时即可顺便通过造影管给予携带eNOS基因的重组腺病毒,顺利完成基因转染可能是一种特异性治疗。希望在不久的将来重组eNOS基因能够在人类蛛网膜下腔出血后迟发性脑血管痉挛的预防和治疗中发挥作用。
[1]Yoshimasa W,Yi C,Jon J,et al. Gene transfer of extracellular superoxide dismutase reduces cerebral vasospasm after subarachnoid hemorrhage[J]. Stroke,2003,34:434-440.
[2]Kazunori T,Frank M,Faraci M,et al. Gene Transfer of Calcitonin Gene-Related Peptide Prevents Vasoconstriction After Subarachnoid Hemorrhage[J]. Circ Res,2000,87:818-824.
[3]Keyrouz SG,Diringer MN. Clinical review:Prevention and therapy of vasospasm in subarachnoid hemorrhage[J]. Crit Care,2007,11(4):220.
[4]Ecker A,Riemensehneider PA. Arteriographic demonstration of spasm of the Intracranial arteries:with special reference to saccular arterial aneurysms[J]. J Neuorsurg,1995,8(6):660-667.
[5]Kullo IJ,Mozes G,Schwartz RS,et al. Enhanced Endothelium-Dependent Relaxations After Gene Transfer of Recombinant Endothelial Nitric Oxide Synthase to Rabbit Carotid Arteries[J]. Hpyertension,1997,30:314-320.
[6]Endo S,Branson PJ,Alksne JF. Experimental model of symptomatic vasospasm in rabbits[J]. Stroke,1988,19(11):1420-1425.
[7]Van der Jagt M,Hasan D,Dippel WJ,et al. Impact of early surgery after aneurysmal subarachnoid haemorrhage[J]. Acta Neurologica Scandinavica,2009,119(2):100-106.
[8]赵振伟,高国栋,赵继培,等. 脑血管痉挛后基底动脉超微结构的变化及内皮素转化酶抑制剂的影响[J]. 第四军医大学学报,2005,26(2):129-132.
[9]吴习威,高国栋,赵振伟,等. 一氧化氮合成酶在痉挛脑血管壁动态变化的实验研究[J]. 武警医学,2004,15(5):337-340.
[10]Thomas JE,McGinnis G. Safety of intraventricular sodium nitroprusside and thiosulfate for the treatment of cerebral vasospasm in the intensive care unit setting[J]. Stroke,2002,33(2):486-492.
[11]Wolf EH. Reversal of cerebral vasospasm using an intrathecally administered nitric oxide donor[J]. J Neurosurg,1998,89:279-288.
[12]Zimmerman L. Hndothelin in cerebral vasospasm Clinical and experimental results[J]. J Neurosurgery Science,1997,41:139-151.
[13]Khurana VG,Smith LA,Baker TA,et al. Protective vasomotor effects of in vivo recombinant endothelial nitric oxide synthase gene expression in a canine model of cerebral vasospasm[J]. Stroke,2002,33:782-789.
[14]Sato J,Mohacsi T,Noel A,et al. In vivo gene transfer of endothelial nitric oxide synthase to carotid arteries from hypercholesterol-emic rabbits enhances endothelium-dependent relaxations[J]. Stroke,2000,31(4):968-975.
[15]Barr E,Carroll J,Kalynych AM,et al. Efficient catheter-mediated gene transfer into the heart using replication-defective adenovirus[J]. Gene Ther. 1994,1(1):51-58.
[16]张 珑,洪 波,刘建民,等. 血管内一氧化氮合酶基因转染预防脑血管痉挛的实验研究[J]. 中华神经外科杂志,2007,23:629-632.
Experimental study on Endothelial nitric oxide synthase gene transfection in prevention of cerebral vasospasm after subarachnoid hemorrhage in rabbits
WUWeijun,ZHANGLong,QIANSuokai.
(DepartmentofNeurosurgery,YichunPeople’sHospitalofJiangxiProvince,336000China)
Objective To investigate the effects of intravascular transfection of eNOS gene on cerebral vasospasm after subarachnoid hemorrhage in rabbits,and explore the related mechanism through observating pathohistology and ultrastructural structure of cerebral arteries. Methods Delayed cerebral vasospasm model after SAH was developed by injecting arterial blood twice through cisterna magna. Recombinant adenovirus was injected into carotid arterial to transfect the rabbits. Forty-five rabbits were randomly divided into three groups,control group,SAH group and AdeNOS group. SAH models were made by two injections of 2.5 ml fresh and non-heparinized arterial blood into the citerna magna of the rabbits in SAH and AdeNOS groups. All animals were killed using perfusion-fixation on day 7 and the brain arteryies tissues were removed for pathohistology and ultrastructural studies. Immunohistochemical method was used for detecting the expression of eNOS. Results In SAH modlel,blood accumulated in the subarachnoid space,especially in the basal cistern. Immunohistochemistry confirmed that recombinant eNOS gene expressed mainly in the endothelium. Under microscope,the average diameters of the cerebral arterial in AdeNOS group were larger than that in SAH group,and there was less vasospasm under electron microscope. SAH group had hippocampal tissue edema and widened perivascular space. SAH group had marked pathological changes of neuron ultrastructure including cell swelling,structural integrity,nuclear condensation,mitochondrial vacuolization. Conclusion This study suggests that continuous use of carotid artery infusion micro-pump method in rabbit cerebral artery make endothelial cells express eNOS,leading to relieve delayed CVS following SAH.
Subarachnoid hemorrhage; Ccerebral vasospasm; eNOS
1003-2754(2016)01-0013-05
2015-01-29;
2015-05-25
(1.江西省宜春市人民医院神经外科,江西 宜春 336000;2.解放军第九四医院神经外科,江西 南昌 330002)
张 珑,E-mail:zhanglong1995@163.com
R743.35
A
