基于单细胞拉曼光谱技术的葡萄球菌黄素生物合成分析
2016-11-09陶站华刘军贤师德强康健广西科学院生物物理实验室南宁5000广西师范大学物理科学与技术学院桂林54004广西科学院国家非粮生物质能源工程技术研究中心南宁5000
陶站华刘军贤师德强康健,(广西科学院生物物理实验室,南宁5000) (广西师范大学物理科学与技术学院,桂林54004)(广西科学院国家非粮生物质能源工程技术研究中心,南宁5000)
基于单细胞拉曼光谱技术的葡萄球菌黄素生物合成分析
陶站华*1刘军贤2师德强3康健1,2
1(广西科学院生物物理实验室,南宁530003)2(广西师范大学物理科学与技术学院,桂林541004)3(广西科学院国家非粮生物质能源工程技术研究中心,南宁530003)
利用光镊拉曼光谱技术研究吲哚对金葡菌细胞中葡萄球菌黄素合成的抑制作用以及色素含量在分批培养过程中的动态变化。收集经不同浓度吲哚(终浓度为0,0.2,0.6,0.8,1.2和1.5 mmol/L)处理后的以及不同培养时间的金葡菌单细胞的拉曼光谱,以光谱1523 cm-1峰强度表征色素含量,并与紫外可见分光光度法得到的结果进行比较。结果表明,细菌拉曼光谱1523 cm-1峰强度与分光光度法测得的色素含量有良好的线性关系,相关系数达0.9772;群体和单细胞水平的光谱数据均表明,吲哚可剂量依赖性地抑制葡萄球菌黄素的合成,色素含量降低幅度超过70%;在分批培养中细菌色素含量在对数生长中期(12 h)达到最大值,各个时间点的群体内部细胞间色素含量的异质性较小,RSD在39.2%~61.1%之间。本研究表明光镊拉曼光谱技术是一种在单细胞水平分析葡萄球菌黄素含量的可靠方法。
单细胞分析;光镊拉曼光谱;金黄色葡萄球菌;葡萄球菌黄素
1 引言
由于生物群体细胞常存在不均一性,传统的基于群体平均值的分析方法可能掩盖个体细胞携带的信息。为了揭示群体中个体细胞之间的差异,更深入地理解细胞的生理或病理过程,需要准确测定单细胞内化学组分的含量,因此单细胞分析技术成为当前分析化学中一个相当活跃的研究领域。目前,较为常见的单细胞分析手段包括流式细胞术、显微镜技术、毛细管电泳、单细胞拉曼光谱等[1~3]。光镊拉曼光谱技术(Laser tweezers Raman spectroscopy,LTRS)将光镊技术和拉曼光谱技术结合起来,利用高度汇聚的激光束,囚禁溶液中的活细胞,再通过瞬时加大囚禁细胞的光束激发细胞内分子的拉曼散射[4~7]。该技术充分结合了共焦显微、光镊、拉曼光谱的优点,提高了检测的灵敏度、准确度,是研究生理状态下单个活细胞内化学物质含量及结构变化的有力工具。目前,LTRS技术已被应用于研究Ca2+诱导下线粒体内分子的变化[8],红酵母类胡萝卜素含量的测定[9],体内血糖浓度的检测[10],以及微血管内单个红细胞的表征[11]等。
金黄色葡萄球菌(Staphylococcus aureus)是引起社区和医院内感染的重要致病菌[12],其细胞膜上附着的金黄色色素——葡萄球菌黄素(Staphyloxanthin)是一种重要的毒力因子,能有效中和有毒氧化物,保护细菌免受宿主吞噬细胞生成的活性氧分子的损伤[13],研究表明,阻断葡萄球菌黄素生物合成是一种很有前景的治疗金葡菌感染的新手段[14,15]。准确测定金萄菌细胞内葡萄球菌黄素含量是研究该色素生物合成调控、致毒力机理,以及进行新型抗感染药物筛选和活性评价的先决条件。传统的测定葡萄球菌黄素的方法是先用有机溶剂抽提菌体内的色素,然后用紫外可见分光光度法[16]或高效液相色谱法[17]定量。这种方法样品需求量较大,临床或自然环境中分离到的菌株需要先经过液体扩大培养才能测定色素含量,不能对存活于不同环境中的细菌实施原位检测。此外,该测定方法得到的是金葡菌群体细胞色素含量的平均结果,无法反映单个细胞色素含量的信息。
本研究建立了一种利用LTRS技术原位检测金葡菌细胞内葡萄球菌黄素含量的方法,并利用此方法在单细胞和群体水平研究了不同浓度吲哚对色素合成的抑制作用,以及在一个生长周期内金葡菌细胞内色素含量的变化规律。与传统的分析方法相比,具有样品需要量小(只需取10μL菌悬液进行适当稀释)、无损、可实现原位单细胞分析等优点。
2 实验部分
2.1细菌培养与药物处理
2.1.1菌株和培养基金黄色葡萄球菌菌株ATCC 6538购自中国普通微生物菌种保藏管理中心。固体培养基TSA组成为胰蛋白胨17 g/L、大豆胨3 g/L、葡萄糖2.5 g/L、NaCl5 g/L、K2HPO42.5 g/L、琼脂粉15 g/L;液体培养基TSB除了不含有琼脂粉外,其它成分与TSA一致。
2.1.2金黄色葡萄球菌的预培养挑取生长于TSA培养基上的单菌落,接种于5 mL TSB培养基中,37℃,200 r/min振荡培养16 h。
2.1.3吲哚对金葡菌色素合成的抑制实验在5个装有50 mL TSB培养基的250 mL摇瓶中分别加入终浓度为0,0.2,0.6,0.8,1.2和1.5 mmol/L吲哚,以10%的比例接入金葡菌预培养物,37℃,200 r/min振荡培养12 h。每个样品取0.1 mL菌液用于拉曼光谱分析,其余的用紫外可见分光光度法测定菌体中葡萄球菌黄素的含量。
2.1.4金葡菌在一个生长周期内色素积累实验金葡菌预培养物以10%比例接种于250 mL装有50 mL TSB培养基的摇瓶中,37℃,200 r/min振荡培养24 h,每隔2 h取0.1mL菌液置于4℃保存,用于后续单细胞拉曼光谱检测。
2.2葡萄球菌黄素的紫外可见分光光度法定量
葡萄球菌黄素的提取及分光光度法定量根据文献[16]方法并略做修改:细菌悬液离心收集菌体,以ddH2O洗涤2次,真空冻干后称重,重悬于适宜体积甲醇中,剧烈涡旋,55℃孵育3 min,离心,收集上清液,重复抽提3次,合并提取液,以紫外可见分光光度计测量465 nm处的吸光值,样品中的葡萄球菌黄素含量用OD465/细胞干重表示。
用旋转蒸发仪挥干色素的甲醇提取液的溶剂后,可得到葡萄球菌黄素的固体粉末。
2.3拉曼光谱收集及光谱数据处理
实验所用光镊拉曼光谱系统与文献[9]描述的一致。
取10μL菌液加入990μL ddH2O,再加入终浓度为0.1%(V/V)的Tween 80,剧烈涡旋0.5 min,以获得更多分散的单细胞。将细菌悬液置于样品槽内,外加盖玻片密封。100×油浸物镜寻找目标细胞,光镊随机俘获单个细胞,激光强度调整为45mW,信号累积时间为30 s,收集目标细胞的拉曼光谱,于细胞附近以相同条件收集背景拉曼光谱,每个样品收集70个单细胞的拉曼光谱及5个背景光谱。
光谱预处理采用Matlab 7.0编写的程序进行,每个细胞的原始光谱分别经过背景扣除,5点Savitzky-Golay平滑,基线校正后得到细胞的实际光谱,然后以光谱1523 cm-1处的峰高对细胞内的葡萄球菌黄素进行定量分析。光谱图的绘制及光谱数据的统计分析在软件Origin 8.5中进行,小提琴图的绘制利用R语言中的ggplot2包完成。
3 结果与讨论
3.1金黄色葡萄球菌的拉曼光谱
从化学结构上看,葡萄球菌黄素属于C30三萜色素,与常见的C40类胡萝卜素结构有很大相似性。实验分别测定了葡萄球菌黄素固体粉末和培养6 h金葡菌单细胞的拉曼光谱(图1)。葡萄球菌黄素由于存在多个共轭双键,拉曼光谱信号很强(曲线A),其中最强的3个特征峰1523,1160和1001 cm-1分别归属于C=C伸缩振动、C-C伸缩振动和C=C 面内摇摆振动[18],这与常见C40类胡萝卜素的主要特征峰形状类似,峰位略有偏移。在金葡菌单细胞光谱(曲线B)中,虽然金葡菌仅培养6 h,细胞内色素含量较低,但3个主要特征峰(1523,1160和1001 cm-1)强度还是远高于细胞内其它化学成分的拉曼光谱信号,可见LTRS技术对金葡菌细胞内色素具有很高的检测灵敏度。在这3个特征峰中,1523 cm-1峰强度高,峰形对称、尖锐,周围没有其它物质的特征峰干扰,适合色素的定量分析。除与葡萄球菌黄素相关的特征峰外,金葡菌细胞拉曼光谱还包含来源于细胞内其它生物分子的特征峰,如归属于核酸的722,780和1092 cm-1峰,与蛋白质CN键伸缩振动相关的1126 cm-1峰,来源于蛋白质酰胺Ⅰ带α螺旋的1663 cm-1峰,与蛋白质、脂类和碳水化合物都有关联的1452 cm-1峰,能提供细胞在环境信号影响下各种生物分子结构和含量的动态变化信息。
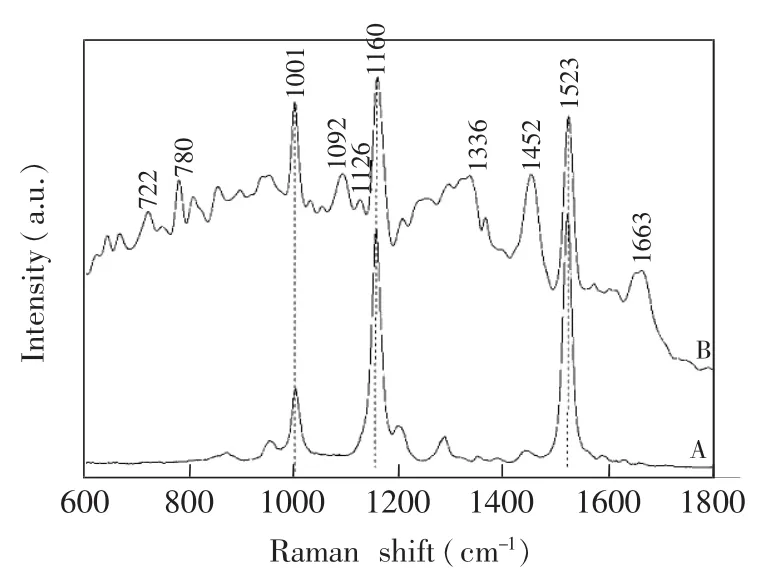
图1 葡萄球菌黄素粉末(A)和培养6 h金葡菌单细胞的拉曼光谱(B)Fig.1 Raman spectra of staphyloxanthin powder(A)and Staphylococcus aureus single cells cultivated for 6 h(B)
3.2利用LTRS研究吲哚对葡萄球菌黄素生物合成的抑制作用
3.2.1吲哚对葡萄球菌黄素合成的剂量依赖性抑制葡萄球菌黄素合成抑制剂有望成为一类新的治疗金葡菌感染的有效药物,现有的色素合成抑制剂的筛选和评价一般是通过目测比较候选药物处理后菌体的颜色进行粗略估计,这种方法主观性强,且无法提供定量数据。LTRS方法能精确测量单个细胞内葡萄球菌黄素的相对含量,可以从群体和单细胞两个水平对候选药物对色素合成的抑制效果进行定量评估。本研究将金葡菌与终浓度为0,0.2,0.6,0.8,1.2和1.5mmol/L吲哚孵育培养12 h,然后每个样品测定70个单细胞的拉曼光谱,各样品的平均光谱如图2所示,随着吲哚浓度提高,细菌拉曼光谱1523 cm-1处的峰强度逐渐降低,从吲哚浓度为0 mol/L时的3561降低到吲哚浓度为1.5mmol/L时的1126,下降幅度约70%。这一方面说明,吲哚可以剂量依赖性地抑制葡萄球菌黄素合成;另一方面也说明,金葡菌细胞拉曼光谱1523 cm-1峰强度是反映葡萄球菌黄素含量的灵敏而可靠的标志。
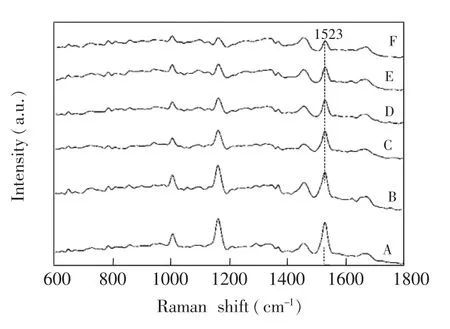
图2 与不同浓度吲哚孵育的金葡菌细胞的平均拉曼光谱,A~F分别为0,0.2,0.6,0.8,1.2和1.5 mmol/L吲哚处理的细菌的拉曼光谱Fig.2 Average Raman spectra of Staphylococcus aureus cells exposed to various concentrations of indol,A-F represent Raman spectra of bacterial cells incubated with 0,0.2,0.6,0.8,1.2 and 1.5 mmol/L of indol,respectively
3.2.2紫外可见分光光度法与LTRS法检测结果的相关性为了进一步验证LTRS定量葡萄球菌黄素的可靠性,将LTRS测得的各样品拉曼光谱1523 cm-1平均峰高与紫外可见分光光度法测得的OD465nm/菌体干重进行线性相关分析,得到图3,二者相关系数R=0.9772,线性相关性良好,证明LTRS定量结果的准确性。
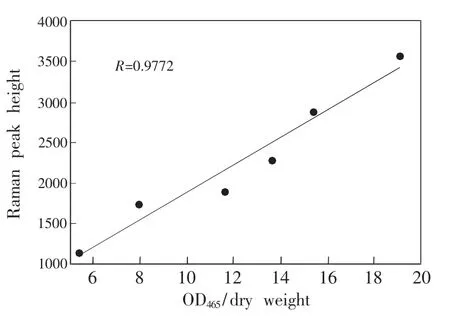
图3 LTRS法测得的不同浓度吲哚处理的金葡菌细胞拉曼光谱1523 cm-1峰强度与UV测得的OD465nm/菌体干重相关性分析Fig.3 Correlation relationship between 1523 cm-1Raman peak intensities of Staphylococcus aureus cells exposed to various doses of indol and OD465nm/bacterial cell dry weightmeasured by UV spectrometry
3.2.3吲哚对葡萄球菌黄素合成抑制作用的单细胞分析传统的基于溶剂提取后UV或HPLC测定的分析方法只能得到色素合成情况的群体平均值,掩盖了单个细胞色素含量的信息。如果某种候选药物能抑制侵入体内大部分细菌的色素合成,但由于遗传或代谢异质性原因[9],在少数菌细胞中色素含量仍然较高,它们就有可能逃避宿主免疫系统的氧化清除而存活,而某些毒力很强的菌株只需少许几个活菌体就可以对宿主造成致死性感染。因此,只有将群体数据和基于单细胞分析的数据结合起来得到的金葡菌色素含量的信息才能更全面、客观地反映药物的抑制效果。LTRS是一种单细胞分析方法,能揭示个体细胞间色素含量的差异及不同色素含量细胞在群体内的分布情况。图4是LTRS方法得到的不同浓度吲哚处理后单细胞色素含量分布的小提琴图。小提琴图是一种用来对多组数据的分布进行比较的方法[19],图中间的白色圆圈代表中位数,便于比较多个样品中色素含量的平均水平;黑色长方形的上下两边分别表示第一和第三分位数;而外围的琴盒表示变量在不同数值处的概率密度,直观地显示了不同色素含量的单细胞在群体中所占的比例:当吲哚浓度为0 mol/L时,少数单细胞内色素含量远高于群体平均值,其1523 cm01峰高超过10000(群体平均值为3561),而在1.5 mmol/L吲哚抑制下,色素含量最高的细菌单细胞的此项数值也仅为2500,因此,无论从群体平均值还是从单细胞分布情况来看,吲哚的色素抑制效果均很显著,因此,本实验从单细胞水平进一步证实了LTRS用于定量评价葡萄球菌黄素合成抑制药物的可行性。
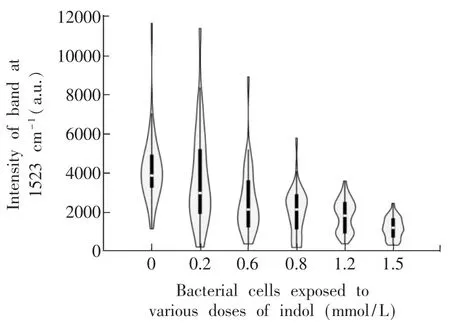
图4 不同浓度吲哚处理的金葡菌单细胞1523 cm01峰强度分布的小提琴图Fig.4 Violin plots for distributions of 1523 cm01Raman peak intensities of individual Staphylococcus aureus cells exposed to various doses of indol
3.3葡萄球菌黄素含量在一个生长周期内的涨落规律
金葡菌在快速增殖过程中,随着细胞密度增加,环境中的营养物质逐渐消耗,代谢产物逐渐积累,细菌细胞必然会通过代谢调控对环境信号的变化作出响应,本实验从群体和单细胞两个水平研究在一个生长周期内细菌色素含量的动态变化规律。
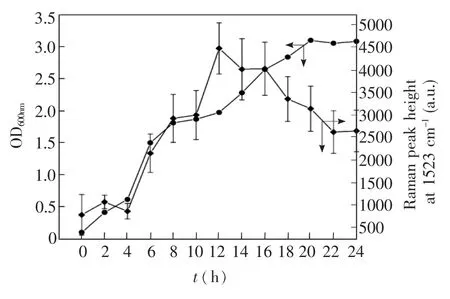
图5 金葡菌的生长曲线(A),分批培养的金葡菌细胞中葡萄球菌黄素含量的时间依赖性变化(B)Fig.5 Growth behavior of Staphylococcus aureus(A) and time-dependent changes of staphyloxanthin content in bacterial cells during batch culture(B)
3.3.1分批培养中色素含量动态变化的群体水平
金葡菌于TSB培养基中37℃,200 r/min培养24 h,每隔2 h取样用于生长曲线测定和色素合成分析(图5):测量不同培养时间的菌液的吸光度值 OD600nm,并绘制细菌生长曲线(曲线A);每个时间点测量70个单细胞的拉曼光谱,以70个光谱1523 cm01峰高平均值随时间的涨落表征色素含量在细胞群体水平的动态变化(曲线B)。对比曲线A,B可知,金葡菌在进入对数生长期不久(6 h)即开始快速合成葡萄球菌黄素,在对数生长中期(12 h)细胞内色素含量达到最大值,此后色素含量逐渐下降,这与一般微生物次级代谢产物的合成规律有较大不同,很多微生物次级代谢产物的产量在对数生长后期或稳定期才达到最大值。
3.3.2色素含量动态变化的单细胞水平分析相对标准偏差(RSD)是统计学中表征数据变异程度的参数。本研究采用RSD反映色素含量的细胞异质性。表1分别显示了不同培养时间70个单细胞拉曼光谱1523 cm01峰高平均值和RSD。在细菌细胞生长的延迟期(2 h)、对数生长前期(6 h)、对数生长中期(12 h)、对数生长后期(20 h)和稳定期(24 h),细胞色素含量的群体平均值波动较大,但每个时间点的群体内部细胞间色素含量的异质性并不大,尤其是对数生长中期(12 h),RSD仅为39.2%,表明群体内的大多数细胞色素积累几乎同步达到最大含量,即同一群体内细胞色素含量相对均一。
4 结论
本研究利用光镊拉曼光谱技术分析单个金葡菌细胞内葡萄球菌黄素相对含量,并考察吲哚浓度及培养时间对色素含量的影响。结果表明,细菌细胞拉曼光谱1523 cm-1峰强度与分光光度法测得的色素含量有良好的线性关系,相关系数达到0.9772;群体和单细胞水平光谱数据均表明吲哚都能剂量依赖性的抑制葡萄球菌黄素的合成;在分批培养中,群体中大多数细胞内色素含量在对数生长中期同步达到最大值。因此,光镊拉曼光谱技术是一种在单细胞水平分析葡萄球菌黄素含量的可靠方法。
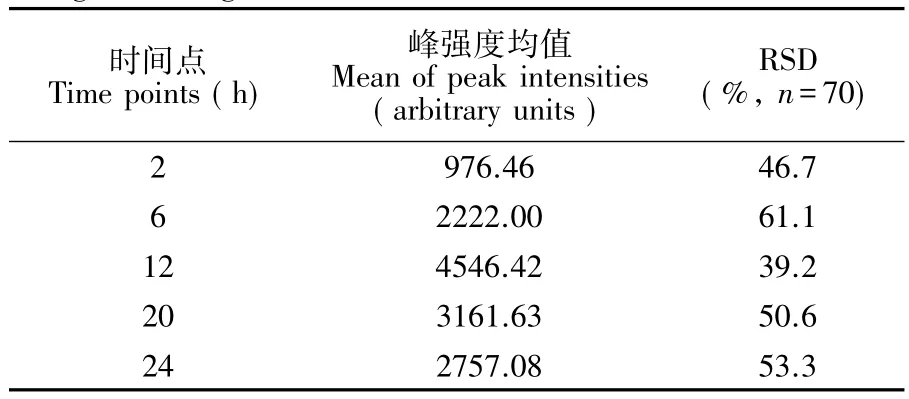
表1 不同生长阶段金葡菌拉曼光谱1523 cm-1峰强度的统计分析Table 1 Statistical summary of 1523 cm-1peak intensities of Raman spectra of Staphylococcus aureus cells during various growth stages
References
1Lindstrm S.Single Cell Analysis.Stockholm:Humana Press,2012:1-12
2AIMin,LIU Jun-Xian,HUANG Shu-Shi,WANGGui-Wen,CHEN Xiu-Li,CHEN Zhi-Cheng,YAO Hui-lu.Chinese J.A-nal.Chem.,2009,37(5):758-763艾敏,刘军贤,黄庶识,王桂文,陈秀丽,陈植成,姚辉璐.分析化学,2009,37(5):758-763
3LAI Jun-Zhuo,LIU Bin,WANG Gui-Wen,TAO Zhan-Hua,HUANG Shu-Shi.Spectroscopy and Spectral Analysis,2011,31(2):412-417赖钧灼,刘斌,王桂文,陶站华,黄庶识.光谱学与光谱分析,2011,31(2):412-417
4Xie C,Dinno M A,Li Y Q.Optics Letters,2002,27(4):249-251
5WANG Yan-Jun,YAO Hui-Lu,WANG Gui-Wen,WANG Yun,FENGMei-Fu.Spectroscopy and Spectral Analysis,2009,29(7):1881-1883王雁军,姚辉璐,王桂文,汪蕴,丰美福.光谱学与光谱分析,2009,29(7):1881-1883
6Xie CG,Li Y Q.J.Appl.Phys.,2003,93(5):2982-2986
7ZHOU Bing,LU Ming-Qian,ZHAO Li-Wei,HUANG Shu-Shi,CHEN Li-Mei.Chinese J.Anal.Chem.,2013,41(12): 1789-1794周冰,卢明倩,赵丽伟,黄庶识,陈丽梅.分析化学,2013,41(12):1789-1794
8Tang H,Yao H,Wang G,Wang Y,Li Y Q,Feng M.Optics Express,2007,15(20):12708-12716
9Tao ZH,Wang GW,Xu X D,Yuan Y F,Wang X,Li Y Q.FEMSMicrobiol.Lett.,2011,314(1):42-48
10Shao JW,Lin M M,Li Y Q,Li X,Liu JX,Liang JP,Yao H L.Plos One,2012,7(10):
11Shao JW,Yao H L,Meng L J,Li Y Q,Lin M M,Li X,Liu JX,Liang JP.Vib Spectrosc,2012,63367-63370
12Fitzgerald-Hughes D,Devocelle M,Humphreys H.FEMS Immunol.Med.Microbiol.,2012,65(3):399-412
13Clauditz A,Resch A,Wieland K P,Peschel A,Gotz F.Infect.Immun.,2006,74(8):4950-4953
14Daum R S.New England J.Med.,2008,359(1):85-87
15Oldfield E.Accounts Chem.Res.,2010,43(9):1216-1226
16Lee JH,Park JH,Cho M H,Lee J.CurrentMicrobiology,2012,65(6):726-732
17Kocher S,Breitenbach J,Muller V,Sandmann G.Arch.Microbiol.,2009,191(2):95-104
18Vitek P,Jehlicka J,Edwards H G,Osterrothova K.Anal.Bioanal.Chem.,2009,393(8):1967-1975
19Hintze JL,Nelson R D.Am.Stat,1998,52(2):181-184
环境仪器新需求不断如何把握先机?
最严环保法、天津危化品爆炸、阅兵蓝、北京首发红色预警,持续一年的环保热词反映了公众强烈的环境诉求。为了我国的持续发展,国家也将环境治理作为一项重要工作来抓,习近平总书记曾提出“绿水青山就是金山银山”,“大气十条”、“水十条”、“土十条”,一项项政策的发布表达了政府对环境治理的决心。可以预见我国环保产业必将会是一个大有发展前景的产业。
而作为衡量环境质量重要工具的科学仪器,在环境治理当中的作用不言而喻,随着环境产业的发展,无论是技术水平、仪器种类还是市场规模,环境领域科学仪器都得到了快速的发展。
三大行动计划全方位开启环境攻坚战
“大气十条”、“水十条”、“土十条”被称为环保“三大战役”,其中前两部已分别于2013年和2015年发布,相信“土十条”的发布也为期不远。随着“三大战役”的开启和不断深入,与之相配套的科学仪器及解决方案也越来越丰富。
大气监测经过几年的发展,逐步形成空地一体、全方位的监控体系。比如为了解我国基本空气质量,在全国范围内建设了环境空气质量监测网络;为说清空气污染来源问题,重点城市纷纷建立了源解析系统;在监控工业污染的排放方面,烟尘/烟气监测系统发挥了重要作用。除此之外,VOCs监测系统、扬尘监测系统、油烟监测系统、无人机、激光雷达等等也开始投入使用。
水质监测的发展则主要表现在检测指标和监测范围的扩张上。随着“水十条”的发布,对总氮总磷的总量控制提上了日程,水质重金属在线分析仪器的需求将更加明确,污水处理厂出水检测指标也将增多。在饮用水监测方面,已从城市已经扩展到了广大农村,水体的监测从重点监测地表水向地表水、地下水并重发展,交通部和海洋局也制定了水质监测的计划。
土壤问题的复杂性导致了“土十条”迟迟没有出台,但从现实需求出发至少可以预见土壤质量监测和土壤修复产业的发展是离不开科学仪器的支持的。
抢占先机各大仪器厂商纷纷布局环境领域
为了满足我国环境领域广大用户对科学仪器的需求,抢占我国环境领域仪器市场,各大仪器厂商纷纷行动,积极布局。
赛默飞世尔在水、空气、辐射、土壤和固体废弃物等环境方面均有完整的监测解决方案。为满足中国环境用户的新需求,赛默飞世尔一方面陆续推出环境领域新产品,如低浓度CEMS系统、汞连续监测系统、COD在线自动监测仪等,一方面发布分析仪器在环境领域的整体解决方案,如PM2.5来源解析全面解决方案。
珀金埃尔默为环境领域用户提供从无机到有机检测、从离线到在线监测、从前处理到仪器分析的完整环境解决方案。其产品不仅包括色谱、质谱、光谱等分析仪器,还包括空气中VOCs连续在线监测方案,Elm多传感器空气质量监测网络技术和便携式GC/MS等多种环境监测专用仪器。
堀场为保护环境提供整体解决方案,针对大气、水质、土壤等环保问题,提供实验室、便携式和在线式多种类型仪器。其产品包括大气自动成分分析装置、污染源排放全面解决方案、水质过程监测方案、油分分析仪、土壤样品有害元素分析仪等。
聚光科技以打造“绿色智慧环境”综合管理平台为目标,业务涵盖环境物联网仪器仪表、环境信息化平台、环境大数据及咨询管理、环境治理工程及运营服务等。通过收购中科光电、吉天仪器、上海安谱等公司,加快环境监测平台的建设;通过自主研发和合作开发,将整个业务平台有机结合,从而推出了“智慧环境”整体规划建设方案。
天瑞仪器在环境重金属分析方面有着自己的独特优势,其产品同样涵盖大气、水质、土壤等领域,包括大气重金属在线分析仪、水质重金属在线分析仪、便携式水质重金属分析仪和手持式XRF土壤重金属分析仪等。
开拓商机analytica China 2016打造环境检测盛宴
为给广大仪器厂商提供一个集中展示新产品和解决方案的平台,给用户一个便捷了解新产品、新技术以及行业发展的机会,目前亚洲最重要的分析、实验室技术、诊断和生化技术领域的专业博览会之一——慕尼黑上海分析生化展(analytica China 2016)将从产品展示和同期研讨会两个方面展示环境领域新产品、新技术、新应用和行业动态。
在analytica China 2016展会现场您可以找到环境检测与监控领域的最新产品和技术。展会将集中展示样品前处理仪器、分析仪器、实验室常用设备、大气分析仪、水质分析仪和土壤专业分析仪等最新产品以及PM2.5、重金属、VOCs等热门环境问题整体解决方案。部分参展厂商企业有:赛默飞世尔、珀金埃尔默、岛津、堀场、安捷伦、刘梅克斯、美国TSI、聚光科技、天瑞仪器、上海仪电等等。
高水平学术研讨会一直是analytica China 2016重点和亮点之一。analytica China 2016同期将举办“第八届上海国际分析化学研讨会”,其环境分会场将会邀请国内外多名专家以及知名厂商专家就新型仪器开发、最新检测技术以及最新应用进行探讨。此会议每年都会吸引超过500名专家、学者及相关从业人员的参与。此外,展会还将举办多个技术培训班,对环境领域用户关注的热门技术,如气相色谱/液相色谱技术、质谱技术、样品前处理等进行培训。
欲获得更多环境领域科学仪器行业动态,欢迎参加2016年10月10~12日在上海新国际博览中心举行的“2016慕尼黑上海分析生化展”。
更多信息,敬请访问展会官网:www.analyticachina.com.cn,或关注官方微信:analyticaChina。
Analysis of Staphyloxanthin Biosynthesis Using Single Cell Raman Spectroscopy
TAO Zhan-Hua*1,LIU Jun-Xian2,SHIDe-Qiang3,KANG Jian1,2
1(Lab of Biophysics,Guangxi Academy of Sciences,Nanning 530003,China)2(College of Physics and Technology,Guangxi Normal University,Guilin 541004,China)3(National Engineering Research Center for Non-Food Biorefinery,Guangxi Academy of Sciences,Nanning 530003,China)
Laser tweezers Raman spectroscopy(LTRS)was used to study the inhibitory effect of indol on staphyloxanthin biosynthesis in Staphylococcus aureus cells and the dynamic changes of this pigment content inside bacterial cells during batch cultivation.The Raman spectra of Staphylococcus aureus cells cultivated for different time and exposed to various doses of indol were acquired.The intensity of 1523 cm-1band was used for the quantification of staphyloxanthin,in themeantime,the pigmentwasmeasured by UV spectrometry.The experimental result showed that an excellent linear relationship existed between the intensities of Raman peak at 1523 cm-1of bacterial cells and the pigment contents estimated by UV spectrometry,with a correlation coefficient of 0.9772.The spectral data at population level aswell as single cell level revealed that indol could inhibit the production of pigment in dose-dependent manner,and the pigment content in bacterial cells incubated with indol decreased by 70%.Under the batch growth condition,the pigment amount in Staphylococcus aureus cells reached the maximum value during the middle exponential growth phase(12 h) and the heterogeneity of pigment content in bacterial cellswithin certain populations at various time pointswas relatively small,with RSDs of 39.2%to 61.1%.This investigation indicates that LTRS can be served as a reliablemethod for the analysis of staphyloxanthin content at single cell level.
Single cell analysis;Laser tweezers Raman spectroscopy;Staphylococcus aureus;Staphyloxanthin
15 September 2015;accepted 20 November 2015)
10.11895/j.issn.0253-3820.150729
2015-09-15收稿;2015-11-20接受
本文系广西自然科学基金(No.2014GXNSFAA118193)和广西科学院基本科研业务费资助项目(No.15YJ22SL08)资助
*E-mail:taozhanhua@163.com
