可溶性环氧化物水解酶抑制剂对CHD患者内皮祖细胞功能产生的影响
2016-11-09林伟东
林伟东
可溶性环氧化物水解酶抑制剂对CHD患者内皮祖细胞功能产生的影响
林伟东①
目的:探讨可溶性环氧化物水解酶抑制剂(sEHi)tAUCB对冠心病(CHD)患者内皮祖细胞(EPCs)功能产生的影响。方法:随机选取2013年7月-2014年12月于本院心内科住院治疗的38例CHD患者作为观察组,另择同期健康体检的38例健康者作为对照组。分析新型sEHi tAUCB对两组EPCs功能和血管内皮生长因子(VEGF)表达等产生的影响。结果:观察组EPCs迁移和血管生成能力均明显低于对照组,比较差异均有统计学意义(P<0.05)。此外,tAUCB呈浓度依赖性增加,CHD患者EPCs迁移和血管生成能力对其EPCs表达VEGF具有促进作用。结论:sEHi对CHD患者的EPCs功能具有良好的调节作用。
可溶性环氧化物水解酶抑制剂; CHD; 内皮祖细胞
First-author's address:Longhua New District Central Hospital of Shenzhen City,Shenzhen 518000,China
内皮祖细胞(EPCs)在干细胞治疗心肌梗死过程中发挥着重要作用[1],可溶性环氧化物水解酶抑制剂(Soluble epoxide hydrolase inhibitor sEHi)为目前临床中普遍应用于心血管疾病治疗的一类药物,其通过作用于可溶性环氧化物水解酶(sEH),进而阻止sEH环氧二十碳三烯酸(EETs)降解为二羟基化合物(DHEH)[2-3]。本次研究旨在探讨sEHi对CHD患者EPCs功能产生的影响,现报道如下。
1 资料与方法
1.1一般资料 随机选取2013年7月-2014年12月于本院心内科住院治疗的38例CHD患者作为观察组,其中男20例,女18例;年龄50~69岁,平均(57.9±2.6)岁。所有入选患者临床上均明确存在心肌缺血表现,同时经冠脉造影均已经确诊为CHD患者。排除严重创伤或接受重大手术者、半年内发生脑血管意外者、甲状腺机能减退者、肾病综合征者、孕妇及哺乳期妇女、存在自身免疫性疾病者、存在急慢性肝胆疾病者、恶性肿瘤者、瓣膜性心脏病者、结缔组织病者、心功能Ⅳ级者、过敏体质及精神病患者。另择同期健康体检的38例健康者作为对照组,其中21例,女17例;年龄50~68岁,平均(58.1±1.8)岁。两组性别和年龄方面比较差异均无统计学意义(P<0.05),具有可比性。
1.2方法
1.2.1试验试剂 胎牛血清为Gibco公司生产,VEGF为美国Peprotech公司生产,EGM-2培养液为美国Clonetics公司研发,淋巴细胞分离液为中国科学院血液研究所研发。人纤维粘连蛋白、FITC标记的荆豆凝集素均为美国Sigma公司生产。Di标记的乙酰化低密度脂蛋白为美国Moiecular Probe公司生产,Matrigel-Matrix为美国BD biosciences公司生产,VEGF抗体、GAPDH抗体均为英国Abcam研发。
1.2.2EPCs分离及培养 清晨于无菌条件下抽取两组研究对象空腹肘静脉血,抽取量均为30 mL作为样本。将血液样本放入含有200 μL肝素的50 mL无菌离心管中,然后将等体积的PBS液加入离心管,并进行混匀摇动。沿着管壁缓慢地将已经过稀释的抗凝血加入盛有淋巴细胞分离液的无菌离心管(15 mL)中,淋巴细胞分离液与抗凝血的比例控制为1∶2。完成离心操作后,将乳白色单个核细胞层吸出,将其放入新的无菌离心管(15 mL)中,然后将等量的PBS液加入离心管中,并进行充分混匀[4-5]。进行离心操作之后将洗涤液去净,然后将4 mL的EGM-2完全培养基加入离心管中,同时进行充分混匀。EGM-2完全培养基中含有浓度为20%的胎牛血清,100 U/mL的青霉素,100 U/mL的链霉素[6-7]。将等量的细胞移入已包被人纤维粘连蛋白的6孔板中,然后放置于37 ℃、CO2含量为5%的培养箱中进行培养,在培养的第4、6天分别进行半量换液。
1.2.3EPCs双染色鉴定 使用PBS液将非贴壁细胞清洗掉,将2.4 mg/L Dil-acLDL贴壁细胞放置于37 ℃环境中进行1 h的孵育之后,对EPCs对Dil-acLDL的摄取情况进行检测[7]。使用浓度为2%的多聚甲醛迪欧细胞进行10 min的固定,然后使用PBS液进行洗涤。完成洗涤之后在标本中加入10 mg/L的FITC-UEA-I,并将标本放置在37 ℃环境中进行1 h的孵育。使用激光共聚焦显微镜对FITC-UEA-I、Dil-acLDL双染色阳性细胞为处于正在分化状态的EPCs进行鉴定。
1.2.4EPCs的流式细胞仪鉴定 PBS液将非贴壁细胞洗掉之后,使用浓度为0.125%的胰酶进行5 min的消化之后将细胞进行收集。实施1000 r/min的离心操作之后使用PBS液对待测细胞浓度进行调整,调整为2×108万个/mL。分别将10 mL的FITC标记CD31、抗CD34抗体加入,然后进行30 min的避光反应。使用冷的PBS液对细胞进行洗涤,将未结合的相关抗体全部去除,然后使用流式细胞仪进行鉴定。
1.2.5EPCs药物处理 实施时间为7 d的EPCs培养之后,更换培养液浓度为1%的胎牛血清EGM-2进行24 h的培养,然后分别与0、10-6、10-5、10-4mol/L的sEHi tAUCB作用,作用时间为24 h。同时取对照组研究对象的EPCs进行上述处理作为对照,该组标本不加入任何药物进行干预。
1.2.6EPCs迁移检测 使用含有0.02% EDTA的胰蛋白酶(0.25%)对各组经过处理之后的细胞进行消化,再用没有添加生长因子的EGM-2对细胞浓度进行调整,调整为1×105/400 μL[8-9]。将细胞添加到趋化性实验装置中的上层,装置中的Transwell小室滤膜是孔径为8 μm的聚碳酸脂微孔滤膜。将含有0、10-6、10-5、10-4mol/L的tAUCB培养液添加到下层,进行时间为24 h的孵育之后,使用细胞刷将存在于滤膜上层的未迁移细胞全部刮除,分别使用戊二醛(2.5%)和甲醇(100%)进行固定,实施HE复染,使用200倍显微镜随机对10个视野进行观测,对EPCs迁移细胞数进行测定[10-11]。
1.2.7EPCs体外血管形成能力检测及Westem印迹 对Matrigel进行1∶2的稀释后,将其平铺于24孔板上,放置于37 ℃的培养箱进行1 h的培养,使得Matrigel充分聚合。取EPCs(1×104个)接种到Matrigel板,分别将含0、10-6、10-5、10-4mol/L的tAUCB培养液加入,进行24 h的孵育之后,倒置于显微镜对新生血管的生成情况进行观察。
1.3统计学处理 使用SPSS 18.0软件对所得数据进行统计学分析,计量资料以(±s)表示,比较采用t检验,计数资料以率(%)表示,比较采用 χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1EPCs鉴定结果 EPCs形态:通过分离操作所得的外周血单个核细胞处于培养的第3~4天时,可以观察到部分贴壁细胞呈不规则三角形或者梭形,梭形细胞的数量不断增加。在培养的第7~8天时,出现诸多个集落,贴壁的梭形细胞从细胞团边缘出芽并不断生长,表现为放射状分布。该种细胞中央呈圆形,周边为放射状梭形细胞结构为典型集落。培养至14 d时,细胞紧密融合生长,表现为“铺路石”样形态特征。使用激光共聚焦显微镜对EPCs结果进行初步鉴定,细胞可摄取Dil-acLDL,同时可与FITC-UEA-1相互结合。其中,双染阳性细胞被认为是处于正在分化状态的EPCs。使用流式细胞仪对接受7 d培养的细胞进行检测时,表达血管内皮祖细胞表面标记CD34+、CD31+的阳性细胞率分别为(53.58±5.64)%和(40.45±6.58)%。
2.2tAUCB对EPCs迁移活性和体外血管形成能力产生的影响 观察组EPCs迁移活性明显低于对照组,比较差异有统计学意义(P<0.05),与接受处理前(0 mol/L)相比较,10-6、10-5、10-4mol/L浓度的tAUCB EPCs迁移活性随tAUCB浓度增加而不断增加,比较差异均有统计学意义(P<0.05)。观察组EPCs体外血管形成长度明显低于对照组,比较差异有统计学意义(P<0.05),与接受处理前(0 mol/L)相比较,10-6、10-5、10-4mol/L浓度的tAUCB作用新生血管形成长度随tAUCB浓度增加而不断增加,新生血管形成长度均表现为浓度依赖性,见表1。
表1 tAUCB对EPCs迁移活性和体外血管形成能力产生的影响(±s)
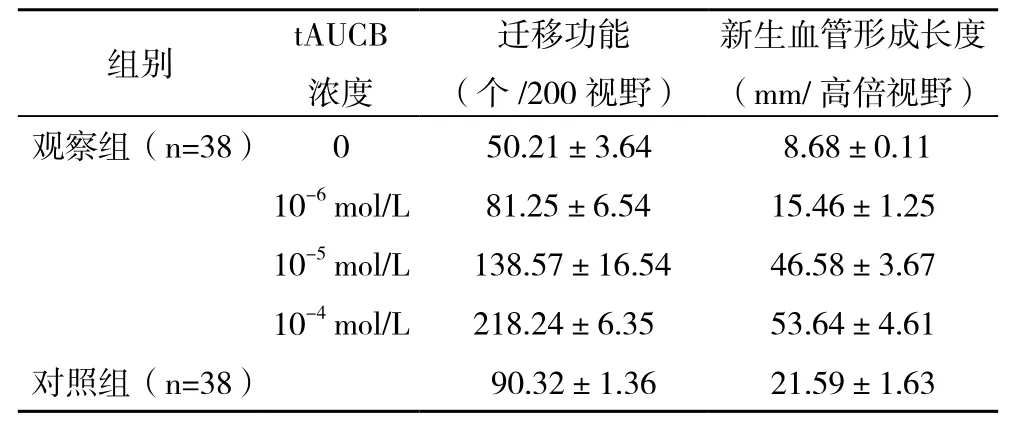
表1 tAUCB对EPCs迁移活性和体外血管形成能力产生的影响(±s)
新生血管形成长度(mm/高倍视野)组别tAUCB浓度迁移功能(个/200视野)观察组(n=38)0 50.21±3.64 8.68±0.11 10-6mol/L 81.25±6.5415.46±1.25 10-5mol/L 138.57±16.5446.58±3.67 10-4mol/L218.24±6.3553.64±4.61对照组(n=38) 90.32±1.3621.59±1.63
2.3CHD患者tAUCB对其EPCs表达VEGF产生的作用 处理前观察组EPCs VEGF表达为0,处理后tAUCB 浓度为10-6mol/L时,患者EPCs VEGF表达为1.43 mol/L;tAUCB 浓度为10-5mol/L时,EPCs VEGF表达为1.49 mol/L;tAUCB浓度为10-4mol/L时,EPCs VEGF表达为1.52 mol/L,与处理前比较差异有统计学意义(P<0.05),tAUCB对其EPCs表达VEGF呈浓度依赖性增强,提示CHD患者tAUCB对其EPCs表达VEGF表现为促进作用。
3 讨论
EPCs为一类血管内皮前体细胞,其直接参与到胚胎时期的血管发生和出生之后的血管新生[13]。因为EPCs存在转化成为血管内皮细胞,进而促进血管生成的能力,其目前已经成为对缺血性疾病进行研究的一种不可或缺的靶细胞。冠心病(CHD)实质上为一种缺血性疾病,因此,在临床上治疗CHD的关键及根本在于促进新生血管形成,实现血运重建[14]。
EPCs作为一类可循环、可增殖、存在多重分化功能的前体细胞,其成为治疗CHD的重要研究内容。李振等[15]研究结果显示,EPCs可通过分化和迁移等方式直接参与到缺血组织损伤修复及新生血管重建中。血管内皮生长因子(VEGF)为目前已知的一种具有最强促血管生长功能的因子,其高度特异性地对血管内皮细胞发生作用,对其迁移、分化及增殖产生良好的诱导作用,进而促进新生血管形成[13]。所以通过增加VEGF水平促进血循环中的EPCs活性得到有效增强,实现血管新生,进而促进缺血心肌血液灌注得到有效改善[16]。本次研究结果显示,与健康者比较,CHD患者EPCs的VEGF表达明显下降,而应用tAUCB之后,CHD患者EPCs的VEGF表达又表现出显著增加的趋势,且该作用表现为浓度依赖性。同时本次研究还发现,CHD患者EPCs迁移活性和血管生成能力亦有明显增加,其增加速度与tAUCB也表现为量效关系。由此可见,sEHi制剂tAUCB对CHD患者的EPCs功能存在正向调节作用,该种作用对血管新生产生良好的促进作用,故其在促进心肌缺血缺氧状态改善上发挥着重要作用[17]。sEH环氧二十碳三烯酸(EETs)为一类具有较强生物活性的内生性脂质环氧化合物,但是EETs在细胞内的半衰期较短,经过可溶性环氧化物水解酶(sEH)迅速催化后其失活便被降解。可溶性环氧化物水解酶抑制剂(sEHi)通过对sEH产生抑制作用而促进EETs效用得到明显增强。白洁等[18]的临床研究结果显示,EETs对VEGF介导的血管生成作用具有良好的促进作用,所以可以推断,sEHi-EETs-VEGF为sEHi对EPCs功能进行正向调节的一个重要通路。EPCs为血管病变细胞进行修复的一种种子细胞,使用EPCs对相关心血管疾病进行治疗的方式为一种新型治疗策略。在对新型药物进行开发的过程中,应使药物具备对EPCs特性进行调节的功能,只有这样才能更好地实现治疗效果的提高[19]。在本次研究中,对38例CHD患者应用新型sEHi制剂tAUCB之后,患者EPCs的VEGF表达得到有效促进。这个研究结果为CHD防治药物的研制提供了一条新思路,对CHD防治效果的提高具有重要价值。
综上所述,对CHD患者应用sEHi可对患者的内皮祖细胞功能产生正向调节作用,进而促进患者临床症状及体征得到更好改善。sEHi制剂tAUCB可能成为治疗CHD的一种新型药物。
[1]王振河,姜德谦,李卫华,等.可溶性环氧化物水解酶抑制剂通过过氧化体增殖物激活型受体γ调节内皮祖细胞功能[J].中国动脉硬化杂志,2015,23(2):137-138.
[2]彭晓琴,张晓东,王云甫,等.sEHi对颈动脉狭窄患者外周血早期内皮祖细胞血管内皮生长因子表达的影响[J].中国动脉硬化杂志,2014,22(11):1109-1110.
[3]黄一伟,张怀勤,毛义建,等.可溶性环氧化物水解酶基因多态性与冠心病的相关性[J].温州医科大学学报,2014,9(8):578-579.
[4]李廷波,马琦琳,彭军.NADPH氧化酶介导的氧化应激与心血管疾病内皮祖细胞功能障碍[J].中南医学科学杂志,2015,43(2):121-122.
[5]欧阳莉娜.血清胆红素与尿酸在冠心病患者临床检验中的价值分析[J].中国医学创新,2013,10(27):89-90.
[6]李晓燕,陈英剑,张国明,等.培哚普利对冠心病患者循环血内皮祖细胞及血管内皮功能的影响[J].中国循环杂志,2015,30(1):22-23.
[7]莫善晓.冠心病患者血清同型半胱氨酸、尿酸水平变化及临床意义[J].中外医学研究,2014,12(3):59-60.
[8]黄忠波,陆刚.血清NO水平与冠心病中医证型的相关性研究进展[J].中外医学研究,2013,11(26):152-153.
[9]赵婷婷,许丹焰,赵水平,等.可溶性环氧化物水解酶抑制剂t-AUCB对巨噬细胞脂质代谢的影响[J].中国动脉硬化杂志,2012,20(4):295-296.
[10]杨辉,谭晓虹.可溶性环氧化物水解酶抑制剂对心脑血管系统疾病的影响[J].神经药理学报,2012,2(5):40-41.
[11]陈小林,杨兴彪,胡基埂,等.环氧化物水解酶与人类疾病的关系[J].生命的化学,2014,34(5):660-661.
[12]杜广胜,文渊,马业新.RNA干扰下调小鼠心肌细胞可溶性环氧化物水解酶的表达[J].中国动脉硬化杂志,2011,19(3):206-207.
[13] Liu Y,Jiang Y R,Zhang J C.Integrative Chinese and western medicine on atherosclerosis of coronary heart disease:what are the new control strategies[J].Chinese Science Bulletin,2014,59(11):1092-1093.
[14]黄树斌.冠心病患者Hcy与内皮祖细胞功能及表达水平相关变化分析[J].现代预防医学,2012,39(5):1271-1272.
[15]李振,萧洪文.可溶性环氧化物酶与缺血性脑卒中的防治[J].泸州医学院学报,2012,35(02):224-225.
[16]李晓燕,陈英剑,张国明,等.冠心病患者外周血内皮祖细胞数量差异及其对内皮功能的影响[J].山东大学学报(医学版),2012,50(8):73-75.
[17]孙云鹏.肝细胞生长因子对体外培养冠心病患者外周血内皮祖细胞生物学功能的影响[J].临床和实验医学杂志,2015,7(11):891-892.
[18]白洁,孟军,蔡泽民,等.高脂蛋白(a)的冠心病患者内皮祖细胞功能受损[J].中国动脉硬化杂志,2015,23(4):384-385.
[19]华先平,吴瑞霞,陈平英,等.法舒地尔对老年冠心病患者内皮祖细胞和内皮微颗粒数量及内皮功能的影响[J].中华老年心脑血管病杂志,2013,15(12):1285-1286.
The Influence of Soluble Epoxide Hydrolase Inhibitor for Endothelial Progenitor Cells Function in Patients with Coronary Heart Disease
L
IN Wei-dong.//Medical Innovation of China,2016,13(28):059-062
Objective:To study the influence of soluble epoxide hydrolase inhibitor(sEHi)tAUCB for endothelial progenitor cells(EPCs) function in patients with coronary heart disease (CHD).Method:From July 2013 to December 2014,38 cases of CHD in our hospital department of cardiology were randomly selected as the observation group and another 38 healthy persons were selected as the control group.Effects of new sEHi tAUCB on the expression of EPCs and vascular endothelial growth factor (VEGF) in two groups were analyzed. Result:The EPCs migration and angiogenesis ability in the observation group were significantly lower than control group,the differences were statistically significant(P<0.05).In addition,tAUCB showed a concentrationdependent increase,CHD patients with EPCs migration and angiogenesis in its EPCs expression of VEGF has a role in promoting.Conclusion:sEHi has an excellent regulating effect on EPCs function in patients with CHD.
Soluble epoxide hydrolase inhibitor; Coronary heart disease; Endothelial progenitor cells
①广东省深圳市龙华新区中心医院 广东 深圳 518000
林伟东
10.3969/j.issn.1674-4985.2016.28.016
(2015-12-25) (本文编辑:李颖)
