外用联合靶向siRNA治疗生殖器疱疹豚鼠模型实验
2016-11-09李淑林韩建德廖绮曼李茵茵李红梅马春光陈木开
李淑林 韩建德 廖绮曼 李 欢 李茵茵 李红梅 马春光 陈木开
·论著·
外用联合靶向siRNA治疗生殖器疱疹豚鼠模型实验
李淑林1,2韩建德1廖绮曼1李欢1李茵茵3李红梅3马春光1陈木开1
目的:评价联合靶向特异性小干扰RNA(HSV-2 UL27.2 和UL29.2 基因)对生殖器疱疹(GH)模型的疗效。方法:(1)病毒攻击实验:雌性豚鼠60只,随机分为治疗组和对照组,每组30只,治疗组小鼠外阴和阴道内外用联合靶向特异性小干扰RNA(CT-siRNA),对照组外用非靶向基因的RNA制剂(siN.C),作用4小时后接种疱疹病毒2型(HSV-2)野生株,观察豚鼠发病情况并计算生存率。(2)选取接种HSV-2后具有初发GH反应的雌性豚鼠60只,分为治疗组和对照组,每组30只,分别外用CT-siRNA和siN.C制剂,每周1次至皮损愈合。2个月后小鼠腹腔内注射环磷酰胺并给予紫外线照射诱导复发,计算疱疹复发率。结果:病毒攻击感染后治疗组存活率(80.0%)高于对照组(23.3%)(P<0.05)。治疗第10天治疗组皮损积分值(0.25±0.25)较对照组明显降低(1.0±1.25)(P<0.05)。诱导复发后,治疗组复发率(16.7%)低于对照组(60.0%)(P<0.05)。结论:外用CT-siRNA制剂能预防HSV-2的感染及复发。
小干扰RNA;生殖器疱疹;动物模型
生殖器疱疹(GH)是由单纯疱疹病毒(HSV-2)感染引起的最常见的性传播生殖器溃疡性疾病。20 世纪80年代研制出的核苷类似物标志着抗疱疹病毒药物新时代的开始,此类药物到目前为止仍是临床首选的药物,但是目前的抗病毒药物不能有效阻止GH感染,完全抑制和清除潜伏的HSV病毒。研究开发新的药物一直是临床关注的热点。体外合成的小分子dsRNA,被称为小干扰RNA(siRNA),能直接触发RNA干扰(RNAi),从而高效率、特异性抑制目的基因[1]。RNAi技术抗病毒具有高效、特异、操作简单等特点,为HSV预防和治疗提供了新的途径。多篇关于用特异siRNA抑制病毒包括HSV复制增殖的文章已被发表[2-4]。我们有关外用联合靶向特异性siRNA制剂(CT-siRNA:联合靶向HSV-2 UL27.2和UL29.2基因,分别编码包膜糖蛋白gB和一个DNA黏合蛋白)的体外抗病毒研究已证实其能明显的抑制HSV复制增殖[5,6]。我们在此基础上,结合GH 临床的发病特点,建立GH动物模型,研究联合靶向HSV-2 UL27.2和UL29.2基因外用制剂预防HSV感染和治疗GH效果,现报道如下。
1 材料和方法
1.1外用siRNA制剂制备
1.1.1siRNA设计与合成根据GenBank中获取HSV-2 gB和DNA黏合蛋白基因mRNA序列(GenBank Accession No.L09242),采用Am2bion公司和Genscript公司在线siRNA设计,以及Palliser et al.在nature杂志发表的论文,得到2对18~19个碱基的siRNA:UL27.2(编码一个包膜糖蛋白gB nt 54370-54388),sense5’-ACGUGAUCGUGCAGAACUC-3’, antisense5’-GAGUUCUGCACGAUCACGU-3’;UL29.2(一个DNA黏合蛋白nt6032-60342),sense5’-CUUUCGCAAUCAAUUCCAA-3’,antisense5’-UUGGAAUUGAUUGCGAAAG-3’;另设随机的不靶向任何基因的对照组(siN.C)作为阴性对照:sense5’-UUCUCCGAACGUGUCACGUTT-3’, antisense5’-ACGUGACACGUUCGGAGAATT-3’上述序列提交上海吉玛公司合成。
1.1.2把特异靶向UL27.2和UL29.2 siRNA干粉分别用DEPC2H2O溶解后,得到浓度为20 μmol/L的siRNA溶液,与脂质体Lipofectamine 2000(Invitrogen)均匀混合[5]。siN.C用同样方法。外用CT-siRNA霜剂参考Takanashi等的方法,油相:白凡士林、硬脂酸、液体石蜡水溶70℃;水相:羟苯乙酯、甘油、三乙醇胺、吐温-80、氮酮、蒸馏水加热保温80℃;将水相缓缓加入油相,至乳化,至室温时加入siRNA,制成外用combined targeting siRNA(CT-siRNA)制剂(浓度为500 pmol/0.1 mL siRNA)。
1.2病毒和实验动物HSV-2野生株来源于中山大学附属第一医院皮肤性病科门诊生殖器疱疹患者水疱疱液分离培养,用免疫荧光方法和RT-PCR方法分型鉴定为HSV-2 D型,并进行扩增。实验动物为干净级Hartley豚鼠,雌性,重量约(250±20)g,合格证号:0084315 0092328和许可证号:SYXK(粤)2009-0023。
1.3实验方法
1.3.1病毒接种方法实验豚鼠先用生理盐水清洗豚鼠外阴,再用粗糙的细玻璃棒摩擦阴道黏膜数次,继之用1 mL注射器吸取0.1 mL含HSV-2野生株,病毒液配上灌胃针头伸入豚鼠阴道内3 cm将病毒液注入阴道穹隆处后缓慢退出,最后用灌胃针头轻柔外阴局部2~3 min,待无病毒液溢出时再将豚鼠放回笼子。随机取10只初发GH皮损作病理检查,诱导复发豚鼠取脊神经根电镜观察。
1.3.2病毒攻击实验实验豚鼠随机分为两组,外用CT-siRNA治疗组30只和对照组(外用siN.C)30只,分别于外阴阴道内涂药后4 h,阴道内接种HSV-2野生株2×104p.f.u.,(接种方法同上)观察外阴局部反应和全身反应、死亡率、阴道分泌物HSV-2培养结果。整理数据,并行统计分析。
1.3.3治疗GH试验实验豚鼠先用生理盐水清洗豚鼠外阴,阴道内接种103p.f.u HSV-2野生株,取有初发GH的实验豚鼠60只,随机分为2组各30 只,分别予阴道内和外阴外用特异CT-siRNA(500 pmol )制剂或外用不靶向任何基因的siN.C制剂治疗,每天观察治疗后豚鼠局部发病的症状和排病毒情况。对每只豚鼠外阴皮损进行积分计算,积分方法参考文献[7]。皮疹愈合后每周1次给予外用制剂,治疗2个月。2个月后(3天内不用外用制剂)给予环磷酰胺注射液(浓度25 mg/mL),按1 mL/kg注射。观察1周后开始局部40 W紫外线照射豚鼠外阴,5~8 min/次,每天1次,共5次。照射后观察记录2周内各组豚鼠GH复发情况,并分别在第1、2周时取阴道分泌物作HSV-2培养。
2 结果
2.1豚鼠GH模型建立
2.1.1豚鼠受HSV-2野生株感染3天后,出现典型GH发生包括:外阴红斑水肿,水疱,继而糜烂溃疡。见图1a、b、c。
2.1.2豚鼠感染HSV-2野生株,观察出现生殖道疱疹后表皮组织病理表皮内出现水疱,细胞的气球变性及网状变性所致细胞内水肿,周围可见多核巨细胞及核内嗜酸性包涵体。真皮乳头水肿,可见血管外红细胞,真皮内程度不等的炎症细胞浸润,有嗜中性白细胞、淋巴细胞等(图2a)。脊神经根电镜观察:髓质髓鞘变性、膜走向乱、模糊;可见球状的病毒样颗粒,直径约134~220 nm,部分颗粒可见有囊膜包囊(图2b)。提示:建立豚鼠生殖器疱疹感染模型成功,可用于外用CT-siRNA治疗研究。
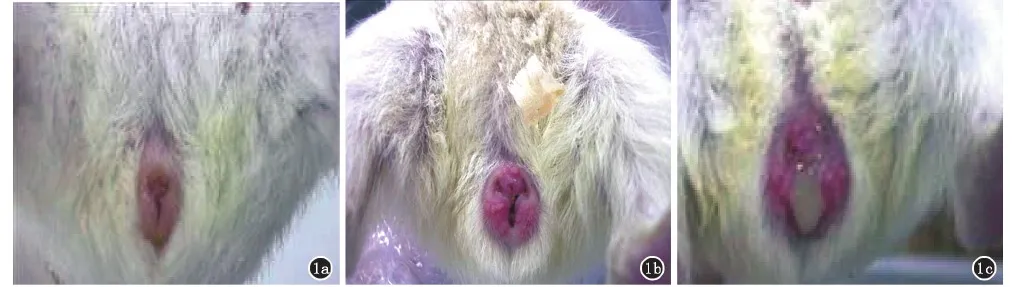
1a:接种病毒前;1b:接种病毒3天后出现红斑、水疱;1c:5天后出现破溃、渗液
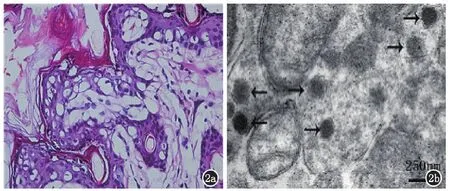
2a:表皮内水疱,细胞内水肿,周围可见多核巨细胞及核内嗜酸性包涵体。真皮乳头水肿,可见血管外红细胞,真皮内炎细胞浸润,有嗜中性粒细胞、淋巴细胞等(HE,×400);2b:脊神经根电镜图像(×40K)
图2豚鼠生殖器疱疹感染模型组织病理和脊神经根电镜改变
2.2豚鼠外用CT-siRNA预防HSV-2感染实验
2.2.1HSV-2野生株感染攻击后,两组受病毒攻击后豚鼠出现的损害严重程度不同,按损害严重程度分级参考文献[8],分为0级无症状和皮疹;I级:红斑和丘疹;II级:水肿水疱;III级:糜烂和渗液;IV级:后肢体麻痹、瘫痪;V级死亡。两组受病毒攻击后出现的损害严重程度统计结果如下,两组不同时间存活率比较见图3。3、5、7天治疗与对照组症状比较t=-5.37(P<0.001);t=-8.25(P<0.001);t=-5.56(P<0.01)。

损害严重程度症状等级规模及评分:0 级蓝色;I级棕红色;II级黄色;III级浅蓝色;IV级紫色;V级红色
图3外用CT-siRNA和对照siN.C制剂后,给予疱疹病毒2型(HSV-2)野生株攻击结果
2.2.2外用CT-siRNA和对照两组HSV-2感染后豚鼠存活率比较病毒攻击8天,CT-siRNA 组存活率80%,对照组存活率23.3%,两组对比,χ2=17.844,P<0.001(图4)。
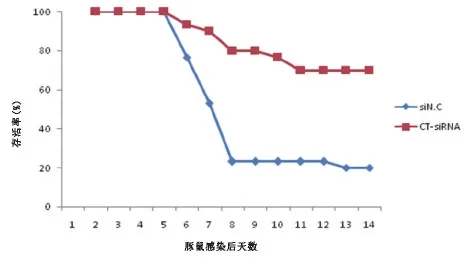
图4外用CT-siRNA和对照siN.C制剂后,给予病毒攻击后不同时间存活率比较
2.3外用CT-siRNA治疗豚鼠GH实验
2.3.1外用CT-siRNA治疗组和对照组豚鼠初发GH皮损积分值比较见表1。
表1 外用CT-siRNA治疗组和对照组
注:t为治疗3、5、7、10天治疗组与对照组比较,P<0.001
2.3.2GH豚鼠治疗组和对照组GH复发情况见表2。

表2 GH豚鼠治疗组和对照组复发率
注:治疗组与对照组两组复发率比较χ12=11.92(P<0.05),治疗组与对照组病毒培养阳性率比较χ22=17.78(P<0.05。
3 讨论
GH是一种由HSV感染引起的常见的性传播疾病。GH除了可以引起患者生殖器的水疱溃疡反复发作,还可引起播散性HSV感染、病毒性脑膜炎、盆腔炎等一系列并发症,孕妇GH可引起胎儿感染和新生儿疱疹,GH还可以增加HIV 感染的危险性。估计全球每年有2300万新发HSV-2感染者[9]。多数GH是由HSV-2引起。传统的抗病毒药物常通过对病毒编码的DNA多聚酶选择性磷酸化而起作用,在病毒潜伏阶段这些基因并不大量表达,故对于潜伏感染的病毒无作用,不能阻止GH的下次复发和无症状排病毒,国内外学者近年来对治疗GH进行了很多探索,包括疫苗研究和免疫佐剂治疗[10],未获得满意收获。
RNA干扰技术抑制病毒的繁殖和感染是当前抗病毒研究领域的一个热点[11]。Palliser等在2006年的nature杂志发表的论文提供了一种简单、高价效的外用siRNA 抗病毒制剂,把标记荧光素的特异siRNA与阳离子脂质混合阴道内投放,在实验中观察到其可以被阴道和子宫颈黏膜上皮细胞、固有层和间质细胞摄取,对预防和治疗GH 有明显效果。有学者认为这是目前最接近临床应用可能的一种抗病毒外用siRNA 制剂。
豚鼠受HSV-2野生株感染生殖道后,出现典型GH发病,包括:外阴红斑水肿,水疱,继而糜烂溃疡;观察出现生殖道疱疹典型表皮组织病理改变。脊神经根电镜观察可见髓质髓鞘变性,球状的病毒样颗粒。提示建立豚鼠生殖器疱疹感染模型成功,可用于外用CT-siRNA治疗研究。
我们选取靶向HSV-2 UL27.2和UL29.2基因(分别编码包膜糖蛋白gB和一个DNA黏合蛋白)的联合,制备了联合靶向特异性siRNA制剂。我们先前体外抗病毒研究已证实这种联合特异性siRNA制剂能明显的抑制HSV复制增殖。雌性豚鼠随机分组给予外阴和阴道内外用CT-siRNA制剂和不靶向任何基因对照RNA(siN.C)制剂后,阴道内给予疱疹病毒2型(HSV-2)野生株攻击,实验结果显示,对照组豚鼠易受病毒感染,发病迅速且症状重,并发症亦严重,部分出现单侧或双侧后肢坏死瘫痪后死亡。而外用CT-siRNA制剂组豚鼠症状明显轻微,存活率显著高于对照组,提示CT-siRNA制剂能特异性干扰抑制目的基因,起到预防和抗HSV-2的感染的作用。
另外建立豚鼠生殖器疱疹感染,观察出现生殖道疱疹后,随机分为治疗组和对照组,分别给予CT-siRNA和siN.C外用制剂治疗,观察发病情况,疱疹皮损变化情况和愈合时间,治疗组皮损改善快和愈合时间缩短(P<0.05)。 提示CT-siRNA能特异性抑制病毒HSV-2复制,控制GH病情和促进愈合。愈合后外用制剂继续治疗每周1次,1个月后两组均给予环磷酰胺注射液腹腔注射和紫外线灯局部照射诱导复发,CT-siRNA制剂治疗组复发率要低于对照组(P<0.05),阴道分泌物的病毒培养阳性率低于对照组(P<0.05),提示定期使用外用CT-siRNA制剂能抑制病毒HSV-2复制,减少GH的无症状排毒和复发。
实验表明外用CT-siRNA制剂能防治HSV-2的感染、早期治疗可以控制缩短GH的病程,每周1次外用可控制或减少GH复发、无明显不良反应。与传统治疗比较,此方法应用简单、有可能在控制GH 的反复发作和间歇性排毒这些方面取得突破。
[1] Hu-Lieskovan S, Heidel JD, Bartlett DW, et al. Sequence-specific knockdown of EWS-FLI1 by targeted, nonviral delivery of small interfering RNA inhibits tumor growth in a murine model of metastatic Ewing's sarcoma[J]. Cancer Res,2005,65(19):8984-8992.
[2] Zhang YQ, Lai W, Li H, et al. Inhibition of herpes simplex virus type 1 by small interfering RNA[J]. Clin Exp Dermatol,2008,33(1):56-61.
[3] Zhu QC, Ren Z, Zhang CL, et al. Silencing HSV1 gD expression in cultured cells by RNA interference[J]. Bing Du Xue Bao,2007,23(1):22-27.
[4] Drannik AG, Nag K, Sallenave JM, et al. Antiviral activity of trappin-2 and elafin in vitro and in vivo against genital herpes[J]. J Virol,2013,87(13):7526-7538.
[5] Palliser D, Chowdhury D, Wang QY, et al. AnsiRNA-based microbicide protects mice from lethal herpes simplex virus 2 infection[J]. Nature,2006,439(7072):89-94.
[6] 陈木开,刘隽华,马春光,等.联合靶向小干扰RNA对疱疹病毒2感染的体外抑制作用[J].中华生物医学工程杂志,2009,15(5):360-364.
[7] Kern ER, Glasgow LA, Overall JC, et al. Treatment of experimental herpes-virus infections with phosphonofor.mate and some comparisons with phosphonoacetate[J]. Antimicrob Agents Chemother,1978,14:817-823.
[8] Stanberry LR, Kern ER, Richards JT, et al. Genital herpes in guinea pigs: pathogenesis of the primary infection and description of recurrent disease[J]. J Infect Dis,1982,146:397-404.
[9] Looker KJ, Garnett GP, Schmid GP. An estimate of the global prevalence and incidence of herpes simplex virus type 2 infection[J]. Bull World Health Organ,2008,86(10):805-812.
[10] Koelle DM. Vaccines for herpes simplex virus infections[J]. Curr Opin Investing Drugs,2006,7(2):136-141
[11] Sophia TM, Hector H, John H, et al. High-Purity Preparation of HSV-2 Vaccine Candidate ACAM529 Is Immunogenic and efficacious in vivo[J]. PLoS One,2013,8(2):e57224.
(收稿:2015-07-20修回:2015-10-05)
Effect of topical combined targeting siRNA on guinea pig with genital herpes
LIShulin1,2,HANJiande1,LIAOQiman1,LIHuan1,LIYinyin3,LIHongmei3,MAChunguang1,CHENMukai1.
1.DepartmentofDermatology,FirstAffiliatedHospitalofSunYat-senUniversity,Guangzhou510080,China; 2.DepartmentofDermatology,ShenzhenZhongshanUropoiesisSurgicalHospital,Shenzhen518000,China;3.StateKeyLaboratoryofSunYat-senUniversityPestManagement,Guangzhou510275,China
CHENMukai,E-mail:ytchen2008@gmail.com
Objective: To assess the effect of combined targeting siRNA (CT-siRNA, HSV-2 UL27.2 gene combined UL29.2 gene) on genital herpes of guinea pig. Methods: (1) HSV-2 infection experiment: sixty guinea pigs were divided into the treatment group and control group (30 in each group). Guinea pigs in the treatment group were treated with topical CT-siRNA on vulva and vagina and those in the control group were treated with siN.C. After 4 hours, the herpes virus type 2 (HSV-2) wild strains were inoculated to vagina in all the guinea pigs. (2) Sixty guinea pig models with the infection of genital herpes were divided into the treatment group and control group (30 guinea pigs in each group). Guinea pigs in the treatment group were treated with topical CT-siRNA on vagina and those in the control group were treated with siN.C, once a week until lesion healing. All guinea pigs were treated with intraperitoneal injections of cyclophosphamide and ultraviolet radiation to induce the recurrence after the 2 month treatment and the recurrence rate was assessed. Results: The survival rate in the treatment group was 80%, which was higher than that in the control group (23.3%), (P<0.05). At day 10 of the treatment, the lesions score in the treatment group was (0.25±0.25), which was lower than that in the control group (1.0±1.25) (P<0.05). The recurrence rate in the treatment group was 16.7%, which was lower than that in the control group (60%), (P<0.05). Conclusion: Topical CT-siRNA can reduce the infection rate and recurrence of HSV-2.
siRNA; genital herpes; animal model
广东省科技计划项目(编号:2008B03030144)
1中山大学附属第一医院皮肤科,广州,510080
2深圳中山泌尿外科医院,深圳,518000
陈木开,E-mali:ytchen2008@gmail.com
3中山大学有害生物防治国家重点实验室,广州,510275
