Bi2Sn2O7的不同水热法制备及其可见光光催化除As(III)性能分析
2016-11-08庄建东田勤奋福建农林大学材料工程学院福州35000福州大学化学学院能源与环境光催化国家重点实验室福州35000
庄建东 田勤奋 刘 平(福建农林大学材料工程学院,福州35000;福州大学化学学院,能源与环境光催化国家重点实验室,福州35000)
Bi2Sn2O7的不同水热法制备及其可见光光催化除As(III)性能分析
庄建东1,*田勤奋1刘平2
(1福建农林大学材料工程学院,福州350002;2福州大学化学学院,能源与环境光催化国家重点实验室,福州350002)
利用微波和普通水热法合成出了具有可见光响应的Bi2Sn2O7纳米光催化剂,并用X射线衍射(XRD)、氮气吸脱附、紫外-可见漫反射光谱(UV-Vis DRS)、扫描电镜(SEM)、透射电镜(TEM)、电子顺磁共振谱(ESR)、X射线光电子能谱(XPS)等技术对样品的晶相、比表面积、光吸收性能、形貌、光催化活性物种等结构与性质进行了系统表征,比较微波水热Bi2Sn2O7(MH-BSO)与普通水热Bi2Sn2O7(TH-BSO)形貌和微结构,并考察两者在可见光光照下光催化氧化As(III)的性能差别。实验结果表明,MH-BSO具有更细小的粒径和更大的比表面积,而在可见光照射下,MH-BSO样品比TH-BSO样品具有更好的As(III)的光催化氧化能力(可达98.7%)。此外,对Bi2Sn2O7纳米光催化剂氧化去除As(III)的光催化机理进行初步探索,结果表明超氧自由基(O-2•)和空穴(hV+B)是主要起作用的中间反应活性物种。
锡酸铋;微波水热法;普通水热法;可见光催化;As(III)氧化
doi:10.3866/PKU.WHXB201511304
1 引言
含砷化合物是一种对人类健康和地球环境危害十分严重而又普遍存在的水中污染物,多见于天然水体和工业废水中1,2。据联合国儿童基金会(UNICEF)的调查显示,2013年在我国华北的大部分省份仍有11万人口受高浓度含砷水的影响。水中的砷化物多以AsO-2(As(III))和AsO34-(As(V))的形式存在,其中As(III)毒性是As(V)的100倍,且比As(V)更难利用目前常用的共沉淀法去除3-5。因此,关于As(III)高效氧化成As(V)并进一步实现吸附去除的研究日益受到重视6,7。现已报道的氧化As(III)的方法有MnO2氧化法8、UV/Fe3+氧化法9、H2O2氧化法10、O2/O3氧化法11和光催化氧化法12-16等。其中,光催化氧化技术作为一种新兴的环境治理技术,因其反应条件温和,无二次污染以及利用天然的太阳光驱动反应的特点,在氧化As(III)污染物方面发挥着重要作用。在此方向做的较早、较典型的有Rajeshwar17、Frimmel12和Choi18小组,主要以TiO2为典型光催化剂考察TiO2对As(III)的氧化能力和相关反应机理。相关研究结果表明,光催化剂可通过产生光生空穴(h+)直接氧化高毒性的As(III)成低毒的As(V),也可通过产生光生电子(e−)并与H2O、O2反应生成具有强氧化性的过氧化氢(H2O2)、羟基自由基(∙OH)或超氧自由基(O2-•)等强氧化性物种而起氧化作用。这些研究结果无疑从原理上证明了光催化氧化技术在水中砷化物治理中的可行性。然而,TiO2的量子效率低且可见光利用率低等问题制约了其在光催化除砷技术中的实际应用,开发具有可见光响应能力的,且对As(III)具有高效氧化能力的新型光催化剂显得尤为重要。
作为一种典型的面心立方烧绿石(pyrochlore)结构化合物,Bi2Sn2O7材料在热催化剂和气体传感器等领域都已有所应用19,20。Bi2Sn2O7晶胞中的SnO6八面体结构分别由一个Sn原子与六个O原子配位组成,SnO6八面体通过共顶点链接起来21。这种共顶点空间结构有利于光生载流子的传输和分离,能够提升载流子的分离效率,使得Bi2Sn2O7有望作为一种优良的光催化剂在光解水和环境光催化领域得到应用。另一方面,众所周知,纳米材料的颗粒尺度和形貌结构对其物理化学性能有显著影响。由于传统水热法制备时间长,容易形成多次成核而影响粒子尺寸的均匀性。近年来,微波水热技术(MH)由于其快速高效、能耗低、无污染和易控制等优点越来越受到人们的关注22。微波水热技术可实现分子水平的加热和振动,具有快速升温和加热均匀等优势,能极大降低温度梯度的影响,使沉淀相快速均匀成核,可以得到形状和尺寸较为均匀的纳米晶。
在本课题组前期的研究中发现23,利用普通水热法(TH)制备的Bi2Sn2O7具有较好的可见光催化活性,能够有效地将As(III)光氧化成As(V)。在此基础上,本文将分别采用TH和MH来制备Bi2Sn2O7纳米晶体(BSO),探讨制备条件对纳米材料晶相、形貌和空间结构的具体影响,进一步考察两种样品在光催化氧化As(III)过程中的性能差异和影响因素,并对Bi2Sn2O7光催化氧化As(III)的机理进行了探讨。
2 实验部分
2.1试剂和仪器
五水硝酸铋(Bi(NO3)3∙5H2O)、四水锡酸钾(K2SnO3∙4H2O)和氢氧化钾(KOH)(国药集团化学试剂有限公司,分析纯);三价砷溶液(中国重金属研究院);去离子水(自制)。
美国CEM全自动微波合成系统(Explorer48);德国Bruker公司的D8 Advance型X射线粉末衍射(XRD)仪;日本JEOL公司JSM6700F型场发射扫描电镜(FE-SEM)和JEM2010型透射电镜(TEM,HRTEM);美国Varian公司的Cary500型紫外-可见漫反射仪(UV-Vis DRS);美国Thermo-Fisher公司ESCALAB 250型X射线光电子能谱(XPS)仪;美国麦克公司ASAP2020型比表面及孔隙度分析仪;德国Bruker公司的Model A300型电子顺磁共振谱(ESR)仪;北京普析仪器通用有限公司PF6型原子荧光分光光度计(AFS)。
2.2催化剂制备
2.2.1普通水热法
准确称取0.01 mol的K2SnO3∙4H2O和Bi(NO3)3∙5H2O,把称好的样品放入带有聚四氟乙烯内衬的不锈钢反应釜中(有效容积100 mL),加入70 mL蒸馏水,搅拌0.5 h,用2 mol∙L-1KOH溶液调节反应溶液的pH值分别为12。继续搅拌1 h后,将反应釜密封并放入烘箱,分别在180和200°C条件下恒温反应24 h,自然冷却至室温,离心、水洗、离心3-5遍,60°C烘干,得到黄色粉末状Bi2Sn2O7催化剂,分别标记为TH-BSO-180和TH-BSO-200。
2.2.2微波水热法
按上述计量称取各反应物加入到70 mL去离子水中,搅拌0.5 h,然后用2 mol∙L-1的KOH调节溶液的pH值为12,继续搅拌1 h后,将得到的前驱体溶液倒入带有聚四氟乙烯内衬的反应器中,使得溶液的填充度为70%。将反应器密封后放入微波反应器内,在180°C恒温1 h后自然冷却至室温,离心、水洗、离心3-5遍,60°C烘干,得到黄色粉末状Bi2Sn2O7,标记为MH-BSO。
2.3光催化除砷性能评价
可见光催化反应在自制的间歇式反应装置中进行,反应光源为置于双层玻璃夹套(通冷凝水)中的300 W卤钨灯,使用组合滤光片以保证入射光为可见光(420 nm<λ<800 nm)。在玻璃反应瓶中加入80 mL的NaAsO2溶液(2.0 mg∙L-1),持续搅拌下加入80 mg的Bi2Sn2O7,待暗吸附平衡1 h后开启可见光光源进行光催化反应。每隔一定时间取2 mL反应液,经离心分离后,适量稀释,用PF6非散射原子荧光分光光度检测As(III)浓度。
3 结果与讨论
3.1XRD结果分析
图1给出了两种不同水热法所制得样品THBSO和MH-BSO的XRD谱图。从图中可以看出,在180°C,pH值为12的条件下,利用普通水热法制得的TH-BSO-180样品已具备较好的晶相结构,其在28.7°、33.3°、47.8°和56.8°处的主要特征峰可分别对应于纯相Bi2Sn2O7的(222)、(400)、(440)和(622)特征峰(JCPDS No.88-0496)。但仍然可以在2θ=26.5°处发现一个归属于SnO2的小峰,表明在该条件下反应24 h后,仍有部分原料难以反应完全。而进一步提升水热温度至200°C后,方可得到单一立方晶相的Bi2Sn2O7纳米晶。同时,随着温度的提高,样品的衍射峰强度得到较大增强,不纯相消失。同时从XRD谱图中可以看出,利用微波水热法能够在较低温度(180°C)和较短时间(1 h)得到纯相Bi2Sn2O7纳米晶,制备效率大大提高。选择样品衍射谱中的(222)晶面,利用Scherrer公式由衍射峰半峰宽可以求得TH-BSO-200和MH-BSO两样品的平均晶粒大小分别为15.4和11.2 nm,说明制备得到的MH-BSO样品的结晶度略差于THBSO-200样品。
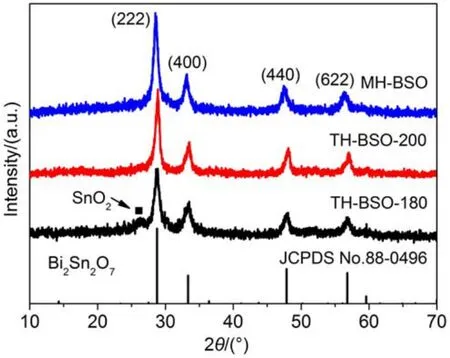
图1 利用不同水热方法制得的BSO的XRD谱Fig.1 XRD patterns of the Bi2Sn2O7samples prepared via different preparation methods
3.2TEM结果分析
催化剂的颗粒尺寸及其分布、催化剂颗粒表面特征是影响其性能的重要因素,它会直接影响催化剂的光催化活性。为了进一步探明样品的晶粒尺寸,我们对两种方法合成的TH-BSO-200和MH-BSO样品进行透射电镜(TEM)分析,结果见图2。从图2(A,B)中的低倍TEM照片中可以看出,利用两种水热方法制备出的BSO纳米颗粒在晶粒的尺寸上存在着明显区别,其中TH-BSO-200样品由许多圆形或椭圆形的纳米颗粒堆积而成,这些纳米颗粒平均粒径大约在10-15 nm之间,而微波水热法制备的MH-BSO样品相比之下颗粒较小。而在HRTEM照片(图2(C,D))下也可发现,两图中纳米晶体衍射条纹清晰可见,晶面间距经仔细测量约为0.31 nm,可对应于立方相Bi2Sn2O7的(222)晶面,证实了所得样品为期望的Bi2Sn2O7晶体。而从SEAD衍射花样照片(图2(E,F))中也可以看到样品的多晶衍射环,其中TH-BSO-200样品的衍射环较为锐利,说明其晶粒具有较好的结晶度,结晶度要高于MH-BSO纳米晶,上述透射电镜表征结果与XRD结果相符。同时还利用EDX能谱对样品进行分析(结果未显示),共检测出Bi、Sn、O、Cu和C五种元素,其中Cu和C来自样品台的基底,进一步佐证了所合成的样品为Bi2Sn2O7晶体。
3.3比表面积和孔径分布结果分析
由于纳米颗粒的堆积作用,在纳米粉体样品中会出现堆积孔道结构,这些孔道结构(孔径和比表面积)又与纳米颗粒的尺寸密切相关。利用物理吸附仪对两种水热合成的BSO纳米颗粒进行氮气吸附-脱附BET比表面积和BJH孔径分布测试,结果见图3。从图3中可以看出,两个样品的吸脱附等温线都属于V型H3滞后环,表明样品中的孔道主要为纳米粒子堆积形成的狭缝孔,而且N2与样品颗粒间的作用力较弱。通过BET比表面积分析发现,利用微波水热法得到的MH-BSO的SBET为74.18 m2∙g-1,比普通水热法得到的TH-BSO-200样品的比表面积(57.88 m2∙g-1)增大了28%。而通过BJH方法对样品的孔径分布进行计算后发现,THBSO-200样品中的堆积孔的孔径约为9.7 nm,要远大于MH-BSO样品的孔径尺寸(1.6-3.8 nm),这一结果从侧面证实了MH-BSO样品的纳米晶尺寸更加细小,致使堆积更加细密,孔径减小。从以上结果可以确定,微波水热法有利于BSO纳米晶体的均相成核和生长,因此产物MH-BSO具有更小的晶粒尺寸和更好的分散性,比表面积增大.由于比表面积是决定催化剂反应活性位和反应基质吸附量的重要因素,因此较大的比表面积有利于光催化反应的进行。
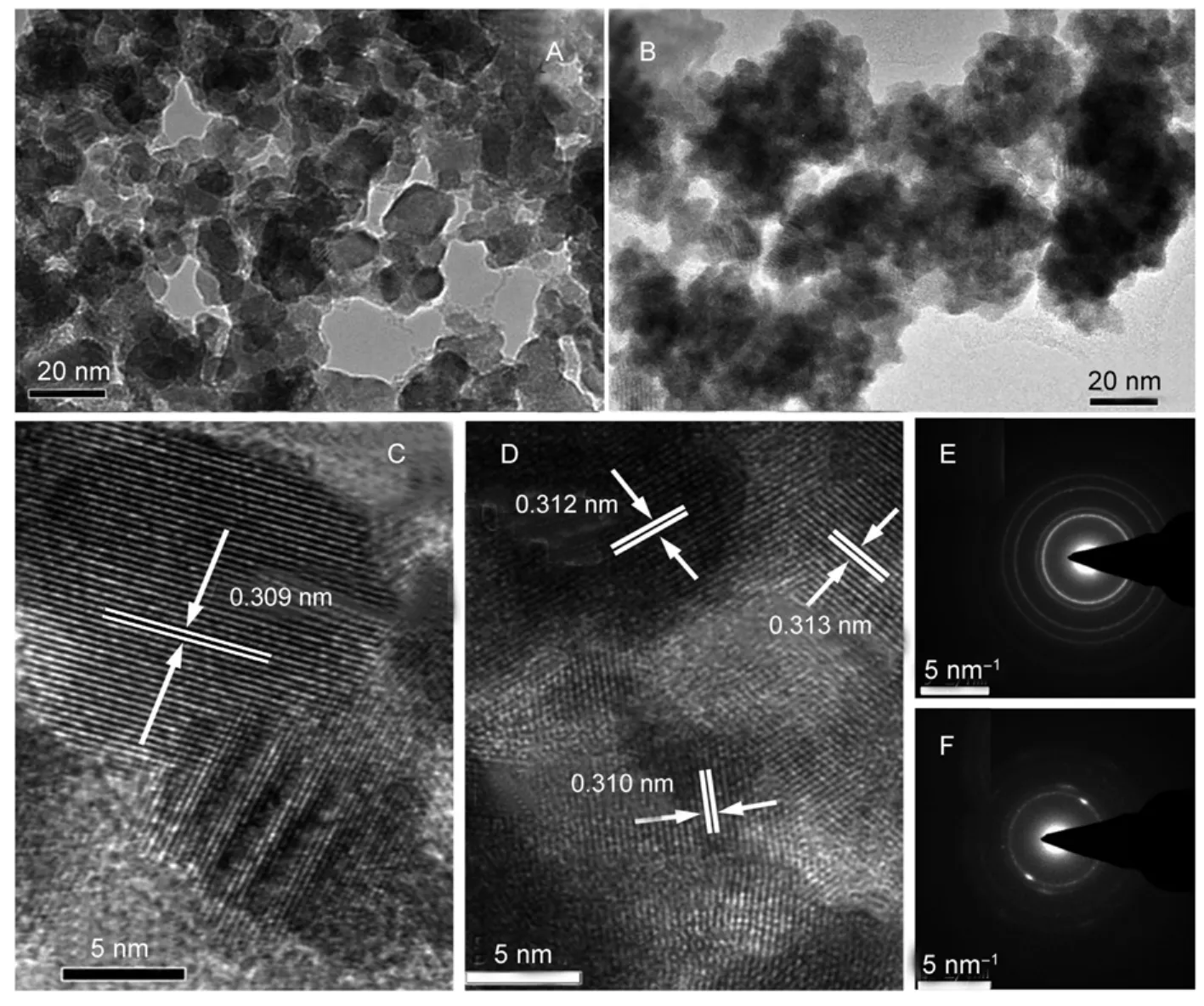
图2 利用不同水热方法制得Bi2Sn2O7(BSO)的TEM(A,B),HRTEM(C,D)和选区电子衍射(E,F)照片Fig.2 TEM(A,B),high-resolution TEM(HRTEM)(C,D)and selected area electron diffraction(SAED)(E,F) images of the Bi2Sn2O7(BSO)samples prepared via different hydrothermal methods
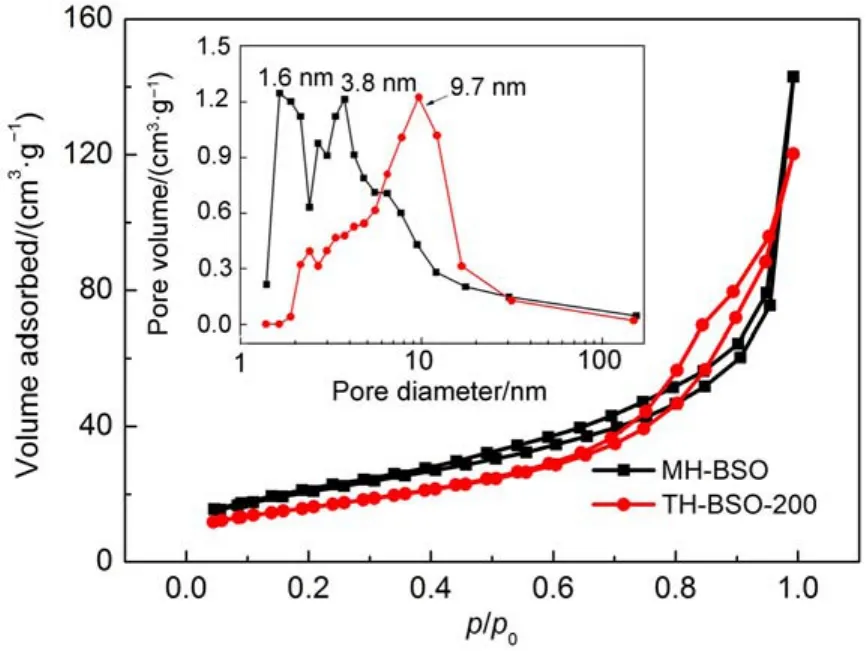
图3 利用不同水热方法制得BSO样品的N2吸脱附曲线图和相应的BJH孔径分布图(插图)Fig.3 N2-sorption isotherms and corresponding pore size distribution curves(inset)of the BSO samples prepared via different hydrothermal methods
3.4光吸收性能结果分析
Bi2Sn2O7纳米颗粒是一种窄带隙的半导体材料,合成方法的差异有可能会影响其光吸收特性。两种样品相应的UV-Vis漫反射谱图如图4所示,可以看出,TH-BSO-200和MH-BSO样品在吸收带边分别为~430和~427 nm,可估算出其相应带隙宽度分别为2.88和2.90 eV,说明两种样品带隙差异不大,且均可响应420 nm以上的可见光。同时,MH-BSO样品的吸收带边较TH-BSO-200样品出现了一定的蓝移,从量子尺寸效应变化来看,MH-BSO样品中的Bi2Sn2O7纳米晶粒的粒径比THBSO-200中的要小,与前面的XRD和TEM表征分析结果相吻合。
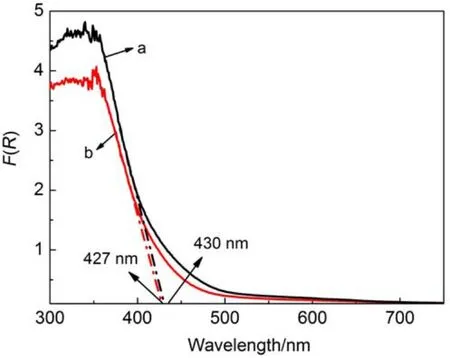
图4 利用不同水热方法制得BSO样品的紫外-可见漫反射光谱Fig.4 UV-Vis diffuse reflection spectra of the BSO samples prepared via different hydrothermal methods
3.5光催化氧化除砷活性分析
表1总结了两种水热方法制备的Bi2Sn2O7纳米颗粒的相关表征数据。为进一步研究样品形貌结构对其光催化活性的影响,我们对两种样品的光催化氧化除砷活性进行评价。图5为不同水热法制备的BSO样品对含As溶液的光催化的活性图。从图5A中可以看出,在可见光光照下含砷溶液中的As(III)浓度并未发生明显变化,表明As(III)在能够在通常环境条件下较稳定存在。加入Bi2Sn2O7催化剂后,在无光照条件下催化剂对As(III)表现出一定的吸附能力,其中MH-BSO较TH-BSO-200吸附能力更佳,这主要是由于前者具有更大的比表面积。在可见光照射(λ>420 nm)下,两种样品对水溶液中的As(III)都表现出极佳的光催化活性。其中,普通水热法合成的TH-BSO-200样品对As(III)氧化率在40 min的光催化反应后即可达到94.5%,而微波水热法合成的MH-BSO样品对As(III)氧化率则高达97.8%。图5B进一步反映了溶液中总砷的含量变化。显然,Bi2Sn2O7样品对As(V)具有较好的吸附能力,而由于MH-BSO具有颗粒小、比表面积大的特点,其对As(V)的吸附能力可达到78.7%,远高于TH-BSO-200样品的52.6%。这一结果也表明通过改变实验条件,制备具有大比表面积的Bi2Sn2O7光催化剂在除砷应用中是非常有必要的。

表1 普通水热法和微波水热法制备的Bi2Sn2O7纳米颗粒的相关数据Table 1 Data of the BSO samples prepared by traditional hydrothermal and microwaves hydrothermal methods
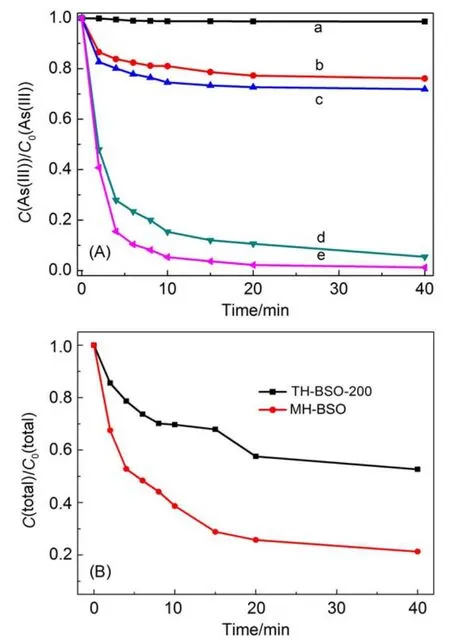
图5 不同实验条件下含砷溶液中As(III)的浓度变化图(A)和在可见光下总As浓度变化图(B)Fig.5 Temporal changes in the concentrations ofAs(III) under different experimental conditions(A)and As(total)under visible light illumination(B)
3.6光催化氧化除砷机理分析
为了进一步证明在可见光照射下Bi2Sn2O7确实能够将As(III)氧化成As(V),而不是还原成As(0)。我们也将光催化反应后的Bi2Sn2O7样品进行回收,并利用XPS分析其表面吸附的As物种的价态,结果如图6所示。从图中可以看出,光催化反应前后两个样品的XPS谱图中都可以明显看到两个As 3d的特征峰,分别对应于44.6 eV处的As(III)峰和45.6 eV处的As(V)峰24。暗吸附后,如图6(A)所示,催化剂表面吸附的As物种主要以As(III)形式存在,而同时也含有微弱的As(V)峰,这可能是由于测试制样过程中见光而引起的部分氧化。而在光催化反应之后,催化剂表面吸附的两种As物种的XPS信号强度发生明显转变(图6(B)),说明在可见光照射下,Bi2Sn2O7可将As(III)光催化氧化为As (V)。此外,从As(III)和As(V)光电子能谱峰的峰面积大小可以得知,光催化反应后催化剂表面能吸附较多的As(V),也证实了Bi2Sn2O7催化剂对水溶液中的As(V)具有较好的吸附能力。
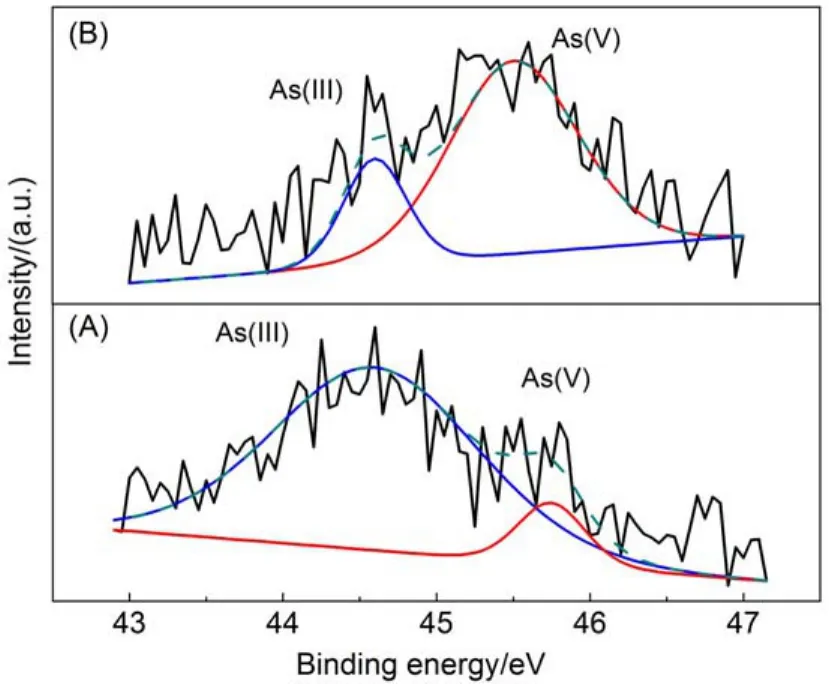
图6 光催化反应前(A)和后(B)BSO光催化剂表面吸附的As物种的As 3d XPS谱图Fig.6 As 3d XPS spectra ofAs species adsorbed on BSO photocatalyst before(A)and after(B) photocatalytic reaction
此外,实验还进一步以二甲基吡啶(DMPO)为捕获剂,利用原位电子顺磁共振(ESR)仪对光催化过程中的活性氧物种进行分析。从ESR(图7)可以看出,Bi2Sn2O7-DMPO-CH3OH体系在420 nm以上可见光照射3 min后,有一组六重谱峰出现,可归属于Bi2Sn2O7-DMPO-O2-•加合物的ESR波谱的特征信号峰25。而Bi2Sn2O7-DMPO-H2O体系在可见光照射3 min后,无明显的信号峰产生,表明体系中无∙OH自由基存在。这主要是由于Bi2Sn2O7的价带位置处于约2.22 V(vs标准氢电池(NHE),pH=7),要低于∙OH/H2O的反应电势(E0=2.38 V(vs NHE), pH=7),因此在反应过程中价带上的光生空穴无法氧化表面羟基产生∙OH自由基。而为了进一步跟踪光生空穴(h+)的后续反应,我们往体系中加入草酸铵(空穴湮灭剂)来考察空穴(h+)在As(III)氧化过程中的作用。实验结果表明,在体系中加入0.1g草酸铵后,Bi2Sn2O7光催化剂对As(III)的氧化速率明显降低。结合先前的ESR实验结果,可以说明在可见光光催化反应条件下,Bi2Sn2O7光催化氧化As(III)主要涉及O2-•自由基的产生和反应以及空穴(h+)直接氧化。
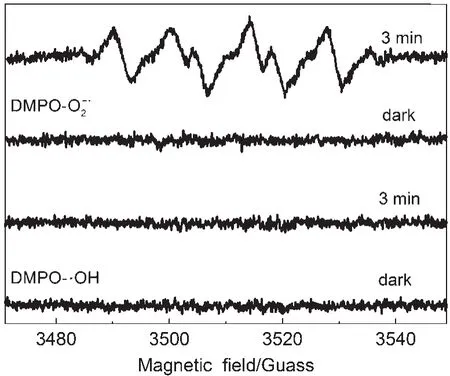
图7 可见光照条件下BSO样品在水和甲醇体系中生成DMPO-O2-•和DMPO-∙OH的ESR谱Fig.7 ESR spectra of DMPO-O2-•and DMPO-∙OH in BSO methanol and water dispersion
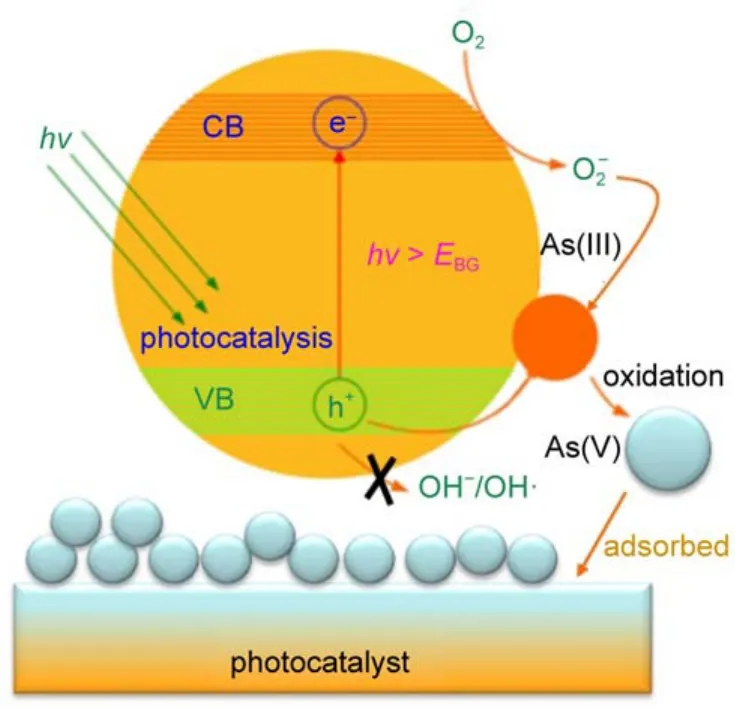
图8 Bi2Sn2O7样品可见光催化氧化As(III)的机理图Fig.8 Proposed mechanism for the visible light photocatalytic oxidation ofAs(III)on Bi2Sn2O7sample CB:conduction band;VB:valence band
根据前面的实验结果分析,可将Bi2Sn2O7可见光光催化氧化As(III)的可能反应机理归纳如下,如图8所示:(1)在可见光(hv>EBG)激发下,Bi2Sn2O7价带上的电子跃迁到导带上,产生了的光生电子(eCB-)和空穴(hVB+)。(2)由于Bi2Sn2O7的导带比E(O2/O2-•)(-0.33 V vs NHE)更负,故光生电子(eCB-)可转移到催化剂表面与吸附的O2反应生成超氧自由基(O2-•);而其价带位置要低于E(∙OH/H2O)(2.38 V vs NHE),光生空穴(hVB+)不足以氧化表面羟基(―OH),故无法产生∙OH自由基。(3)根据上述表征结构,可以认为在Bi2Sn2O7光催化氧化As(III)过程中,体系中的主要活性物种为超氧自由基(O2-•)和空穴(hVB+),其中超氧自由基(O2-•)起主要作用。
4 结论
综上,不同合成方法对催化剂的活性具有影响显著。采用微波水热技术制备的Bi2Sn2O7样品显示出了较高的光催化活性,这与微波水热独特的加热方式有关。在微波电磁场下,反应物分子剧烈运动和磨擦,使溶液在短时间内被均匀加热,消除了温度梯度的影响,从而有利于获得颗粒度更小,比表面积较高的Bi2Sn2O7纳米粉体。而光催化活性结果进一步表明,MH-BSO纳米晶对As(III)具有更好的光催化氧化能力,对As(III)的去除能力达到98.6%,要明显高于TH-BSO样品。此外,还对MH-BSO可见光光催化氧化As(III)的机理进行探索,分析结果表明,在Bi2Sn2O7纳米晶光催化氧化As(III)的反应过程中,超氧自由基(O2-•)和空穴(hVB+)是主要起作用的中间反应活性物种。
References
(1)Amini,M.;Mueller,K.;Abbaspour,K.C.;Rosenberg,T.; Afyuni,M.;Møller,K.N.;Sarr,M.;Johnson,C.A. Environmental Science&Technology 2008,42,3662.doi: 10.1021/es071958y
(2)Welch,A.H.;Westjohn,D.;Helsel,D.R.;Wanty,R.B.Ground Water 2000,38,589.doi:10.1111/gwat.2000.38.issue-4
(3)Kumar Maji,S.;Pal,A.Recent Patents on Engineering 2010, 4,92.doi:10.2174/187221210791233461
(4)Lee,H.;Choi,W.Environmental Science&Technology 2002, 36,3872.doi:10.1021/es0158197
(5)Kim,Y.;Kim,C.;Choi,I.;Rengaraj,S.;Yi,J.Environmental Science&Technology 2004,38,924.doi:10.1021/es0346431
(6)Bissen,M.;Frimmel,F.H.Acta Hydrochimica et Hydrobiologica 2003,31,9.doi:10.1002/aheh.200390025
(7)Bissen,M.;Frimmel,F.H.Acta Hydrochimica et Hydrobiologica 2003,31,97.
(8)Driehaus,W.;Seith,R.;Jekel,M.Water Research 1995,29, 297.doi:10.1016/0043-1354(94)E0089-O
(9)Emett,M.T.;Khoe,G.H.Water Research 2001,35,649.doi: 10.1016/S0043-1354(00)00294-3
(10)Pettine,M.;Campanella,L.;Millero,F.J.Geochimica et Cosmochimica Acta 1999,63,2727.doi:10.1016/S0016-7037 (99)00212-4
(11)Kim,M.J.;Nriagu,J.Science of the Total Environment 2000, 247,71.doi:10.1016/S0048-9697(99)00470-2
(12)Bissen,M.;Vieillard-Baron,M.M.;Schindelin,A.J.; Frimmel,F.H.Chemosphere 2001,44,751.doi:10.1016/ S0045-6535(00)00489-6
(13)Dutta,P.K.;Pehkonen,S.;Sharma,V.K.;Ray,A.K. Environmental Science&Technology 2005,39,1827.doi: 10.1021/es0489238
(14)Fostier,A.H.;Pereira,M.D.S.S.;Rath,S.;Guimarães,J.R. Chemosphere 2008,72,319.doi:10.1016/j. chemosphere.2008.01.067
(15)Xu,T.;Cai,Y.;O'Shea,K.E.Environmental Science& Technology 2007,41,5471.doi:10.1021/es0628349
(16)López-Muñoz,M.;Revilla,A.;Alcalde,G.Catalysis Today 2015,240,138.doi:10.1016/j.cattod.2014.05.008
(17)Yang,H.;Lin,W.Y.;Rajeshwar,K.Journal of Photochemistry and Photobiology A:Chemistry 1999,123,137.doi:10.1016/ S1010-6030(99)00052-0
(18)Ryu,J.;Choi,W.Environmental Science&Technology 2004, 38,2928.doi:10.1021/es034725p
(19)Devi,G.S.;Manorama,S.;Rao,V.Journal of the Electrochemical Society 1998,145,1039.doi:10.1149/ 1.1838385
(20)Udod,L.;Aplesnin,S.;Sitnikov,M.;Molokeev,M.Physics of the Solid State 2014,56,1315.doi:10.1134/ S1063783414070336
(21)Andrews,P.C.;Junk,P.C.;Nuzhnaya,I.;Thielemann,D.T. Inorganic Chemistry 2012,51,751.doi:10.1021/ic202707p
(22)Du,S.Q.;Yuan,Y.F.;Tu,W.X.Acta Phys.-Chim.Sin.2013, 29(9),2062.[杜书青,袁宇峰,涂伟霞.物理化学学报,2013, 29(9),2062.]doi:10.3866/PKU.WHXB201306213
(23)Tian,Q.;Zhuang,J.;Wang,J.;Liu,P.Applied Catalysis A: General 2012,425,74.
(24)Nesbitt,H.;Canning,G.;Bancroft,G.Geochimica et Cosmochimica Acta 1998,62,2097.doi:10.1016/S0016-7037 (98)00146-X
(25)Liu,G.;Zhao,J.;Hidaka,H.Journal of Photochemistry and Photobiology A:Chemistry 2000,133,83.doi:10.1016/S1010-6030(00)00227-6
Bi2Sn2O7Visible-Light Photocatalysts:Different Hydrothermal Preparation Methods and Their Photocatalytic Performance for As(III)Removal
ZHUANG Jian-Dong1,*TIAN Qin-Fen1LIU Ping2
(1College of Materials Engineering,Fujian Agriculture and Forestry University,Fuzhou 350002,P.R.China;2State Key Laboratory of Photocatalysis on Energy and Environment,College of Chemistry,Fuzhou University,Fuzhou 350002,P.R.China)
Bi2Sn2O7,synthesized through different hydrothermal routes(the microwave hydrothermal method (MH-BSO)and the traditional hydrothermal method(TH-BSO)),was used for photocatalytic removal of arsenic from aqueous solution.The as-synthesized Bi2Sn2O7products were characterized by X-ray diffraction(XRD), N2sorption-desorption,UV-Vis diffuse reflectance spectroscopy(UV-Vis DRS),transmission electron microscopy (TEM),electron spin resonance(ESR),X-ray photoelectron spectra(XPS),and electrochemistry technology. Under visible light irradiation,the MH-BSO sample exhibited a higher photocatalytic activity(up to 98.7%)than that of the TH-BSO sample during the oxidization of arsenite(AsO3)3-.The active species,O-2•and hVB+,were identified as the primary active species responsible for As(III)oxidation.In addition,a possible mechanism for the photo-oxidation ofAs(III)over Bi2Sn2O7is proposed.
Bi2Sn2O7;Microwave hydrothermal method;Traditional hydrothermal method;Visible-light photocatalysis;As(III)oxidation
October 6,2015;Revised:November 26,2015;Published on Web:November 30,2015.
O643
*Corresponding author.Email:jdzhuang113@163.com;Tel:+86-591-83715175.
The project was supported by the National Natural Science Foundation of China(21303244)and Outstanding Youth Fund of FujianAgriculture and Forestry University,China(XJQ201419).
国家自然科学基金(21303244)和福建农林大学杰出青年基金(XJQ201419)资助项目
©Editorial office ofActa Physico-Chimica Sinica
