玉米酒糟为主要氮源的Nisin生产菌株的诱变选育
2016-11-07张拴力扈士海崔云赵地顺
张拴力,扈士海,崔云,赵地顺
(1.石家庄新宇三阳实业有限公司 总工办,河北 石家庄 051430;2.石家庄新宇三阳实业有限公司 技术处,河北 石家庄 051430;3.河北科技大学 化学与制药工程学院,河北 石家庄 050000)
玉米酒糟为主要氮源的Nisin生产菌株的诱变选育
张拴力1,扈士海2,崔云3,赵地顺3
(1.石家庄新宇三阳实业有限公司 总工办,河北 石家庄051430;2.石家庄新宇三阳实业有限公司 技术处,河北 石家庄051430;3.河北科技大学 化学与制药工程学院,河北 石家庄050000)
为使乳酸乳球菌适应玉米酒糟作为发酵生产乳酸链球菌素(Nisin)的主要氮源,首先对培养基进行了初步优化,发现在酒糟清液中加入蔗糖、酵母膏和磷酸氢二钾明显促进了乳酸乳球菌的生长.在此基础上,使用等离子体对乳酸乳球菌进行诱变处理,利用24方孔深孔板技术可实现对高产Nisin突变菌株的选择性筛选.结果表明,诱变菌株在只有5.0%存活率时,得到的正突变菌株可达26.2%.借助摇瓶发酵实验对其生产Nisin的发酵水平进行研究,发现有1株诱变选育菌株发酵Nisin的活性高达6 520 U/mL,并且其发酵能力比诱变起始菌株能力更强.
乳酸链球菌素;乳酸乳球菌;常压室温等离子体诱变;玉米酒糟
乳酸链球菌素(Nisin)是从乳酸链球菌或乳酸乳球菌发酵产物中提制的一种多肽抗菌素类物质,由34个氨基酸组成,不仅可抑制大多数革兰氏阳性菌的生长和繁殖,且对革兰氏阴性菌同样也有较强的抑制作用[1-2].Nisin用作食品添加剂,可在一定程度上改善和提高食品的质量,延长了食品的保存期[3-4].此外,其为一种多肽物质,可被人体内的胰凝乳蛋白酶快速分解成氨基酸,不会产生任何毒副作用,因此,Nisin被认为是一种天然防腐剂,广泛应用于食品行业.
酵母发酵生产酒精时,会产生大量的废液酒糟,每生产1 t酒精就会排放8~15 t酒糟,酒糟中除含大量水外,还含有5%~8%的营养物质,但无重金属和有毒物质的残留[5-6].其BOD 值为25 000~35 000 mg/L,COD 值为35 000~50 000 mg/L[7].因此,如果将酒糟直接排放,不仅会浪费大量的有用资源,而且也会对生态环境造成严重污染.将酒糟作为培养基成分来处理,不仅能解决酒糟污染的问题,还可以生产出有价值的产品,一举多得.
目前,在Nisin的研究上存在的主要技术瓶颈是如何降低成本,提高Nisin产量[8-9].本研究探索将酒糟清液作为培养基的主要氮源,添加其他营养物质后,发酵生产Nisin,降低Nisin的生产成本.首先对培养基进行优化,然后利用清华大学研发的常压室温等离子体诱变乳酸乳球菌株,采用24方孔深孔板筛选技术进行选择性的高效筛选正突变菌株,并借助摇瓶发酵实验深入探究所获得的正突变菌株的生长特性和Nisin发酵水平.
1 实验部分
1.1实验用品
乳酸乳球菌(Nisin产生菌,由本实验室诱变筛选并保藏);藤黄微球菌(效价检测菌);Nisin标准品;牛肉膏、葡萄糖、蛋白胨、酵母膏、NaCl、K2HPO4、MgSO4·7H2O、Tween 20和NaH2PO4(上海生工生物工程技术服务有限公司);玉米酒糟(本公司酒精生产车间).
1.2培养基的制备
菌种活化、种子培养基:蔗糖2%(质量分数,下同),酵母膏1%,蛋白胨1%,K2HPO41%,NaCl 0.2%,MgSO4·7H2O 0.02%,配制固体培养基时加入2%琼脂.培养基使用前均需在121 ℃灭菌锅中灭菌20 min.
Nisin发酵培养基:蔗糖 2%,酵母膏 0.4%,K2HPO41%,NaCl 0.2%,酒糟清液体积分数50%,121 ℃灭菌锅中灭菌20 min.
筛选培养基:蔗糖2%,K2HPO41%,NaCl 0.2%,琼脂2.0%,Nisin 6 000 U/mL,酒糟清液体积分数50%,121 ℃灭菌锅中灭菌20 min.
效价测定培养基:牛肉膏0.3%,蛋白胨0.5%,NaCl 0.5%,葡萄糖0.3%,K2HPO40.1%,Tween 20 0.05%,MgSO4·7H2O 0.02%.
1.3乳酸乳球菌菌种的活化
将保藏的乳酸乳球菌菌种接种至用于菌种活化的固体平板上,37 ℃培养24 h后,挑取生长旺盛的单菌落接种到装有菌种活化液体培养基的试管中,37 ℃活化12 h,再以体积比5%的接种量接入100 mL体积分数为50%的酒糟清液的发酵培养基中,37 ℃,125 r/min 恒温摇床培养,测定不同时间的OD600.
1.4培养基配方优化
在含酒糟清液体积分数为50%的基础上,选取蔗糖、酵母膏和磷酸氢二钾作为实验因素,按L9(33)正交表设计实验,接种量为体积比4.0%,36 ℃,120 r/min摇床培养9 h,取菌液测定其在600 nm处的吸光度值,以吸光度值结果优化培养基配方.
1.5菌种发酵
用无菌接种环挑取平板上的目标单菌落,接种到液体种子培养基中,在温度36 ℃,转速150 r/min的摇床中培养至OD600值约为1时结束(用时大约4 h),再以体积比4.0%的接种量将初步筛选好的菌种接种到100 mL发酵培养基中,置于36 ℃,150 r/min的摇床中,发酵培养.期间每隔1 h取样一次,实时监测发酵液的OD600及Nisin活性.
1.6等离子体诱变育种
采用涂布法把乳酸乳球菌菌液均匀涂抹于无菌金属平板上,用常压室温等离子体诱变育种机(ARTP)进行诱变处理15~150 s后涂布于固体平板上,置于37 ℃无菌培养箱,静置培养48 h后数取菌落,计算致死率,计算公式如下:
致死率=(Y-X)/Y×100%,
式中:Y——不经过诱变处理的总菌落数;X——经过诱变处理后的总菌落数.
1.7Nisin高产菌株的筛选
在无菌条件下,将诱变后的单菌落接种到盛有3 mL发酵培养液的24方孔深孔板中,37 ℃、150 r/min摇床培养 10~12 h,4 000 r/min离心10 min,测定菌株的Nisin活性.
1.8Nisin活性的测定
将藤黄微球菌接种到液体培养基中,摇床培养约3 h测定OD600,OD600约为0.5时为宜(32 ℃、150 r/min).取500 μL该菌液接种到固体培养基中,倒板,固化后打孔,分别将10、40、70、100、200、400 U/mL的Nisin标准品溶液和发酵清液(稀释20倍)加入孔中.30 ℃静置培养24 h,通过测定抑菌圈直径与Nisin浓度的对数关系来求得其Nisin活性.
2 结果与讨论
2.1培养基优化对乳酸乳球菌生长繁殖的影响
在酒糟清液中,直接接种乳酸乳球菌,菌体生长缓慢,9 h后,OD600仅有0.7左右(图1).这是由于酒糟清液中营养成分单一,缺乏直接碳源和必要的生长因子及磷源.乳酸乳球菌在优化后的培养基中的摇瓶生长曲线如图1所示,与只用酒糟清液作为培养液相比,乳酸乳球菌的生长速度明显加快,开始进入的是生长缓慢的延迟期,1 h后进入迅速增长的对数期,大约6 h,菌体生长进入对数生长后期,7 h后进入稳定期,9 h后,OD600达到2.03,菌体浓度达到最大值,比只用酒糟清液提高了2.9倍.
2.2正交设计优化培养基实验结果
选择蔗糖作为直接碳源,酵母膏补充生长因子,K2HPO4作为磷源,使用正交设计研究这些营养因子对乳酸乳球菌生长繁殖的影响.正交实验设计见表1,正交实验结果如表2所示,影响乳酸乳球菌生长的主次顺序为C>A>B,即酵母膏的添加量对乳酸乳球菌的生长影响最为显著,然后为蔗糖的添加量,K2HPO4影响较小.培养基的最佳组合为A2B2C2,即质量分数分别为蔗糖2.0%、K2HPO40.4%、酵母膏0.4%.

图1 培养基优化前后乳酸乳球菌的摇瓶生长曲线对比Fig.1 Growth curve comparis of Lactococcus lactis on medium before and after optimization in shake flask
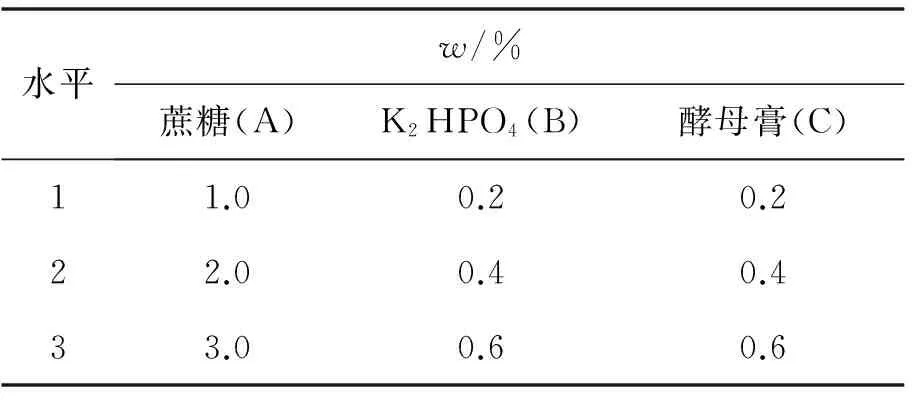
水平w/%蔗糖(A)K2HPO4(B)酵母膏(C)11.00.20.222.00.40.433.00.60.6

表2 培养基优化正交实验结果Tab.2 Results of orthogonal test on culture medium optimization
2.3诱变前后乳酸乳球菌的Nisin发酵过程曲线
图2是诱变前后的乳酸乳球菌的摇瓶发酵生产Nisin曲线,起始菌株发酵10 h 后达到最高效价3 650 U/mL,两诱变菌株发酵最高效价达到6 000 U/mL以上.已有研究报道,表明Nisin属于初级代谢产物,其产量与菌体浓度成正比例增长关系的说法是一致的[10-11],图1与图2的对比很好地说明该关系,当菌体生长到达稳定期后,菌体浓度达到最大值后Nisin效价很快也达到最大.随后,虽然菌体浓度基本不变, Nisin效价不再增加甚至会呈现下降趋势,这可能与蛋白酶降解了部分代谢产物Nisin[12]有关.
2.4等离子体诱变致死率曲线的测定
为提高Nisin产量,进一步采用等离子体诱变技术和24方孔深孔板来实现对Nisin高产菌株的高效筛选.为保证筛选的成功率,所选菌体大小、生理状态要基本保持一致,还要保证具有一定的细胞浓度,故选择对数生长中后期的细胞作为研究对象.依据研究经验,选择诱变对象为培养6.0 h后的乳酸乳球菌.
微生物经过ARTP处理后,能自己修复损害的DNA,产生基因突变而进化存活下来的即为优选菌种.因此,该诱变方法现已成为一种高效的微生物诱变育种技术[13-14].
由图3可以看出,ARTP对乳酸乳球菌的杀伤力极强,处理60 s就可使87%的菌株死亡;处理90 s后菌株致死率达95.2%.由于细胞存活率在 1%~10%时,细胞的诱变效应较强[15-17].因此,本实验选择对细胞进行等离子体处理时间为90 s.
2.5诱变菌株的快速筛选
在无菌操作下,将等离子体处理后的乳酸乳球菌均匀涂布在筛选培养基上,筛选培养基中仅以酒糟清液作为氮源,使得筛选得到的菌种更能适应酒糟清液,并且高产Nisin的菌株还要能够耐受高浓度的Nisin,本实验选择碳源为蔗糖,通过ARTP处理高浓度Nisin培养基,培育高效价的抗Nisin乳酸乳球菌[8,18].

图2 菌株诱变前后乳酸乳球菌摇瓶发酵曲线Fig.2 Nisin curve of strains Lactococcus lactis and mutant strains in shake flask

图3 乳酸乳球菌的致死率与ARTP处理时间的关系Fig.3 Curve of the fatality rate of Lactococcus lactis with the ARTP processing time
在平板上接种适当稀释诱变后的菌液,当菌落数为10~50个时,接种至24方孔深孔板中,从而实现对突变菌株的快速筛选.深孔板中的培养基也是以酒糟清液为基础的优化培养基.由图4 可以看出,在培养9 h后的42株诱变菌株中,有11株发生了正突变,即Nisin相对活性在1.2以上,正突变率为26.2%.其中6株(A2,B2,B6,D2,E3 和G1)的Nisin相对活性超过了1.5,作为后续实验研究对象.
2.6高产Nisin乳酸乳球菌诱变菌株的摇瓶复筛
为了找到能够稳定遗传的高产Nisin乳酸乳球菌诱变株,将起始菌株和筛选出的6株高产Nisin的正突变菌株进行摇瓶发酵重复筛选[17].当菌株摇瓶培养9 h后,测定其Nisin活性.由图5可知,B2和E3正突变菌株的Nisin活性超过6 000 U/mL,为高产Nisin的乳酸乳球菌诱变株.

图4 培养9 h后菌株的Nisin相对活性Fig.4 Lactococcus lactis’s Nisin relative activity after 9 hours

图5 发酵后菌株的Nisin活性Fig.5 Lactococcus lactis’ Nisin activity after fermentation
2.7高产Nisin菌株发酵特性
为了考察高产Nisin诱变菌株的发酵特性,将起始菌株和B2、E3诱变菌株进行发酵培养,检测其细胞和Nisin效价.
由图6可以看出,B2和E3诱变菌株的增值速度比起始菌株的增殖速度快很多,说明经过等离子诱变处理后,B2和E3诱变菌株更能适应酒糟清液为主要氮源的培养基.
由图2可知,诱变菌株的Nisin效价增长速度明显快于起始菌株,在10 h后,优化培养基后的菌株Nisin效价达到最高值.由图5可知,B2和E3诱变菌株摇瓶发酵后的Nisin活性均超过6 000 U/mL,其中B2诱变菌株发酵的Nisin活性最高,达6 520 U/mL,且比起始菌株增加了1.51倍.
由图7可以看出,在发酵过程中,随着发酵的进行,发酵液的pH不断下降,发酵10 h后,pH降到4.89 (图7).

图6 不同菌株的摇瓶生长曲线Fig.6 Growth curve of different strains in shake flask

图7 乳酸乳球菌诱变菌株E3摇瓶发酵pH变化曲线Fig.7 pH curve of E3 Lactococcus lactis mutant strains in shake flask fermentation
3 结论
乳酸乳球菌发酵生产Nisin过程中,以玉米酒糟上清液为主要氮源,对培养基进行优化,等离子体诱变乳酸乳球菌后,获得了B2和E3 2株发酵Nisin活性超过6 000 U/mL的乳酸乳球菌诱变菌株,并且其在玉米酒糟上清液中的发酵能力比起始菌株更强.
[1]BREUKINK E,de KRUIJFF B. The lantibiotic Nisin,a special case or not[J].Biochimica et Biophysica Acta, 1999,1462:223-234.DOI:10.1016/S0005-2736(99)00208-4.
[2]GIFFARD C J,LADHA S,MACKIE A R,et al.Interaction of nisin with planar lipid bilayers monitored by fluorescence recovery after photobleaching[J].Membr Biol,1996,151:293-300.DOI:10.1007/s002329900079.
[3]PEREZ R H,ZENDO T,SONOMOTO K.Novel bacteriocins from lactic acid bacteria (LAB):various structures and applications[J].Microb Cell Fact,2014,13(Suppl 1):S3.DOI:10.1186/1475-2859-13-S1-S3.
[4]ISLAM M R,NAGAO J,ZENDO T,et al.Antimicrobial mechanism of lantibiotics[J].Biochem Soc Trans,2012,40(6):1528-1533.DOI:10.1042/BST20120190.
[5]闫国栋,姜丽艳,王秀丽,等.利用浓醪酒糟生产乳链菌肽的发酵培养基优化[J].酿酒科技,2009,3:33-36.
YAN G D,JIANG L Y,WANG X L,et al.Optimization of fermentation medium for Nisin production by thick mash[J].Liquor-making Science & Technology,2009,3:33-36.
[6]王玉红,丁重阳,章克昌,等.以浓醪酒糟为基质的发酵生产单细胞蛋白的工艺条件的优化[J].酿酒,2002,29(5):44- 46.
WANG Y H,DING C Y,ZHANG K C,et al.Study on the fermentation of SCP on the base of the distillerss grain[J].Liquor-making,2002,29(5):44-46.
[7]IBRAHIM RAJOKA M,TARIQ KIANI M A,SOHAIL KHAN,et al.Production of single cell protein from rice polishings usingCandidautilis[J].World Journal of Microbiology & Biotechnology,2004,20:297- 301.DOI:10.1023/B:WIBI.0000023845.96123.dd.
[8]ZHANG Y F,LIU S Y,DU Y H,et al.Genome shuffling ofLactococcuslactissubspecies lactis YF11 for improving Nisin Z production and comparative analysis[J].Dairy Sci,2014,97(5):2528-2541.DOI:10.3168/jds.2013-7238.
[9]CHEIGH C I1,PARK H,CHOI H J,et al.Enhanced nisin production by increasing genes involved in Nisin Z biosynthesis inLactococcuslactisssp.lactis A164[J].Biotechnol Lett,2005,27:155-160.DOI:10.1007/s10529-004-7661-3.
[10]TODOROV S D,DICKS L M.Influence of growth conditions on the production of a bacteriocin byLactococcuslactissubsp.lactis ST34BR,a strain isolated from barley beer[J].Basic Microbiol,2004,44(4):305-316.DOI:10.1002/jobm.200410413.
[11]TODOROV S D,VAN REENEN C A,DICKS L M.Optimization of bacteriocin production byLactobacillusplantarumST13BR,a strain isolated from barley beer[J].Gen Appl Microbiol,2004,50(3):149-157.
[12]CHEIGH C I,CHOI H J,PARK H,et al.Influence of growth conditions on the production of a nisin-like bacteriocin byLactococcuslactissubsp.Lactis A164 isolated from Kimchi[J].Biotechnol,2002,95(3):225-235.DOI:10.1016/S0168-1656(02)00010-X.
[13]WANG L Y,HUANG Z L,LI G,et al.Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma[J].Appl Microbiol,2010,108(3):851-858.DOI:10.1111/j.1365-2672.2009.04483.x.
[14]ZHANG X,ZHANG X F,LI H P,et al.Atmospheric and room temperature plasma (ARTP)as a new powerful mutagenesis tool[J].Appl Microbiol Biotechnol,2014,98(12):5387-5396.DOI:10.1007/s00253-014-5755-y.
[15]LAROUSSI M.Low temperature plasma-based sterilization:overview and state-of-the-art[J].Plasma Proc Polym,2005,2:391-400.DOI:10.1002/ppap.200400078.
[16]万青,曹伟佳,张常青,等.常压室温等离子体诱变高效利用木糖产丁二酸菌株[J].生物工程学报,2013,29(11):1692-1695.DOI:10.13345/j.cjb.2013.11.017.
WAN Q,CAO W J,ZHANG C Q,et al.MutatingEscherichiacoliby atmospheric and room temperature plasmas for succinic acid production from xylose[J].Chinese Journal of Biotechnology,2013,29(11):1692-1695.DOI:10.13345/j.cjb.2013.11.017.
[17]董晓宇,滕虎,修志龙.高产1,3-丙二醇的等离子体诱变菌株选育及发酵动力学分析[J].过程工程学报,2011,11(2):304-311.
DONG X Y,TENG H,XIU Z L .Selection of strain exposed under plasma discharge with enhanced 1,3-propanediol production and kinetic analysis of batch fermentation[J].The Chinese Journal of Process Engineering,2011,11(2):304-311.
[18]QIAO M,OMAETXEBARRIA M J,Ra R, et al.Isolation of aLactococcuslactisstrain with high resistance to nisin and increased nisin production[J].Biotechnol Lett,1997,19(2):199-202.DOI:10.1023/A:1018384919362.
(责任编辑:赵藏赏)
Mutating Lactococcus lactis for high-yield strain of Nisin using corn thick mash as main nitrogen source
ZHANG Shuanli1,HU Shihai2,CUI Yun3,ZHAO Dishun3
(1.General Labor Office,Shijiazhuang Xinyu Sanyang Industrial Co.,Ltd,Shijiazhuang 051430,China; 2.Research and Development Office,Shijiazhuang Xinyu Sanyang Industrial Co.,Ltd, Shijiazhuang 051430,China;3.College of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology,Shijiazhuang 050000,China)
Corn thick mash was used as main nitrogen source to produce Nisin.Firsty,the fermentation media were optimized by single factor experiment.The results indicated that the growth ofLactococcuslactiswas obviously enhanced by adding sucrose,yeast extract and K2HPO4to thick mash.As the starting strain,the strain was further treated by atmospheric and room temperature plasmas and quickly selected using 24 well culture plate.At a survival rate of 5%,the positive mutation rate of theLactococcuslactiswas found to be 26.2% evaluated by the comparison with the starting strain.The results from shake flask culture further confirmed that a positive mutant strains could produce 6 520 IU/mL Nisin.
Nisin;Lactococcuslactis;atmospheric and room temperature plasma (ARTP)mutation;corn thick mash
10.3969/j.issn.1000-1565.2016.04.014
2015-10-15
河北省科技计划项目(13272802D)
张拴力(1968—),男,河北栾城人,石家庄新宇三阳实业有限公司高级工程师,主要从事生物化工研究.
E-mail :zslyx96@126.com
Q815
A
1000-1565(2016)04-0417-07
