维A酸衍生物ECPIRM对维A酸核受体的影响及小鼠皮肤刺激反应
2016-11-06张孟丽魏峻马鹏程李玲珺钱坤陶蕾
张孟丽 魏峻 马鹏程 李玲珺 钱坤 陶蕾
210042南京,中国医学科学院 北京协和医学院 皮肤病医院激光科(张孟丽),药物研究室(魏峻、马鹏程、李玲珺、钱坤、陶蕾)
·论著·
维A酸衍生物ECPIRM对维A酸核受体的影响及小鼠皮肤刺激反应
张孟丽 魏峻 马鹏程 李玲珺 钱坤 陶蕾
210042南京,中国医学科学院 北京协和医学院 皮肤病医院激光科(张孟丽),药物研究室(魏峻、马鹏程、李玲珺、钱坤、陶蕾)
目的 探讨维A酸衍生物ECPIRM对维A酸核受体的影响,评估ECPIRM对小鼠皮肤的红斑、脱屑等刺激反应。方法 10 μmol/L ECPIRM和全反式维A酸(ATRA)作用于SCL-1细胞24 h,用蛋白免疫印迹法和实时荧光定量PCR法分别检测维A酸受体(RARα、RARβ、RARγ和RXRα)的蛋白和mRNA表达变化。用实时荧光定量PCR检测维A酸受体RAR激活通路的靶基因细胞色素P450家族成员26A1和他扎罗汀诱导基因1(TIG1)的mRNA表达变化。BALB/c小鼠剃毛后外涂ECPIRM凝胶,以等摩尔浓度的全反式维A酸乳膏为对照,观察小鼠皮肤刺激反应。结果 ATRA作用后,RARα、RARβ、RARγ的蛋白和mRNA表达明显增高,与对照组比较差异有统计学意义(P<0.05)。CYP26A1和TIG1的mRNA表达分别增加到25.49倍和3.88倍,差异有统计学意义(P<0.01)。但ECPIRM作用后并不增加核受体RARα、RARβ、RARγ及RXRα的蛋白表达;RARα、RARβ、RARγ的mRNA表达变化差异无统计学意义(P>0.05);RAR靶基因CYP26A1和TIG1的mRNA表达变化差异无统计学意义(P>0.05)。BALB/c小鼠外用全反式维A酸乳膏后2 d出现明显的红斑、脱屑反应,用药5 d达高峰。而连续外用0.075%ECPIRM凝胶21d,小鼠一直未出现红斑、脱屑反应。结论 ECPIRM不激活经典的维A酸受体通路,未出现ATRA样皮肤刺激反应。
维甲酸;皮肤刺激试验;小鼠;ECPIRM;维A酸核受体
维A酸化合物因其复杂的药理作用,用于治疗痤疮、光老化及多种角化性皮肤病等。研究表明,许多维A酸化合物发挥生物学效应都与维A酸受体的表达与激活密切相关,但同时会产生明显与维A酸核受体激活相关的不良反应,其中在皮肤上表现为红斑、脱屑等刺激反应,限制了药物的使用[1-2]。本实验室合成出一种维A酸衍生物ECPIRM[N-(4-ethoxycarbonylphenyl)isoretinamide],发现该化合物具有较强的抗肿瘤增生及抗炎作用[3-4]。本文探讨其对维A酸核受体的作用,并观察该衍生物对小鼠皮肤的刺激反应,以初步评估ECPIRM的安全性。
材料与方法
一、材料
ECPIRM 由本实验室合成(纯度 > 98%)[3]。全反式维A酸(ATRA)购自美国Sigma公司(纯度>98%)。0.05%的ATRA乳膏由重庆华邦制药股份有限公司馈赠,0.075%的ECPIRM凝胶由本课题组制备。DMEM培养基,胰酶,胎牛血清,TRIzol购自美国Invitrogen公司。DMSO购自美国Sigma公司。Reverse Transcription system和GoTaqqPCR Master Mix购自美国 Promega公司。RARα、RARβ、RARγ及 RXRα 的 一 抗 购 自 美 国 Cell Signaling Technology。人皮肤鳞癌细胞株SCL-1源于德国癌症研究中心,由中国医科大学何春涤教授馈赠。BALB/c小鼠(合格证号0248335)购自上海西普尔必凯实验动物有限公司。
二、方法
1.细胞培养与药物处理:SCL-1细胞生长于含10%FBS、100 U/ml青霉素及 0.1 mg/ml链霉素的DMEM培养基中,置于5%CO2,37℃孵育培养,2~3 d换液1次,取对数生长期的细胞用于实验。ECPIRM及ATRA用DMSO溶解,配制成0.1 mol/L的母液保存于-80℃冰箱中,加药前用含有10%胎牛血清的DMEM培养基稀释成终浓度10 μmol/L。药物配制均在避光环境中进行。
2.蛋白免疫印迹法测定维A酸核受体的蛋白含量:SCL-1细胞以2×105个/皿的密度接种于10 cm的平皿中,观察细胞生长约80%时,弃上清,分别加入含10 μmol/L的ECPIRM和ATRA的培养基8 ml(以不含药物的培养基为阴性对照),作用24 h后,PBS洗2次,利用蛋白提取试剂盒提出相同质量的蛋白,进行凝胶电泳后将蛋白电转印到硝酸纤维膜上,以含5%的脱脂奶粉的TBST缓冲液室温封闭1 h,一抗4℃孵育过夜,其中抗体稀释度为:其中抗体稀释度为:RARα(1 ∶200)、RARβ(1 ∶400)、RARγ(1∶400)、RXRα(1∶400),β 肌动蛋白(1∶400)。继以二抗室温孵育l h,化学发光法检测反应条带。应用图像分析软件对图像进行分析,以β肌动蛋白为内参照,计算RARα、RARβ、RARγ 和RXRα 的相对量。蛋白相对表达量=目的蛋白条带灰度值/内参照蛋白条带灰度值。
3.实时荧光定量PCR测定维A酸核受体和受体通路靶基因的mRNA表达:SCL-1细胞以5×104个/皿的密度接种于60 mm培养皿中,观察细胞生长约80%时,弃上清,分别加入10 μmol/L的ECPIRM和ATRA的培养基2 ml(以不含药物的培养基为阴性对照),作用24 h后,PBS洗2次,根据TRIzol试剂说明书提取总的RNA并检测其纯度和浓度。按照反转录系统合成cDNA。待测的mRNA为核受体RARα、RARβ、RARγ、RXRα 和 受 体 通 路 靶 基 因TIG1和CYP26A1,其相关引物为:RARα引物,上游:5′-CTGCCAGTACTGCCGACTGC-3′,下游 5′-ACGTTGTTCTGAGCTGTTGTTCGTA-3′,235bp;RARβ 引物,上游:5′-CTGGGAGGAATTGTTTGCA T-3′,下游:5′-GTTCTCAACCAGCTCAGACTCA-3′,145 bp;RARγ 引物,上游:5′-CTGCCAGTACTGCCG GCTAC-3′,下游:5′-TCTGCACTGGAGTTCGTGGTA TACT-3′,228 bp,RXRα 引物,上游:5′-CGACCCTG TCACCAACATTTGC-3′,下游:5′-GAGCAGCTCATT CCAGCCTGCC-3′,142 bp;TIG1 引物,上游:5′-TGA GGCAGTGGAAAACTAATGA-3′,下游:5′-AAGTGA ATGCGACAGGGAAT-3′,100 bp;CYP26A1 引物,上游:5′-AGGTTCAGCTTCATTCCATTTG-3′,下游:5′-GGTTTTCATTGTAGGAGGTCCAT-3′,144 bp;GAPDH 引物,上游:5′-TGGGTGTGAACCATGAGAA GT-3′,下游:5′-TGAGTCCTTCCACGATACCAA-3′,126 bp。合成的cDNA根据GoTaqqPCR Master Mix说明书配置反应体系。扩增结束后,分析得到mRNA的相对表达含量。
4.皮肤刺激试验:BALB/c小鼠分成ECPIRM组、ATRA组,每组4只,雌雄各半,分笼饲养。试验前一天用皮肤标记笔在每只小鼠背部近头部和近尾部各标记一块1.5 cm×1 cm大小区域,两区域间隔约1.5 cm,剃毛。分别称取约0.030 g的0.075%的ECPIRM凝胶和0.05%的ATRA乳膏(两种制剂所含药物的摩尔浓度相同),涂于近头部标记区。所有动物近尾部区域涂基质。每天用药1次,连续用药21 d。观察小鼠皮肤变化并记录局部皮肤反应。皮肤反应评分等级:0分为用药局部无可见反应;0.5分为隐约可见红斑、脱屑;1分为轻度红斑、脱屑;2分为中度红斑、脱屑;3分为重度红斑、脱屑。局部皮肤不同用药时间平均刺激分值=每组所有观察动物当天的局部刺激分值之和/观察动物数。
5.统计分析:采用SPSS 17.0软件进行分析计算,计量资料采用单因素方差分析,组间比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
一、ECPIRM 对维 A 酸核受体 RARα、RARβ、RARγ、RXRα的蛋白表达影响
RARα、RARβ、RARγ 和 RXRα 反应条带见图1。各组的蛋白相对表达量如下,对照组:RARα 0.43 ± 0.11,RARβ 0.27 ± 0.08,RARγ 0.45 ± 0.10,RXRα 0.51±0.23,ECPIRM 组 RARα 0.42± 0.06,RARβ 0.28 ± 0.10,RARγ 0.45 ± 0.15,RXRα 0.50 ±0.21,ATRA 组 RARα 0.83 ± 0.15,RARβ 0.62 ±0.05,RARγ 0.96±0.33,RXRα 0.48±0.19。与对照组相比,ATRA能诱导RARα、RARβ和RARγ高表达,RARα和RARβ变化有统计学意义(P<0.01),RARγ变化有统计学意义(P<0.05)。而ECPIRM对RARα、RARβ、RARγ、RXRα 的蛋白表达影响不明显(P>0.05)。
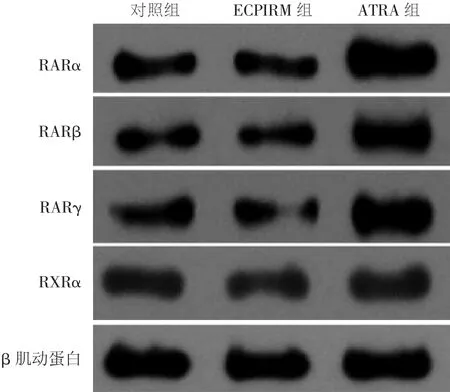
图1 10 μmol/L的ECPIRM和全反式维A酸(ATRA)作用24 h对 SCL-1细胞中维 A 酸核受体(RARα、RARβ、RARγ、RXRα)的蛋白印迹
表1 ECPIRM和全反式维A酸(ATRA)对SCL-1细胞维A酸核受体mRNA表达的影响(±s)

表1 ECPIRM和全反式维A酸(ATRA)对SCL-1细胞维A酸核受体mRNA表达的影响(±s)
注:n=3。a:与对照组比较,P<0.01
组别 RARα RARβ RARγ RXRα对照组 1.00±0.06 1.00±0.23 1.00±0.13 1.00±0.03 ECPIRM组 0.90±0.09 0.63±0.29 0.79±0.11 0.70±0.03a ATRA组 1.78±0.22a 2.40±0.21a 1.36±0.18a1.05±0.04
二、ECPIRM 对 RARα、RARβ、RARγ、RXRα 的mRNA表达影响
由表1可知,与对照组比较,ATRA可诱导RARα、RARβ、RARγ 的高表达,差异有统计学意义(均P<0.01),RXRα则无明显变化。而ECPIRM组的RARα、RARβ、RARγ的mRNA表达量均出现与阴性对照组无统计学意义的降低,RXRα的mRNA表达量则有降低,差异有统计学意义(P<0.01)。
三、ECPIRM对RAR通路靶基因mRNA表达影响
CYP26A1和TIG1等均是经典维A酸受体通路(RARE)激活的靶基因,各组TIG1和CYP26A1的mRNA表达量变化见表2。与对照组比较,ATRA处理细胞24 h后,TIG1和CYP26A1的mRNA表达量增加到3.88倍和25倍,与对照组比较,差异有统计学意义(P<0.01)。但是,ECPIRM作用后SCL-1细胞中的TIG1和CYP26A1的mRNA表达量降低,变化无统计学意义(P>0.05)。
四、小鼠皮肤刺激反应
表2 ECPIRM和全反式维A酸(ATRA)对SCL-1细胞中TIG1和CYP26A1的mRNA表达量的影响(±s)

表2 ECPIRM和全反式维A酸(ATRA)对SCL-1细胞中TIG1和CYP26A1的mRNA表达量的影响(±s)
注:n=3。a:与对照组比较,P<0.01
组别 TIG1 CYP26A1对照组 1.00±0.43 1.00±0.35 ECPIRM组 0.58±0.22 0.49±0.05 ATRA组 3.88±0.11a 25.49±1.37a
为了进一步了解药物可能的临床副作用,我们以0.05%全反式维A酸乳膏为对照,检测了0.075%ECPIRM凝胶对BALB/c小鼠的局部皮肤刺激反应(两种药物含相同的摩尔浓度)。结果见图2,外用0.05%全反式维A酸乳膏,用药2 d出现红斑、脱屑反应,用药5 d达高峰,持续1~2 d后,反应逐渐减轻,用药17 d消失,这种“出现一高峰一消退”的一过性规律,与既往研究结果一致[6];而连续外用0.075%ECPIRM凝胶21 d,一直未出现红斑、脱屑反应,与用药前相比无明显变化。所有外用基质部位与用药前相比无明显变化。根据两组不同用药时间平均刺激分值结果,ECPIRM的安全性远大于等摩尔浓度的全反式维A酸。图3显示ECPIRM凝胶组小鼠和全反式维A酸组小鼠第0天和第5天的皮肤反应。
讨 论
维A酸化合物的作用机制较复杂,通常认为与维A酸核受体密切相关。维A酸核受体分为两大类,即维A酸受体(RAR)和维A酸X受体(RXR)。RAR同RXR形成异二聚体并且连接维A酸反应元件(retinoic acid responsive element,RARE)进而调控CYP26A1和TIG1等维A酸受体靶基因的表达,影响细胞增殖及分化[2-3]。也有研究表明,合成的维A酸化合物芬维A胺主要以非受体依赖方式介导皮肤癌[5]、畸胎瘤[6]等多种肿瘤的凋亡。先前的研究表明,ECPIRM能明显抑制皮肤鳞癌细胞系的增殖,诱导细胞凋亡,将细胞周期阻滞在G1期[3],调节细胞分化,并具有明确的抗炎活性[4]。本研究结果表明,ECPIRM 不能诱导核受体 RARα、RARβ、RARγ和RXRα蛋白及mRNA表达的增加,也不能增加RAR的激活通路靶基因CYP26A1和TIG1的表达,而ATRA则能明显上调维A酸受体及RAR通路靶基因CYP26A1和TIG1的表达。表明ECPIRM的增殖、诱导细胞凋亡及抗炎活性机制与经典的维A酸类药物不同,它不依赖于维A酸受体及其激活通路。

图2 小鼠背部外用维A酸乳膏不同时间的皮肤平均刺激分值
维A酸类药物的标志性不良反应为皮肤刺激反应,如红斑、脱屑、干燥、瘙痒、灼烧感、刺痛感等,这些皮肤刺激反应主要涉及 RARβ、RARγ[7]和RARα[8-10]的高表达及被激活。我们观察了外用ECPIRM对BALB/c小鼠皮肤的刺激反应,结果临床常用的0.05%全反式维A酸乳膏出现了与既往研究结果一致[11]的典型的一过性红斑、脱屑反应,而相同摩尔浓度的ECPIRM凝胶(0.075%)连续外用21 d均未出现皮肤刺激反应。通常认为维A酸类药物的疗效与皮肤刺激反应相关联[11],我们的研究结果表明,不经过维A酸受体激活途径而发挥作用的维A酸类药物的疗效与皮肤刺激反应不一定关联。多年来,研发受体选择性维A酸药物曾是热点,我们的研究结果提示,对于维A酸研究领域而言,研发低毒高效的维A酸类药物将成为一种新途径。

图3 两种制剂对小鼠皮肤的刺激反应 全反式维A酸组小鼠在用药后第5天出现明显的红斑、脱屑反应,ECPIRM组未出现红斑和脱屑反应
[1]Bunaciu RP,Yen A.Retinoid Chemoprevention:Who Can Benefit?[J].CurrPharmacol Rep,2015,1 (6):391-400.DOI:10.1007/s40495-015-0036-8.
[2]Altucci L,Leibowitz MD,Ogilvie KM,et al.RAR and RXR modulation in cancer and metabolic disease [J].Nat Rev Drug Discov,2007,6(10):793-810.DOI:10.1038/nrd2397.
[3]Zhang M,Tao Y,Ma P,et al.Synthesis and characterization of a new retinoic acid ECPIRM as potential chemotherapeutic agent for human cutaneous squamous carcinoma[J].Anticancer Agents Med Chem,2015,15(9):1204-1212.
[4]杨林芳,曹玉萍,张孟丽,等.新型维A酸ECPIRM及全反式维A酸对白细胞介素17刺激HaCaT细胞白细胞介素1β表达的影响 [J].中华皮肤科杂志,2015,48(11):797-800.DOI:10.3760/cma.j.issn.0412-4030.2015.11.011.Yang LF,CaoYP,Zhang ML,et al.Effects of a novel retinoic acid ECPIRM and all-trans-retinoic acid on interleukin-1β expression in interleukin-17-stimulated HaCaTcells [J].Chin J Dermatol,2015,48 (11): 797-800. DOI: 10.3760/cma.j.issn.0412-4030.2015.11.011.
[5]Xu H,Cheepala S,McCauley E,et al.Chemoprevention of skin carcinogenesis by phenylretinamides: retinoid receptorindependent tumor suppression [J].Clin Cancer Res,2006,12(3 Pt 1):969-979.DOI:10.1158/1078-0432.CCR-05-1648.
[6]Malone W,Perloff M,Crowell J,et al.Fenretinide:a prototype cancer prevention drug[J].Expert OpinInvestig Drugs,2003,12(11):1829-1842.DOI:10.1517/13543784.12.11.1829.
[7]Otley CC,Stasko T,Tope WD,et al.Chemoprevention of nonmelanoma skin cancer with systemic retinoids:practical dosing and management of adverse effects [J].DermatolSurg,2006,32(4):562-568.DOI:10.1111/j.1524-4725.2006.32115.x.
[8]吴秋菊,马鹏程,陈志强,等.外用维A酸引起小鼠皮肤反应的研究[J].中华皮肤科杂志,2005,38(6):380-382.DOI:10.3760/j.issn.0412-4030.2005.06.018.Wu QJ,Ma PC,Chen ZQ,et al.Skin reactions induced by topical retinoic acid in mice[J].Chin J Dermatol,2005,38(6):380-382.DOI:10.3760/j.issn.0412-4030.2005.06.018.
[9]吴秋菊,马鹏程,陈志强,等.外用维A酸后小鼠皮肤中维A酸受体的表达[J].中华皮肤科杂志,2005,38(7):449-450.DOI:10.3760/j.issn.0412-4030.2005.07.017.Wu QJ,Ma PC,Chen ZQ,et al.Expression of retinoicreceptor in mice skin tissues after topical treatment with retinoic [J].Chin J Dermatol,2005,38 (7):449-450.DOI:10.3760/j.issn.0412-4030.2005.07.017.
[10]后文俊,马鹏程.连续外用维A酸皮肤刺激反应中维A酸受体mRNA 的表达[J].中国热带医学,2009,9(5):827-828.Hou WJ,Ma PC.The expressions of retinoic acid receptors in the skin irritation induced by topical retinoic acid[J].China Tropical Medicine,2009,9(5):827-828.
[11]Chen S,Ostrowski J,Whiting G,et al.Retinoic acid receptor gamma mediates topical retinoid efficacy and irritation in animal models[J].J Invest Dermatol,1995,104(5):779-783.
Effect of a tretinoin derivative ECPIRM on retinoic acid receptors and skin irritation responses to it in mice
Zhang Mengli,Wei Jun,Ma Pengcheng,Li Lingjun,Qian Kun,Tao Lei
Department of Cosmetic Laser Surgery,Hospital of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China (Zhang ML);Department of Pharmacal Research,Hospital of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Wei J,Ma PC,Li LJ,Qian K,Tao L)
Objective To estimate the effect of a tretinoin derivative ECPIRM on retinoic acid receptors(RARs),and to observe skin irritation responses to it in mice.Methods Cultured SCL-1 cells were divided into 2 groups to be treated with culture medium containing 10 μmol/L ECPIRM (ECPIRM group)or 10 μmol/L all-trans retinoic acid(ATRA) (ATRA group)for 24 hours,and those treated with drug-free culture medium served as the control group.Western blot analysis and real-time fluorescence-based quantitative PCR were performed to quantify the protein and mRNA expressions of RARs (RARα,RARβ,RARγ and RXRα)respectively.In addition,real-time fluorescence-based quantitative PCR was conducted to measure the mRNA expressions of two target genes of the activated RAR signaling pathway,i.e.,cytochrome P450 26A1 (CYP26A1)and tazarotene-induced gene 1 (TIG1).Eight BALB/c mice were equally divided into 2 groups to be topically treated with 0.075%ECPIRM gel or 0.05%ATRA cream at equal molar concentrations on the shaved skin once daily for 21 successive days.Skin irritation reactions were assessed in these mice.Results Compared with the control group,the ATRA group showed significantly increased protein and mRNA expressions of RARα,RARβ and RARγ (allP<0.05).The mRNA expressions of CYP26A1 and TIG1 genes in the ATRA group were 25.49 and 3.88 times that in the control group respectively (bothP<0.01).However,there was no significant difference in the protein expressions of RARα,RARβ,RARγ and RXRα,or mRNA expressions of RARα,RARβ,RARγ,CYP26A1 and TIG1 between the ECPIRM group and control group (allP>0.05).Obvious Skin irritation reactions such as erythema and desquamation were observed in BALB/c mice after 2-day topical treatment with ATRA cream,and their degree peaked after 5-day treatment.However,neither erythema nor desquamation was observed in BALB/c mice during 21-day treatment with 0.075%ECPIRM gel.Conclusion Unlike ATRA,ECPIRM cannot activate the canonical RAR signaling pathway or cause skin irritation reactions.
Tretinoin;Skin irritancy tests;Mice;ECPIRM;Retinoic acid receptor
Ma Pengcheng,Email:mpc815@163.com
马鹏程,Email:mpc815@163.com
10.3760/cma.j.issn.0412-4030.2016.06.013
北京协和医学院协和青年基金(3332015115)
Fund program:PUMC Youth Fund(3332015115)
2016-01-05)
(本文编辑:吴晓初)
