Nicastrin基因突变的反常性痤疮患者皮损Notch-HES信号通路的表达
2016-11-06肖学敏李诚让何艳艳张晓峰徐浩翔王宝玺
肖学敏 李诚让 何艳艳 张晓峰 徐浩翔 王宝玺
350001福州,福建医科大学附属协和医院皮肤科(肖学敏);中国医学科学院 北京协和医学院皮肤病研究所 江苏省皮肤病与性病分子生物学重点实验室 皮肤科(李诚让、何艳艳、张晓峰、徐浩翔);中国医学科学院 北京协和医学院 整形外科医院皮肤科(王宝玺)
·论著·
Nicastrin基因突变的反常性痤疮患者皮损Notch-HES信号通路的表达
肖学敏 李诚让 何艳艳 张晓峰 徐浩翔 王宝玺
350001福州,福建医科大学附属协和医院皮肤科(肖学敏);中国医学科学院 北京协和医学院皮肤病研究所 江苏省皮肤病与性病分子生物学重点实验室 皮肤科(李诚让、何艳艳、张晓峰、徐浩翔);中国医学科学院 北京协和医学院 整形外科医院皮肤科(王宝玺)
目的 检测nicastrin基因突变的反常性痤疮患者皮损标本中,nicastrin及其下游Notch-HES信号通路蛋白的表达。方法 免疫组化法检测nicastrin及Notch-HES信号通路分子在4例nicastrin基因突变的患者皮损石蜡标本的表达,并用6例正常皮肤组织作对照,同时采用Spearman相关分析,分析nicastrin与Notch-HES信号通路分子表达的相关性。结果 Nicastrin蛋白广泛表达于表皮全层、皮肤附属器,如,毛囊皮脂腺单位、大汗腺及小汗腺。在携带nicastrin基因突变的患者皮损中,表皮及毛囊漏斗部nicastrin表达较正常对照明显减少;同时,Notch-HES信号通路分子表达亦较正常对照明显减少。Nicastrin蛋白与Notch1、Notch3以及HES-1的表达呈明显正相关(r分别为 0.831、0.748、0.807,P 值分别 <0.01,<0.05、<0.01),而与 Notch2、HES-5 的表达之间的相关性,差异无统计学意义(r分别为0.597和0.591,均P>0.05)。结论 Nicastrin基因突变患者的皮损中nicastrin低表达,且与多种Notch-HES信号通路分子表达呈正相关,提示nicastrin表达减少可能通过影响下游Notch-HES信号通路的表达参与反常性痤疮的发病。
基因;突变;信号传导;反常性痤疮;Nicastrin基因;Notch-HES信号通路
反常性痤疮(acne inversa,AI;OMIM 142690),又称化脓性汗腺炎、毛囊闭锁三联征,是一种慢性复发性炎症性疾病。2010 年,Wang等[1]发现,γ 分泌酶与部分家族性AI相关引起了学术界的极大兴趣。γ分泌酶是一种跨膜蛋白酶,包含4个必要组分,分别为:早老素、nicastrin(NCT)蛋白、前咽缺陷蛋白、早老素增强子。目前文献中共报道AI患者的γ分泌酶基因上发现27个不同的突变位点,其中出现在NCT基因上的突变有22个,均为功能缺失性突变[2-4]。NCT亚基属于Ⅰ型跨膜糖蛋白,参与γ分泌酶的组装、成熟及稳定。最近发现,NCT亚基还具有募集γ分泌酶底物的功能,其表达异常可导致γ分泌酶活性和功能受损[5]。然而,NCT基因突变的AI患者皮损NCT蛋白的表达情况与正常人是否存在差异,未见文献报道。同时,Notch蛋白作为γ分泌酶的重要底物在AI发病中的作用越来越受到重视[2]。在NCT基因突变的AI患者中,NCT基因的突变能否导致Notch信号通路表达异常亦未见文献报道。本研究在4例含有NCT基因突变的AI患者皮损中使用免疫组化法检测了NCT蛋白及其下游信号通路中的Notch、HES分子的表达,并探讨NCT基因突变导致AI的可能机制。
对象与方法
一、对象
AI患者组:4例患者均符合 AI的诊断标准[6],其中男3例,女1例,年龄24~29岁,平均27.3岁;病程3~10年,平均6.3年。发病部位:腋下3/4例、肛周及臀部4/4例、腹股沟3/4例、会阴3/4例、颈部4/4例。根据Hurley分级对患者皮损进行评估[7]:Ⅰ级是脓肿形成,不伴窦道及瘢痕,Ⅱ级是一处或多处孤立的脓肿,伴窦道及瘢痕,Ⅲ级是融合的脓肿及窦道形成。本组患者3例Hurley分级为Ⅲ级,1例为Ⅱ级;4例患者均已证实含有NCT基因突变,其中3例有家族史,1例为散发患者;3例男性患者均有长期吸烟史。AI患者2例皮损组织切片来自中国医学科学院皮肤病医院病理科存档的石蜡块,2例皮损组织切片来自手术室切除AI患者皮损制作石蜡块。取材部位为臀部2例、腋下1例、颈部1例。
正常对照组:2例皮肤组织切片来自江苏省人民医院整形外科腋臭切除术的患者正常皮肤制作石蜡块,4例皮肤组织切片来自本院行整形外科手术患者的正常皮肤制成的石蜡块(臀部及头皮各2例),其中男3例、女3例,年龄18~29岁,平均23.8岁。本研究经中国医学科学院皮肤病医院医学伦理委员会批准,入选患者及正常对照者均签署知情同意书。
二、主要试剂
兔抗人NCT多克隆抗体(工作浓度1∶1 600)、兔抗人Notch1单克隆抗体(1∶600)、兔抗人Notch2多克隆抗体(1∶400)、兔抗人Notch3多克隆抗体(1∶2 000)、兔抗人 HES-5多克隆抗体(1∶1 200)均购自美国Abcam公司;兔抗人HES-1单克隆抗体(1∶2 500)购自美国Cell Signaling公司。即用型免疫组化检测试剂盒、DAB显色试剂盒及苏木素体细胞染色液均购自福州迈新生物技术有限公司。
三、免疫组化法
所有标本经4%甲醛固定,常规脱水、包埋,连续切成4 μm薄片,置于防脱载玻片上;在58~60℃条件下烤片2 h,二甲苯脱蜡和梯度乙醇水化;用稀释后的1×柠檬酸组织抗原修复液高压3 min进行抗原修复,PBS清洗后加过氧化物酶阻断剂孵育10 min,PBS清洗后非免疫羊血清孵育10 min,除去血清后滴加适当稀释的一抗,4℃孵育过夜;PBS清洗后滴加生物素标记的二抗IgG,孵育10 min后清洗,DAB显色,苏木素复染,0.5%盐酸乙醇分化后中性树胶封片。已知阳性片作阳性对照,PBS替代一抗作阴性对照。所有样本染色条件相同,每批染色均有阳性对照、阴性对照。
四、结果判定
由两位病理医师分别随机选择5个不连续高倍镜视野计数,细胞内出现淡黄色至棕黄色颗粒者判断为阳性细胞。结合着色强度和阳性细胞百分比进行结果判定。着色强度计分:基本无着色计0分,着色弱阳性计1分,中度阳性计2分,强阳性计3分;阳性细胞百分比计分:每个高倍镜视野下分别计数100个细胞,阳色细胞所占细胞总数的百分比均值:<5%计0分,5%~25%计1分,26%~50%计2分,>50%计3分。以两者的乘积为最后得分:阴性(-)为0分,弱阳性(+)为1~2分,阳性(++)为 3~4分,强阳性(+++)为 5 分以上[8]。
五、统计学分析
用SPSS 20.0软件对数据进行统计学处理,NCT与Notch-HES信号分子之间的相关性用Spearman相关分析,P<0.05表示差异有统计学意义。
结 果
一、NCT蛋白在正常皮肤的表达
NCT蛋白广泛表达于正常表皮全层、皮肤附属器如,毛囊上皮、皮脂腺、大汗腺及小汗腺。免疫组化显示其阳性着色部位为胞质(图1)。
二、NCT蛋白在正常对照皮肤及患者皮损的表达差异
在正常毛囊上皮中,NCT蛋白在毛囊漏斗部高表达;AI皮损处毛囊口扩张,可见毛囊角栓,毛囊漏斗部NCT蛋白低表达(图2A,2B)。AI皮损表皮肥厚,表皮突锯齿状延长呈银屑病样增生,且NCT蛋白的表达水平较正常表皮明显较少(图2C,2D)。
三、Notch-HES信号通路在患者皮损及正常对照皮肤的表达差异
Notch1、Notch2、Notch3 的阳性着色部位为胞质、可有少量胞核的阳性表达;核因子HES-1及HES-5的阳性着色部位为胞核,代表其活化状态。Notch-HES信号分子在正常表皮全层均有表达;皮损中 Notch1、Notch2、Notch3、HES-1 及 HES-5 的表达水平较对照正常表皮明显减少。见图3,表1。
四、NCT蛋白与Notch-HES信号通路分子表达的相关性分析
NCT 蛋白与 Notch1(r=0.831,P<0.01)、Notch3(r=0.748,P<0.05) 以及 HES-1(r=0.807,P<0.01)的表达呈明显正相关,NCT蛋白与Notch2(r=0.597,P=0.069)、HES-5(r=0.591,P=0.072)的表达之间的相关性无统计学意义。
讨 论

图1 NCT蛋白广泛表达于正常表皮全层(1A)、皮肤附属器如毛囊上皮和皮脂腺(1B)、大汗腺(1C)及小汗腺(1D),阳性着色部位为胞质(1A、1C、1D免疫组化×200;1B:×100) 图2 NCT蛋白在正常对照(2A)与皮损处(2B)毛囊皮脂腺单位的表达(免疫组化×100);NCT蛋白在正常对照(2C)与皮损处(2D)表皮的表达(免疫组化×200)
本研究结果表明,NCT蛋白广泛表达于表皮全层、皮肤附属器如,毛囊上皮、皮脂腺、大汗腺及小汗腺。目前公认,AI的始动因素是毛囊漏斗部位的角化过度及栓塞,而大汗腺受累仅是继发现象[9]。本研究显示,在正常毛囊上皮中,NCT蛋白在毛囊漏斗部高表达,而在皮损标本中,NCT在毛囊漏斗部的表达较正常对照明显减少。因此,我们推测,NCT蛋白功能缺失性突变可能导致毛囊漏斗部角质形成细胞的NCT蛋白表达缺失,从而诱发毛囊漏斗部的异常角化,最终出现毛囊口扩张及毛囊角栓。另外,表皮增生是AI的一个新发现的组织学特征;本研究还发现,在NCT蛋白功能缺失性突变患者的皮损中,表皮肥厚,表皮突锯齿状延长呈银屑病样增生,且NCT蛋白的表达水平较正常表皮明显减少。
Notch 蛋白包括,Notch1-4,Notch 配体包括Jagged1、Jagged2和3种 Delta样蛋白(DLL-1,-3,-4)。Notch蛋白与邻近细胞配体结合活化后,γ分泌酶在膜平面切割蛋白,将胞内功能域NICD(Notch intracellular domain)释放入胞质并入核。在核内,NICD与细胞核内的转录因子CSL结合并使之活化,激活下游靶基因HES-1(hairy enhancer of split-1)等的转录[10]。既往研究中证实,Notch1、Notch2、Notch3在正常表皮中全层均有表达,本研究发现,其靶基因HES-1及HES-5在正常表皮中亦广泛表达[11]。本研究结果表明,在NCT蛋白突变患者的皮损中,其Notch-HES信号分子的表达水平较对照正常表皮明显减少,且表达的减少程度与NCT蛋白表达的减少水平呈正相关;由于HES-1及HES-5是Notch通路直接作用的效应分子,其表达下降表明Notch信号通路活性降低[12]。

图3 Notch-HES信号通路分子在正常对照及患者皮损的表达差异 Notch1、Notch2、Notch3的阳性着色部位为胞质、可有少量胞核的阳性表达;核因子HES-1及HES-5的阳性着色部位为胞核(3A~3E为正常对照;3F~3J为皮损,免疫组化×200)
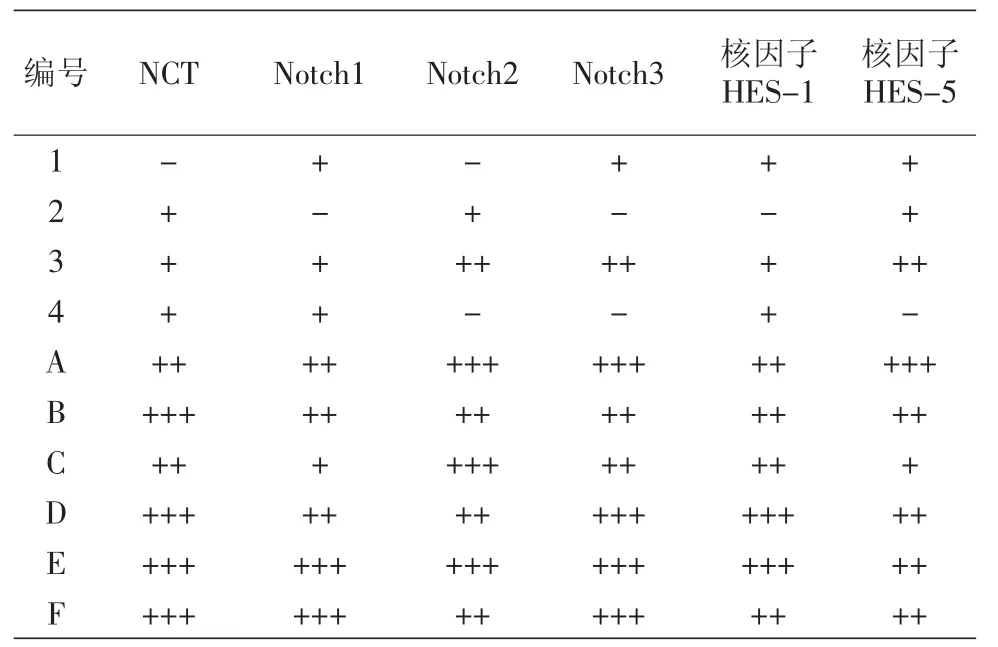
表1 nicastrin(NCT)蛋白与Notch-HES信号通路分子在患者皮损及正常对照表皮的表达
Notch信号通路在维持表皮角质形成细胞及毛囊外毛根鞘细胞正常增殖和分化是必须的[13]。AI的一个重要组织病理学特征是表皮囊肿的形成[14]。缺乏γ分泌酶可使外毛根鞘细胞向表皮细胞分化,导致毛囊转化为表皮囊肿;在Notch通路缺陷的小鼠中也出现了类似的表现,即毛囊终末分化缺陷,被表皮囊肿所替代[15]。因此,NCT蛋白功能缺失性突变下调Notch信号通路,导致异常的外毛根鞘角化可能在本病发病中发挥重要的作用。同时,Notch1表达缺失可促进复层鳞状上皮增殖;AI患者和Notch1基因缺陷的小鼠皮损都出现了毛囊间表皮银屑病样异常增殖的组织学表现。
综上所述,本研究在NCT蛋白功能缺失性突变的AI患者皮损中检测NCT蛋白及其下游Notch、HES信号分子的表达,表明NCT蛋白功能缺失性突变可导致Notch信号通路表达异常。结合文献,我们提出一个设想:NCT蛋白功能缺失性突变导致γ分泌酶及其下游Notch信号通路表达及活性受损可使毛囊漏斗部异常角化(毛囊角栓)及表皮囊肿形成,膨胀的毛囊漏斗部及表皮囊肿破裂释放的内容物可继发严重的炎症反应,而Notch信号通路受损使其无法有效地抑制激活的自身免疫反应,加之肥胖及皱褶部位的摩擦、机械性压力等诱发因素都可进一步损害Notch信号通路,导致病情的加重以及迁延,形成窦道及瘢痕,可解释AI的主要病理改变和危险因素[10,14]。
志谢 中国医学科学院皮肤病研究所姜祎群主任医师、万川博士
[1]Wang B,Yang W,Wen W,et al.Gamma-secretase gene mutations in familial acne inversa[J].Science,2010,330(6007):1065.DOI:10.1126/science.1196284.
[2]Pink AE,Simpson MA,Desai N,et al.gamma-Secretase mutations in hidradenitis suppurativa:new insights into disease pathogenesis[J].J Invest Dermatol,2013,133(3):601-607.DOI:10.1038/jid.2012.372.
[3]肖学敏,张晓峰,李诚让,等.外显子组测序技术在遗传性皮肤病的应用[J].中华皮肤科杂志,2013,46(9):691-693.DOI:10.3760/cma.j.issn.0412-4030.2013.09.031.Xiao XM,ZhangXF,Li CR,et al.Application of exome sequencing in genetic skin diseases[J].Chin J Dermatol,2013(9):691-693.DOI:0.3760/cma.j.issn.0412-4030.2013.09.031.
[4]NomuraY,NomuraT,SuzukiS,etal.A novel NCSTN mutation alone may be insufficient for the development of familial hidradenitis suppurativa [J].J Dermatol Sci,2014,74 (2):180-182.DOI:10.1016/j.jdermsci.2014.01.013.
[5]Xie T,Yan C,Zhou R,et al.Crystal structure of the gamma-secretase component nicastrin[J].Proc Natl Acad Sci U S A,2014,111(37):13349-13354.DOI:10.1073/pnas.1414837111.
[6]Danby FW,Margesson LJ.Hidradenitis suppurativa[J].Dermatol Clin,2010,28(4):779-793.DOI:10.1016/j.det.2010.07.003.
[7]徐浩翔,王宝玺.反常性痤疮发病机制和治疗的研究进展[J].国际皮肤性病学杂志,2011,37(4):242-245.DOI:10.3760/cma.j.issn.1673-4173.2011.04.017.Xu HX,Wang BX.Advances in the pathogenesis and treatment of acne inversa[J].Int J Dermatol Venereol,2011,37(4):242-245.DOI:10.3760/cma.j.issn.1673-4173.2011.04.017.
[8]Campo E,Merino M J,Liotta L,et al.Distribution of the 72-kd type IV collagenase in nonneoplastic and neoplastic thyroid tissue[J].Hum Pathol,1992,23(12):1395-1401.
[9]van der Zee HH,Prens EP.Preliminary findings suggest hidradenitis suppurativa may be due to defective follicular support[J].Br J Dermatol,2013,168(5):926-927.DOI:10.1111/bjd.12297.
[10]肖学敏,何艳艳,张晓峰,等.γ-分泌酶在皮肤病中的研究进展[J].国际皮肤性病学杂志,2014,40(4):243-247.DOI:10.3760/cma.j.issn.1673-4173.2014.04.013.Xiao XM,He YY,Zhang XF.γ-Secretase in skin diseases[J].Int J Dermatol Venereol,2014,37 (4):243-247.DOI:10.3760/cma.j.issn.1673-4173.2014.04.013.
[11]Ota T,Takekoshi S,Takagi T,et al.Notch signaling may be involved in the abnormal differentiation of epidermal keratinocytes in psoriasis[J].Acta Histochem Cytochem,2014,47(4):175-183.DOI:10.1267/ahc.14027.
[12]Borggrefe T,Oswald F.The Notch signaling pathway:transcriptional regulation at Notch target genes[J].Cell Mol Life Sci,2009,66(10):1631-1646.DOI:10.1007/s00018-009-8668-7.
[13]Lin HY,Kao CH,Lin KM,et al.Notch signaling regulates latestage epidermal differentiation and maintains postnatal hair cycle homeostasis[J].PLoS One,2011,6(1):e15842.DOI:10.1371/journal.pone.0015842.
[14]Fismen S,Ingvarsson G,Moseng D,et al.A clinical-pathological review of hidradenitis suppurativa:using immunohistochemistry one disease becomes two[J].APMIS,2012,120(6):433-440.DOI:10.1111/j.1600-0463.2011.02771.x.
[15]Demehri S,Kopan R.Notch signaling in bulge stem cells is not required for selection of hair follicle fate[J].Development,2009,136(6):891-896.DOI:10.1242/dev.030700.
Expression of the Notch-HES signaling pathway in lesions of patients with acne inversa harbouring nicastrin gene mutations
Xiao Xuemin,Li Chengrang,He Yanyan,Zhang Xiaofeng,Xu Haoxiang,Wang Baoxi
Department of Dermatology,Union Hospital,Fujian Medical University,Fuzhou 350001,China(Xiao XM);Department of Dermatology,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College;Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Nanjing 210042,China(Li CR,He YY,Zhang XF,Xu HX);Department of Dermatology,Plastic Surgery Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100144,China(Wang BX)
Objective To measure expressions of nicastrin and its downstream Notch-HES signaling pathwayassociated proteins in skin lesions of patients with acne inversa harbouring nicastrin gene mutations.Methods An immunohistochemical study was performed to measure the expressions of nicastrin and Notch-HES signaling pathwayassociated proteins in paraffin-embeded skin samples from lesions of 4 patients with acne inversa and confirmed nicastrin mutations and from normal skin of 6 human controls.Spearman correlation analysis was carried out to assess the relationship between the expressions of nicastrin and Notch-HES signaling pathway-associated proteins.Results In normal control skin samples,nicastrin was widely distributed in the full-thickness epidermis and skin appendages such as pilosebaceous units,apocrine glands and eccrine glands.However,the expressions of nicastrin and Notch-HES signaling pathway-associated proteins were markedly decreased in the epidermis and hair follicle infundibulum in lesions of patients harbouring nicastrin gene mutations compared with normal control skin.Furthermore,nicastrin expression was positively correlated with Notch1,Notch3 and HES-1 expressions(r=0.831,0.748 and 0.807,P<0.01,0.05 and 0.01 respectively),but not significantly correlated with Notch2 or HES-5 expressions (r=0.597,0.591 respectively,bothP>0.05).Conclusion Nicastrin expression markedly decreases in lesions of patients with acne inversa harbouring nicastrin gene mutations,and is positively correlated with the expressions of several Notch-HES signaling pathway-associated proteins,suggesting that the decrease in nicastrin expression may take part in the pathogenesis of acne inversa by influencing the expression of the downstream Notch-HES signaling pathway.
Genes;Mutation;Signal transduction;Acne inversa;Nicastrin gene;Notch-HES signaling pathway
s:Xu Haoxiang,Email:xbpipi@163.com;Wang Baoxi,Email:wangbx@ncstdlc.org
徐浩翔,Email:xbpipi@163.com;王宝玺,Email:wangbx@ncstdlc.org
10.3760/cma.j.issn.0412-4030.2016.06.012
国家自然科学基金(81472905、81472872、81101207);北京协和医学院协和青年基金(3332013056、33320140048)
Fund programs:National Natural Science Foundation of China(81472905,81472872,81101207);PUMC Youth Fund(3332013056,33320140048)
2015-07-13)
(本文编辑:吴晓初)
