西达本胺联合姜黄素对人皮肤T细胞淋巴瘤细胞系Hut78的影响及其分子机制
2016-11-06谷晓广吴芳妮张芊张春雷100191北京大学第三医院皮肤科
谷晓广 吴芳妮 张芊 张春雷100191北京大学第三医院皮肤科
西达本胺联合姜黄素对人皮肤T细胞淋巴瘤细胞系Hut78的影响及其分子机制
谷晓广 吴芳妮 张芊 张春雷100191北京大学第三医院皮肤科
目的 研究西达本胺联合姜黄素对皮肤T细胞淋巴瘤(CTCL)细胞的增殖抑制和凋亡诱导作用,探讨西达本胺联合姜黄素治疗CTCL的机制。方法 分别用0.3、0.6、1.2、2.4 μmol/L西达本胺,10 μmol/L姜黄素,1.2 μmol/L西达本胺联合10 μmol/L姜黄素处理Hut78细胞24、48、72 h后,采用MTS法检测Hut78细胞的生存率。用0.6、1.2 μmol/L西达本胺,10 μmol/L姜黄素,1.2 μmol/L西达本胺联合 10 μmol/L姜黄素分别处理Hut78细胞24 h,用流式细胞仪检测细胞凋亡情况及细胞周期,用实时PCR和Western印迹法检测凋亡相关基因Fas、caspase 8、NF-κB p65及细胞周期相关基因P21、CDK2、细胞周期蛋白E(cyclin E)mRNA和蛋白的表达。统计分析采用重复测量方差分析、单因素方差分析和LSD-t检验。结果 西达本胺能明显抑制Hut78细胞的增殖,且呈剂量依赖性(F=266.558,P<0.001)和时间依赖性(F=564.966,P<0.001)。培养 48 h和72 h时,1.2 μmol/L西达本胺联合10 μmol/L姜黄素对细胞增殖的抑制作用显著强于1.2 μmol/L西达本胺及10 μmol/L姜黄素(均P<0.001)。流式细胞仪结果显示,联合组的凋亡细胞比例均显著高于0.6、1.2 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.001)。此外,联合组和1.2 μmol/L西达本胺组G0/G1期细胞比例明显高于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组,而其S期细胞比例及G2/M期细胞比例均明显低于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.05),联合组与1.2 μmol/L西达本胺组各细胞周期比例差异均无统计学意义(均P>0.05)。实时PCR结果显示,联合组和1.2 μmol/L西达本胺组Fas、caspase 8、P21 mRNA的表达均明显高于 0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.001),而其 NF-κB p65、CDK2、cyclin E mRNA的表达均明显低于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.001)。联合组Fas mRNA的表达明显高于 1.2 μmol/L 西达本胺组(P<0.001),而 caspase 8、P21、NF-κB p65、CDK2、cyclin E mRNA 的表达与1.2 μmol/L西达本胺组差异无统计学意义(均P>0.05)。Western印迹结果显示,联合组与0.6、1.2 μmol/L西达本胺、不加药物的对照组比较,Fas、caspase 8、P21蛋白的表达明显增加,而 NF-κB p65、CDK2、CyclinE 蛋白的表达明显降低,与以上基因mRNA的表达一致。结论 西达本胺通过抑制细胞增殖和促进细胞凋亡来抑制CTCL细胞系Hut78生长,联合姜黄素能明显提高抑制CTCL细胞系Hut78的生长率。
淋巴瘤,T细胞,皮肤;姜黄素;细胞增殖;细胞凋亡;西达本胺;Hut78细胞
皮肤T细胞淋巴瘤(cutaneous T-cell lymphoma,CTCL)是原发于皮肤的T淋巴细胞克隆性增生造成的疾病,其中蕈样肉芽肿(MF)和Sézary综合征(SS)是最常见的类型。但目前CTCL的治疗方法十分有限,特别是进展为肿瘤期MF及病变扩散累及周围淋巴结和内脏器官,局部治疗只能缓解症状,系统性化疗也很难达到治愈[1-2]。西达本胺是我国具有自主知识产权和全新化学结构的选择性组蛋白去乙酰化酶抑制剂(HDAC inhibitor,HDAC-I),特异性地针对与肿瘤发生和发展高度相关的第Ⅰ大类组蛋白去乙酰化酶(HDAC)的亚型,主要抑制HDAC2 和HDAC3[3],具有高抗癌活性和低毒性。姜黄素在很多肿瘤细胞系和动物模型中可抑制细胞生长和诱导凋亡。近年来的研究显示,姜黄素能明显诱导CTCL细胞系的凋亡并抑制其增殖[4]。本研究通过观察西达本胺和姜黄素对CTCL细胞系Hut78增殖和凋亡的影响,检测Hut78细胞周期和凋亡相关基因的表达,探讨西达本胺联合姜黄素治疗CTCL的分子机制。
资料和方法
一、资料及试剂
Hut78细胞系(ATCC号 TIB-161),RPMI 1640培养基、胎牛血清(美国Gibco公司),西达本胺(深圳微芯生物科技有限公司,批号H20140129),姜黄素(美国Sigma公司,批号C7727)。MTS细胞增殖检测试剂盒(美国Promega公司),cDNA合成试剂盒(立陶宛Fermentas公司),FITC-Annexin V凋亡检测试剂盒(美国CA公司),PI试剂盒(美国BD公司),兔抗人多克隆抗体Fas、兔抗人多克隆抗体caspase 8、兔抗人多克隆抗体NF-κB p65、鼠抗人单克隆抗体P21、鼠抗人单克隆抗体CDK2、兔抗人单克隆抗体GAPDH(美国Abcam公司),细胞培养箱(美国Thermo公司)。
二、细胞培养
Hut78细胞在含有10%胎牛血清和1%青链霉素的RPMI 1640培养基,37℃5%CO2孵育箱中培养传代,取对数生长期不同浓度细胞进行后续试验。
三、MTS法检测细胞增殖
取对数生长期Hut78细胞(2×104/ml)接种于6孔板中,每孔1 ml。以西达本胺在人体内的峰浓度1.2 μmol/L 为基点[5],通过倍比稀释和倍比增加,实验组分别每孔加入 0.3、0.6、1.2、2.4 μmol/L 西达本胺,10 μmol/L 姜黄素,1.2 μmol/L 西达本胺联合10 μmol/L姜黄素(联合组),对照组加入 DMSO,每孔 10 μl,分别培养 24、48、72 h。在每个时间点混匀细胞,取100 μl细胞混悬液至96孔板中,每个浓度做3个复孔,每孔中加20 μl预先配置的MTS溶液,37℃孵箱中孵育2 h,在分光光度仪490 nm处测定吸光度(A值),重复测定3次。
四、流式细胞仪检测细胞凋亡及细胞周期
取对数生长期Hut78细胞(2×104/ml)接种于6孔板中,每孔1 ml。实验组分别每孔加入0.6、1.2 μmol/L西达本胺,10 μmol/L 姜黄素,1.2 μmol/L西达本胺联合10 μmol/L姜黄素(联合组),对照组加入 DMSO,每孔 10 μl,培养 24 h。
细胞凋亡的检测:每个浓度组计数5×105个细胞,以冷的PBS缓冲液清洗细胞2次,将106/ml细胞重悬在结合缓冲液中。取100 μl细胞悬液转移到5 ml培养管中,每管中加入FITC偶联的AnnexinV 5 μl以及 PI 5 μl。混匀细胞,避光孵育 15 min。每管中加入400 μl结合缓冲液,1 h内用流式细胞仪检测。采用FlowJo 8.0软件分析,计算FITC阳性细胞百分比。重复测定3次,取平均值。
细胞周期检测:每个浓度组计数106个细胞,离心并将其重新混悬在0.3 ml PBS缓冲液中。向细胞中逐滴加入0.7 ml冰无水乙醇以固定细胞,同时不断振荡混匀,置冰上1 h。1 200×g离心5 min去除固定液,用冰PBS缓冲液冲洗细胞2次。将细胞重新溶于500 μl PI溶液中,在室温下避光孵育60 min。加入3 ml PBS缓冲液,室温下1 200×g离心5 min。将上清液小心移除,并将细胞重新混悬在500 μl PBS中。用流式细胞仪PE/PI通道进行分析,计算G0/G1期、S期和G2/M期细胞所占的比例。重复测定3次,取平均值。
五、实时PCR检测细胞凋亡及细胞周期相关基因mRNA的表达
分别取 0.6、1.2 μmol/L 西达本胺组,10 μmol/L姜黄素组,联合组及对照组培养24 h的Hut78细胞4×105个,离心弃上清液,加入Trizol®Reagent提取细胞RNA,反转录为cDNA,以cDNA为模板,加入相应目的基因的引物,各引物序列见表 1。采用powerSYBR®GreenPCR Master Mix试剂盒进行实时荧光定量PCR,同时扩增GAPDH基因作为定量PCR的内参对照。各目的基因mRNA的表达值=(目的基因Ct值-内参基因Ct值)/内参基因Ct值×104,每个样本分别重复3管,取均值为最终结果。

表1 凋亡相关基因Fas、NF-κB p65、caspase 8,细胞周期相关基因P21、CDK2、CyclinE和内参GAPDH的引物序列
六、Western印迹法检测细胞凋亡及细胞周期相关蛋白的表达
分别取 0.6、1.2 μmol/L 西达本胺组,10 μmol/L姜黄素组,联合组及对照组培养24 h的Hut78细胞107个,离心弃上清液,用PBS洗涤细胞2次,加入蛋白裂解液,混匀。4℃振荡孵育1 h,4℃18 000×g离心10 min。收集上清液,采用BSA法蛋白定量试剂盒,对待测蛋白进行蛋白定量。取一定体积的总蛋白,加入5×蛋白电泳上样缓冲液,充分混匀后,水浴99℃变性5min。加样孔注入等量20μg总蛋白和5 μl marker,80 V 恒压 30 min 后,120 V 恒压 SDSPAGE电泳90 min。200 mA 120 min将电泳条带电转印到PVDF膜上,5%BSA封闭1 h后,分别加入一抗1∶1 000稀释兔抗人Fas多克隆抗体、1∶800稀释兔抗人caspase8多克隆抗体、1∶800稀释兔抗人NF-κB p65多克隆抗体、1∶1 000稀释鼠抗人P21单克隆抗体、1∶1 000稀释鼠抗人CDK2单克隆抗体、1∶1 000稀释兔抗人GAPDH单克隆抗体4℃过夜。TBST洗涤后加入1∶2 000辣根过氧化物酶标记的山羊抗兔二抗或山羊抗鼠二抗,室温孵育0.5 h,TBST漂洗,加入显色底物显色3 min。

图1 西达本胺和姜黄素单用或联合对Hut78细胞体外增殖的影响 24、48、72 h,与对照组相比,各浓度西达本胺组、姜黄素组和西达本胺联合姜黄素组的细胞增殖均有不同程度降低,西达本胺联合姜黄素组对细胞增殖的抑制作用最强。24 h时,联合组对细胞的增殖抑制作用与1.2 μmol/L西达本胺组相比,差异无统计学意义,但在48、72 h时,联合组比1.2 μmol/L西达本胺组对细胞的增殖抑制明显加强
七、统计学分析
结 果
一、西达本胺和姜黄素对Hut78细胞体外增殖的影响
如图 1所示,与对照组相比,0.3、0.6、1.2、2.4μmol/L西达本胺组、10 μmol/L姜黄素组、联合组的细胞增殖均有不同程度降低。重复测量方差分析显示,各处理组细胞增殖的A值随时间变化的趋势(F=564.966,P<0.001),且不同处理对细胞的增殖抑制差异有统计学意义(F=266.558,P<0.001)。LSD-t检验显示,24h时,联合组细胞增殖的A值与1.2μmol/L西达本胺组相比,差异无统计学意义(P=0.499),但低于10 μmol/L姜黄素组,差异有统计学意义(P<0.001)。48h时,联合组细胞增殖A值低于1.2μmol/L西达本胺及10 μmol/L姜黄素,差异有统计学意义(均P<0.001),而1.2 μmol/L西达本胺组显著低于10 μmol/L姜黄素组(P<0.001)。72 h时,联合组细胞增殖的A值仍低于1.2 μmol/L西达本胺组和10 μmol/L姜黄素组,差异有统计学意义(均P<0.001),且1.2 μmol/L西达本胺组细胞仍显著低于10 μmol/L姜黄素组(P<0.001)。
表2 西达本胺和姜黄素作用Hut78细胞24 h后对细胞周期的影响(%,±s)
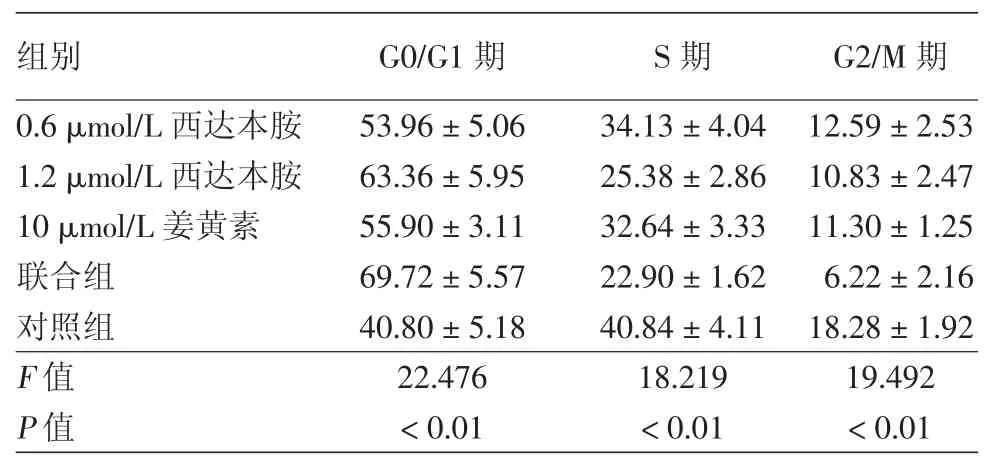
表2 西达本胺和姜黄素作用Hut78细胞24 h后对细胞周期的影响(%,±s)
注:n=3。联合组为1.2 μmol/L西达本胺联合10 μmol/L姜黄素
组别 G0/G1期 S期 G2/M期0.6 μmol/L西达本胺 53.96±5.06 34.13±4.04 12.59±2.53 1.2 μmol/L西达本胺 63.36±5.95 25.38±2.86 10.83±2.47 10 μmol/L姜黄素 55.90±3.11 32.64±3.33 11.30±1.25联合组 69.72±5.57 22.90±1.62 6.22±2.16对照组 40.80±5.18 40.84±4.11 18.28±1.92 F值 22.476 18.219 19.492 P值<0.01<0.01<0.01
二、西达本胺和姜黄素对Hut78细胞凋亡影响
0.6、1.2 μmol/L 西达本胺组、10 μmol/L 姜黄素组、联合组、对照组凋亡细胞比例分别为差异有统计学意义(F=186.324,P=0.00)。两两比较显示,0.6、1.2 μmol/L 西达本胺组、10 μmol/L 姜黄素组、联合组的凋亡细胞比例均显著高于对照组(均P<0.01);而 0.6 μmol/L 西达本胺组与 1.2 μmol/L 西达本胺组、10 μmol/L姜黄素组相比,差异无统计学意义(均P>0.05);1.2 μmol/L西达本胺组凋亡细胞比例明显高于 10 μmol/L姜黄素组(P<0.01);联合组的凋亡细胞比例均高于0.6、1.2 μmol/L西达本胺组、10 μmol/L姜黄素组,差异有统计学意义(均P<0.001)。见图 2。

图2 流式细胞仪检测西达本胺和姜黄素单用或联合对Hut78细胞凋亡的影响 各组Hut78细胞处理24 h后,西达本胺及姜黄素均能诱导细胞凋亡,1.2 μmol/L西达本胺联合10 μmol/L姜黄素组对细胞的凋亡诱导作用最强
三、西达本胺和姜黄素对Hut78细胞周期影响
0.6、1.2 μmol/L 西达本胺,10 μmol/L 姜黄素,联合组及对照组分别作用Hut78细胞24 h后,G0/G1期、S期、G2/M期细胞比例差异均有统计学意义(表2)。与对照组相比,各实验组G0/G1期细胞比例增加,S期细胞比例及G2/M期细胞比例明显降低(均P<0.05)。联合组和1.2 μmol/L西达本胺组G0/G1期细胞比例明显高于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组,而其S期细胞比例及G2/M期细胞比例明显低于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.05)。而联合组与1.2 μmol/L 西达本胺组,0.6 μmol/L 西达本胺组与10 μmol/L姜黄素组各细胞周期比例差异无统计学意义(均P>0.05)。
四、西达本胺和姜黄素对Hut78细胞凋亡和细胞周期相关基因表达的影响
0.6、1.2 μmol/L 西达本胺,10 μmol/L 姜黄素,联合组及对照组分别作用Hut78细胞24 h后,凋亡相关基因 Fas、caspase 8、NF-κB p65,细胞周期相关基因P21、CDK2、CyclinE mRNA的相对表达量差异有统计学意义(F值分别为265.439、121.476、67.340、487.653、59.129、34.385,均P<0.01)。与对照组相比,各实验组 Fas、caspase 8、P21 mRNA 的表达均明显增加,而 NF-κB p65、CDK2、CyclinE mRNA 的表达明显降低(均P<0.05)。联合组和1.2 μmol/L西达本胺组Fas、caspase 8、P21 mRNA的表达明显高于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.001),而其 NF-κB p65、CDK2、CyclinE mRNA的表达均明显低于0.6 μmol/L西达本胺组和10 μmol/L姜黄素组(均P<0.001)。联合组 Fas mRNA的表达明显高于1.2 μmol/L西达本胺组(P<0.001), 而 caspase 8、P21、NF-κB p65、CDK2、CyclinE mRNA的表达与1.2 μmol/L西达本胺组差异无统计学意义(均P>0.05)。0.6 μmol/L西达本胺组与10 μmol/L姜黄素组相比,细胞凋亡和细胞周期各相关基因mRNA的表达量差异无统计学意义(均P>0.05)。见图3。

图3 西达本胺和姜黄素单用或联合对Hut78细胞的凋亡和细胞周期相关基因表达的影响 1~5分别为对照组、0.6 μmol/L西达本胺组、1.2 μmol/L西达本胺组、10 μmol/L姜黄素组,1.2 μmol/L西达本胺联合10 μmol/L姜黄素组。与对照组及各单独用药组相比,联合组显著增强了Fas、caspase 8、P21 mRNA 的表达,抑制了 NF-κB p65、CDK2、CyclinE mRNA 的表达
五、西达本胺和姜黄素对Hut78细胞凋亡和细胞周期相关蛋白表达的影响
如图4所示,与对照组相比,0.6、1.2 μmol/L西达本胺,1.2 μmol/L西达本胺联合10 μmol/L姜黄素分别作用 Hut78细胞 24 h 后,Fas、caspase 8、P21 蛋白的表达明显增加,而 NF-κB p65、CDK2、CyclinE蛋白的表达明显降低。

图4 西达本胺和姜黄素对Hut78细胞凋亡和细胞周期相关蛋白的影响 1~4分别为对照组、0.6、1.2 μmol/L西达本胺组、1.2 μmol/L西达本胺联合10 μmol/L姜黄素组。与对照组相比,各实验组作用Hut78细胞24 h后,Fas、caspase 8、P21蛋白条带灰度逐渐增加,NF-κB p65、CDK2、CyclinE 蛋白条带灰度逐渐减弱,GAPDH 为内参对照。与对照组和各单独用药组相比,1.2 μmol/L西达本胺联合10 μmol/L姜黄素显著增强了Fas、caspase 8、P21蛋白表达,抑制了NF-κB p65、CDK2、CyclinE 的蛋白表达
讨 论
近年来,表观遗传学调控药物-HDAC-Ⅰ逐渐应用于MF的治疗[6]。HDAC-Ⅰ可以通过上调染色质中组蛋白的乙酰化水平活化基因表达,诱导细胞周期停滞来促进肿瘤细胞的凋亡[1]。非选择性HDAC-I伏立诺他(vorinostat)是针对HDAC表观遗传的小分子药物,现已被美国FDA批准用于CTCL的治疗。临床试验显示,口服伏立诺他对2次系统治疗失败的CTCL患者总体有效率可达到29%和42%,患者的瘙痒和生活质量也显著改善[7-8]。西达本胺是选择性HDAC抑制剂,与伏立诺他相比,它可特异性地针对与肿瘤发生和发展高度相关的第Ⅰ大类 HDAC 亚型,主要抑制 HDAC2和HDAC3[3],具有高抗癌活性和低毒性。有研究[9]显示,西达本胺能通过诱导P21表达明显抑制胰腺癌细胞的增殖,且呈浓度和时间依赖性,并且能协同增加吉他西滨对胰腺癌细胞凋亡的诱导和增殖抑制。Dong等[10]用西达本胺对进展期实体肿瘤Ⅰ期进行临床研究,结果显示31例实体肿瘤中的5例非霍奇金淋巴瘤有4例达到部分缓解,部分缓解率达90%。我们的研究显示,西达本胺作用Hut78细胞后,可明显抑制细胞增殖并呈时间和浓度依赖性,还可明显诱导细胞凋亡及细胞周期抑制,呈明显的浓度依赖性。
细胞表面的死亡受体Fas是细胞凋亡的主要受体,当死亡配体FasL表达增加并与Fas结合,或者细胞受到某种刺激其表面Fas表达增加并与FasL结合,都可以诱导细胞凋亡通路的激活,然后凋亡级联反应通路中的caspase 8被剪切活化,从而激活下游的效应caspase引起DNA链断裂等一系列的细胞凋亡反应[11]。NF-κB与细胞凋亡有密切关系。大量研究表明,NF-κB激活能够阻断细胞死亡通路,保护细胞免于TNF和其它凋亡刺激因子诱导的凋亡级联反应[12]。本研究显示,西达本胺在诱导细胞凋亡的同时可引起凋亡相关基因Fas、caspase 8表达的升高,及NF-κB p65表达的降低。P21是细胞周期中非常重要的负性调节子,通过抑制CDK1和CDK2的活性而抑制细胞周期的进展,进而导致细胞的生长抑制[13]。本研究显示,西达本胺在导致细胞增殖抑制和细胞周期停滞的同时,引起细胞周期相关基因P21表达的升高和细胞周期正性调节基因CDK2和CyclinE表达的降低。因此,我们推测,西达本胺可能通过上调Hut78细胞表面的Fas表达触发了细胞的FasL-Fas细胞凋亡信号通路,并同时通过上调负性细胞周期相关基因P21的表达进而抑制CDK2和CyclinE的活性表达,从而引起细胞周期和细胞增殖的抑制。
姜黄素是从植物姜黄的根茎中分离的天然黄色颜料,在很多肿瘤细胞系和动物模型中抑制细胞生长和诱导凋亡。人体临床试验[4]显示,当姜黄素的剂量达到12 g/d时也不存在剂量限制性毒性,并揭示姜黄素可通过抑制NF-κB信号选择性诱导CTCL细胞凋亡。在CTCL中,NF-κB的活性对细胞存活和对凋亡抵抗是必须的[14-15]。本研究显示,与单用西达本胺相比,西达本胺联合姜黄素对Hut78细胞的增殖抑制、凋亡诱导和周期抑制作用更加明显,并对凋亡相关基因Fas、caspase 8表达的升高,NF-κB p65表达的降低和细胞周期相关基因P21表达的升高,CDK2和CyclinE表达的降低作用均明显高于单用西达本胺,显示西达本胺联合姜黄素能明显提高抑制CTCL细胞系Hut78的生长率。
[1]Zhang C,Richon V,Ni X,et al.Selective induction of apoptosis by histone deacetylase inhibitor SAHA in cutaneous T-cell lymphoma cells:relevance to mechanism of therapeutic action[J].J Invest Dermatol,2005,125(5):1045-1052.DOI:10.1111/j.0022-202X.2005.23925.x.
[2]Frescas D,Pagano M.Deregulated proteolysis by the F-box proteins SKP2 and beta-TrCP:tipping the scales of cancer[J].Nat Rev Cancer,2008,8(6):438-449.DOI:10.1038/nrc2396.
[3]Ning ZQ,Li ZB,Newman MJ,et al.Chidamide(CS055/HBI-8000):a new histone deacetylase inhibitor of the benzamide class with antitumor activity and the ability to enhance immune cellmediated tumor cell cytotoxicity[J].Cancer Chemother Pharmacol,2012:69(4):901-909.DOI:10.1007/s00280-011-1766-x.
[4]Zhang C,Li B,Zhang X,et al.Curcumin selectively induces apoptosis in cutaneous T-cell lymphoma cell lines and patients′PBMCs:potential role for STAT-3 and NF-kappaB signaling[J].J Invest Dermatol,2010,130 (8):2110-2119.DOI:10.1038/jid.2010.86.
[5]Dong M,Ning ZQ,Xing PY,et al.Phase I study of chidamide(CS055/HBI-8000),a new histone deacetylase inhibitor,in patients with advanced solid tumors and lymphomas[J].Cancer Chemother Pharmacol,2012,69 (6):1413-1422.DOI:10.1007/s00280-012-1847-5.
[6]Duvic M,Vu J.Update on the treatment of cutaneous T-cell lymphoma(CTCL):Focus on vorinostat[J].Biologics,2007,1(4):377-392.
[7]Duvic M,Talpur R,Ni X,et al.Phase 2 trial of oral vorinostat(suberoylanilide hydroxamic acid,SAHA)for refractory cutaneous T-cell lymphoma (CTCL)[J].Blood,2007,109(1):31-39.DOI:10.1182/blood-2006-06-025999.
[8]Piekarz RL,Frye R,Turner M,et al.Phase II multi-institutional trial of the histone deacetylase inhibitor romidepsin as monotherapy for patients with cutaneous T-cell lymphoma[J].J Clin Oncol,2009,27(32):5410-5417.DOI:10.1200/JCO.2008.21.6150.
[9]Qiao Z,Ren S,Li W,et al.Chidamide,a novel histone deacetylase inhibitor,synergistically enhances gemcitabine cytotoxicity in pancreatic cancer cells[J].Biochem Biophys Res Commun,2013,434(1):95-101.DOI:10.1016/j.bbrc.2013.03.059.
[10]Dong M,Ning ZQ,Xing PY,et al.Phase I study of chidamide(CS055/HBI-8000),a new histone deacetylase inhibitor,in patients with advanced solid tumors and lymphomas[J].Cancer Chemother Pharmacol,2012,69 (6):1413-1422.DOI:10.1007/s00280-012-1847-5.
[11]Yee C,Yang W,Hekimi S.The intrinsic apoptosis pathway mediates the pro-longevity response to mitochondrial ROS inC.elegans[J].Cell,2014,157 (4):897-909.DOI:10.1016/j.cell.2014.02.055.
[12] Mayo MW,Wang CY,Cogswell PC,et al.Requirement of NF-kappaB activation to suppress p53-independent apoptosis induced by oncogenic Ras[J].Science,1997,278(5344):1812-1815.
[13]Mahmoud AI,Kocabas F,Muralidhar SA,et al.Meis1 regulates postnatal cardiomyocyte cell cycle arrest[J].Nature,2013,497(7448):249-253.DOI:10.1038/nature12054.
[14]Sors A,Jean-Louis F,Pellet C,et al.Down-regulating constitutive activation of the NF-kappaB canonical pathway overcomes the resistance of cutaneous T-cell lymphoma to apoptosis[J].Blood,2006,107(6):2354-2363.DOI:10.1182/blood-2005-06-2536.
[15]Döbbeling U.Transcription factor profiling shows new ways towards new treatment options of cutaneous T cell lymphomas[J].Curr Drug Discov Technol,2007,4 (1):24-30.DOI:10.2174/157016307781115467.
Effects of chidamide combined with curcumin on human cutaneous T-cell lymphoma cell line Hut78 and their molecular mechanisms
Gu Xiaoguang,Wu Fangni,Zhang Qian,Zhang Chunlei
Department of Dermatology,Peking University Third Hospital,Beijing 100191,China
ObjectiveTo evaluate the inhibitory effect of chidamidecombined with curcumin on the proliferation of cutaneous T-cell lymphoma(CTCL)cell line Hut78,as well as their promotive effect on its apoptosis,and to explore their therapeutic mechanisms in CTCL.MethodsSome Hut78 cells were treated with different concentrations of chidamide(0.3,0.6,1.2,2.4 μmol/L)and 10 μmol/L curcumin alone or the combination of 1.2 μmol/L chidamide and 10 μmol/L curcumin for 24,48 and 72 hours separately.MTS assay was conducted to estimate cell viability at each time point.After selection of chidamide concentrations,some Hut78 cells were treated with chidamide (0.6 and 1.2 μmol/L)and curcumin(10 μmol/L)alone or in combination(1.2 μmol/L chidamide and 10 μmol/L curcumin)for 24 hours,then,flow cytometry was performed to detect cell apoptosis and analyze cell cycle,real-time(RT)-PCR and Western-blot analysis were conducted to quantify the mRNA and protein expressions of apoptosis-associated genes Fas,caspase 8,nuclear factor(NF)-κB p65 as well as cell cycle-associated genes P21,CDK2 and cyclin E respectively.Statistical analysis was carried out by repeated-measures analysis of variance,one-way analysis of variance and the least significant difference (LSD)-ttest.ResultsChidamide could significantly inhibit the proliferation of Hut78 cells in a dosedependent and time-dependent manner(F=266.558,564.966,respectively,bothP<0.001).After 48-and 72-hour culture,the combination of 1.2 μmol/L chidamide and 10 μmol/L curcumin showed significantly stronger inhibitory effect on cell proliferation compared with 1.2 μmol/L chidamide or 10 μmol/L curcumin alone (allP<0.001).As flow cytometry showed,the percentage of apoptotic cells was significantly higher in the combined treatment group than in the 0.6-,1.2-μmol/L chidamide groups and 10-μmol/L curcumin group (allP<0.001).Compared with the 0.6-μmol/L chidamide group and 10-μmol/L curcumin group,the combined treatment group and 1.2-μmol/L chidamide group both showed significantly increased proportion of cells at G0/G1 phase and mRNA expressions of Fas,caspase 8 and P21,but decreased proportion of cells at S phase or G2/M phase and mRNA expressions of NF-κB p65,CDK2 and cyclin E (P<0.05 for proportion of cells at different phases,P<0.001 for mRNA expressions of different genes).Furthermore,the mRNA expression of Fas was significantly higher in the combined treatment group than in the 1.2-μmol/L chidamide group (P<0.001),while no significant differences were observed in the mRNA expressions of caspase 8,P21,NF-κB p65,CDK2 and cyclin E or the proportion of cells at any phase between the combined treatment group and 1.2-μmol/L chidamide group (allP> 0.05).Western-blot analysis showed that protein expressions of Fas,caspase 8 and P21 significantly increased,but those of NF-κB p65,CDK2 and cyclin E significantly decreased in the combined treatment group compared with the 0.6-,1.2-μmol/L chidamide groups and blank control group receiving no treatment,which were in accordance with the above changes in mRNA expressions of these genes.ConclusionChidamide can inhibit the growth of the CTCL cell line Hut78 by directly decelerating cell proliferation and inducing cell apoptosis,and the combibation with curcumin can markedly enhance the inhibitory effect of chidamide on the growth of Hut78 cells.
Lymphoma,T-cell,cutaneous;Curcumin;Cell proliferation;Apoptosis;Chidamide;Hut-78 cell
Zhang Chunlei,Email:zhangchunleius@163.com
2015-04-09)
(本文编辑:周良佳 颜艳)
张春雷,Email:zhangchunleius@163.com
10.3760/cma.j.issn.0412-4030.2016.02.008
国家自然科学基金(81372915、81402259);北京市科技计划项目(Z131107002213028);北京大学第三医院临床重点项目(BYSY201209)
Fund programs:National Natural Science Foundation of China (81372915,81402259);Beijing Science and Technology Planning Project (Z131107002213028);Key Clinical Program of Peking University Third Hospital(BYSY201209)
