SAK-HV灌胃给药对高脂大鼠降脂效果的影响
2016-11-05黄志广付文亮景浩然龙民慧甘向东徐东刚
黄志广 , 付文亮 , 景浩然 , 龙民慧, 甘向东, 徐东刚,*
(1.广西医科大学,南宁530021;2.军事医学科学院基础医学研究所,北京100850)
SAK-HV灌胃给药对高脂大鼠降脂效果的影响
黄志广1, 付文亮2, 景浩然2, 龙民慧2, 甘向东2, 徐东刚1,2*
(1.广西医科大学,南宁530021;2.军事医学科学院基础医学研究所,北京100850)
研究重组蛋白SAK-HV口服给药对高脂模型大鼠血脂水平及氧化应激指标的影响,并对其降低胆固醇机制进行初步探讨.高脂饲料喂养雄性Wistar大鼠10周建立高脂模型,将成模大鼠按体质量随机分为:模型组、溶剂对照(碳酸氢钠)组、给药(SAK-HV)组及阳性对照(他汀)组.口服给药6周,分别检测血清中甘油三酯和总胆固醇含量、肝脏脂肪沉积情况、小肠Npc1l1及肝脏Abcg5/Abcg8的mRNA及蛋白表达水平、主动脉ROS含量、血清SOD活性及MDA含量.检测结果显示,与模型组大鼠相比,SAK-HV组大鼠血清总胆固醇和甘油三酯显著降低;肝脏脂肪沉积减少,小肠中NPC1L1的表达显著低下降,同时肝脏ABCG5/ABCG8的表达显著升高;大鼠主动脉ROS含量显著降低,血清SOD活性显著升高,而血清MDA含量显著降低.结果表明SAK-HV口服给药可通过抑制小肠对胆固醇的吸收,增强肝脏对胆固醇的外排作用降低血脂,同时它可降低机体氧化应激水平,因此有望成为治疗高脂血症的候补药物.
SAK-HV; 高脂血症; 口服给药; 胆固醇转运; 氧化应激
随着人们生活水平的提高,饮食结构及生活习惯的改变,高脂血症发病率逐年升高.高脂血症,又称血脂异常,是指血液中脂质含量过高,能导致心脑血管疾病,如动脉粥样硬化、冠心病和脑梗等[1].另外,它还能引起机体氧化应激水平升高,而氧化应激水平过高能促进动脉粥样硬化的发生发展[2].据保守估计,我国高脂血症患病人数已超1.6亿.因此,研发降脂新药具有十分重要的意义.
SAK-HV是我室前期研制的具有抗动脉粥样硬化作用的融合蛋白,它是以葡激酶(SAK)突变体为骨架,整合精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)序列和水蛭素C端12肽,具有溶栓、抗血小板聚集和抗凝酶作用[3-4].动物实验发现,SAK-HV尾静脉注射给药能显著降低ApoE-/-小鼠血清TG、TC水平,影响小肠胆固醇转运相关基因尼曼-匹克C1型类似蛋白1(Niemann-Pick C1 Like 1,Npc1l1)及ATP结合盒转运蛋白G5/G8(ATP-binding cassette(ABC) transporters G5/G8,Abcg5/Abcg8)的表达,显示该药物降低血清胆固醇可能与小肠对胆固醇的吸收和转运有关[5].另外,口服给药是一种方便、经济和依从性好的用药方式,加上肝脏是胆固醇代谢的主要器官,因此,研究口服SAK-HV是否能有效降低血脂,能否影响胆固醇在肝脏中的代谢具有重要的临床应用价值.本实验利用大鼠高脂模型,采用灌胃给药方式,通过检测血脂水平、肝脏脂肪沉积情况、小肠及肝脏组织胆固醇转运相关蛋白的表达水平、氧化应激指标,评价SAK-HV口服给药的降脂效果,探讨其降胆固醇机制,为该药物的后续研发奠定基础.
1 研究方法
1.1材料和试剂
Wistar大鼠及高脂饲料购自军事医学科学院动物实验中心(实验动物质量合格证许可证号:SCXK-(军)2012-0004).高脂饲料配方(质量分数):胆固醇2%,猪油10%,糖5%及基础饲料83%.SAK-HV由本室研制.阿托伐他汀钙片购自辉瑞制药有限公司(商品名为立普妥).油红购自Sigma公司.NPC1L1、ABCG5抗体购自Santa公司,ABCG8抗体购自Novus Biologicals公司.RNA提取试剂盒(货号:71201-50)购自北京天恩泽基因科技有限公司.反转录试剂盒(货号:K1622)、Maxima SYBR Green/ROX qPCR Master Mix (2X)(货号:K0222)购自Thermo scientific公司.引物用Primer 3.0软件设计,由生物工程(上海)股份有限公司合成(表1).甘油三酯(TG)测定试剂盒(货号:A110-1)、总胆固醇(TC)测定试剂盒(货号:A111-1)、活性氧(ROS)检测盒(货号:E004)、总超氧化物歧化酶(T-SOD)测试盒(货号:A001-1)及丙二醛(MDA)测试盒(货号:A003-1)购自南京建成生物工程研究所. 食用碳酸氢钠、生理盐水等.

表1 引物序列表
1.2实验方法
(2) 对照组继续普通饲料喂养,高脂组换成高脂饲料,大鼠自由进食和饮水.高脂组大鼠喂养10周后,其血清中甘油三脂(Triglyceride, TG)和总胆固醇(Total Cholesterol, TC)含量均高于对照组,差异极显著(P<0.01)(图1A),据此判定造模成功.
(3)将造模成功的24只大鼠按体质量随机分成模型组、碳酸氢钠组、SAK-HV组及他汀组4组,每组各6只.各组继续高脂饲料喂养,自由进食和饮水.结果显示各组大鼠摄食量呈缓慢下降趋势,组间差异不显著(数据未给出).
(4)第11周开始连续给药,每天1次.模型组:灌生理盐水,3 mL/只;碳酸氢钠组:灌0.1 mol/L的碳酸氢钠溶液(生理盐水配制),pH 8.0,3 mL/只;SAK-HV组:先灌0.1 mol/L的碳酸氢钠溶液,pH 8.0,2 mL/只,再灌SAK-HV溶液(碳酸氢钠溶液配制),剂量为15 mg/kg,1 mL/只;他汀组:灌阿托伐他汀溶液(生理盐水配制),剂量为20 mg/kg,3 mL/只.
(5) 给药6周后停止给药,禁食12 h,对大鼠实施麻醉,心脏取血并处死.血液样品4 000 r/min离心10 min,取上层血清,分装,-70 ℃保存.分离大鼠主动脉,生理盐水漂洗,除去残留血块,-70 ℃保存.取大鼠胃部以下3~12 cm处的小肠组织,剪成小段,一部分-70 ℃保存,另一部分用福尔马林保存;取肝脏大叶中部,剪成小块,一部分-70 ℃保存,另一部分用福尔马林保存.实验过程保障实验动物福利,并严格遵守实验动物伦理准则.
1.3测试方法
1.3.1检测血清中TG、TC含量实验过程严格按照测试盒附带说明书的步骤进行.
1.3.2qPCR检测相关基因相对表达提取小肠及肝脏组织的mRNA,反转录成cDNA,进行qPCR反应,检测小肠中Npc1l1及肝脏中Abcg5/Abcg8的相对表达量.
1.3.3肝脏组织油红O染色实验将福尔马林固定的组织脱水沉底,再进行速冻包埋、切片.冰冻切片复温干燥10 min,4%多聚甲醛固定15 min.油红工作液孵育10~15 min,破膜10~15 min,再用油红工作液37 ℃染色1 h.75%酒精分化2 s,水洗1 min.Harris苏木素复染2 min,水洗1 min;1%盐酸酒精分化数秒,水洗1 min,氨水反蓝,水洗.吸去多余水分,甘油明胶封片.显微镜镜检并采集图像.
各模块以Arduino Uno主控板为核心,Arduino采用开放源代码的软硬件平台,具有类似Java、C语言的Processing/Wiring开发环境.模块通过Arduino主控板编写程序,通过Arduino Xbee扩展板连接Xbee pro S1无线模块进行无线数据交互.
1.3.4石蜡切片免疫组化实验福尔马林固定的组织先水洗、脱水包埋,再进行切片.石蜡切片脱蜡至水,浸入柠檬酸抗原修复缓冲液(pH 6.0)中进行抗原修复,放入3%过氧化氢溶液(双氧水:纯水=1∶9)室温避光孵育25 min以阻断内源性过氧化物酶,BSA室温封闭30 min.加入PBS配好的一抗,湿盒内4 ℃孵育过夜.加入与一抗相应的HRP标记的二抗,室温孵育50 min.加入新配制的DAB显色液显色,流水冲洗终止.Harris苏木素复染3 min,水洗,1%盐酸酒精分化数秒,水洗1 min,氨水反蓝,水洗.最后脱水封片,显微镜镜检并采集图像.
1.3.5大鼠主动脉ROS含量检测研磨大鼠主动脉,离心,取上层蛋白液,检测ROS含量,实验过程严格按照测试盒附带说明书的步骤进行.
1.3.6血清SOD活性及MDA含量检测实验过程严格按照测试盒附带说明书的步骤进行.
1.4数据处理
2 结果与分析
2.1各组间血脂结果比较
用酶法检测大鼠血清中TG和TC含量,结果(图1B)表明,SAK-HV组大鼠血清TG、TC含量分别低于模型组、碳酸氢钠组和他汀组,差异具有统计学意义;他汀组TG、TC含量低于模型组,差异具有统计学意义.
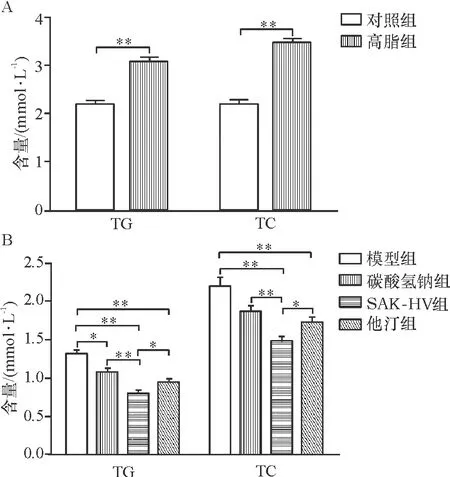
图1 各处理组大鼠血清中TG和TC含量
注:*P<0.05表示差异显著;**P<0.01表示差异极显著,下图同.
2.2大鼠小肠组织中Npc1l1的mRNA及蛋白质水平比较
采用实时定量PCR技术检测各组小肠中Npc1l1的mRNA表达水平.结果(图2A)显示,SAK-HV组小肠中Npc1l1的mRNA表达量分别低于模型组和他汀组,差异具有统计学意义.采用石蜡切片免疫组化技术检测小肠中NPC1L1蛋白表达,图片中棕黄色为阳性表达(图2B).采用Image-pro plus图像处理软件统计阳性表达面积比.结果(图2C)显示,在小肠上皮绒毛部位,SAK-HV组棕黄色面积显著低于模型组和他汀组,表明SAK-HV组NPC1L1蛋白表达量显著低于模型组和他汀组,与qPCR结果相一致.
2.3大鼠肝组织中脂肪沉积比较
油红O染色将肝细胞中的脂滴染成红色,能直观反映肝脏脂肪沉积情况.染色结果显示各组肝组织细胞轮廓清晰,红色部分为脂滴,蓝色部分为细胞核.模型组肝组织细胞体积增大,胞浆中可见大量鲜红色脂滴,几乎占据整个肝细胞(图3A).与模型组比较,SAK-HV组的肝细胞体积变小,胞浆中脂滴颜色呈浅红色(图3C),说明SAK-HV组肝脏脂肪沉积少于模型组.与他汀组比较,SAK-HV组细胞胞浆中脂滴颜色略浅,说明SAK-HV组肝脏脂肪沉积少于他汀组(图3D).与模型组比较,碳酸氢钠组肝细胞胞浆脂滴油红着色无明显变化(图3B).

图2 各组大鼠小肠中Npc1l1的mRNA及蛋白表达水平

图3 大鼠肝脏红油O染色结果
2.4大鼠肝脏组织中Abcg5/Abcg8 mRNA及蛋白水平比较
qPCR结果(图4A)显示,SAK-HV组肝脏组织中Abcg5/Abcg8的mRNA表达水平分别高于模型组、碳酸氢钠组和他汀组,差异具有统计学意义.肝脏免疫组化结果(图4B)显示,SAK-HV组ABCG5棕黄色面积比显著高于模型组、碳酸氢钠组和他汀组;SAK-HV组ABCG8棕黄色面积比显著高于模型组、碳酸氢钠组和他汀组(图4C),表明SAK-HV组ABCG5、ABCG8蛋白表达量都显著高于模型组、碳酸氢钠组和他汀组,与qPCR的结果基本一致.
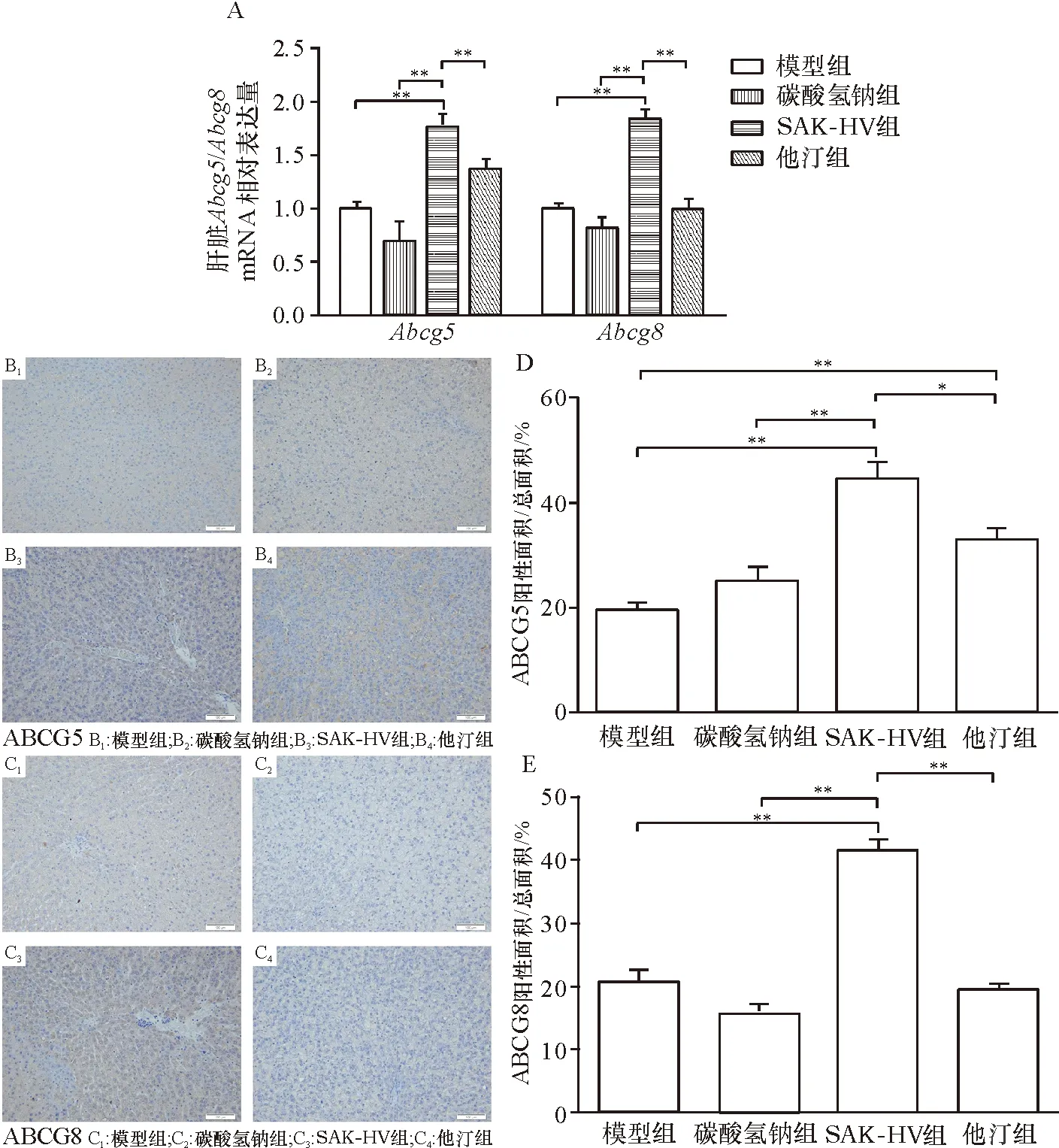
图4 各组大鼠肝脏中Abcg5/Abcg8的mRNA及蛋白质表达水平
2.5大鼠主动脉中活性氧(ROS)水平比较
采用化学荧光法检测大鼠主动脉中ROS含量.结果(图5)显示,SAK-HV组ROS含量分别低于模型组、碳酸氢钠组和他汀组,差异具有统计学意义;碳酸氢钠组ROS含量低于模型组,差异具有统计学意义.
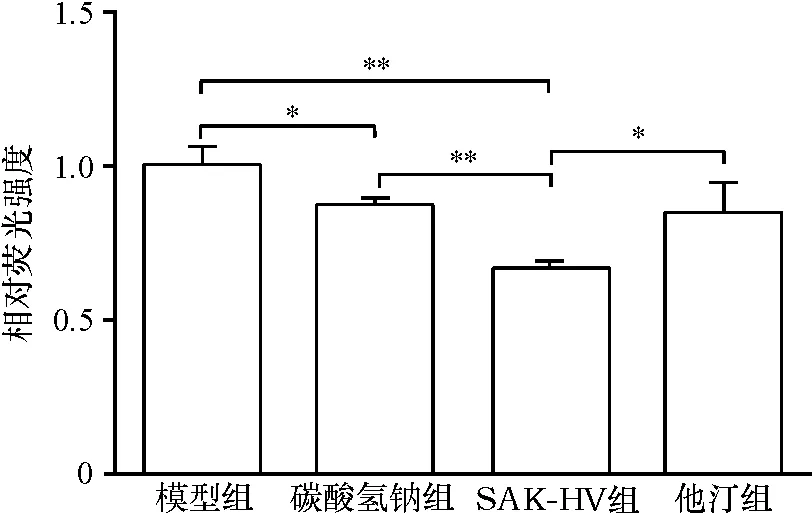
图5 各组大鼠主动脉中ROS含量
2.6大鼠血清中超氧化物歧化酶(SOD)活性比较
采用羟胺法检测血清中SOD活性.结果(图6)显示,SAK-HV组血清中SOD活性分别高于模型组和碳酸氢钠组,差异具有统计学意义;与模型组相比,碳酸氢钠组和他汀组SOD活性显著提高,差异具有统计学意义.

图6 各组大鼠血清中SOD活性变化
2.7大鼠血清中丙二醛(MDA)含量比较
采用TBA法检测各组血清中MDA含量.结果(图7)显示,SAK-HV组、碳酸氢钠组和他汀组MDA含量都低于模型组,差异具有统计学意义.

图7 各组大鼠血清中MDA含量变化
3 讨论
阿托伐他汀是目前治疗高脂血症最常用的他汀类药物,因此,本实验选用阿托伐他汀作为阳性对照药物,评价SAK-HV的降脂效果.实验结果表明,SAK-HV组TG、TC指标均低于他汀组,差异具有统计学意义,说明SAK-HV的降脂效果优于阿托伐他汀.
血液胆固醇含量偏高是高脂血症的症状之一.体内胆固醇代谢主要包括合成、吸收、转运、消耗及外排等生理生化过程.本课题组已有的研究结果[5-6]提示,SAK-HV降低血清总胆固醇,可能与胆固醇的吸收和转运有关,小肠是胆固醇吸收的主要器官.2004年,ALTMANN等[7]发现,在小肠上皮细胞中高表达的NPC1L1在胆固醇吸收过程中起重要作用.DAVIES等[8]报道,与正常小鼠相比,Npc1l1-/-小鼠小肠对胆固醇吸收降低70%.哺乳动物主要以分泌胆汁的方式排除体内的胆固醇,而胆汁胆固醇的分泌依赖于ABCG5和ABCG8蛋白.Abcg5、Abcg8是ATP结合盒转运蛋白G亚家族(ATP-binding cassette transporters subfamily G)成员,此二者是ABC半转运蛋白,需相互结合形成异二聚体后才能发挥作用[9-10].YU等[11]报道,在肝脏中,ABCG5/ABCG8的作用是将肝脏中未酯化的胆固醇经肝胆管外排至小肠.本实验通过实时定量PCR技术和免疫组化技术检测小肠Npc1l1及肝脏Abcg5/Abcg8的mRNA及蛋白质水平.结果显示,SAK-HV能显著降低Npc1l1的表达,提高ABCG5/ABCG8的表达.由此可见,SAK-HV一方面抑制小肠对食物中游离胆固醇的吸收;另一方面增强肝脏对胆固醇的外排作用,从而起到降低血清总胆固醇的作用.
大量文献[12-14]报道高脂饮食能引起血脂水平及机体氧化应激水平升高,而高脂血症是导致动脉粥样硬化等心脑血管疾病的重要危险因素之一.高脂血症能引起组织线粒体ROS增加,降低NADPH/NADP+比值.而线粒体ROS过多与动脉粥样硬化发生发展密切相关.它能诱导内皮功能紊乱、炎性细胞激活及内皮和血管平滑肌细胞发生凋亡[15-16].SOD是机体抗氧化系统中不可或缺又普遍存在的酶类,其活性高低能反映机体抗氧化能力[17].MDA是多不饱和脂肪酸过氧化的终产物之一,其含量高低可衡量机体氧化应激水平[18].本实验结果显示,SAK-HV能降低主动脉ROS含量,提高血清SOD活性,降低血清MDA水平,表明SAK-HV能降低机体氧化应激水平,提高机体抗氧化能力,提示该药物对动脉粥样硬化等疾病具有积极的治疗作用.
此外,本课题组之前的研究是以ApoE-/-小鼠为实验对象并采取尾静脉注射方式对药效进行评价[5].该实验存在以下2个问题:一是ApoE-/-小鼠为基因敲除鼠,缺失胆固醇运输的载脂蛋白,该模型不能很好地模拟正常情况下饮食诱导形成的高脂血症;二是注射给药在实际应用上有一定局限,不利于药物的广泛使用.本实验通过高脂饲料喂养,建立大鼠高脂血症模型,较好地模拟正常情况下饮食诱导形成的高脂血症,同时还证实口服给药的方式亦能起到很好的降脂效果和降低机体氧化应激水平的作用.
口服给药虽能克服注射用药的不足,但SAK-HV作为一种重组蛋白,直接口服给药,胃酸极易使之变性失活.预实验结果表明,SAK-HV直接灌胃给药对高脂大鼠血脂水平无显著影响,证实了该推测.因此,本实验借鉴治疗胃酸过多的方法[19],先灌碳酸氢钠溶液,快速中和胃酸,再灌SAK-HV.实验结果显示,SAK-HV组血脂及机体氧化应激水平均显著低于碳酸氢钠组,说明利用这种给药方式SAK-HV能明显降低血脂和机体的氧化应激水平,这些研究为该药物后续口服剂型的开发奠定了基础.同时本研究显示,碳酸氢钠也能降低血清TG含量、降低机体氧化应激水平,其机制尚不明确,可能通过影响小肠对脂类的吸收,进而对血脂及机体氧化应激水平产生影响.
综上所述,SAK-HV口服给药能通过影响胆固醇转运相关蛋白的表达,显著降低高脂饲料喂养引起的血脂升高及机体氧化应激水平升高,有望成为新型降脂药物.
[1]ZHANG F, JIA Z, GAO P, et al. Metabonomics study of atherosclerosis rats by ultra fast liquid chromatography coupled with ion trap-time of flight mass spectrometry [J]. Talanta, 2009, 79(3): 836-844.
[2]AIKAWA M, SUGIYAMA S, HILL C C, et al. Lipid lowering reduces oxidative stress and endothelial cell activation in rabbit atheroma [J]. Circulation, 2002, 106(11): 1390-1396.
[3]CHEN H, MO W, SU H, et al. Characterization of a novel bifunctional mutant of staphylokinase with platelet-targeted thrombolysis and antiplatelet aggregation activities [J]. BMC Molecular Biology, 2007, 8: 88.
[4]VARGAS H O, VON H C, LIPPS M, et al. Hirudin versus heparin for anticoagulation in continuous renal replacement therapy [J]. Intensive Care Medicine, 2001, 27(4): 673-679.
[5]袁敏, 王旻, 付文亮, 等. SAK-HV蛋白通过上调ABCG5/ABCG8的表达降低胆固醇的吸收[J]. 医学研究杂志, 2015,44 (7):17.
YUAN M, WANG M, FU W L, et al. SAK-HV protein inhibits cholesterol absorption through up-regulation of ABCG5/ABCG8 expression [J]. Journal of Medical Research, 2015,44(7):17-22.
[6]龙民慧, 朱泽轶, 王园园,等. SRH蛋白抑制SHR大鼠动脉粥样硬化发展[J]. 华南师范大学学报(自然科学版), 2013, 45(5):89-92.
LONG M H, ZHU Z Y, WANG Y Y, et al. Inhibitory effect of Staphylokinase Mutant SRH on the development of SHR Rat′s Atherosclerosis [J]. Journal of South China Normal University (Natural Science Edition), 2013, 45(5):89-92.
[7]ALTMANN S W, DAVIS H R, ZHU L J, et al. Niemann-Pick C1 like 1 protein is critical for intestinal cholesterol absorption [J]. Science, 2004, 303(5661): 1201-1204.
[8]WANG J, MITSCHE M A, LVTJOHANN D, et al. Relative roles of ABCG5/ABCG8 in liver and intestine [J]. Journal of Lipid Research, 2015, 56(2): 319.
[9]DIETER M Z, MAHER J M, CHENG X, et al. Expression and regulation of the sterol half-transporter genes ABCG5 and ABCG8 in rats [J]. Comparative Biochemistry and Physiology: Part C, 2004, 139(4): 209.
[10]YU L, LI-HAWKINS J, HAMMER R E, et al. Overexpression of ABCG5 and ABCG8 promotes biliary cholesterol secretion and reduces fractional absorption of dietary cholesterol [J]. Journal of Clinical Investigation, 2002, 110(5): 671-672.
[11]YU L, GUPTA S, XU F, et al. Expression of ABCG5 and ABCG8 is required for regulation of biliary cholesterol secretion [J]. Journal of Biological Chemistry, 2005, 280(10): 8742-8747.
[12]LIN C P, HUANG P H, LAI C F, et al. Simvastatin attenuates oxidative stress, NF-κB activation, and artery calcification in LDLR-/-mice fed with high fat diet via down-regulation of tumor necrosis factor-α and TNF receptor 1 [J]. PLoS One, 2015, 10(12): Art: e0143686,20pp.
[13]ALI M I, CHEN X, DIDION S P. Heterozygous eNOS deficiency is associated with oxidative stress and endothelial dysfunction in diet-induced obesity [J]. Physiological Reports, 2015, 3(12): Art e12630,13pp.
[14]YIDA Z, IMAM M U, ISMAIL M, et al. High fat diet-induced inflammation and oxidative stress are attenuated by N-acetylneuraminic acid in rats [J]. Journal of Biomedical Science, 2015, 22: 96-105.
[15]HULSMANS M, VAN DOOREN E, HOLVOET P. Mitochondrial reactive oxygen species and risk of atherosclerosis [J]. Current Atherosclerosis Reports, 2012, 14(3): 264-276.
[16]VICTOR V M, APOSTOLOVA N, HERANC R, et al. Oxidative stress and mitochondrial dysfunction in atherosclerosis: mitochondria-targeted antioxidants as potential therapy [J]. Current Medicinal Chemistry, 2009, 16(35): 4654-4667.
[17]BATINIC-HABERLE I, TOVMASYAN A, ROBERTS ER, et al. SOD therapeutics: latest insights into their structure-activity relationships and impact on the cellular redox-based signaling pathways [J]. Antioxidants & Redox Signaling, 2014, 20(15): 2372-2415.
[18]DEL R D, STEWART A J, PELEGRINI N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition Meta-bolism and Cardiovascular Diseases, 2005, 15(4): 316-328.
[19]王银燕. 慢性胃溃疡的诊治进展[J]. 中外医学研究, 2015, 13(10): 156.
WANG Y Y. Progress in diagnosis and treatment of chronic gastric ulcer [J].Chinese and Foreign Medical Research, 2015, 13(10): 156-158.
【中文责编:成文英文责编:李海航】
Effect of SAK-HV on Reducing Lipid in Hyperlipidemic Rats by Gavage
HUANG Zhiguang1, FU Wenliang2, JING Haoran2, LONG Minhui2, GAN Xiangdong2, XU Donggang1,2*
(1.Guangxi Medical University, Nanning 530021, China; 2.Institute of Basic Medical Sciences, the Academy of Military Medical Sciences, Beijing 100850, China)
This article is to assess the influence of SAK-HV given by gavage on blood lipid and oxidative stress in hyperlipidemia model rats and to investigate the possible mechanism of lowering cholesterol. Male Wistar rats were fed by high-fat diet for 10 weeks to build hyperlipidemia model rats. Then the model rats were randomly assigned to model group, NaHCO3group, treatment (SAK-HV) group and positire control (atorvastatin) group by body weight and administrated with drugs perorally. 6 weeks later, all rats were anesthetized. Serum, aortas, intestines and livers were separated and analyzed. Data showed that compared to model group, the level of triglyceride and total cholesterol in serum of SAK-HV group were significantly reduced; fat deposition in liver was improved; the expression of NPC1L1 in intestine was inhibited and the expression of ABCG5/ABCG8 in liver was enhanced; the content of ROS in aorta was significantly reduced; the activity of SOD in serum was significantly improved; the content of MDA in serum was significantly decreased. These results demonstrated that SAK-HV could reduce the content of blood lipid, the level of body oxidative stress and the total cholesterol via inhibiting cholesterol intake in intestine and enhancing the excretion of cholesterol in liver. SAK-HV may be a promising candidate drug against hyperlipemia.
SAK-HV; hyperlipidemia model; oral medication; cholesterol transport; oxidative stress
2015-09-20《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家科技重大专项新药创制项目(2012ZX09102301-017) ;“十二五”国家重大新药创制生物技术大平台项目(2012ZX09301003-001-005-026)
徐东刚,研究员,Email: xudg@bmi.ac.cn.
R963;R966
A
1000-5463(2016)03-0115-07
