不同比对标准在全自动生化分析仪贝克曼AU5800与罗氏c701检测结果比对应用
2016-11-04杨锐华王香玲王玉环
杨锐华,何 谦,周 挺,王香玲,王玉环
(西安交通大学第二附属医院:1.检验科;2.内分泌科 710004)
·临床研究·
不同比对标准在全自动生化分析仪贝克曼AU5800与罗氏c701检测结果比对应用
杨锐华1,何谦1,周挺1,王香玲1,王玉环2△
(西安交通大学第二附属医院:1.检验科;2.内分泌科710004)
目的通过贝克曼AU5800全自动生化分析仪(AU5800分析仪)和罗氏c701全自动生化分析仪(c701分析仪)的血清尿素(BUN)检测结果进行比对分析和偏倚评估,建立分析模式,验证2台仪器检测结果的可比性。方法参考美国临床实验室标准化委员会(NCCLS) EP5-A2 文件,验证贝克曼AU5800的精密度并进行比对分析。分别采用AU5800分析仪和c701分析仪对40份新鲜血清 BUN水平进行检测,计算2台生化分析仪检测结果的相关系数。最后以CLIA′88总允许误差的1/2为标准,判断2台仪器的可比性,并通过基于生物学变异导出质量规范,对AU5800检测系统进行评价。结果AU5800分析仪BUN检测结果精密度较高,批内、批间变异系数均较小;2台分析仪BUN检测结果的相关系数均大于0.999。结果总误差达到“适当的性能规范”。结论AU5800分析仪和c701分析仪检测结果可比性良好,为进一步开展其他项目的比对分析奠定了基础。
血清尿素;性能验证;生物学变异系数;比对分析
随着检验医学的发展,同时拥有2台或2台以上不同型号或不同厂家的全自动生化分析仪已是普遍现象。不同仪器的试剂、方法及稳定性能有所不同,具有不同的分析系统,可能存在同一检测项目结果不一致,影响诊断和治疗[1-3]。因此对同一实验室不同仪器进行比对分析,明确检测结果的可比性,确保检测结果准确[4]。通过对检测结果改变的临床意义和统计学意义进行正确判断,提供更为客观的临床指导[5]。该科室同时拥有贝克曼AU5800分析仪与罗氏c701分析仪进行常规生化项目检测,为验证2台仪器的可比性,按照美国临床实验室标准化委员会(NCCLS)EP5-A2、EP9-A2文件要求,以美国临床实验室修正法规(CLIA′88)规定的总允许误差范围的1/2为标准,对2台仪器检测血清尿素(BUN)的结果进行比对分析和偏倚评估,同时把质量规范作为生物变异学评价标准,对U5800检测系统进行更加全面客观的分析,实现2台仪器检测结果的可比性[6]。
1 资料与方法
1.1一般资料每天收集并检测该院患者新鲜BUN标本8例,要求无溶血、无黄疸、无乳糜,连续测定5 d;按照EP9-A2要求,要有50%的BUN标本水平位于参考区间外,并尽可能覆盖医学决定水平和参考区间。
1.2仪器与试剂罗氏c701分析仪采用原厂家试剂、校准品;贝克曼AU5800分析仪BUN 试剂由中生北控生物科技股份有限公司提供;质控品中值(批号 HN1530)和高值(批号 HE1532)来自英国朗道公司。
1.3方法
1.3.1标本检测及质控均按照标准操作保养流程对2台生化分析仪进行操作和保养。每天确保质控结果在控,才进行临床标本检测。
1.3.2精密度测定批内精密度:取中值和高值质控血清各1例,在AU5800分析仪上连续检测20次,计算2个水平检测结果的均值、标准差和变异系数。批间精密度:根据最近连续20 d的BUN质控结果,计算各水平的均值、标准差和变异系数。
1.3.3离群值的判定算出每份标本重复检测结果差值的均值和绝对值,每套检测系统重复测定差值的可接受限为绝对差值均值的4倍,超出可接受限时判定为离群值。按照EP9-A2的要求[7],40例标本的离群值不能超过1个。
1.3.4比对试验参照要求,每日对选择的8例新鲜血清标本,分别采用AU 5800分析仪和c701分析仪按照1~8和8~1的顺序重复测定2次,2 h内完成,连续测定5 d。c701分析仪使用原厂家试剂盒校准品,因此将c701作为比对系统(X),AU5800作为试验系统(Y),计算线性回归方程。
1.3.5临床可接受性评价参照EP9-A2文件要求,将临床给定的BUN医学决定水平值(Xc)带入回归方程,得到试验浓度值(YC),再计算出两者之间的系统偏差(SE)及相对偏差SE%。以SE%小于等于CLIA′88总允许误差范围的1/2作为临床可接受标准[8]。根据基于生物学变异导出的质量规范对AU5800检测系统进行评价[9]。
1.4统计学处理采用SPSS18.0统计软件进行数据分析,P<0.05为差异有统计学意义。
2 结 果
2.1精密度评价与罗氏c701分析仪比较,贝克曼AU5800分析仪BUN检测结果的精密度较高,差异无统计学意义(P>0.05)。见表1。
2.2离群值判定2台生化分析仪BUN测定结果均无离群值。
2.3线性回归分析2台生化分析仪BUN检测结果的回归方程为Y=0.007+1.035X,相关系数为0.999,相关性良好,一致性较高。
2.4临床可接受性评价临床给定的2个BUN水平的医学决定水平值(Xc)分别为10和18 ,试验浓度值(Yc)分别为10.36和18.64,各水平之间的SE分别为0.36和0.36,相对偏差SE%分别为3.6%和3.6%。CLIA′88规定的BUN总允许误差范围的1/2为4.5%。AU5800分析仪BUN检测结果的相对偏差SE%均小于CLIA′88总允许误差的1/2,可以被临床接受。

表1 AU5800分析仪检测血清BUN精密度评价结果
2.5基于生物学变异导出的质量规范2台生化分析仪器的比对结果满足基于生物学变异导出的质量规范。见表2。
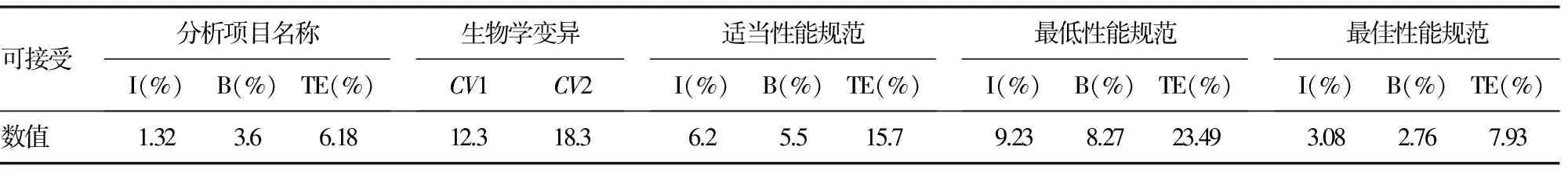
表2 基于生物学变异导出的质量规范
3 讨 论
随着临床标本量的增加,同一实验室采用不同型号和厂家的仪器对同一项目进行检测。不同仪器由于各方面原因,在检测同一项目时可能存在检测结果不一致或者缺乏可比性。不同仪器间的比对分析和相关性研究,逐渐被重视。ISO15189文件规定:采用不同设备或程序进行相同项目测定时,要有确切的机制来验证在临床整个适用区间内测定结果的可比性;应按合适的周期进行验证。不同分析系统对同一项目的测定结果具有可比性是实验室质量控制的重要内容[10]。
报告结果为一单一数值,但是每一个数值有其固有的变异,如果忽略分析前变异那么种种变异是由个体内生物变异和分析随机变异——精密度和偏倚改变,对检测系统进行一致性比较时,可根据生物学变异推导出对精密度和偏倚的要求,对检测系统进行评价。本组试验首先参照NCCLS EP9-A2文件要求,对AU5800分析仪检测BUN的精密度进行评估,并和c701分析仪进行比对,结果表明,AU5800分析仪检测BUN测定精密度高,批间和批内变异系数小,2台分析仪检测血清BUN水平结果的相关系数为0.999,相关性良好。将BUN的医学决定值代入回归方程,计算结果显示,AU5800分析仪与c701分析仪血清BUN水平测定结果的SE%均小于CLIA′88总允许误差的1/2,同时可达到基于生物学变异导出的质量规范的最佳要求。说明AU5800分析仪的测定结果的偏倚在临床可接受区间内,2台分析仪血清BUN水平检测结果有可比性。
本实验通过AU5800分析仪和c701分析仪检测BUN,构建一个比对分析模式,为其他项目奠定了基础。
[1]康建华,杨立顺,袁海生.临床实验室项目检测的比对试验[J].河北医药,2011,33(21):3330-3332.
[2]李熙建,张立营,刘影,等.同一生化分析仪不同检测模块间的误差分析及溯源性的探讨[J].国际检验医学杂志,2013,34(2):201-203.
[3]李桂才,张丽萍,杨平,等.2台分析仪C-反应蛋白检测结果比对研究[J].北方药学,2014,23(3):70-70.
[4]刘伟平,殷明刚,马盛余,等.东芝TBA-40FR与日立7600生化分析仪检测结果的一致性分析[J].当代医学,2009,15(30):2-3.
[5]林琳,王治国,何法霖,等.全国517家实验室11项特殊蛋白检验室内质控不精密度变异分析[J].现代检验医学杂志,2013,28(5):208-209.
[6]占松涛.探讨生物学变异在临床化学检验的质量规范设定和结果评价中的应用[J].中国现代医生,2014,52(20):52-54.
[7]NCCLS.Method comparison and bias estimation using patient samples;approved guideline EP9-A2[S].2nd ed.Wayne,PA:NCCLS,2002.
[8]陈先荣,李智,刘一平.NCCLS EP9-A文件在全自动生化分析仪评价中的应用[J].实验与检验医学,2010,28(4):407-408.
[9]王治国.临床检验生物学变异与参考区间[M].北京:人民卫生出版社,2012:230-231.
[10]崔雯,史光华.2个检测系统ALT、AST、CK、LDH测定结果比对分析[J].首都医药,2011,21(2):55-56.
,E-mail:wangyuhuan369@126.com。
10.3969/j.issn.1673-4130.2016.19.056
A
1673-4130(2016)19-2781-02
2016-02-21
2016-06-16)
