肇庆地区人类乳头瘤病毒感染型别及年龄分布
2016-11-04申学基李成德李海珠吴小文
申学基,李成德,刘 健,李海珠,吴小文
(广东省肇庆市第一人民医院 526020)
·经验交流·
肇庆地区人类乳头瘤病毒感染型别及年龄分布
申学基,李成德,刘健,李海珠,吴小文
(广东省肇庆市第一人民医院526020)
目的了解肇庆地区人类乳头瘤病毒(HPV)的感染型别及年龄分布。方法采用反向杂交技术对该院收集的住院及门诊患者2 004例有性生活史的女性宫颈分泌物进行分型研究。结果2 004例标本中437例阳性,阳性率21.6%,单一感染334例(16.6%),混合感染103例(5.2%)。其中52亚型79例,占阳性例数的18.07%,16亚型45例,占10.29%,58亚型33例,占7.6%。低危型例数明显少于高危型,差异有统计学意义(P<0.05)。HPV感染主要分布在21~50岁年龄段。结论肇庆地区HPV感染的主要是52亚型,年龄主要分布在21~50岁。
人类乳头状瘤病毒;宫颈炎;宫颈癌
宫颈癌是女性最常见的恶性肿瘤之一,发展中国家宫颈癌占女性肿瘤的15%,发达国家宫颈癌占女性肿瘤的4.4%[1]。我国宫颈癌发病率及新发例数均较高,每年新发病例约4.5万,占全球发病总数的1/4,严重影响女性身心健康[2]。早期诊断和治疗是预防宫颈癌的有效途径,病理学检查可作为宫颈癌前病变的金标准[3]。由于临床主观判断的不一致性,因此宫颈癌需要其他辅助诊断措施。大量实验证明人类乳头瘤病毒(HPV)感染与宫颈癌的发生密切相关,而HPV分型检测可作为宫颈癌的初步筛查,为其早期诊断和治疗开拓新局面[4]。现对肇庆地区病例进行初步分析,了解该地区HPV分型感染和年龄分布情况。
1 资料与方法
1.1一般资料收集2015年1月1号至12月31号该院门诊及住院有性生活史的女性患者标本2 004例,年龄20~60岁,病理学检查确诊为宫颈癌32例,其余为宫颈炎或有症状患者。
1.2方法将取材刷子在患者宫颈处旋转6周以上以取得更多的宫颈上皮细胞,标本收集后置-20 ℃保存待测。(1)HPV DNA提取。(2) HPV DNA扩增。(3) HPV DNA 分子导流杂交显色基因分型,结果判断按试剂盒说明书进行。
1.3仪器与试剂美国ABI7500型聚合酶链反应(PCR)扩增仪,HB 2012A核酸分子杂交仪,HPV基因分型试剂盒(潮州凯普生物化学有限公司)。
1.4统计学处理采用SPSS 19.0统计软件进行数据分析,组间比较使用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1HPV感染患者年龄分布情况21~50岁是HPV感染的高发年龄,占阳性例数的93.7%。其中21~30岁、31~40岁、41~50岁低危型感染,两两比较,差异无统计学意义(P>0.05)。31~40岁、41~50岁HPV高危型感染例数略高于21~30岁组别,前者宫颈癌发病率也高于后者。51~60岁HPV高危型感染例数与其他3组比较,差异有统计学意义(P<0.05)。31~50岁是HPV高危型感染的高峰期,宫颈癌患者也于31~50岁多见。见表1。
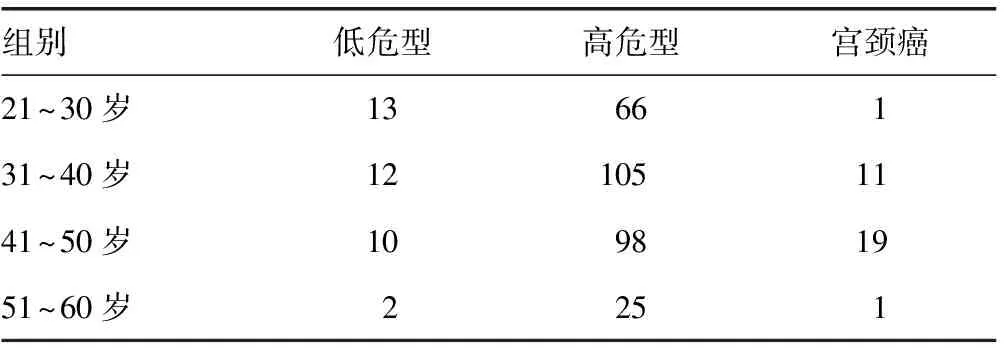
表1 肇庆地区女性不同年龄组别HPV感染分布情况(n)
2.2HPV感染患者各亚型分布情况HPV感染率为434/2 004(21.6%),主要以HPV高危型单一感染为主,占67.7%。单一感染占76.3%,混合感染占23.7%。2 004例标本中阳性434例。52亚型单一感染所占比例最高,74例,占阳性例数的17.0%;16亚型45例,占阳性例数的10.3%,58亚型33例(7.6%),cp8304亚型30例,39亚型18例,11亚型18例,6亚型16例,33亚型15例。见表2。
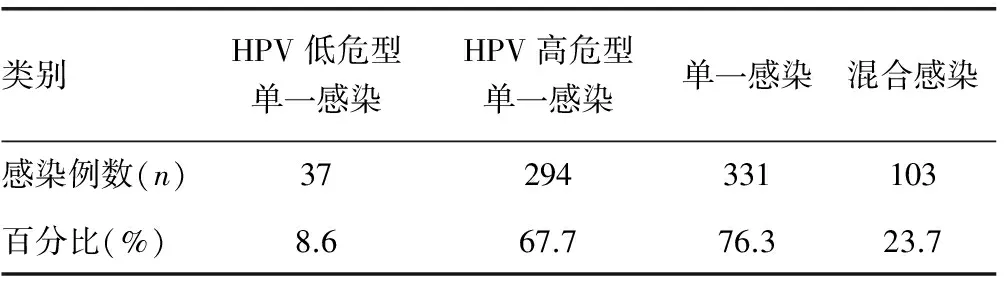
表2 肇庆地区女性不同型别HPV感染分布情况
3 讨 论
HPV感染多发生于21~50岁女性,有10%~15%持续感染,这部分女性是宫颈癌的高发人群,HPV感染是重要的致病和致癌因素[5-6]。本研究2 004例有性生活史女性宫颈分泌物,阳性标本434例,感染率21.6%,在广东地区属中等水平。HPV低危型感染主要引起尖锐湿疣,通过手术治疗可以治愈,而低危型感染的主要以年轻及中年女性为主,21~50岁为高发期,主要感染途径是不洁性交,与性生活活跃显著相关。HPV高危型感染高发期主要在31~50岁,大部分会在短期内自动消失,高危型 HPV持续感染与子宫颈癌及CIN的发生密切相关[7]。其发生机制是其E6、E7基因组整合至宿主细胞DNA,最终导致宿主细胞肿瘤抑制蛋白下调,E6和E7蛋白和宿主细胞的P53和PRB具有高度亲和力,影响其功能与基因的稳定性,最终导致细胞癌变[8]。因此早期进行HPV筛查,具有极其重要的临床作用。此外宫颈癌的发生与早婚、早育、多产及性生活紊乱有关[9]。
目前HPV有100多种亚型,27种可在宫颈癌组织中发现,可以单一感染或多重感染。本研究434例HPV感染患者,单一感染76.3%,混合感染23.7%,其中有32例确认宫颈癌,9例为混合感染。有研究表明,多型别HPV感染不一定预示宫颈高级病变存在,而HPV多型别持续感染是宫颈发生病变的重要原因[10]。
本组调查结果显示,该地区HPV感染率属于中等水平,21~50岁为高发年龄段,高危型52亚型所占比例最高,16、 58亚型其次,而16亚型是宫颈癌的主要致病型别。我国HPV感染主要是25~50岁高发,以16、18亚型为主,58、52亚型有较高的流行趋势。大型流行病学研究显示,广东潮州地区HPV感染以21~50岁年龄段为主,感染类型以52亚型为主,16、58亚型次之,与本研究结果相一致。本组HPV感染有年轻化趋势,可能与多种因素有关。病理检查是宫颈癌诊断的金标准,而CIN的病理诊断和分级与临床的主观判断有一定关系,HPV筛查对宫颈癌的辅助诊断起到重要的临床作用。HPV治疗性疫苗还在研究阶段,预防性疫苗已经上市[11]。了解HPV感染人群分布情况可有针对性地研究疫苗,从根本上改变HPV感染,从而减少宫颈癌的发生率。因此早期筛查具有极其重要的临床意义。
[1]Bauer HM,Ault K.Human papillomavirus:current prevalence and future protection[J].Sex Transm Dis,2006,33(8):509-511.
[2]田玉旺,刘光,周建,等.细胞DNA定量分析技术在宫颈癌及癌前病变早期筛查中的应用价值[J].诊断病理学杂志,2013,20(7):425-428.
[3]陈玲,谷灿,廖淑梅.大学女生对人类乳头瘤病毒及其疫苗认知研究现状[J].医学综述,2015,16(10):1825-1827.
[4]尹格平,支园园,武爱芳.6 700例宫颈脱落细胞HPV基因分型检测的临床分析[J].中国保健营养(中旬刊),2012,12(12):18-20.
[5]Georgette DA,Theresa FW.Human Papillomavirus and cervical screening[J].Curd Opin Obstet Gynecol,2003,15(6):473-477.
[6]王欣欣,付丽.DNA去甲基化与肿瘤治疗的研究进展[J].中华病理学杂志,2009,38(5):355-357.
[7]Bodily J,Laimins LA.Persistence of human papillomavirus infection:keys to malignant progression[J].Trends Microbiol,2011,19(1):33-39.
[8]Burd EM.Human papillomavirus and cervical cancer[J].Clin Microbial Rev,2003,16(4):1-17.
[9]史鹏,张瑞芹,陈静.阴道镜检查在诊断宫颈病变中的作用[J].中外医学研究,2009,7(8):52-53.
[10]关婷,张志文,谢燕芳.人类乳头状瘤病毒基因型与宫颈上皮内瘤样变的关系[J].中国妇幼保健,2006,21(11):960-963.
[11]Ault K,Reisinger K.Programmatic issues in the implementation of an HPV vaccination program to prevent cervical cancer[J].Int J Infect Dis,2007,11(Suppl 2):S26-S28.
10.3969/j.issn.1673-4130.2016.19.067
B
1673-4130(2016)19-2799-02
2016-02-16
2016-04-25)
