颅内感染患者脑脊液高迁移率族蛋白-1和RAGE水平及意义*
2016-11-03黎艳晖张圣岸蔡业平戴新贵
黎艳晖,张圣岸,蔡业平,戴新贵
(郴州市第一人民医院重症医学科,湖南 郴州 423000)
颅内感染患者脑脊液高迁移率族蛋白-1和RAGE水平及意义*
黎艳晖,张圣岸,蔡业平,戴新贵
(郴州市第一人民医院重症医学科,湖南郴州423000)
目的:观察颅内感染患者血清高迁移率族蛋白-1(HMGB-1)和晚期糖基化终产物受体(RAGE)的脑脊液水平,并探讨其对诊断颅内感染的价值。方法: 62例拟诊为颅内感染患者根据最后诊断分为颅内感染(n=48)和非颅内感染组(n=14)。酶联免疫法吸附法 (ELISA)检测脑脊液中的HMGB-1和RAGE蛋白水平。并分病脑组、化脑组、结脑组进行亚组分析。受试者工作曲线(ROC)分析其对颅内感染的诊断意义。 结果: 脑脊液的HMGB-1和RAGE水平在颅内染组和非颅内感染组之间比较差异有统计学意义(P<0.05)。亚分组显示,病脑组、化脑组、结脑组HMGB-1和RAGE脑脊液水平均高于非颅内感染组(P<0.05)。脑脊液HMGB-1和RAGE水平诊断颅内感染受试者工作曲线(ROC)的曲线下面积(AUC)分别为:0.856(95% CI:0.748~0.964)、0.937(95% CI:0.849~1.000)。HMGB-1临界值分别为75.00 ng·mL-1(敏感性:0.792,特异性:0.856);RAGE临界值为101.50 ng·mL-1(敏感性:0.979,特异性:0.856)。结论:脑脊液HMGB-1和RAGE水平诊断颅内感染有较高的灵敏性和特异性,具有重要的诊断价值。
颅内感染;高迁移率族蛋白-1;晚期糖基化终产物受体;受试者工作曲线;脑脊液
颅内感染是临床常见的急危重症,诊断主要依靠临床症状体征和实验室检查,但在病史不清、不典型发病和经过不正规治疗等情况时一次性确诊具有困难。高迁移率族蛋白(High mobility group box-1,HMGB-1)是重要的晚期促炎症因子,在正常脑组织不表达或低水平表达[1],在感染性因素或非感染因素刺激下,HMGB-1分泌到细胞外与其受体晚期糖基化终产物受体(Receptor for advanced glycosylation end products,RAGE)、TLR2等结合,介导炎症反应[2-3]。我们前期研究发现,脑脊液HMGB-1及RAGE水平对颅脑外伤术后患者发生颅内感染具有一定的诊断价值[4],但对非颅脑外伤术后患者的诊断价值尚未明确,本研究通过检测这类颅内感染患者脑脊液的HMGB-1水平,为临床诊断颅内感染提供全面的理论依据。
1 资料与方法
1.1一般资料2013年8月~2015年8月我科收治的拟诊为颅内感染患者62例,男38例,女24例,年龄15~63岁,平均(38.23±13.94)岁。入选病例根据诊断分为颅内感染组(n=48)和非颅内感染组(n=14)。颅内感染诊断标准:(1)临床表现有高热、头痛、呕吐、脑膜刺激征临床表现;(2)脑脊液中白细胞数> 0.01×109·L-1,糖定量<400 mg·L-1,蛋白定量>450 mg·L-1;(3)脑脊液或颅内引流管头细菌培养阳性。颅内感染组:病毒性脑炎(病脑组)18例,化脓性脑膜炎(化脑组)13例,结核性脑膜炎(结脑组)17例,其中男30例,女18例,年龄15~58岁,平均(37.73±12.78)岁;非颅内感染组:肺炎3例、糖尿病酮症酸中毒2例、伤寒2例、艾滋病2例、疟疾1例、其他不明原因4例,其中男8例,女6例,年龄19~63岁,平均(39.94±17.80)岁。两组性别、年龄比较无统计学意义(P>0.05)。
排除标准:①有严重的心、肺、肝、肾等脏器疾病的患者;②1个月内接受过激素治疗的患者;③3个月内接受过开颅手术的患者;④恶性肿瘤患者。
1.2方法 记录患者一般资料。当患者有高热和脑膜刺激征等临床表现,拟诊发生颅内感染时通过腰椎穿刺留取脑脊液标本,3 000转离心5 min,留取上清-80°C保存待检。采用酶联免疫法吸附法(ELISA)检测脑脊液中的HMGB-1和RAGE水平。试剂盒购自武汉中美科技公司,按照说明书操作。
1.3统计学处理 资料采用均数±标准差表示,采取两独立样本t检验,多组比较采用单因素方差分析;计数资料两组间比较进行χ2检验。用受试者工作曲线(receiver operating characteristic curve,ROC)得到HMGB-1和RAGE诊断颅内感染的曲线下面积(AUC)和95%可信区间(CI)。处理采用 SPSS 19.0软件,P<0.05表示差异有统计学意义。
2 结 果
2.1颅内感染组和非颅内感染组HMGB-1和RAGE脑脊液水平比较 脑脊液的HMGB-1和RAGE水平在颅内感染组和非颅内感染组之间比较差异有统计学意义(P<0.05),见表1。亚分组显示,病脑组、化脑组、结脑组HMGB-1和RAGE脑脊液水平均高于非颅内感染组(P<0.05),见表2。
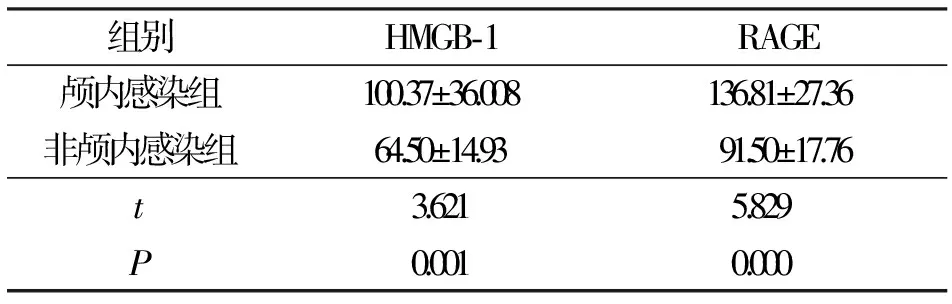
表1 2组HMGB-1和RAGE的脑脊液水平比较/ng·mL-1
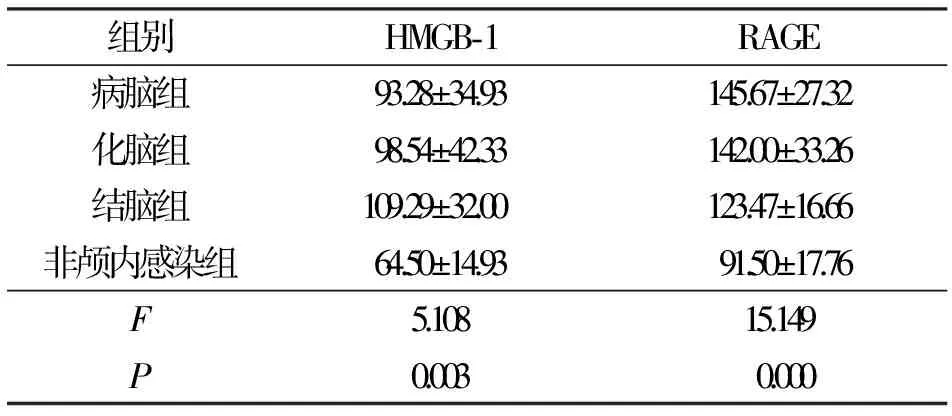
表2 病脑组、化脑组、结脑组和非颅内感染组HMGB-1和RAGE的脑脊液水平比较/ng·mL-1
2.2 脑脊液HMGB-1和RAGE诊断颅内感染的ROC检验 见图1。脑脊液HMGB-1和RAGE诊断颅内感染有统计学意义(P<0.05),ROC结果显示,脑脊液HMGB-1和RAGE诊断颅内感染的ROC曲线下面积(AUC)分别为:0.856(95%CI:0.748~0.964)、0.937(95%CI:0.849~1.000)。HMGB-1临界值分别为75.00 ng·mL-1(敏感性:0.792,特异性:0.856), 阳性预测值(positive predictive value,PPV)为84.0%,阴性预测值(negative predictive value,NPV)为70.0%,约登指数(Youden index,YI)为:0.72;RAGE临界值为101.50 ng·mL-1(敏感性:0.979,特异性:0.856), PPV为89.6%, NPV为80.0%, YI为:0.53。
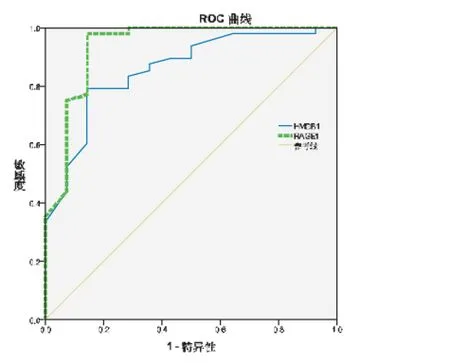
图1颅内感染脑脊液HMGB-1和RAGE的诊断ROC曲线
3 讨 论
颅内感染发病凶险,临床表现多样,迅速准确诊断具有一定困难。颅内感染重要的临床症状是持续性发热,体征为脑膜刺激征阳性,脑脊液检查是颅内感染诊断不可缺少的手段,但脑脊液检查具有一定的片面性,细菌培养需要一定的时间,因此在脑脊液检查中寻找其它具有快速诊断价值的生物学指标具有重要意义。炎症反应是颅内感染的重要发病机制,HMGB-1是重要的促炎因子,具有广泛的生物学活性,在正常情况下,HMGB-1存在细胞核内,应激产生的促炎因子与相应受体结合促发HMGB-1释放,释放到胞外的HMGB-1与相关受体(如RAGE、TLR2)结合可刺激细胞生长、血管发生、介导炎症反应、诱导细胞凋亡以及破坏血脑屏障等[3,5]。研究表明HMGB-1可通过记过NF-κB进而产生炎性因子,在星形胶质细胞培养液中加入HMGB-1,可引起COX-2表达上调,而给予RAGE抗体可抑制这种表达[6-7],HMGB-1和其受体在星形胶质细胞和小胶细胞中的表达提示其可能与炎症的启动有关。越来越多的研究表明HMGB-1的升高与颅内炎性疾病严重程度和预后相关[8-11]。
目前国内外关于颅内感染与HMGB-1水平的研究主要集中在外周血液,在CSF中的HMGB-1和RAGE水平诊断颅内感染的诊断价值尚未报道。有研究报道正常CSF的HMGB-1和RAGE含量极低[8-9,12],本研究通过比较颅内感染和非颅内感染患者脑脊液的HMGB-1和RAGE蛋白水平,发现前者较后者有明显增高,ROC曲线分析证实了其对颅内感染具有重要的诊断价值,且灵敏性和特异性均较高。亚分组显示,脑脊液中HMGB-1和RAGE对病毒性脑炎、化脓性脑膜炎、结核性脑膜炎均具有一定意义,但HMGB-1和RAGE脑脊液水平在三亚组间比较无明显差异(P>0.05),说明其无助于颅内感染的分型。
综上所述,对于颅内感染的诊断,脑脊液HMGB-1和RAGE蛋白水平具有较高的灵敏性和特异性,有较好的临床应用价值,是临床较好的参考指标,缺点是不能鉴别各种病因的颅内感染。
[1]Lee SA, Kwak MS, Kim S, et al. The role of high mobility group box 1 in innate immunity[J].Yonsei Med J, 2014,55 (5):1165-1176.
[2]Yang H, Tracey K J. Targeting HMGB1 in inflammation[J]. Biochim Biophys Acta,2010,1799 (1-2): 149-156.
[3]Musumeci D,Roviello GN,Montesarchio D.An overview on HMGB inhibitors as potential therapeutic agents in HMGB1 related pathologies[J].Pharmacol Ther,2014,141(3):347-357.
[4]戴新贵,付春来,张圣岸,等.重型颅脑外伤术后颅内感染患者脑脊液高迁移率族蛋白-1和RAGE水平的变化及意义[J].川北医学院学报,2015,30(6):748-751.
[5]Huang W, Tang Y, Li L. HMGB1, a potent proinflammatory cytokine in sepsis[J]. Cytokine,2010,51(2):119-126.
[6]Palumbo R, Galvez BG, Pusterla T, et al. Cells migrating to sites of tissue damage in response to the danger signal HMGB1 require NF-κB activation[J]. J Cell Biol,2007,179(1):33-40.
[7]Pedrazzi M,Patrone M,Passalacqua M,et al.Selective proinflammatory activation of astrocytes by high mobility group box 1 protein signaling[J].J Immunol,2007,179(12):8525-8532.
[8]Au AK, Aneja RK, Bell MJ, et al. Cerebrospinal fluid levels of high-mobility group box 1 and cytochrome C predict outcome after pediatric traumatic brain injury[J]. J Neurotrauma,2012,29(11):2013-2021.
[9]Glasnovic A, Cvija H, Stojic M, et al. Decreased level of sRAGE in the cerebrospinal fluid of multiple sclerosis patients at clinical onset[J]. Neuroimmunomodulat, 2014, 21(5):226-233.
[10]Miyasho T, Nakamura K, Nomura S, et al. High mobility group box 1 (HMGB1) protein is present in the cerebrospinal fluid of dogs with encephalitis[J]. J Vet Med Sci, 2011, 73 (7):917-922.
[11]Hohne C, Wenzel M, Angele B, et al. High mobility group box 1 prolongs inflammation and worsens disease in pneumococcal meningitis[J]. Brain, 2013,136(6):1746-1759.
[12]Gibot S, Massin F, Cravoisy A, et al.High mobility group box 1 protein plasma concentrations during septic shock[J]. Intensive Care Med, 2007, 33 (9):1347-1353.
Cerebrospinal Fluid Levels and Significance of High Mobility Group Box-1 and RAGE in Patients with Intracranial Infection
LIYan-hui,ZHANGShen-an,CAIYe-ping,DAIXin-gui
(DepartmentofIntensiveCareUnit,TheFirstPeople'HospitalofChenzhou,ChenzhouHunan423000)
Objective:To investigate the changes of cerebrospinal fluid (CSF) levels of high mobility group box 1 (HMGB-1) and receptor for advanced glycosylation end products (RAGE) in patients with intracranial infection, and their diagnostic value for intracranial infection. Methods: Sixty-two polyeystic intracranial infection patients were divided into intracranial infection group (n=48) and non-intracranial infection (n=14) according to the final diagnosis. HMGB-1 and RAGE protein levels in CSF were detected by enzyme-linked immunosorbent assay (ELISA). Subset analysis was performed among viral encephalitis group, purulent meningitis group, and tubercular meningitis group. The diagnostic value of HMGB-1 and RAGE protein levels in CSF for intracranial infection were tested by receiver operating characteristic (ROC) curve. Results:CSF levels of HMGB-1 and RAGE in intracranial infection group were significantly higher than non-intracranial infection group(P<0.05). The results of subgroup analysis showed the statistical difference among viral encephalitis group, purulent meningitis group, tubercular meningitis group and non-intracranial infection group (P<0.05). Area under the curve (AUC) of HMGB-1 and RAGE ROC curve were 0.856 (95%CI:0.748~0.964) and 0.937 (95%CI:0.849~1.000), respectively. The best cut-off value of HMBG-1 for a diagnosis of intracranial infection was 75.00 ng·mL-1(sensitivity and specificity were 0.792 and 0.856), and the best cut-off value of HMBG-1 was 101.50 ng·mL-1(sensitivity and specificity were 0.979 and 0.856). Conclusion: The CSF levels of HMGB-1 and RAGE were suitable biomarkers for diagnosing intracranial infection with high sensitivity and specificity.
Intracranial infection;High mobility group box-1;Receptor for advanced glycosylation end products;Receiver operating characteristic curve;Cerebrospinal fluid
国家自然科学基金青年项目(81601708)
戴新贵,男,博士,副主任医师。研究方向:重症医学。E-mail: dyce@2008.sina.com
R446.14
A
1001-5779(2016)04-0577-03
10.3969/j.issn.1001-5779.2016.04.022
2015-12-30)(责任编辑:刘仰斌)
